Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mess-Diffusionskoeffizienten über Zwei-Photonen-Fluorescence Recovery After Photobleaching
In diesem Artikel
Zusammenfassung
In diesem Artikel beschreiben wir das Verfahren zur Messung von Diffusionskoeffizienten mittels Multi-Photonen-Fluoreszenz-Erholung nach Ausbleichen. Wir werden durch die Angleichung der Laser entlang der optischen Pfad zu der Probe und Bestimmung der richtigen experimentellen Parameter beginnen, dann weiter generiert und schließlich passende Fluoreszenz Erholung Kurven.
Zusammenfassung
Multi-Fluorescence Recovery After Photobleaching ist ein Mikroskopie-Technik verwendet, um den Diffusionskoeffizienten (oder analoge Transport-Parameter) von Makromolekülen zu messen, und kann sowohl angewendet werden
Protokoll
1. Richten Sie die Optik.
Die wichtigsten Geräte für einen MP-FRAP-Experiment sind: eines modengekoppelten Laserquelle, Pockels-Zelle (für Strahlmodulation), Impulsgeber, dichroitische, Objektiv, Fluoreszenzemission Filter, gated Photomultiplier und einem Datenerfassungssystem (Photonen-Zähler und Mehrkanal-Scaler).
2. Bestimmen Sie sicher überwachen Kräfte.
- Dämpfen Sie den Laser auf einen niedrigen, aber vernünftig, Energie zur Erzeugung von Fluoreszenz in der Probe.
- Fokus in der Probe.
- Set ein Photon Zähler zu integrieren über eine Zeitskala viel länger als die erwartete Fluoreszenz-Recovery. Mit dem Fokalvolumen stationär gehalten in der Probe (auf unserem Mikroskop-Software ist dies durch einen Punkt erreicht Scan), Aufnahme einer angemessenen Anzahl von Photonen Zähldaten.
- Steigern Sie die Leistung und nehmen eine andere Reihe von Photonenzahl Daten. Wiederholen, bis die Erhöhung der Photonen offenbar deutlich verringert in Bezug auf die Leistung zu erhöhen.
- Plot log (Photonen) als Funktion von log (Leistung). Eine Abweichung von einem Hang aus zwei zeigt Bleichen während des Monitors. Wählen Sie als Ihren Monitor Macht eine Macht, die unter diesem abgeschnitten, aber die einen vernünftigen Signal-Rausch-Verhältnis ermöglicht.
3. Bestimmen Sie Input-Parameter mit dem Impulsgenerator und Multichannel-Scaler.
- Bestimmen back-of-the-envelope Schätzungen der Diffusionskoeffizient und Recovery-Zeit auf die Literatur und / oder die Stokes-Einstein-Gleichung und der Diffusionsgleichung basiert.
- Stellen Sie die erforderlichen Parameter-Werte auf der Impulsgeber und der Scaler.
- Auf der Impulsgeber, stellen Sie den Pre-Bleichmittel und Bleich-Zeiten. Ein guter Satz von Regeln besagt, dass der Pre-Bleiche sollte 1-2 mal größer als die erwartete Erholung ein halb Mal, und das Bleichmittel Zeit sollte ein Zehntel des erwarteten ein halb Recovery-Zeit.
- Auf der Scaler, stellen Sie den Bin-Breite auf etwa die Hälfte der Bleiche Dauer und die Anzahl der Behälter pro Datensatz, so dass das Produkt von Ihnen gewählten Bin-Breite und Behälter pro Datensatz größer als oder ungefähr gleich Ihre voraussichtliche vollständige Genesung sowie Pre ist -Bleichmittel und Bleich-Zeiten.
- Zurück zum Impulsgeber und stellen Sie die Frequenz des pre-bleach/bleach/monitor Sequenz gleich auf einen Wert knapp kleiner als der Kehrwert des Produkts der Bin-Breite mal der Anzahl der Behälter pro Datensatz. *
- Schließlich stellen Sie die Anzahl der Datensätze / Scan auf dem Scaler basierend auf der Signalintensität am gewünschten Monitor mit Strom versorgt.
* Es ist sehr wichtig, dass die Zeit für eine vollständige pre-bleach/bleach/monitor Sequenz (1/frequency) am Puls Generator größer als die Datensammlung Zeit (bin Breite x bins / record) auf der Scaler eingestellt ist. Wenn diese Kriterien nicht erfüllt ist, können mehrere Bleichmittel Trigger innerhalb eines einzelnen Datensatzes auf dem Scaler erscheinen.
- Stellen Sie den Monitor mit Strom versorgt, um ein akzeptables Niveau, ermittelt zuvor. Stellen Sie die Bleiche Leistung bis 200 mW oder so über das Bleichen Cutoff während der Monitor Bleichen ermittelt. Diese Befugnisse gesetzt sind, wie unterschiedliche Spannungen über den PC-Kristall.
- Seal das Mikroskop, löschte das Licht, schalten Sie den PMT, beginnen einen Punkt Scan auf dem Mikroskop-Software, starten Sie dann den Impulsgeber und Scaler.
- Analysieren Sie die resultierende Erholung durch Auftragen der Kurve und Kennzeichnung drei wichtige Punkte: 1) die Pre-Bleiche Fluoreszenz, 2) die Fluoreszenz sofort post-Bleichmittel, und 3) die Fluoreszenz am Ende des Datensatzes. Verwenden Sie die Fluoreszenz-Werte vor und unmittelbar nach der Bleiche zur besseren Abschätzung der Halb-Recovery-Zeit.
- Mit dieser Einschätzung der Halb-Recovery-Zeit, die Faustregeln zuvor, um neue Werte für die Pre-Bleichmittel, Bleichmittel bestimmen skizziert und bin Breite Dauer. Auch die Vor-Bleiche Fluoreszenz-und Fluoreszenz am Ende des Datensatzes zu einer besseren Abschätzung der Zeitaufwand für die vollständige Genesung zu erreichen. Als Faustregel gilt, sollten die Daten für einen Zeitraum, der für die vollständige Wiederherstellung für die zweite Hälfte der gemeldeten Daten ermöglicht gesammelt werden.
- Passen Sie die Parameter auf der Impulsgeber und Scaler, nehmen Sie eine neue Kurve, und weiterhin Feinabstimmung der Parameter, bis Ihr Kurve zeigt eine starke Bleichmittel und reibungslose Genesung. Beachten Sie, dass das Bleichmittel Dauer kann und sollte, unter der Faustregel verringert werden, wenn möglich. Das Bleichmittel Macht kann auch eingestellt werden, wenn zu flach oder zu tief, ein Bleichmittel erreicht werden.
4. Test für die Anregung Sättigung.
- Mit entsprechenden Monitor und Bleichmittel Kräfte bestimmt vorher, nehmen eine Reihe von MP-FRAP Kurven. Analysieren Sie jede Erholung, normiert auf die Pre-Bleiche Fluoreszenz, mit den entsprechenden mathematischen Form und eine nicht-lineare Least-Squares Fitting-Algorithmus (siehe "Data Analysis" weiter unten). Notieren Sie den angepassten Wert der Bleiche Tiefe Parameter.
- Setzen Sie die Einnahme und Analyse von aufeinander folgenden Reihe von MP-FRAP Kurven bei steigenden Werten der Bleiche Macht.
- Plot log (Bleiche Tiefe Parameter) als Funktion von log (Leistung). Jede Abweichung von einem Hang aus zwei gibt Anregung Sättigung. Wählen Sie ein Bleichmittel Macht, die ein starkes Bleichmittel ergibt, bewirkt aber keine Sättigung.
5. Weiter unter MP-FRAP Kurven.
- Setzen Sie die Einnahme Kurven, wie oben beschrieben, werden alle Parameter richtig eingestellt sind.
6. Data Analysis.
- Entfernen Sie die Pre-Bleichmittel und Bleich-Daten aus der Fluoreszenz-Daten einstellen und die Zeit-Daten, so dass t = 0 entspricht der Fluoreszenz-Wert sofort nach der Bleiche.
- Normalisieren der resultierenden Fluoreszenz Erholung in Bezug auf die durchschnittliche pre-Bleiche Fluoreszenz.
- Fit der normierten Kurve mit den entsprechenden mathematischen Modell und eine nicht-lineare, Least Squares Fitting-Algorithmus, wie die lsqcurvefit Funktion in MATLAB. Das hier vorgestellte Modell-Konten für die Fluoreszenz-Rückforderungen von beiden Diffusion und konvektive Strömung beeinflusst:
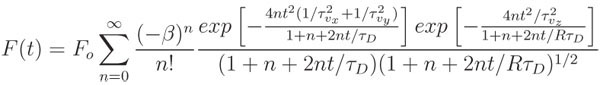
wo F o der Pre-Bleiche durchschnittliche Fluoreszenz, β der Bleiche Tiefe Parameter ist, τ D die charakteristische diffusive Recovery-Zeit ist, ist R das Verhältnis des Quadrats der axialen (w z) radial (w r) Breiten der Zwei-Photonen-Fokalvolumen, τ vx = w r / v x, τ vy = w r / v y, τ vz = w z / v z und v 2 = v x 2 + v y 2 + v z 2 ist die Geschwindigkeit des konvektiven Strömung. Für flow beschränkt sich auf die Bildebene, τ vz → ∞ und 1 / τ vx + 1 / τ vy kann mit 1 / τ vr ersetzt werden. In Abwesenheit von Konvektionsströmung, beide Exponenten im Zähler auf 1 zu gehen, und der Ausdruck ist stark reduziert, um nur zwei Anpassungsparameter, β und τ D. Der Diffusionskoeffizient ist leicht als D = w r 2 / 8τ D berechnet.
7. Repräsentative Ergebnisse.
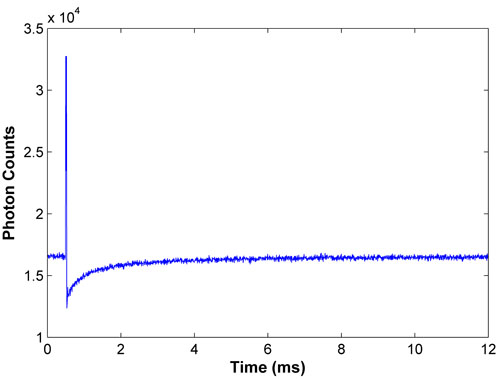
Abbildung 1. Representative Bleich-und Recovery-Kurve für FITC-BSA. Ein gutes Recovery-Kurve zeigt eine starke Bleichmittel und glatte Erholung, mit der Fluoreszenz bei voller Erholung wird für die zweite Hälfte der gemeldeten Daten.
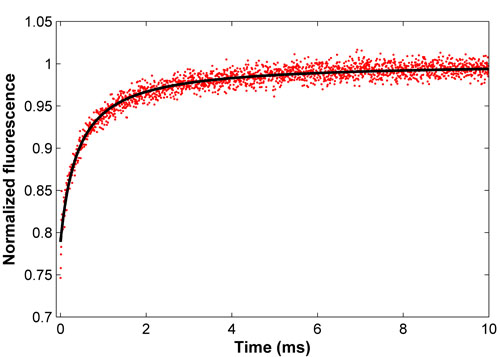
Abbildung 2. Normalized Recovery-Kurve für FITC-BSA (rot) und die damit verbundenen kleinsten Quadrate (schwarz). Diese passen ergibt sich ein Diffusionskoeffizient von 52,9 um2 / s, im Einklang mit der Literatur.
Diskussion
Die Macht der Multi-Photonen-Fluoreszenz-recovery after photobleaching liegt in seiner Fähigkeit, dicken Proben mit 3D-Auflösung Sonde. Seit seiner Entwicklung in den 1990er Jahren hat MP-FRAP verwendet worden, um den Diffusionskoeffizienten (oder analoge Transport-Parameter) in Zellkörper, ex vivo dicken Gewebeschnitten und in vivo Gewebe und Interstitium bestimmen. In diesem Artikel haben wir die notwendige Ausrüstung, um ein MP-FRAP-Experiment, sowie das richtige Verfahren für die Ausrichtung d...
Danksagungen
Diese Arbeit wurde durch ein Department of Defense Era of Hope Scholar Award (Nr. W81XWH-05 bis 0396) und eine Pew Scholar in der Biomedical Sciences Award Edward B. Brown III finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Ti:sapphire laser | Newport Corp. | Mai Tai | |
| Pockels Cell | Conoptics | 350-80 | |
| Laser Scanning Microscope | Olympus Corporation | Fluoview | |
| Short pass dichroic mirror | Chroma Technology Corp. | 670 DCSX-2P | |
| Photomultiplier tube | Hamamatsu Corp. | HC125-02 | |
| Photon counter | Stanford Research Systems | SR 400 | |
| Multi-channel scaler/averager | Stanford Research Systems | SR 430 | |
| Pulse Generator | Stanford Research Systems | DG 535 | |
| FITC-BSA | Invitrogen | -- |
Referenzen
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Biophys J. 60, 73-76 (1990).
- Brown, E. B., Wu, E. S., Zipfel, W., Webb, W. W. Measurement of molecular diffusion in solution by multiphoton fluorescence photobleaching recovery. Biophys J. 77, 2837-2849 (1999).
- Sullivan, K. D., Sipprell, W. H. B. r. o. w. n., Jr, E. B., Brown, E. B. Improved model of fluorescence recovery expands the application of multiphoton fluorescence recover after photobleaching in vivo. Biophys J. 96, 5082-5094 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten