Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Live-Bildgebung Drosophila melanogaster Embryonale Hemocyte Migrationen
In diesem Artikel
Zusammenfassung
Drosophila Blutzellen über die Gesamtheit des sich entwickelnden Embryos zu zerstreuen. Dieses Protokoll zeigt, wie die Montage und Bild dieser Migrationen Verwendung von Embryonen mit fluoreszenzmarkierten Blutzellen.
Zusammenfassung
Viele Studien befassen sich mit der Zellwanderung
Protokoll
Vorbereitung
- Erhalten entsprechenden Drosophila-Linien mit einer hemocyte-spezifische Gal4-Treiber (zB SRP-Gal4 2) und einem genetisch kodierten fluoreszierenden Reporter unter UAS Kontrolle (z. B. UAS-GFP). Fliegen homozygot für SRP-Gal4, UAS-GMA 3 oder CRQ-Gal4, UAS-GFP 4, 5 sind besonders nützlich für die Bildgebung Zwecke (nb GMA ist GFP fusioniert mit dem Aktin-bindende Domäne von Moesin), siehe unten für eine Diskussion über Bereich von Gal4 Treiber und uas Konstrukte zur Verfügung (die Bloomington Lager Zentrum enthält ein breites Spektrum).
- Typischerweise genetische Kreuze sind so ausgeführt, dass mutierte Allele ausgeglichen sind unter Verwendung von fluoreszierenden Balancer CTG oder TTG 6, mit Gal4 Treiber und uas Konstrukte auf alternative homologen Chromosomen durchgeführt. Dadurch ist es möglich, um homozygote Mutanten auf der Grundlage der Abwesenheit von CTG / TTG-assoziierten GFP-Fluoreszenz (dies ist in der Stufe 2,11 getan) zu wählen.
- Amplify Aktien und Platz fliegt in das Mauerwerk Käfig mit einem Apfelsaft-Agar-Platte 7. Die Fliegen müssen mindestens zwei Tage, um die Verlegung Käfig zu akklimatisieren, bevor genügend Embryonen verlegt werden beginnen. Im Allgemeinen twenty fliegt von jedem Geschlecht sollte ausreichen, um genügend Embryonen für die Bildgebung erzeugen, aber es ist zu beachten, dass verschiedene Linien haben unterschiedliche Grade der Fruchtbarkeit. Wir verwenden 55mm Petrischalen, die in den Boden eines Kunststoffbecher passen, an ihrer Basis punktiert, um den Luftstrom zu ermöglichen. Die genaue mittels Embryo-Entnahme ist unwichtig, aber die Zeiten sind, um vollständig zu sammeln kritischen inszeniert Embryonen.
- Sammeln Embryonen aus einer Übernachtkultur Apfelsaft-Agar-Platte bei 25 ° C oder von einer zeitlich Platte erhalten. Für letztere haben wir in der Regel erlauben die Fliegen auf einer vorgewärmten Platte für 4 Stunden lag, bevor Sie die Platte und stellen Sie es bei 18 ° C für 15-16 Stunden vor der Montage von Embryonen, dies sorgt für Embryonen aus späten Stadium 12 bis bis 15 der Entwicklungsphase. Eine Übernachtung Platte enthält eine größere Vielfalt der Stadien, sondern bietet den Vorteil der höheren Ebenen von fluoreszierenden Reporter Ausdruck in Blutzellen durch eine längere Zeit bei 25 ° C als Gal4-UAS-System ist temperaturempfindlich.
Verfahren
- Verdrängen Embryonen aus der Apfelsaft-Agar-Platte mit einer geringen Menge Wasser und einer weichen Spitze Pinsel. Entfernter Embryonen können leicht mit dem bloßen Auge gesehen werden.
- -Embryonen eine Zelle Sieb (Fisher) oder hausgemachte Warenkorb 7 von strömendem Wasser aus der Apfelsaft-Agar-Platte in den Korb über einen Becher gehalten, um Abwasser zu sammeln.
- Wiederholen Sie Schritt 2.2 bis Sie zufrieden sind, Sie haben genug Embryonen aus der Apfelsaft-Agar-Platte übertragen.
- Wash Embryonen in Zellsieb / Korb mit Wasser.
- Legen Sie Zellsieb / Korb in der Petrischale Deckel der Apfelsaft-Agar-Platte, und fügen Sie genug saubere Bleichmittel auf Embryonen in die Zelle Sieb / Korb auszusetzen.
- Folgen Sie dechorionation der Embryonen auf einem Dissektionsmikroskop unter Hellfeld: dechorionation ist abgeschlossen, wenn die Rückenanhänge aufgelöst haben, die innerhalb von zwei Minuten auftreten.
- Entfernen Zellsieb / Korb mit Embryonen aus der Bleich-und abwaschen Bleichmittelreste mit Wasser. Alle Spuren von Bleichmittel sollten, bevor Sie fortfahren bis 2,8 entfernt werden. Ein Trick, um festzustellen, ob alle der Bleiche entfernt wurde ist es, abtupfen Restwasser auf blauen Labor Gewebe - wenn es Bleichmittelreste die blaue Farbe wird gebleicht weiß / rosa sein.
- Blot off restliche Wasser mit Labor Gewebe / mediwipes angewendet an der Unterseite der Zelle Sieb / Korb.
- Legen Sie einen Tropfen Wasser in eine Petrischale Deckel. Mit einem feinen Pinsel, sammeln Sie alle dechorionated Embryonen aus dem Embryo Korb und resuspendieren sie in den Tropfen. Next trocknen die Embryonen durch Absaugen Wasser mit einer Mikropipette oder sorgfältig absorbierenden es mit einem Labor Gewebe / mediwipes.
- Einmal wurden die Embryonen getrocknet worden, einen Tropfen Öl Voltalef alle Embryonen zu decken. Setzen Sie einen zweiten kleinen Tropfen Öl neben der Tröpfchen mit den Embryonen. NB es uns nicht gelungen, eine in Großbritannien ansässige Anbieter von Voltalef Öl zu finden; Halocarbonöl 700 (Sigma) können ebenfalls verwendet werden.
- Unter einem fluoreszierenden Dissektionsmikroskop wählen entsprechend inszeniert Embryonen des gewünschten Genotyp mit einem Paar Uhrmacher Pinzette (Nummer 5) aus der Öltröpfchen. Diese Zange ist nach innen gebogen (Abbildung 1) werden, um zu schöpfen die Embryonen ohne Durchstechen der Dotterhaut. Transfer ausgewählter Embryonen in die zweite Öltröpfchen. Es ist wichtig, dass Sie in der Lage, fluoreszierenden Blutzellen auf dem Binokular sehen, um in der Lage sein, um gute Bilder auf dem konfokalen Mikroskop (Abbildung 2) zu sammeln. Wir typischerweise montieren Bühne 13/14 Embryonen Bild seitliche Migration von Blutzellen auf der ventralen Mittellinie oder Stufe 15 Embryonenzur Abbildung der Motilität von Blutzellen nach Zerstreuung über den Embryo.
- Stick zwei Deckgläsern (18x18mm, Dicke 1) an der Unterseite eines Petriperm / lumox Schale (Sarstedt), mit 2 kleinen Tropfen Voltalef Öl, so dass ca. 1 cm zwischen ihnen (Abb. 3), diese werden verwendet, um ein Deckglas platziert über Unterstützung die Embryonen, um nicht zu zerquetschen. Petriperm Gerichte (50mm Durchmesser) enthalten eine hydrophobe, gasdurchlässige Membran. Wir finden, dass die Gerichte einfacher zu bedienen, wenn sie bereits mehrfach verwendet haben (Gerichte können mit 70% Ethanol abgewischt und wieder verwendet werden) zu werden.
- Unter Hellfeld auf die Dissektionsmikroskop, abholen ausgewählten Embryonen eins nach dem anderen mit dem gebogenen Pinzette und Line sie Bauchseite nach oben und parallel zur Kante der Deckgläser (Abbildung 3). Es ist möglich, richten bis zu 15 Embryonen auf diese Weise, je nach Geschicklichkeit und Geduld. Es ist wichtig, um die Embryonen vorsichtig zu manipulieren, da sowohl die Embryonen und Petriperm Gericht Membran zerbrechlich sind und kann leicht gebrochen werden.
- Sobald die Embryonen ausgerichtet fügen Sie einen kleinen Tropfen Öl und lassen Sie es verbreitet zu einer homogenen Schicht zwischen den beiden Deckgläsern bilden. Nachdem das Öl ausgebreitet hat (dies kann einige Minuten dauern) zu überprüfen, dass die Embryonen noch Bauchseite auf. Wenn die Embryonen leicht gerollt haben, positionieren Sie sie wieder mit der Zange.
- Schließlich mit einer Pinzette (Nummer 3) statt einem Deckglas (18x18mm, Dicke 1) über die Embryonen, gestützt auf die beiden zuvor eingehalten Deckgläser. Kleben Sie dieses Deckglas auf das Deckglas unterstützt die Verwendung von Nagellack (Abbildung 3).
- Nehmen Sie die Petriperm Gericht mit montiertem Embryonen in die konfokale oder Weitwinkel-Mikroskop und montieren Sie die Petriperm Gericht auf der Bühne mit einem entsprechenden Adapter. Entweder eine aufrechte oder inverse Mikroskop verwendet werden, mit dem Objektiv Fokussierung durch das Deckglas (wie durch die Membran entgegen).
Vertreter Ergebnis:
Dieses Protokoll beschreibt, wie Drosophila-Embryonen für die Live-Darstellung von Blutzellen auf der Bauchseite des Embryos zu montieren. Wenn es richtig gemacht wird es leicht sein, um entweder Standbilder oder Filme von Blutzellen zu generieren. Die wichtigste Determinante ist das Mikroskop zur Abbildung der Blutzellen (insbesondere das Objektiv), aber die Art der Bilder erworben werden sie auch auf der Stufe der Entwicklung ab, die Temperatur der Embryonen wurden bei angehoben und die Gal4 und UAS-Linien verwendet.
Höhere fluoreszierende Protein-Expression ermöglicht Blutzellen mit größerer Leichtigkeit abgebildet werden, daher ist es wichtig zu können Blutzellen zu sehen, wenn die Embryonen im Stadium 2.11 des Protokolls (Abbildung 2 enthält Beispiele für klare Blutzellen innerhalb Embryonen mit einer getroffen werden Kamera ausgestattet, eine Dissektionsmikroskop). Deshalb erhöhte Anzahl von Gal4 und UAS-Konstrukte ermöglichen ein größeres Signal-Rausch-Verhältnis. Des Weiteren wird diese reduziert den Bedarf an hohen Intensitäten oder erhöhte Belichtungszeiten bei der Abbildung, was wiederum ermöglicht hemocyte Verhalten für längere Zeit zu folgen.
Sehr hohe GFP-Expression zeigen sich feine Details der hemocyte Morphologie, besonders die dünnen flächigen Lamellen, dass die kreisförmige Zellkörper (Abb. 4A-B) umgeben. Circular Regionen ohne GFP vertreten Phagosomen (Abb. 4A-C). Finger-wie Filopodien ist auch ersichtlich, die sich aus den Lamellen (Abbildung 4B) werden. Zwei Gal4-Treiber noch ausreichen, um diese Prozesse (4C), siehe vor allem, wenn einer oder mehr SRP-Gal4 (siehe Diskussion), aber langsamer Scangeschwindigkeit oder mehr Laserleistung auf dem konfokalen Mikroskop kann erforderlich sein. Als Ausdruck Niveau sinken, wird es schwieriger zu Bild die Vorsprünge von Blutzellen, trotzdem ist es immer noch möglich, die Migration von Blutzellen unter diesen Bedingungen Spur wie die Zellkörper bleibt offensichtlich auch dann, wenn Vorsprünge weniger deutlich (Abbildung 4D) sind.
In früheren Stadien der Entwicklung (bis 13 Stufe) Blutzellen in engem Kontakt zu einer anderen migrieren und es ist oft schwer zu einzelnen Zellen zu unterscheiden. Bis zum Ende der 13. Etappe Blutzellen haben eine einzige Linie in der ventralen Mittellinie (Abbildung 5A) gebildet, dann, immer beweglich, seitlich wandern, um die Kanten des Bauchmark (Abbildung 5B). Das Aktin-Zytoskelett in der dynamischen Vorsprünge Blutzellen können direkt durch die Expression des GMA (Abbildung 5C) oder Kirschbaum-Moesin beobachtet werden.
Montage des Embryos auf diese Weise ermöglicht Gasaustausch und verhindert das Austrocknen und Embryonen lebensfähig bleiben folgende Abbildung. Wenn der Embryo bei der Montage ist es im Allgemeinen auf der Hand, da der Embryo Inhalt durch seine Dotterhaut Leck wird beschädigt. Wenn ein Embryo nicht zu starten, um dann austrocknen kann dies oft durch Verformungen in der Dotterhaut gesehen worden. Gelegentlich ein Embryo wird im Laufe eines Zeitraffer Film roll, allerdings nur tendenziell länger Zeitskala Filme problematisch. Lastly, der Montage von mehreren Embryonen auf einmal gibt der Experimentator die beste Chance auf ein Embryo in die perfekte Orientierung für ihr Experiment.

Abbildung 1. Pinzetten zur Manipulation von dechorionated Embryonen.
Die Spitzen der Uhrmacher Pinzette (Größe Nr. 5) sollte nach innen gebogen werden, um Mode ein Werkzeug aufnehmen Embryonen wie hier gezeigt. Die äußere Oberfläche des gebogenen Region ist auch nützlich, um Embryonen zu manipulieren, wenn die Positionierung auf dem Petriperm Membran, da sie keine scharfen Kanten sein, die die Embryos besitzen.
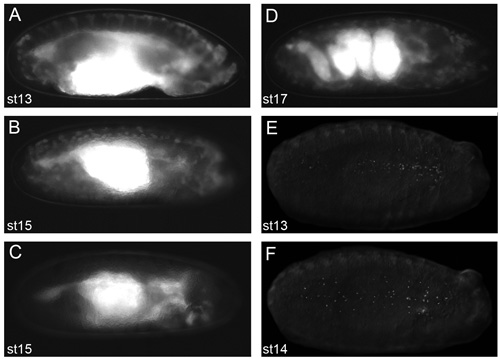
Abbildung 2. Repräsentative Bilder von Embryonen, die gute Live-Imaging-Ergebnisse zu erhalten.
Bilder von dechorionated Embryonen in Voltalef Öl (auf Stufe 2.11 des Protokolls) auf einem fluoreszierenden Präpariermikroskop genommen. Seitenansichten der Stufe 13 (A) und der Stufe 15 (B) SRP-Gal4, UAS-GFP; CRQ-Gal4, UAS-GFP Embryonen. Seitliche Ansicht einer Stufe 15 SRP-Gal4, UAS-GFP / +; CRQ-Gal4, uas-GFP/uas-N17Rac Embryo (C) in die Blutzellen haben es versäumt, die Migration aus dem Kopf, zu zeigen, was Embryonen aussehen, wenn Blutzellen nicht entlang ihrer Migrationsrouten erkennbar. Seitliche Ansicht einer Stufe 17 SRP-Gal4, UAS-GFP; CRQ-Gal4, UAS-GFP Embryo zeigt die verschlungenen Struktur des Darms in diesem Stadium der Entwicklung (D), das Auftreten von Muskel-Kontraktion wird verhindert, Live-Aufnahmen von Embryonen jenseits dieser Stadium der Entwicklung. Ventral Blick auf Stufe 13 (E) und der Stufe 14 (F) SRP-Gal4, UAS-rote Stachel Embryonen zeigen die Verbreitung von Blutzellen mit fluoreszenzmarkierten Kernen. Die Beobachtung der Blutzellen durch Fluoreszenz im Stadium 2.11 des Protokolls ist eine Voraussetzung für gute Bilder zu erhalten; vordere ist auf der rechten Seite für alle Bilder.

Abbildung 3. Montage von Embryonen auf einem Petriperm / lumox Gericht.
Zwei 18x18mm Deckgläser (Dicke 1) sind an der Unterseite des Petriperm Teller mit einem kleinen Tropfen Öl, um etwa 1cm als getrennt dargestellt stecken. Die Embryonen werden dann bis Bauchseite aufgereiht mit ihren langen (anterior-posterior)-Achse parallel zu den Rändern der Deckgläser und mit einem kleinen Tropfen Öl. Sobald das Öl ausgebreitet hat, um die Lücke zwischen den beiden Deckgläsern ein Drittel Deckglas (18x18mm Dicke 1) vorsichtig auf der Öl-bedeckten Embryonen mit Hilfe der beiden zuvor eingehalten Deckgläser als Brücke zu den Embryonen entfernt, zerquetscht zu verhindern, ist in Verkehr gebracht. Das Deckglas wird dann an den beiden Brücken Deckglas mit zwei kleinen Tropfen Nagellack verklebt. Einmal eingestellt, kann die Embryonen auf eine aufrechte oder inverse Mikroskop mit dem Objektiv Fokussierung nach unten durch das Deckglas (wie durch die Membran im Gegensatz Petriperm) abgebildet werden.
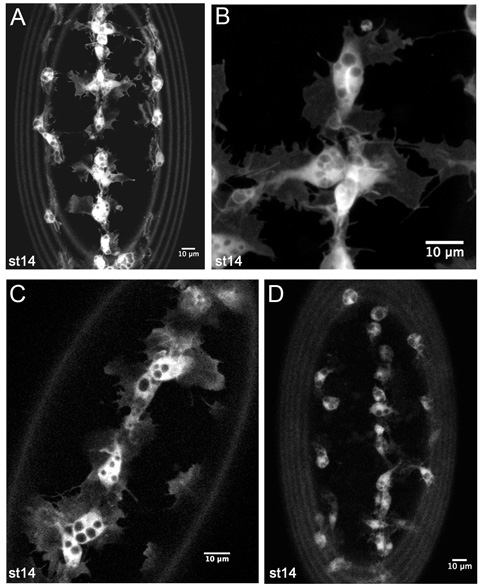
Abbildung 4. Repräsentative Ergebnisse aus Live-Aufnahmen von GFP-markierten Blutzellen.
Z-Projektionen von Blutzellen auf der Bauchseite eines Stufe 14 SRP-Gal4, UAS-GFP; CRQ-Gal4, UAS-GFP Embryo (AB). (A) ist eine niedrigere Vergrößerung Bild wie zur hemocyte Entwicklungs-Migrationen in Zeitraffer-Filme zu überwachen. (B) ist ein höherer Vergrößerung immer noch von Blutzellen auf der ventralen Mittellinie, zeigt feine Details ihrer Morphologie. (C) ist ein einzelner 1 m Scheibe Blutzellen auf der ventralen Mittellinie in einer Stufe 14 SRP-Gal4, UAS-GFP / +; CRQ-Gal4, UAS-GFP / + Embryonen und enthüllt, dass niedrigere Kopienzahlen Gal4 Treiber und uas Konstrukte sind auch ausreichend, um gute Bilder zu erzeugen. (D) zeigt eine z-Projektion der Blutzellen in einer Stufe 14 CRQ-Gal4, UAS-GFP Embryo. Hier hemocyte Vorsprünge sind weniger offensichtlich aufgrund der geringeren Expression von GFP, aber es ist immer noch möglich, Filme zu machen und zu verfolgen hemocyte Migration mit dieser Kombination von Gal4-Treiber und Fachhochschulen zu errichten. Die Bilder wurden auf einem Leica LSM510 konfokalen Mikroskop aufgenommen; vordere ist in allen Bildern, die Ringe an der Peripherie der Bilder sind durch Dotterhaut Autofluoreszenz verursacht.

Abbildung 5. Repräsentative Ergebnisse aus Live-Aufnahmen von GMA Ausdruck Blutzellen.
Z-Projektionen von Blutzellen auf der ventralen Mittellinie der Stufe 13 (A) und der Stufe 14 (B) SRP-Gal4, UAS-GMA Embryonen aus Zeitraffer-Filme getroffen, um Entwicklungs-Migrationen von Blutzellen zeigen. Detaillierte Informationen über Aktindynamik kann durch höhere Vergrößerung Bildgebung von GMA Ausdruck Blutzellen (C) bezogen werden. GMA besteht aus GFP fusioniert mit dem Aktin-bindende Domäne von Moesin und Etiketten Aktinfilamente. Anterior ist in allen Bildern, Bilder wurden auf einem konfokalen Mikroskop aufgenommen.
Diskussion
Die wichtigsten Elemente dieses Verfahrens sind die Auswahl gesunder Embryonen mit deutlich gekennzeichneten Blutzellen und sie vorsichtig montieren, ohne sie zu beschädigen. Sobald die Embryonen in die Halocarbonöl sind, sind sie resistent gegen Austrocknung und einmal montiert werden kann für mehrere Stunden abgebildet werden. In unseren Händen können wir Bild Blutzellen für drei Stunden, mit vernachlässigbarer Austrocknung des Embryos oder offensichtliche Foto-Schäden, wobei ein z-Stapel von Bildern alle drei...
Danksagungen
Dieses Protokoll wurde durch unsere Arbeit im und in Zusammenarbeit mit den Labors von Paul Martin und Antonio Jacinto entwickelt. Wir danken der Bloomington Lager Zentrums für seinen ausgezeichneten Service und die Drosophila-Community für die Weiterbildung zu fliegen Linien teilen. BS wird derzeit von einer BBSRC Projektförderung finanziert. WW wird durch eine Wellcome Trust Career Development Fellowship gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| Cell strainer | BD Biosciences | 352350 | 70μm pores |
| Halcarbon oil 700 | Sigma-Aldrich | H8898 | |
| Lumox/Petriperm dish | Sarstedt Ltd | 96077305 |
Referenzen
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Bruckner, K. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Dev Cell. 7, 73-84 (2004).
- Dutta, D., Bloor, J. W., Ruiz-Gomez, M., VijayRaghavan, K., Kiehart, D. P. Real-time imaging of morphogenetic movements in Drosophila using Gal4-UAS-driven expression of GFP fused to the actin-binding domain of moesin. Genesis. 34, 146-151 (2002).
- Stramer, B. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Halfon, M. S. New fluorescent protein reporters for use with the Drosophila Gal4 expression system and for vital detection of balancer chromosomes. Genesis. 34, 135-138 (2002).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila protocols. , (2000).
- Tepass, U., Fessler, L. I., Aziz, A., Hartenstein, V. Embryonic origin of hemocytes and their relationship to cell death in Drosophila. Development. 120, 1829-1837 (1994).
- Millard, T. H., Martin, P. Dynamic analysis of filopodial interactions during the zippering phase of Drosophila dorsal closure. Development. 135, 621-626 (2008).
- Doerflinger, H., Benton, R., Shulman, J. M., St Johnston, D. The role of PAR-1 in regulating the polarised microtubule cytoskeleton in the Drosophila follicular epithelium. Development. 130, 3965-3975 (2003).
- Olofsson, B., Page, D. T. Condensation of the central nervous system in embryonic Drosophila is inhibited by blocking hemocyte migration or neural activity. Dev Biol. 279, 233-243 (2005).
- Paladi, M., Tepass, U. Function of Rho GTPases in embryonic blood cell migration in Drosophila. J Cell Sci. 117, 6313-6326 (2004).
- Vlisidou, I. Drosophila embryos as model systems for monitoring bacterial infection in real time. PLoS Pathog. 5, e1000518-e1000518 (2009).
- Jacinto, A. Dynamic actin-based epithelial adhesion and cell matching during Drosophila dorsal closure. Curr Biol. 10, 1420-1426 (2000).
- Wood, W., Jacinto, A. Imaging cell movement during dorsal closure in Drosophila embryos. Methods Mol Biol. 294, 203-210 (2005).
- Kunwar, P. S. Tre1 GPCR initiates germ cell transepithelial migration by regulating Drosophila melanogaster E-cadherin. J Cell Biol. 183, 157-168 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten