Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Plastic Embedding und Schnitte von Xenopus laevis Embryonen
Zusammenfassung
Kunststoffprofile pflegen wahre Gewebemorphologie in dünne Schnitte von Gewebe, das mit fluoreszierenden Sekundärantikörper immungefärbt werden können, so dass diese Methode besser geeignet als Paraffin eingebettet oder Gefrierschnitten für viele Arten von Gewebe. Die Methode zur Färbung-, Kunststoff-Einbettung und Schneiden wird in diesem Video demonstriert.
Zusammenfassung
Protokoll
Fixierung
- Transfer ganzen Embryonen oder seziert Explantate in MEMFA oder 3,7% FA + PBS in einem kleinen Glasszintillationsröhrchen (Fisher cat # 03-339-25B). Inkubieren Durchstechflasche auf dem Kolbenpendel bei RT nur für 2 Stunden und nicht mehr. Lassen Sie den Embryo in FA für mehr als 2 Stunden. Längere Inkubation in FA wird das embryonale Gewebe härter und führen zu einer schlechten Penetration von Antikörpern in der Detektion.
- Saugen Sie die meisten FA und fügen Dent ist Fixativ bis an die Spitze des Fläschchens (~ 4,5 ml). Vorsichtig auf den Kopf der Flasche für ein paar Mal um die Embryonen in Dents waschen, den Austausch mit anderen 4.5ml von frischen Dent ist, und inkubieren sie in -20 º C für mindestens 48 Stunden. Übernachtung ist nicht genug. Dieser Schritt macht die Embryonen durchlässiger für den Antikörper. Embryonen können in diesem Zustand für mehrere Wochen aufbewahrt werden.
Immunfluoreszenz
- Rehydrieren die Probe. Inkubieren es in einer abgestuften Reihe von Methanol, wie folgt:
75% MeOH / H 2 O 10min 50% MeOH / PBS 10min 25% MeOH / PBS 10min PBS 10min PBS 10min - Machen 1,5% Agarose / PBS-Platten mit 60mm Plastikschalen. Gießen PBS auf dem Agarose, nachdem es geworden ist solide.
- Hemi-Schnitte der Embryonen: Setzen Sie die Embryonen in einem 1,5% Agarose / PBS Platte. Schnappen eines Embryos mit einer Pinzette und schneiden Sie es in der Hälfte durch die Mitte des Embryos mit einem dünnen Rasierklinge. Wählen Sie diejenigen, die Sie erfolgreich in die Hälfte haben mit einem geraden Schnittebene geschnitten.

- Übertragen Sie die halbierten Embryonen in einen Glasszintillationsröhrchen mit PBT. Austausch mit 4.5ml 20% Ziegenserum + PBT. Inkubation bei RT für 2 Stunden auf einem Kolbenpendel (Blocking).
- Eine geeignete Verdünnung des primären Antikörpers in PBT. 0,5 ml dieser Proben pro benötigt wird. Zum Beispiel habe ich 1 / 200 Verdünnung des Kaninchen-Anti-C-Cadherin pAb die subzelluläre Lokalisation von C-Cadherin in 5mm Kunststoff Abschnitte zu studieren.
- Absaugen der Blockierungslösung und fügen 0,5 ml des verdünnten primären Antikörper. Legen Sie die Fläschchen in Stand-up-Position auf einem Styropor-Rohrhalter. Inkubieren über Nacht bei 4 º C auf einem Kolbenpendel.
- Entfernen Sie die verdünnten primären Antikörper (dieser verdünnten primären Antikörper können gespeichert und wiederverwendet werden in den nächsten 1-2 Wochen). Waschen mit 4,5 ml des PBT für 4-fach (40-60 Minuten) bei RT.
- Exchange mit 0,5 ml 1 / 100 Verdünnung des Biotin-konjugierten sekundären Antikörper in PBT. Inkubieren über Nacht bei 4 º C auf einem Kolbenpendel. Decken Sie die Röhrchen mit Alu-Folie an Biotin vor Licht zu schützen.
- Ab diesem Zeitpunkt sollte darauf geachtet werden, um die Probe vor Licht, dh zu schützen, halten Sie die Fläschchen unter einigen Abdeckung oder Alufolie werden.
- Entfernen Sie die Biotin-Sekundär-Antikörper (dies kann auch in den nächsten 1-2 Wochen wieder verwendet werden). Wash mit oder 4.5ml von PBT für 4-fach (40-60 Minuten) bei RT.
- Exchange mit 0,5 ml 1 / 200 Verdünnung des fluoreszenzmarkierten (FITC, Texas-Rot, etc.) Streptavidin in PBT. Inkubieren über Nacht bei 4 º C auf einem Kolbenpendel.
- Entfernen Sie das Streptavidin (diese können wiederverwendet werden kann). Waschen mit 4,5 ml des PBT für 3-mal (15 bis 30 Minuten) bei RT.
- Fix die Embryonen in 4,5 ml von 3,7% FA + PBS für 30 Minuten bei RT.
- Waschen mit 4,5 ml PBS zweimal.
- Entwässern der Probe. Inkubieren es in einer abgestuften Reihe von Ethanol, wie folgt:
30% EtOH / H 2 O 10 min 50% EtOH / H 2 O 10 min 75% EtOH / H 2 O 10 min 100% EtOH 10 min - Die Probe kann in 100% EtOH bei 4 º C mit einer Abdeckung, um sie vor Licht zu schützen gespeichert werden.
Infiltration
- Machen Technovit 7100 Infiltration zu mischen. Ich mache für gewöhnlich 15ml der Basis Flüssigkeit in einem 50ml konischen Rohr, fügen 150mg Härter I und mischen Sie es mit Schaukeln auf einem Kolbenpendel für 15 Minuten. Diese Infiltration Mischung kann bei 4 ° C aufbewahrt werden bis zu einem Monat.
- Infiltrate der Probe mit der Infiltration Mix durch den Austausch mit einer abgestuften Reihe von Technovit Infiltration mix / EtOH-Combo, wie folgt:
- 50% Technovit / EtOH - 1 Stunde
- 100% Technovit - 1 Stunde
- 100% Technovit - Übernachtung
- 50% Technovit / EtOH - 1 Stunde
- Die specimen kann in der 100%-Infiltration Mix gelagert werden bis zu einem Monat bei 4 º C. Setzen Sie einen Deckel auf die Proben, um sie vor Licht zu schützen.
Embedding
- Machen Technovit 7100 Einbettung Mix: Take 0,75 ml der Infiltration Mix in einem 1,5 ml Tube und füge 50 ml Härter II. Mix it durch Invertieren des Röhrchens mehrmals.
- Mit einem Kunststoff Transferpipette, nehmen Sie eine Probe infiltriert über Nacht in 0,5 ml dünnwandigen PCR-Röhrchen. Entfernen Sie die meisten der Überstand.
- Add 0,25 ml der Einbettung Mischung in Schritt 1 dieses Abschnitts, "Embedding", auf die Probe gestellt. Richten Sie die halbierten Embryo in die Dissektionsfläche Blick auf den Boden des Röhrchens zu machen, indem Sie vorsichtig nudging mit einer stumpfen Nadel-Spitze Dissektion (Holz-Griff Dissektion Nadel).
- Schließen Sie den Deckel und inkubieren das Rohr an einem dunklen Ort für ca. 4 Stunden, damit der Kunststoff polymerisieren.
- Machen Technovit 3040 mischen. Nehmen Sie 1 Gramm des Pulvers auf eine Waagschale, und fügen Sie 0,5 ml der Flüssigkeit. Sofort-Mix Pulver und Flüssigkeit mit einem bluetip. Füllen Sie auf der gehärteten spacimen. Diese gelbe Technovit 3040 wird die gesamte Kunststoff-Block kommen aus dem Rohr zu verhindern.
Sectioning
- Wischen Histoknife H mit Xylol (EtOH ist oft nicht gut genug) und setzen Sie ihn auf Ihrer Mikrotom. Angle die Klinge bei etwa 45 °. Wischen Sie die Bühnenfläche vor der Klinge mit Xylol, auch, weil die Reinheit diesem Bereich ist entscheidend für die Qualität der geschnittenen Scheiben schneiden.
- Schneiden Sie die Seite des Rohres und schälen die Spitze aus mit einer Pappe Messer.
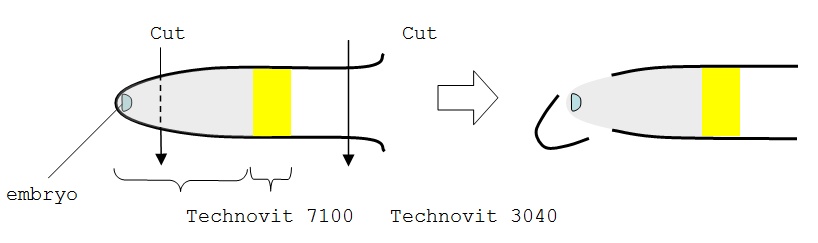
- Stellen Sie die Probe in das Futter Inhaber des Mikrotoms.
- Bringen Sie ein "press-to-Siegel" Silizium-Isolator auf einem Objektträger auf einer Montageplatte Kammer für Schnittscheiben machen. Drücken Sie das Isolator, um die Folie auf sauberen Tisch-und schaue von der anderen Seite, um sicherzustellen, dass der Isolator vollständig ohne Luftblasen befestigt. Gießen Sie sauber und warm dH 2 O (~ 40 ° C), um den Pool auf der Folie mit einer Pasteurpipette, bis auf die Ebene, wo sie sehen, dass die Wasseroberfläche flach, nicht konkav oder konvex in Form wird können.
- Beginnen Sie mit Abschnitt Scheiben schneiden. Für Immunfluoreszenz-Studien, mache ich 5 mm Abschnitt Scheiben schneiden. Für in-situ-Hybridisierung Proben kann die Dicke der Scheiben im Bereich von ~ 3 eingestellt werden - 8 mm, je nach Zweck und die Intensitäten der Signale.
- Tragen Sie den Abschnitt Scheiben von der Bühne vor der Klinge an der Montageplatte wird mit Wasser gefüllt, mit einem kleinen Pinsel. Halten Sie den Pinsel mit einer Scheibe auf der Oberseite des Schwimmbad-and-Drop die Scheibe hinunter zum Wasser durch Klopfen mit einem matt-Spitze Dissektion Nadel. Die Scheibe wird in eine runde Form so bald erweitern, da sie die Oberfläche des Wassers Treffer.
- Wenn die meisten der Wasserfläche der Montage Kammer mit Schnittscheiben gefüllt ist, saugen fast die Hälfte des Wassers mit einer Pasteurpipette. Inkubieren Sie die Folie auf einer Folie wärmer Nacht, um die Probe vollständig zu trocknen.
- Counter-Fleck mit 1 ml DAPI (0.1mg/ml in TE) für fünf Minuten. Saugen Sie DAPI und trocknen Sie die Probe.
- Entfernen Sie das Silikon-Kautschuk-Isolator aus der Folie. Jetzt Bilder können von der Probe entnommen werden. Bewahren Sie die Probe bei 4 ° C, vor Licht geschützt.
Materialien
Primärer Antikörper gegen Ihren Antigen oder Epitop-Tags: Machen Sie eine entsprechende Verdünnung in PBT. Biotin-konjugierten sekundären Antikörper: Verschiedene Anbieter verkaufen Biotin-konjugierten Antikörper.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten