Method Article
Bestimmung des mitochondrialen Membranpotentials und Reactive Oxygen Species in Live Rat kortikalen Neuronen
In diesem Artikel
Zusammenfassung
Wir demonstrieren die Anwendung der Fluoreszenz-Indikator, TMRM, in kortikalen Neuronen, die relativen Veränderungen in TMRM Fluoreszenzintensität vor und nach der Anwendung eines bestimmten Stimulus zu bestimmen. Wir zeigen auch die Anwendung der Fluoreszenz-Sonde H 2 DCF-DA auf die relative Höhe der reaktiven Sauerstoffspezies in kortikalen Neuronen zu beurteilen.
Zusammenfassung
Mitochondrialen Membranpotentials (ΔΨm) ist entscheidend für die Aufrechterhaltung der physiologischen Funktion der Atmungskette zur ATP zu generieren. Ein signifikanter Verlust von ΔΨm macht Zellen von Energie mit anschließender Tod erschöpft. Reaktive Sauerstoffspezies (ROS) sind wichtige Signalmoleküle, aber ihre Häufung in pathologischen Zuständen führt zu oxidativem Stress. Die beiden wichtigsten Quellen von ROS in der Zelle sind Umweltgifte und den Prozess der oxidativen Phosphorylierung. Mitochondriale Dysfunktion und oxidativer Stress in der Pathophysiologie vieler Krankheiten in Verbindung gebracht, daher die Fähigkeit, ΔΨm und ROS bestimmen kann wichtige Hinweise über die physiologischen Zustand der Zelle und die Funktion der Mitochondrien liefern.
Mehrere Fluoreszenzsonden (Rhodamin 123, TMRM, TMRE, JC-1) kann verwendet werden, um Δψm in einer Vielzahl von Zelltypen zu bestimmen, und viele Fluoreszenz-Indikatoren (Dihydroethidium, Dihydrorhodamin 123, H 2 DCF-DA) kann verwendet werden, um ROS bestimmen . Fast alle der verfügbaren Fluoreszenz-Sonden verwendet werden, um ΔΨm oder ROS beurteilen einzigen Wellenlänge Indikatoren, die erhöhen oder verringern ihre Fluoreszenzintensität proportional auf einen Stimulus, erhöht oder verringert die Höhe der ΔΨm oder ROS. So ist es unerlässlich, die Fluoreszenz-Intensität dieser Sonden an der Grundlinie auf und nach der Anwendung eines spezifischen Reiz zu messen. Dies erlaubt es, den Prozentsatz der Änderung in der Fluoreszenzintensität zwischen der Grundlinie Ebene und einen Stimulus zu bestimmen. Diese Änderung in der Fluoreszenz-Intensität spiegelt die Veränderung der relativen Werte von ΔΨm oder ROS. In diesem Video zeigen wir, wie die Fluoreszenz-Indikator, TMRM, in Ratte kortikalen Neuronen beziehen sich auf die prozentuale Veränderung in TMRM Fluoreszenzintensität zwischen der Grundlinie auf und nach der Anwendung FCCP, eines mitochondrialen Entkoppler zu bestimmen. Die unteren Ebenen der TMRM Fluoreszenz aus FCCP Behandlung spiegeln die Depolarisation des mitochondrialen Membranpotentials. Wir zeigen auch, wie die Fluoreszenz-Sonde H 2 DCF-DA beziehen sich auf die Ebene von ROS in kortikalen Neuronen, zuerst an der Basislinie zu beurteilen und dann nach der Anwendung von H 2 O 2. Dieses Protokoll (mit kleinen Änderungen) kann auch verwendet werden, um Änderungen in ΔΨm und ROS in verschiedenen Zelltypen und in Neuronen von anderen Hirnregionen isoliert zu bestimmen.
Protokoll
1. Zellkultur
- Kortikalen Neuronen isoliert und gezüchtet Verwendung der vorher beschriebenen Techniken und plattiert auf Kulturschalen mit Glasboden (MatTek Corporation, Ashland, MA) mit Poly-D-Lysin und Laminin 1 beschichtet.
2. Vorbereitung der Stammlösungen für die fluoreszierenden Sonden TMRM und H 2 DCF-DA
- Bereiten Sie eine 10-mM Stammlösung von TMRM durch Auflösen von 5,0 mg TMRM in 1 ml wasserfreiem Dimethylsulfoxid. Vortex es für 1 min. Dann machen Aliquots und lagern Sie sie bei -20 ° C, vor Licht schützen, und innerhalb von 1 Monat.
- Als nächstes bereiten ein 10-mM Stammlösung von H 2 DCF-DA durch Auflösen von 4,87 mg H 2 DCF-DA in 1 ml wasserfreiem DMSO. Ebenso Vortex es für 1 min. Dann machen Aliquots und lagern Sie sie bei -20 ° C, vor Licht schützen, und innerhalb von einer Woche.
3. Loading Ratte kortikalen Neuronen mit TMRM und H 2 DCF-DA
TMRM ist eine potentiometrische, zellpermeablen fluoreszierenden Indikator dafür, dass in der stark negativ geladenen Inneren der Mitochondrien akkumuliert. Es ist wichtig, die geringen Konzentrationen (10-50 nM-Bereich) von TMRM nutzen, um auto-Abschrecken der mitochondrialen TMRM zu vermeiden. Dann kann das Fluoreszenzsignal TMRM direkt Zusammenarbeit im Zusammenhang mit ΔΨm über die innere Membran der Mitochondrien. Ein Verlust von ΔΨm Ursachen TMRM von Mitochondrien, woraus ein Verlust der Fluoreszenzintensität auslaufen. H 2 DCF-DA ist zellpermeablen Sonde in DCF-DA durch intrazelluläre Esterasen umgewandelt, und die Oxidation führt in fluoreszierenden DCF. Die Endkonzentration von H 2 DCF-DA liegt zwischen 2-10 um und es sollte empirisch in Neuronen aus verschiedenen Hirnregionen abgeleitet getestet werden, da hohe Belastung Konzentrationen in der Sättigung des DCF-Fluoreszenz auch in Abwesenheit von H 2 O 2 entstehen könnten. Das Vorhandensein einer endogenen oder exogenen Oxidationsmittel (z. B. Stickstoffmonoxid, Wasserstoffperoxid) erhöht DFC Fluoreszenzintensität. Nachfolgend stellen wir ein Protokoll für die Be-Ratte kortikalen Neuronen mit TMRM und H 2 DCF-DA.
- Zum Laden der Ratte kortikalen Neuronen mit TMRM zunächst, waschen Sie die kultivierten Neuronen 3-mal mit Tyrode-Puffer (Text-Overlay: TB: 145 mM NaCl, 5 mM KCl, 10 mM Glukose, 1,5 mM CaCl 2, 1 mM MgCl 2 und 10 mM HEPES; pH-Wert auf 7,4 mit NaOH). Dann bereiten 20 nM von TMRM durch Verdünnen der 10 mM TMRM Lager 1 / 1000 mal in TB und fügen Sie dann 2 ul verdünnt TMRM pro 1 ml TB. Inkubieren Sie die Neuronen mit TMRM für 45 min im Dunkeln bei Raumtemperatur. Nach 45 min, montieren Sie die Kulturschale auf der Bühne des Mikroskops und starten Bildgebung.
- Zum Laden der Ratte kortikalen Neuronen mit H 2 DCF-DA, waschen Sie die kultivierten Neuronen 3-mal mit TB. Als nächstes bereiten 2 uM von H 2 DCF-DA durch Verdünnen der 10 mM H 2 DCF-DA Lager 1 / 10 mal in TB und fügen Sie dann 2 ul der verdünnten H 2 DCF-DA pro 1 ml TB. Dann inkubieren die Neuronen mit H 2 DCF-DA für 45 min im Dunkeln bei Raumtemperatur. Nach 45 min, waschen Sie die Neuronen 4 mal mit TB, um überschüssige Fluoreszenzindikator vor Gewinnung von Bildern zu entfernen.
4. Live-Darstellung von Neuronen mit TMRM inkubiert, um ΔΨm bestimmen
- So führen Sie Live-Aufnahmen von Neuronen mit TMRM, konfokale Laser Scanning Mikroskopie (Text-Overlay: LSM 510, Carl Zeiss Inc.) inkubiert, mit der Anwendung von Live-Time-Serie Programm verwendet wird. Bewerben mit niedriger Auflösung und gedämpft Laserleistung (Text-Overlay: niedrige Auflösung: 256 x 256; Laserleistung: 1%), um die benötigte Zeit, um Bilder zu erhalten und zu vermeiden, Bleichen zu minimieren.
- . Als nächstes stellen Sie den Fokus des montierten Neuronen mit TMRM geladen mit reflektiertem Licht. Untersuchen Sie die TMRM Fluoreszenz-Beleuchtung bei 514 nm und Detektion bei 570 nm. Stellen Sie die Erkennung Gewinn von einer Kamera direkt unterhalb der Sättigung.
- Wenn alle Parameter, die Auflösung, Laserleistung, Erkennung Gewinn von einer Kamera, und Zeitraffer-Intervall gehören zu erlangen Bilder gesetzt werden; nicht ändern diese Einstellungen zwischen den Experimenten. Als nächstes ändern Sie das Feld. Starten Sammeln von Bildern.
- Um zu testen, Änderungen in ΔΨm, können Reize wie 1 uM FCCP oder 2 pg / ml Oligomycin, angewandt werden, die deutlich depolarisieren oder hyperpolarisieren des mitochondrialen Membranpotentials, bzw.. Diese Veränderungen werden durch einen Rückgang in TMRM Fluoreszenzintensität im Vergleich zum Ausgangswert Fluoreszenzintensität bei FCCP, oder eine Erhöhung der TMRM Fluoreszenzintensität bei Oligomycin reflektiert werden.
5. Live-Darstellung von Neuronen mit H 2 DCF-DA inkubiert, um festzustellen, ROS
- So führen Sie Live-Aufnahmen von Neuronen mit H 2 DCF-DA zunächst inkubiert, montieren Sie die Kulturschale auf der Bühne eines Mikroskops. Stellen Sie den Fokus der Zellen unsIng. reflektierte Licht. Untersuchen DCF-Fluoreszenz durch Anregung bei 488 nm und Emission bei 515 nm.
- Als nächstes stellen Sie die Laserleistung auf 5-7%, Detektor zu gewinnen, und die Auflösung von 256 x 256. Ändern Sie diese Einstellungen zwischen den Experimenten. Dann legen Sie die Frequenz für den Erhalt von Live-Bildern mit der Zeitreihen-Programm.
- Wählen Sie ein neues Feld und beginnen Erfassen von Bildern. Um Veränderungen in ROS Ebenen zu behandeln Zellen mit 100-200 um H 2 O 2. Dies wird durch einen Anstieg der DCF-Fluoreszenz-Intensität im Vergleich zum Ausgangswert Ebene reflektiert werden.
6. Datenanalyse
- Verwenden region of interest (Text-Overlay: ROI)-Tool aus dem LSM-Programm, um die Bereiche auszuwählen. Dann messen Sie die TMRM oder ROS Fluoreszenzintensitäten. Wählen Sie ROIs von mitochondrialen Regionen oder ROIs aus dem gesamten Zellkörper in abgebildet Zellen, die Fluoreszenz-Intensitäten der TMRM oder ROS bzw. zu messen.
- Berechnen Sie die durchschnittliche Fluoreszenz-Intensitäten von allen ROIs jeder Zelle für TMRM oder aus ganzen Zellkörper für alle abzubildenden Zellen für ROS für jeden Zeitpunkt. Wählen Sie Regionen neben den Zellen, die Hintergrund-Fluoreszenz-Intensität zu berechnen. Nehmen Sie mehrere Messungen und Berechnung der durchschnittlichen Hintergrund Intensität.
- Subtrahieren Sie die durchschnittliche Hintergrund Fluoreszenzintensität von durchschnittlich Fluoreszenzintensitäten ROIs in jeder Zelle für jeden Zeitpunkt mit Microsoft Excel. Nach Abzug Hintergrund Intensität, normalisieren die TMRM oder DCF-Fluoreszenz-Intensität auf die Grundlinie Fluoreszenz mit dieser Formel (Text-Overlay: AF = FF o / F o x 100, wobei F = Fluoreszenz-Intensität zu jedem Zeitpunkt, Fo = baseline Fluoreszenz). Verwenden Sie dann die Sigma Plot Programm, um die grafische Darstellung der Veränderungen in der Fluoreszenz-Intensität im Laufe der Zeit zu generieren.
7. Repräsentative Ergebnisse
Abbildung 1A zeigt ein Fluoreszenz-Bild der Ratte kortikalen Neuronen mit TMRM inkubiert. Die Zugabe von FCCP, eines mitochondrialen Entkoppler, führt zu mitochondrialen Depolarisation und einen Verlust von TMRM Fluoreszenzintensität (Abb. 1B). Die Baseline TMRM Fluoreszenz Ebene bleibt vor der Zugabe von FCCP (die ersten 350 sec.; Abb. 1C) stabil. Quantitative Analyse der TMRM Fluoreszenz ändert sich im Laufe der Zeit zeigt eine signifikante Abnahme in TMRM Fluoreszenz nach Zugabe von FCCP (Abb. 1C).
1D zeigt die Fluoreszenz-Bild der Ratte kortikalen Neuronen mit DCF geladen. Die Zugabe von H 2 O 2 führt zu einer erhöhten DCF Fluoreszenz-Intensität in Zellkörper (Abb. 1E). Die Baseline-DCF-Fluoreszenz-Ebene bleibt unverändert (die ersten 120 sec) vor dem Auftragen von H 2 O 2. Zeitraffer-Messungen der DCF-Fluoreszenz zeigen seine stetige Ebenen, die Zunahme nach H 2 O 2-Behandlung (Abb. 1F).
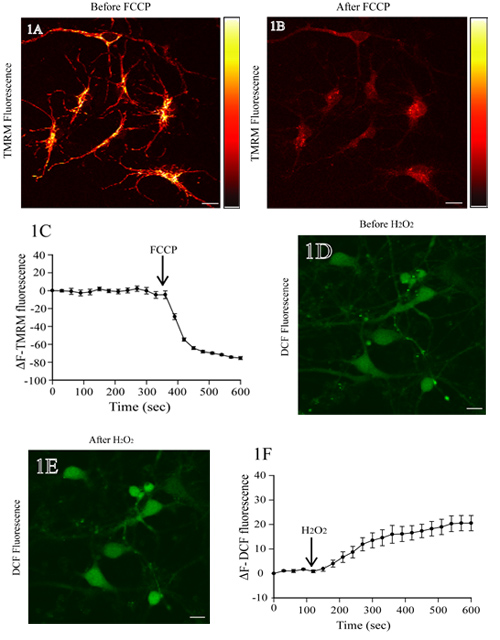
Abbildung 1. Einschätzung der mitochondrialen Membranpotentials und ROS Ebenen in lebenden Ratte kortikalen Neuronen. (A) Repräsentative Fluoreszenzbild der kortikalen Neuronen mit TMRM geladen. Nach dem Scannen der Grundlinie TMRM Fluoreszenz wurden Neuronen mit dem protonophore FCCP (1 uM) behandelt. Auf der rechten Seite ist eine Falschfarbendarstellung Intensität bar TMRM Fluoreszenz mit leuchtend gelben und schwarzen vertreten maximalen und minimalen Intensität, jeweils. Der Verlust von TMRM Fluoreszenz von der mitochondrialen Regionen zeigt den Zusammenbruch des ΔΨm auf FCCP Behandlung (Panel B). Die quantitative Darstellung der Veränderung in TMRM Fluoreszenzintensität zu verschiedenen Zeitpunkten vor und nach FCCP Behandlung ist in Panel C (D) Fluoreszenzbild Ratte kortikalen Neuronen mit H2DCF-DA geladen angezeigt. Nach der Bestimmung der Baseline-DCF-Fluoreszenz wurden die Zellen mit 200 uM H 2 O 2 behandelt, und die Veränderung der DCF-Fluoreszenz wurde beurteilt. Eine Erhöhung des DCF-Fluoreszenz spiegelt der Anstieg der ROS Ebenen auf H 2 O 2-Behandlung (E). Quantitative Analyse des Wandels in DCF-Fluoreszenz vor und nach der H 2 O 2-Behandlung ist in Panel F. Skala bar = 10 pm gezeigt
Video.7.1 - labmedia 2704_Joshi.avi
Live Cell Imaging von TMRM in kortikalen Neuronen vor und nach FCCP zusätzlich mit 40X-Objektiv. Die Falschfarben-Intensität zeigt ein Maximum (leuchtend gelb, bevor FCCP Addition) und zurück (rote Farbe, nach FCCP Addition) TMRM Fluoreszenzintensität nach FCCP hinaus. Klicken Sie hier, um Video anzusehen
Video. 7,5 - labmedia 2704_Joshi.avi
Live Cell Imaging von DCF in kortikalen Neuronen vor und nach der H 2 O 2-Zugabe mit 40X-Objektiv. Die Baseline-DCF-Fluoreszenz hat hellgrüne Farbe in Zellkörper und H2O2 Zusätzlich erhöht sich die DCF Fluoreszenzintensität auf leuchtend grüne Farbe. Klicken Sie hier, um Video anzusehen
Diskussion
Wir haben eine Schritt-für-Schritt-Verfahren beschreiben, wie ΔΨm und ROS in Ratte kortikalen Neuronen mit dem fluoreszierenden Indikatoren TMRM und H 2 DCF-DA, bzw. festzustellen, vorgestellt. Für andere Zelltypen, ist es wichtig, empirisch bestimmt die endgültige Konzentration und Ladezeit für TMRM oder H 2 DCF-DA. Im Allgemeinen TMRM Konzentrationen liegen im Bereich von 20 bis 200 nM, und die Zelle Inkubationszeit mit TMRM variiert von 20 bis 60 min. Die Endkonzentration von H 2 DCF-DA reicht von 2-10 um, und die Inkubation von Zellen in einem Laden-Lösung mit diesem Indikator variiert von 30 bis 45 min.
Es ist wichtig, die Laserleistung und Scan-Geschwindigkeit von unter die Bilder, um sowohl photo-Toxizität für die Zellen und Veränderungen in der Fluoreszenz-Intensität (z. B. Flackern TMRM Fluoreszenz) in Ermangelung einer Stimulus zu vermeiden optimieren. Das optimierte optische Einstellungen sollten in einem Fluoreszenz-Signal, das nicht über oder unter gesättigten (Schwelle) in Abwesenheit des Stimulus führen. Die optimalen Bedingungen, um die Bilder aus einem ausgewählten Feld an einer bestimmten Laserleistung und eine Scan-Geschwindigkeit sammeln werden erzielt, wenn es keine Änderungen in der Fluoreszenz-Intensität der Sonde in das Fehlen jeglicher Anreiz für 10-15 min von Live-Bildgebung.
Andere Fluoreszenz-Sonden an ΔΨm bestimmen, sind Rhodamin 123 und Tetra methyl Rhodamin Ethylester (TMRE). Allerdings waren sie zu finden, um die Atemwege Prozesse in isolierten Mitochondrien 2 hemmen. Wichtig ist, dass TMRM keinen Einfluss auf die mitochondriale Atmung bei niedrigen Konzentrationen 2 und hat einen geringen Phototoxizität und Ausbleichen 3 im Vergleich mit anderen Sonden. H 2 DCF-DA ist ein guter Indikator für ROS, wie sie ist gut in den Zellen erhalten und erkennt verschiedene Oxidantien, wie Peroxide, Superoxide und Salpetersäure Oxid 4.
Offenlegungen
Danksagungen
Diese Arbeit wurde von den National Institutes of Health (K22NS050137 zu JCB) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz | Firma | Katalog-Nummer | |
|---|---|---|---|
| Glasboden Kulturschale | MatTek Inc. | P35G-1,5-14-C | |
| NbActive4 | BrainBits | NbActive4 | |
| TMRM | Invitrogen | T668 | |
| H 2 DCF-DA | Invitrogen | C400 | |
| NaCl | Sigma | S6191 | |
| KCl | Sigma | P3911 | |
| CaCl 2 • 2H 2 O | Sigma | C3306 | |
| MgCl 2 • 6H 2 O | Sigma | M2670 | |
| D-Glucose | Sigma | G6152 | |
| HEPES | Invitrogen | 15630 |
Referenzen
- Hilgenberg, L. G., Smith, M. A. Preparation of dissociated mouse cortical neuron cultures. J. Vis. Exp. , (2007).
- Scaduto, R. C., Grotyohann, L. W. Measurement of mitochondrial membrane potential using fluorescent rhodamine derivatives. Biophys. J. 76, 469-477 (1999).
- Ward, M. W. The amyloid precursor protein intracellular domain (AICD) disrupts actin dynamics and mitochondrial bioenergetics. J. Neurochem. 113, 275-284 (2010).
- Gunasekar, P. G., Kanthasamy, A. G., Borowitz, J. L., Isom, G. E. NMDA receptor activation produces concurrent generation of nitric oxide and reactive oxygen species: implication for cell death. J. Neurochem. 65, 2016-2021 (1995).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten