Method Article
Fluoreszenz-basierte Messung von Calcium-Shop-Eintrag in lebenden Zellen: aus kultivierten Krebszelle zu Skelettmuskelfaser
In diesem Artikel
Zusammenfassung
Das Ausmaß der store-betriebenen Ca 2 + Eintrag (SOCE) kann überwacht werden, unter Verwendung von fluoreszierenden Ca 2 + Indikatoren. Mn 2 + Löschung solcher Indikatoren Assays SOCE in kultivierten Zellen und Fasern der Skelettmuskulatur. Eine Technik, so dass räumliche und zeitliche Auflösung von SOCE durch konfokale Bildgebung von mechanisch gehäutet Muskelfasern wird ebenfalls beschrieben.
Zusammenfassung
Shop betrieben Ca 2 +-Eintrag (SOCE), früher nannte kapazitiven Ca 2 +-Eintrag, ist ein stark regulierter Mechanismus zum Einstrom von extrazellulären Ca 2 + in Zellen mit abgereichertem Endoplasmatischen Retikulum (ER) oder sarkoplasmatischen Retikulum (SR) Ca 2 + wieder aufzufüllen 1,2. Da Ca 2 + ist ein allgegenwärtiges second messenger, ist es nicht überraschend zu sehen, dass SOCE spielt eine wichtige Rolle in einer Vielzahl von zellulären Prozessen wie Proliferation, Apoptose, Gen-Transkription und Motilität. Aufgrund ihrer weiten Verbreitung in nahezu allen Zelltypen, einschließlich Epithelzellen und Skelettmuskulatur, hat dieser Signalweg großes Interesse 3,4 erhielt. Allerdings sind die Heterogenität der SOCE Eigenschaften in verschiedenen Zelltypen und die physiologische Funktion noch nicht klar, 5-7.
Die funktionellen Eigenschaften von Kanal SOCE kann durch Patch-Clamp-Studien enthüllt werden, während ein großer Teil der Kenntnisse über this-Mechanismus wurde durch Fluoreszenz-basierten intrazellulärer Ca 2 +-Messungen wegen seiner Bequemlichkeit und Machbarkeit für das Hochdurchsatz-Screening gewonnen werden. Das Ziel dieses Berichtes ist es, ein paar Fluoreszenz-basierten Methoden zusammenfassen, um die Aktivierung von SOCE in Monolayer-Zellen, suspendierten Zellen und Muskelfasern 5,8-10 messen. Die am häufigsten von dieser Fluoreszenz-Methoden verwendet, ist die direkte Überwachung der Dynamik der intrazellulären Ca 2 + aus dem Verhältnis von F und F 340 nm 380 nm (510 nm für die Emissions-Wellenlänge) des ratiometrische Ca 2 +-Indikator Fura-2. Um die Aktivität von unidirektionalen SOCE von intrazellulärer Ca 2 +-Freisetzung und Ca 2 +-Extrusion zu isolieren, wird ein Mn 2 +-Quenching-Assay häufig verwendet. Mn 2 + ist bekannt, können in die Zellen über SOCE Permeat während es undurchlässig für die Oberflächenmembran Extrusionsverfahren oder ER Aufnahme von Ca 2 + Pumpen aufgrund seiner sehr hohen Affinität nämlichh Fura-2. Als Ergebnis stellt das Abschrecken Fura-2 Fluoreszenz durch den Eintrag von extrazellulärem Mn 2 + in den Zellen induziert eine Messung der Aktivität von SOCE 9. Quotientenmeßschaltung und die Mn +2 Abschrecken Assays können auf einer Küvette-basierten Spektrofluorometer in einer Zellpopulation Modus oder in einem Mikroskop-System, um einzelne Zellen zu visualisieren durchgeführt werden. Der Vorteil einer einzigen Zelle Messungen ist, dass einzelne Zellen unterzogen, um Gen-Manipulationen ausgewählt werden unter Verwendung von GFP oder RFP-Reporter, so dass Studien in genetisch modifizierten oder mutierten Zellen werden. Diese räumliche Merkmale SOCE strukturell spezialisierten Skelettmuskel in Haut Muskelfasern durch gleichzeitiges Überwachen der Fluoreszenz von zwei geringe Affinität Ca 2 +-Indikatoren erreicht werden und gezielt auf die Abteile der Muskelfaser, wie zB Fluo-5N in der SR und Rhod- 5N im transversalen Tubuli 9,11,12.
Protokoll
1. Intrazellulärer Ca 2 +-Messung für einzelne Zellen
- KYSE-150, einen menschlichen Ösophagus Plattenepithelkarzinom (ECSS) Zelllinie wird in 5% CO 2-Atmosphäre bei 37 ° C in RPMI gemischten 1640/Ham 's F-12 Medium (1:1), enthaltend 5% fötales Rinderserum.
- KYSE-150 Zellen mit den Plasmiden transfiziert, die entweder spezifisch gegen shRNA Orai1 oder eines verschlüsselten Sequenz. Die Plasmide enthalten auch ein Gen, das rot fluoreszierende Protein (RFP) als Reporter, der durch ein separates Promotor angetrieben wird.
- Die Zellen werden im Glasbodenboot Speisen gezüchtet (Nr. 1.5 Deckglas, MatTek, MA) für 48 Stunden.
- Entfernen Sie das Medium und waschen Sie die Zellen mit einer ausgewogenen Salzlösung (BSS) (140 mM NaCl, 2,8 mM KCl, 2 mM CaCl 2, 2 mM MgCl 2, 10 mM HEPES, pH 7,2).
- 1 ml BSS Lösung mit 2 uM Fura-2 Acetoxymethylester (Molecular Probes) in die Schüssel und wickeln die ganze Schüssel mit Folie zu protect aus Licht.
- Inkubieren der Zellen für 40 min bei 37 ° C und sie dann für weitere 15 Minuten-Zeitraum bei Raumtemperatur zu ermöglichen Esterhydrolyse abgeschlossen werden. Waschen Sie die Zellen mit BSS zweimal.
- Montieren Sie die Schüssel auf der Bühne der Nikon TE200 inversen Mikroskop, das PTI Spektrofluorometer angeschlossen ist, mit Anregungswellenlängen bei 350 und 390 nm und Emission bei 510 nm. Die genauen Anregungswellenlängen verwendet werden kann variieren in Abhängigkeit von der Optik der einzelnen Systeme. Die zwei Wellenlängen mit beste Verhältnis von dynamischen Scanning-Anregungsspektrum von Fura-2-Salz in Lösungen, die Ca 2 + im Bereich von 0 bis 39,8 pM (oder höheren Konzentration, bei der Fluoreszenz-Fura-2 gesättigt ist) bestimmt.
- Einrichten einer Dichte Perfusion mit 4 verschiedenen Lösungen in BSS: Ca 2 + (2 mM), EGTA (0,5 mM), EGTA-TG (Thapsigargin, 5 pM), Ca 2 +-2-APB (a SOCE Inhibitor, 75 uM). Computer-gesteuerte automatische perfusiauf Systemen können ebenfalls verwendet werden.
- Wählen Sie die Zellen, die RFP im Darstellungsmodus.
- Positionieren Sie die Spitze der Eröffnung Perfusionssystem bei 10facher Vergrößerung, bis die Spitze ist direkt über der Region von Interesse in einem 45 Grad Winkel.
- Gleichzeitig erfassen die Fluoreszenz-Signale F 350nm und 390nm F. Verhältnis (F 350nm / F 390 nm) wird in dem dritten Fenster angezeigt. Ändern Sie die Perfusionslösungen in der folgenden Reihenfolge: Ca 2 +; EGTA, Ca 2 +; EGTA-TG, Ca 2 +, Ca 2 +-2-APB.
Das obige Protokoll kann für die Messung von intrazellulärem Ca 2 + in Zelle Aufhängungssystem modifiziert werden.
- Kultur KYSE-150-Zellen in einer T25-Flasche mit der gleichen Kulturbedingungen wie oben.
- Wenn die Zellen 90% Konfluenz erreichen, entfernen Sie das Medium und spülen Sie die Zellen mit einem BSS-Lösung.
- Fügen Sie 2,5 ml BSS Lösung mit 2 uM Fura-2 AM und inkubierendie Zellen für 40 min bei 37 ° C, gefolgt von Verseifung.
- Nehmen Sie die BSS, fügen Sie 2,5 ml Trypsin in den Kolben und bei 37 ° C, bis die Zellen zu lösen. Dann fügen Sie 2,5 ml Kulturmedium, um die Trypsinierung stoppen und Ernte der Zellen durch Zentrifugation bei 800 rpm für 5 min.
- Waschen Sie die Zellen mit Kulturmedium ein weiteres Mal durch Zentrifugation und Resuspendieren der Zellen Pellet in BSS-Lösung (ohne Zugabe von 2 mM CaCl 2, uM Bereich mit Ca 2 +) und zählen Sie die Anzahl Zellen mit Hilfe eines hematometer.
- Fügen Sie ~ 10 6 Zellen in einer Quarzküvette (10 mm, Starna Cells) und füllen Sie das Volumen bis zu 2 ml mit BSS.
- Legen Sie die Küvette (Rühren mit einem Magnetrührer bar) in die Spektrofluorometer.
- Gleichzeitig erfassen die Fluoreszenz-Signale F 340nm und 380nm mit F-Emission bei 510 nm Wellenlänge. Die laufende Protokoll ist: BSS, Zugabe von 0,5 ul EGTA (0,25 M Lager), Zugabe von 1 ul Thapsigargin(TG, 10 mM Lager), die Zugabe von 4 ul Ca 2 + (1 M Stammlösung).
2. Mn Abschrecken Assay in kultivierten Zellen
- Führen Anregungswellenlänge Scannen von Fura-2 in Lösungen mit verschiedenen Ca 2 +-Konzentration im Bereich von 0 bis 39,8 pM, um die Ca-Konzentration unabhängigen Wellenlänge wie der isosbestischen Punkt zu bestimmen. Üblicherweise ist die isosbestischen Punkt bei oder um 360 nm liegt.
- KYSE-150-Zellen werden in Glasboden-Schalen kultiviert und beladen mit Fura-2 AM.
- Richten Sie die Perfusion System mit 5 verschiedenen BSS-Lösungen: Ca 2 + (2 mM), EGTA / TG (0,5 mm und 5 &mgr; M.), Mn 2 + (0,5 mM, ohne Zusatz von EGTA oder Ca 2 +, mit freien Ca 2 + in pM-Bereich), Mn 2 + / 2-APB (75 uM), EGTA / Triton X-100 (0,1%).
- Montieren Sie die Schüssel auf den Tisch des Mikroskops und wählen Sie die "Excitation Ratio"-Modus mit Anregungswellenlängen bei 360 nm und 390 nm und Emission bei 510nm.
- Gleichzeitig erfassen die Fluoreszenz-Signale F 360nm und 390nm mit F-Verhältnis (F 360nm / 390nm F) im dritten Fenster angezeigt. Die Laufzeit-Protokoll ist: Ca 2 + für 1 min, um die Fluoreszenz zu stabilisieren, Mn 2 + 30 s, EGTA / TG für 10 min, Mn 2 + für 2 min, EGTA-Triton X-100 (0,1%) für 1 min um den Hintergrund Ablesung zu erhalten. Mn 2 + / 2-APB-Lösung kann anstelle von Mn 2 + verwendet werden, um die Fluoreszenzlöschung abgeschafft, so dass die Mn 2 + Eintrag durch SOCE Weg ist zeigt an, zu untersuchen.
3. Mn Abschrecken Assay in den Muskelzellen
- C2C12, eine Maus myogenen Zelllinie, auf Glas-Boden Speisen in 5% CO 2-Atmosphäre bei 37 ° C in DMEM, enthaltend 10% fötales Rinderserum, 10% Pferdeserum.
- Nachdem die Zellen Konfluenz zu erreichen, wird das Kulturmedium zu einer Differenzierung Medium gewechselt (entfernen fötalem Rinderserum und Reduktione Pferdeserum auf 2,5%). Die C2C12 Myoblasten zu Myotuben wird nach 4 Tagen zu unterscheiden.
- Laden C2C12 Myotuben mit einer Endkonzentration von 5 uM Fura-2 AM wie in 1,4-1,6 beschrieben.
- In einer Endkonzentration von 20 pM N-Benzyl-p-Toluolsulfonamid (BTS), um Muskelkontraktionen und die Bewegungsartefakte durch sie verursachten hemmen und ermöglichen 15 min vor Beginn des Experiments.
- Montieren Sie die Schüssel auf den Tisch des Mikroskops mit dem PTI-Gerät und laden Sie die folgenden BSS-Lösungen in das Perfusionssystem: 2 Ca 2 + (2 mM), 0 Ca 2 +, Mn 2 + (0,5 mM); Mn 2 + / TG (0,5 mM, 20 um, beziehungsweise).
- Einrichten des Perfusionssystem wie oben beschrieben.
- Gleichzeitig erfassen die Fluoreszenz-Signale F 360nm und 390nm mit dem F-Verhältnis (F 360nm / 390nm F) im dritten Fenster angezeigt. Die Laufzeit-Protokoll ist: 2 Ca 2 + für 1 min, 0 Ca 2 + für 1 min bis flächenbündig entfernt Ca 2 +, Mn 2 + für 0,5 min, Mn 2 + / TG für 10 min, und Mn 2 + / EGTA-Triton X-100 (0,1%).
4. Räumlich und zeitlich aufgelöste SOCE in gehäuteten Muskelfasern
- Stellen Sie folgende Lösungen.
Isotonische Tyrode-Puffer: 140 mM NaCl, 5 mM KCl, 10 mM HEPES, 2 mM MgCl 2, 2,5 mM CaCl 2, pH 7,2, 290 mosm
Kulturmedium: DMEM mit 2% Pferdeserum und 1% Penicillin und Streptomycin
Die Waschlösung # 1: 109,6 mM K-Glutamat, 2 mM EGTA-KOH, 6,7 mM MgCl 2, 2 mM ATP, 6 mM Kreatinphosphat (CP), 20 mM N, N-Bis (2-hydroxyethyl)-2-aminoethansulfonsäure Säure (BES)-KOH, pH 7,0
Waschlösung # 2: 140 mM K-Glutamat, 5 mM EGTA-KOH, 6,5 mM MgCl 2, 2 mM ATP, 6 mM CP, 20 mM BES-KOH, pH 7,0
Skinning-Lösung: 140 mM K-Glutamat, 6,5 mM MgCl 2, 2 mM ATP, 6 mM CP, 20 mM BES-KOH, pH 7,0
TT-loadingLösung: 90,6 mM K-Glutamat, 18 mM Na-Glutamat, 0,55 mM CaCl 2, 2 mM EGTA-KOH, 6,7 mM MgCl 2, 5,4 mM ATP, 15 mM CP, 0,0025 mg / ml Kreatinkinase (CK), 20 mM BES-KOH, 5 uM Carbonylcyanid p-trifluoromethoxyphenylhydrazone (FCCP), pH 7,0, 7,0 pCa
SR Beladung Lösung: 107,8 mM K-Glutamat, 0,98 mM CaCl 2, 2 mM EGTA-KOH, 6,6 mM MgCl 2, 5,4 mM ATP, 15 mM CP, 0,0025 mg / ml CK, 20 mM BES-KOH, 5 uM FCCP, pH 7,0, 6,6 pCa
SR abbauende Lösung: 100 mM K-Glutamat, 40 mM Na-Glutamat, 10 mM EGTA-KOH, 10 mM 1,2-Bis (o-aminophenoxy) ethan-N, N, N ', N'-tetraessigsäure (BAPTA ), 0,35 mM MgCl 2, 0,5 mM ATP, 1 mM CP, 20 mM BES-KOH, 5 uM FCCP, pH 7,0. 25 mM caffeine/20 uM Thapsigargin (TG) werden vor Experimenten aufgenommen. - Um die extensor digitorum longus (EDL) Muskel sezieren, legen die ersten Mäuse und ordnen Sie das Bein in Seitenlage, dann entfernen Sie die Haut vor dem Knöchelbereich bis zum Knie, schneidendie oberflächlichen Muskelschichten von Gewebe zur Freilegung der EDL, und beide trennen die oberen und unteren Sehnen, die Muskeln intakt EDL zu befreien, es ist wichtig, Sehnen halten so lange wie möglich. Die EDL ist mit einer Tyrode-Lösung mit 0 Ca 2 + und 0,1 mM EGTA, um alle Kontraktionen verhindern übertragen.
- Unter einem Stereomikroskop, verwenden Sie zwei Pinzetten zur unteren Insertion Sehnen halten und spaltete die EDL Muskel in zwei Bündel. Wiederholen Sie den Vorgang bis 4 und dann 8 Bündel zu erhalten. Es ist wichtig, dass Sehnen für jede der 8 Bündel am Ende des Prozesses bleiben. Wenn sie aus einigen Bündeln verloren gehen, werfen Sie sie weg.
- Unter einem Stereomikroskop wird jedes Bündel EDL Streifen an beiden Sehnen gegriffen und vorsichtig gedehnt, bis 3 ~ 4 getrennte einzelne Muskelfasern sind intakt gelassen mit Sehne auf beiden Seiten.
- Bringen Sie 1 Tropfen Ca 2 +-freien Tyrode-Puffer in der Mitte des Glasboden-Schale, legen die EDL-Streifen direkt auf den Teller, schnell zu entfernen, so viel wie möglich von derLösung, dann hinunter Band mit beiden Sehnen wasserdicht Tesafilm, und vergewissern Sie sich das Band straff ist. Waschen der Faser zuerst mit dem 0 Ca 2 +-Lösung und dann mit einer 2,5 mM Ca 2 +-Lösung 2-mal. Wenn die Faser hyper-Verträge und Schaden bemerkt wurde, entsorgen Sie die Faser.
- Bei Bedarf können die Faser für kultiviert werden bis zu 96 Stunden, so dass für genetische Manipulationen. Waschen Sie die Faser 3-mal mit komplettem Kulturmedium und 2 ml Medium in die Schüssel, in 5% CO 2 und 37 ° C Inkubator. Vor jedem Experiment untersuchen Muskelfasern und verwerfen solche ohne klare Streifenbildung oder mit Anzeichen von Kontamination oder mit Anzeichen von Schäden wie Kontraktur der sarkolemmalen Membran. Gute Fasern zu KCl, elektrische Stimulation, und Koffein Stimulation reagieren.
- Einzelne Muskelfasern werden 3-mal mit der Waschlösung Nr. 1 gewaschen und gebadet in intrazelluläre wie Skinning-Lösung mit 500 uM Rhod-5N und 0,5 mM Ca 2 + für 5 min.
- mit einem Wolfram-Nadel an einem Stifthalter, mechanisch Haut die Faser unter einem Stereomikroskop, eine transversale Tubuli (TT), um automatisch verschließen und die Rhod-5N, konjugiert mit Ca 2 + in der einzufangen TT, wäscht die Haut Fasern zweimal mit Waschlösung # 2. Die mechanische Enthäuten Verfahren ist optimal, wenn weniger als 25% der Breite der Zelle bei der Schälung entfernt wird.
- Um den SR zu laden, gehäutet Fasern mit der Häutung Lösung mit 20 uM Fluo-5N Uhr für 1 h bei Raumtemperatur, gefolgt von ausgiebigem Waschen mit Waschlösung # 2, und Inkubation für weitere 30 min inkubiert, damit komplette Entesterung der Farbstoff ist.
- Nach 30 min sind gehäuteten Fasern unter 60X Ziel des konfokalen Mikroskops sichtbar gemacht werden. Fluoreszenz-Bilder werden mit Wellenlängen von den entsprechenden Farbstoffen (; Anregung bei 488 nm und Emission bei 530 bis 560 nm für Fluo-5N Anregung bei 543 nm und Emission mehr als 570 nm für Rhod-5N) erfasst. Regions von Interesse (ROI) für jede farbstoffbeladenes ausgewählten Gebieten.
- Das experimentelle Protokoll ist wie folgt: TT-loading-Lösung für 120 s, SR-loading-Lösung für 120 s, SR-Depletion-Lösung für 400 bis 750 s, um das SR Ca 2 +-Speicher führen. Während dieses Vorgangs werden Änderungen in Rhod-5N Intensität (TT Ca 2 +) und Fluo-5N Intensität (SR Ca 2 +) erfasst, wodurch eine zeitliche Verlauf Bestimmung der relativen Änderungen in der Fluoreszenz-TT und SR. Mittelwerte der Fluoreszenzintensität aus mehreren Fasern, weiter analysiert. Die maximale Belastung Intensität am Ende von TT / SR Ladung wird auf 100% normiert.
5. Repräsentative Ergebnisse
Wir untersuchten SOCE Aktivität in KYSE-150-Zellen mittels intrazellulärer Ca 2 +-Messung (Abb. 2.). Mit RFP als Reporter, konnten wir die einzelnen Zellen mit Plasmid-haltigen spezifische shRNA gegen Orai1 transfiziert wählen, kodiert ein Gen, das SOCE cHannel. Im Vergleich zu Zellen mit Plasmiden, die Gerangel shRNA (schwarze Kurve), den Zuschlag von Orai1 Protein führt zu einer verringerten Aktivität SOCE (rote Kurve). Transfiziert
SOCE in KYSE-150-Zellen wurde auch mit dem Mn 2 + Abschrecken Assay (Abb. 3). Bestätigt. Die Anregungswellenlänge von 360 nm berichtet den isosbestischen Punkt von Fura-2, wobei die Fluoreszenz ist unabhängig von der Ca 2 +-Konzentration. Nach TG völlig erschöpft ER Ca 2 +-Stores, die Perfusion von Mn 2 + führte zu einer signifikanten Abnahme Fluoreszenz. Die gesamte SOCE Aktivität kann durch die Abnahme von Fura-2 Fluoreszenz-Intensität mit einer steileren Neigung angibt, eine aktivere SOCE gemessen werden, während ein flacher Hang Sinn eine weniger aktive SOCE. Die Steigung der Fluoreszenz-Abnahme in 2-APB-behandelten Zellen zu sein schien viel flacher, was bedeutet, dass SOCE Aktivität wurde durch diese Verbindung blockiert angezeigt. Der Mn2 + Abschreckgeschwindigkeiten wurden aus der Aufzeichnung der ersten 10 Sekunden, in denen die Abschreckung war noch im linearen Bereich ohne Sättigung bestimmt.
Eine ähnliche Mn 2 + Abschrecken Assay wurde in den Muskel (Abb. 4.) Durchgeführt. In diesem Fall Mn 2 + wurde zusammen mit TG angelegt. Während TG wurde zum Abbau der SR Ca 2 +-Stores, die Fluoreszenzlöschung Hang allmählich verändert, bis es seine maximale Geschwindigkeit erreicht ist. Die S-förmigen Kurve zeigt die abgestufte Aktivierung SOCE unter diesen experimentellen Bedingungen.
Gesunde, intakte einzelne Muskelfasern in Kultur zeigten klare und einheitliche Streifenbildung, keine Anzeichen von Verunreinigungen und keine Anzeichen einer Kontraktion-verursachte Schäden. Diese Fasern konnten in Reaktion auf elektrische Stimulation oder depolarisierende Lösungen zusammenziehen. Unter konfokale Bildgebung zeigte gehäutet Faser Einfangen von Rhod-5N Farbstoff in der TT-Abteilung die charakteristische Dublett Säugetier-Muster (VISUfunktionalisierten im roten Kanal). Nach dem Laden des SR mit Fluo-5N AM, war das typische Muster durchbrochen SR sichtbar (im grünen Kanal). Nach Perfusion der Haut Faser mit TT / SR Beladungslösung, erhöhte Fluoreszenz Intensität sowohl Rhod-5N und Fluo-5N; nach Perfusion mit SR Erschöpfung Lösung, begann Fluoreszenz-Ebenen in der SR-Fach und der TT-Abteilung zu verringern, was auf enge Kopplung zwischen SR Ca 2 +-Speicher Erschöpfung und SOCE Aktivierung bzw. (Abb. 5.).
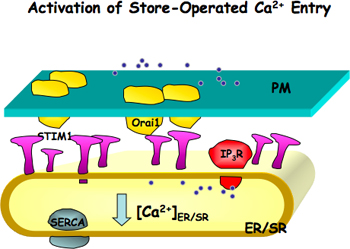
Abbildung 1. Die Aktivierung der Speicher-betriebenen Ca 2 +-Einstrom (SOCE). Orai1, wird ein Kanal Poren bildende Einheit, die auf der Plasmamembran (PM) und STIM1 ein Ca 2 +-Sensor befindet, auf das endoplasmatische oder sarkoplasmatischen Retikulum (ER / befindet SR) Membranen. Wenn ER / SR Ca 2 +-Stores werden entweder durch Blockierung des ER / SR Ca 2 +-Pumpe (SERC reduziertA) oder Ca 2 +-Freisetzung durch IP 3-Rezeptor oder Ryanodinrezeptor wird STIM1 aktiviert. Aktiviert STIM1 Moleküle bilden Patches und induzieren die Aggregation von Orai1, die weiter führt die Aktivierung von SOCE.
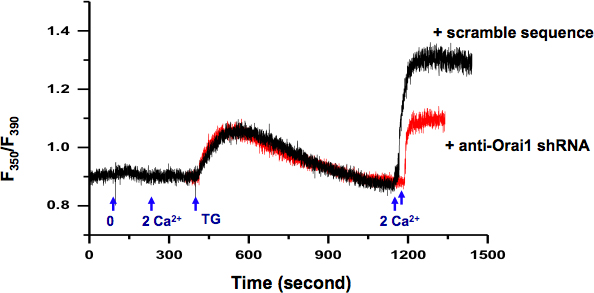
Abbildung 2. Messung der intrazellulären Ca 2 + in KYSE-150-Zellen. Austausch von extrazellulären Lösung von 0 Ca 2 + (0,5 mM EGTA) bis 2 mM Ca 2 + induziert keine Änderung der intrazellulären Ca 2 +. 5 uM TG in 0 Ca 2 + Badlösung induzierte passive ER Ca 2 +-Freisetzung. Nach dem ER Ca 2 + speichert dezimiert waren (> 10 min), Zugabe von extrazellulärem Ca 2 + (2 mM) aktiviert einen nachhaltigen intrazellulärer Ca 2 + Erhöhung durch SOCE, die durch SOCE Inhibitoren blockiert werden können, zB SKF-96365 und 2 - APB (Daten nicht zeigen). Zellen mit Plasmiden, die shRNA spezifisch gegen transfiziertOrai1 (rot) belegt deutlich reduziert SOCE als Zellen mit Scramble-Sequenz (schwarz) transfiziert.
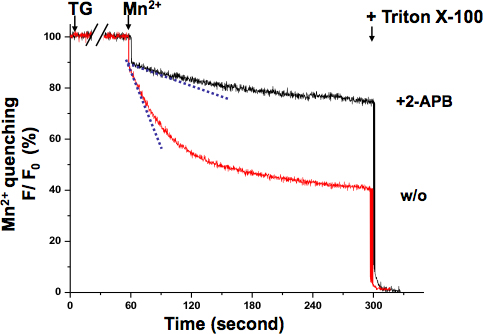
Abbildung 3. Mn 2 + Abschrecken Assay SOCE in KYSE-150-Zellen. Das Abschrecken von Fura-2 Fluoreszenz durch Mn 2 + (0,5 mM) wurde bei der Ca 2 +-unabhängige Anregungswellenlänge von Fura-2 (360 nm) gemessen. Die Zellen wurden mit 5 uM TG für 10 min behandelt, um vollständig entleeren ER Ca 2 +-Stores. Der Zerfall Steigung von Fura-2-Fluoreszenz bei Mn 2 + zusätzlich (gestrichelte Linien innerhalb der ersten 10 Sekunden) dargestellt wird die Aktivierung von SOCE, die als prozentuale Abnahme der Fluoreszenz pro Zeiteinheit (der Anfangswert als 100%) ausgedrückt wurde. Die maximal abgeschreckten Fluoreszenzsignal wurde am Ende des Experiments durch Lyse der Zellen mit etablierten 0,1% Triton X-100 (als 0%). Zellen mit 2-APB (75 uM) behandelt wurden, zeigten eine deutlich flachereHang, was darauf hindeutet SOCE wird durch diese Verbindung in KYSE-150-Zellen blockiert.
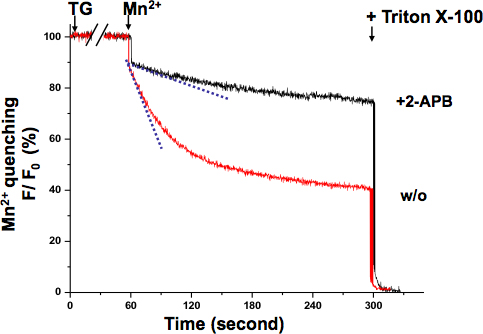
Abbildung 4. Graded Aktivierung SOCE in den Muskelzellen durch Mn 2 + offenbarte Abschrecken Assay. Die Aktivierung von SOCE könnte registriert, während TG wurde abbauende SR Ca 2 +-Läden werden. Gleichzeitige Anwendung von Mn 2 + (0,5 mm) und TG (20 uM) induziert eine abgestufte-und sigmoidale Rückgang von intrazellulären Fura-2 Fluoreszenz (Cyan gestrichelte Linie, um den schnellsten Abschrecken Punkt zeigen), die sich von anfänglichen Mn 2 + war Abschrecken Rate (blau gestrichelte Linie). Mn 2 + Abschrecken Steigung blieb fast die gleiche wie Grundniveau in Zellen beobachtet 2-APB (75 uM), was darauf hindeutet, dass SOCE gehemmt wurde.
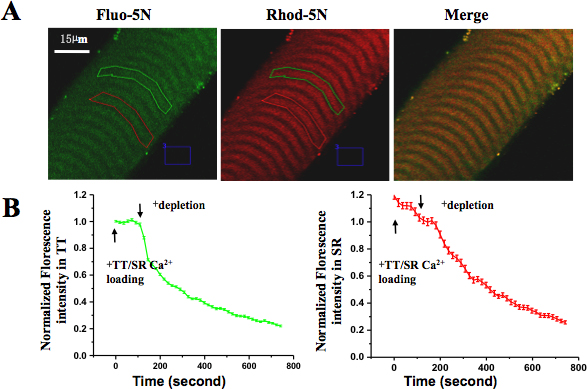
Abbildung 5. Räumlich und zeitlich aufgelöste SOCE in gehäuteten Muskelfaser. (A) Rhod-5N Salz wurde in TT-und Fluo-5N AM beladen wurde in SR geladen. (B) Nach dem Anlegen Ca 2 +-Lösung Erschöpfung, verringerte sich die Fluoreszenz in TT-und SR-Abteile. Der Verlust von Fluo-5N Fluoreszenz angezeigt schnell freigesetzt SR Ca 2 +-Gehalt und der Verlust von Rhod-5N Fluoreszenz vorgeschlagen Aktivierung SOCE.
Diskussion
Obwohl die Anregungswellenlängen für Ca 2 +-Bindung und Ca 2 +-freien Fura-2 340 nm und 380 nm sind jeweils das beste Verhältnis Dynamikbereich von Fura-2 für Ca 2 +-Konzentration Messung kann bei anderen Wellenlängen bei einer bestimmten Mikroskop-System. Solche Verschiebungen in der Wellenlänge sind in der Regel aufgrund von Änderungen in dem optischen Pfad mit der Zugabe von verschiedenen optischen Komponenten. In dieser Studie wurden die Anregungswellenlängen für Fura-2 als 350 nm und 390 nm zur Spektralanalyse von Fura-2 Fluoreszenz bestimmt.
Die intrazellulären Ca 2 +-Ebene im Zytosol resultiert aus einem Gleichgewicht aus mehreren Quellen, einschließlich intrazellulärer Ca 2 +-Freisetzung, extrazellulären Ca 2 +-Eintrag, sowie Ca 2 +-Ausschluss-Mechanismus an der ER und Plasmamembran. Um die unidirektionale SOC-vermittelte Ca 2 +-Einstrom aus intrazellulären Ca 2 +-Freisetzung und Ca 2 + extr isolierenusion, kann die Mn 2 + Abschrecken des Tests verwendet werden. Mn 2 + ist bekannt, können in die Zellen über SOCE Permeat aber undurchlässig für Oberflächenmembran Extrusion oder ER Aufnahme von Ca 2 +-Pumpen. Daher stellt Fluoreszenzlöschung eine Messung der unidirektionalen Mn 2 +-Fluss in die Zellen, die den Grad der Aktivierung des SOCE schätzt. Mn 2 + Abschrecken Test wird bei der isosbestischen Punkt durchgeführt, an solchen Wellenlänge Fura-2-Fluoreszenzintensität ist unabhängig von Ca 2 +-Konzentration. Die isosbestischen Punkt für jedes System sollte durch Scannen Spektrum bestimmt werden. Alternativ kann Mn 2 + Abschrecken durch angepasste Fluoreszenz bei zwei beliebigen Wellenlängen so dass der endgültige Wert unabhängig von Ca 2 +-Konzentration 13 aufgezeichnet werden.
Um die räumlichen und zeitlichen Informationen der Tätigkeit der SOCE in der Skelettmuskulatur zu gewinnen, verwendeten wir eine Dual-Farbstoff-Methode, die gleichzeitige MeasureMe erlaubtnt von SOCE Aktivität und SR Ca 2 +-Gehalt in enthäuteten erwachsener Säugetiere EDL Muskelfasern. Die Korrelation zwischen den Veränderungen im SR Ca 2 +-Gehalt und SOCE Aktivität kann aufgetragen, um die Schwelle und Empfindlichkeit der SOCE Aktivierung zu einer Erschöpfung des SR Ca 2 +-Lagerung hinzuweisen. Der TT-loading Lösung ist optimiert, um zusätzlich laden die T-Tubuli mit Ca 2 + und für die Grundierung der T-Tubuli und der SR-loading-Lösung wurde entwickelt, um maximale SR Ca 2 +-Beladung zu fördern und zusätzlich laden die T-Tubuli mit ~ 500 uM Ca 2 +. FCCP befindet sich im TT / SR-loading-Lösung und der SR-abbauenden Lösung, um die Effekte aus den Mitochondrien eliminieren enthalten.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken Dr. Noah Weisleder zum Lesen und Editieren von diesem Manuskript. Diese Arbeit wurde durch Forschungsstipendien UMDNJ Stiftung 62-09 bis ZP, American Heart Association SDG2630086 zu XZ, 0535555N zu MB, und National Institutes of Health RC2AR058962-01 bis MB unterstützt.
Materialien
Tabelle der spezifischen Reagenzien und Geräte:
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| RPMI 1640 | Mediatech | 10 bis 040-CV | |
| Ham 's F-12 | Mediatech | 10 bis 080-CV | |
| DMEM | Mediatech | 10 bis 013-CV | |
| Glass Bottom Dish | MatTek | P35G-1.5-14-C | |
| Fura-2 AM | Invitrogen (Molecular Probes) | F1221 | -20 ° C, Dichtung eng, vor Licht geschützt, in DMSO gelöst |
| Fluo-5N Uhr | Invitrogen (Molecular Probes) | F14204 | -20 ° C, Dichtung dicht, von l geschütztight |
| Rhod-5N | Invitrogen (Molecular Probes) | R14207 | -20 ° C, Dichtung eng, vor Licht geschützt |
| Quarzküvette | Starna Cells | 3-Q-10 | |
| Thapsigargin | Tocris | 1138 | |
| 2-Aminoethoxydiphenylborane (2-APB) | Tocris | 1224 | |
| N-Benzyl-p-Toluolsulfonamid (BTS) | Sigma-Aldrich | 435600 | |
| Kollagenase Typ I | Sigma | C0130 |
Ausstattung:
- Ein Spektrofluorometer (Photon Technology International, New Jersey): Xenon-Bogenlampe, computergesteuerten High-Speed-Random-Access-Monochromator, Küvetten-basierte Emissionsmonochromator, Nikon TE-200 invertierte Fluoreszenz-MikroskopE, S Fluor 40x/1.30 Öl-Objektiv, PMT-Detektoren.
- Laser-Scanning-konfokalen Mikroskop (BioRad Radiance2100): 453/477/488/514 Argonlaser, HeNe-Laser 543nm, Nikon TE2000 inversen Mikroskop, 60x Objektiv (NA 1.4, Öl).
- Ein Stereomikroskop mit einer Vergrößerungsleistung> 100 (Zeiss Stemi SV11 Apo).
Referenzen
- Parekh, A. B., Putney, J. W. Store-operated calcium channels. Physiol. Rev. 85, 757-810 (2005).
- Ma, J., Pan, Z. Retrograde activation of store-operated calcium channel. Cell Calcium. 33, 375-384 (2003).
- Feske, S. ORAI1 and STIM1 deficiency in human and mice: roles of store-operated Ca2+ entry in the immune system and beyond. Immunol. Rev. 231, 189-209 (2009).
- Parekh, A. B. Store-operated CRAC channels: function in health and disease. Nat. Rev. Drug Discov. 9, 399-410 (2010).
- Pan, Z. Dysfunction of store-operated calcium channel in muscle cells lacking mg29. Nat. Cell Biol. 4, 379-383 (2002).
- Shin, D. W. A retrograde signal from calsequestrin for the regulation of store-operated Ca2+ entry in skeletal muscle. J. Biol. Chem. 278, 3286-3292 (2003).
- Ma, J., Pan, Z. Junctional membrane structure and store operated calcium entry in muscle cells. Front Biosci. 8, d242-d255 (2003).
- Pan, Z., Damron, D., Nieminen, A. L., Bhat, M. B., Ma, J. Depletion of intracellular Ca2+ by caffeine and ryanodine induces apoptosis of chinese hamster ovary cells transfected with ryanodine receptor. J. Biol. Chem. 275, 19978-19984 (2000).
- Hirata, Y. Uncoupling store-operated Ca2+ entry and altered Ca2+ release from sarcoplasmic reticulum through silencing of junctophilin genes. Biophys. J. 90, 4418-4427 (2006).
- Zhao, X. Enhanced resistance to fatigue and altered calcium handling properties of sarcalumenin knockout mice. Physiol. Genomics. 23, 72-78 (2005).
- Zhao, X. Azumolene inhibits a component of store-operated calcium entry coupled to the skeletal muscle ryanodine receptor. J. Biol. Chem. 281, 33477-33486 (2006).
- Launikonis, B. S., Barnes, M., Stephenson, D. G. Identification of the coupling between skeletal muscle store-operated Ca2+ entry and the inositol trisphosphate receptor. Proc. Natl. Acad. Sci. U.S.A. 100, 2941-2944 (2003).
- Shuttleworth, T. J. Temporal relationships between Ca2+ store mobilization and Ca2+ entry in an exocrine cell. Cell. Calcium. 15, 457-466 (1994).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten