Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Rodent stereotaktischen Chirurgie und Tierschutz Outcome Verbesserungen für Behavioral Neuroscience
In diesem Artikel
Zusammenfassung
Stereotaktischen Operation an Nagern ermöglicht eine gezielte Verabreichung von Medikamenten oder Elektrostimulation und Aufnahmen an wachen, sich verhaltenden Tier. In diesem Video-Präsentation werden wir den letzten prozedurale Verfeinerungen dieser langjährigen Verfahren, die erfolgreich eine verbesserte Überlebensrate und weniger postoperative Gewichtsverlust zu demonstrieren.
Zusammenfassung
Stereotaktischen Operation zur Implantation von Kanülen in bestimmten Hirnregionen seit vielen Jahrzehnten eine sehr erfolgreiche experimentelle Technik, um die Auswirkungen von lokal manipuliert Neurotransmitter und Signalwege in wach, sich verhaltenden Tier zu untersuchen. Darüber hinaus hat die stereotaktische Implantation von Elektroden für elektrophysiologische Stimulation und Ableitung Studien maßgeblich zu unserem heutigen Verständnis der Neuroplastizität und Gehirn Netzwerke im sich verhaltenden Tier. Bei immer mehr Wissen über die Optimierung von chirurgischen Techniken in Nagetieren 1-4, das öffentliche Bewusstsein in Bezug auf Fragen des Tierschutzes und der strengen Gesetzgebung (zB die 2010 EU-Richtlinie über die Verwendung von Versuchstieren 5) hat uns veranlasst, diesen chirurgischen Eingriffen zu suchen, insbesondere im Hinblick um die Umsetzung neuer Verfahren für die Sauerstoff-Supplementierung und die kontinuierliche Überwachung von Blut mit Sauerstoff und Herzfrequenz-Niveaus während der Operation sowieEinführung eines standardisierten Protokolls zur postoperativen Pflege. Unsere Beobachtungen zeigen, dass diese Änderungen in einer erhöhten Überlebensrate und eine Verbesserung der allgemeinen Zustand der Tiere nach der Operation (z. B. weniger Gewichtsverlust und eine aktivere Tier) geführt. Dieses Video-Präsentation zeigt die allgemeinen Verfahren in dieser Art von stereotaktischen Operation mit besonderem Augenmerk auf unsere verschiedenen Modifikationen beteiligt. Wir illustrieren diese chirurgischen Verfahren bei Ratten, aber es ist auch möglich, diese Art der Chirurgie in Mäusen oder anderen kleinen Labortieren durchgeführt durch die Verwendung spezieller Adapter für die stereotaktische Vorrichtung 6.
Protokoll
Hinweis: Antiseptische Techniken sollten während des gesamten Verfahrens eingesetzt werden. Alle Instrumente und Materialien (Baumwolle-bestückte Tupfer, Gaze, etc.), die während der Operation eingesetzt werden, sollten durch Autoklavieren sterilisiert werden. Ein OP-Maske, Haar-Motorhaube und sterile Handschuhe getragen werden. Der Arbeitsbereich und der stereotaktischen Gerät gründlich gereinigt werden, und desinfiziert mit einer 70% igen Ethanol-Lösung.
1. Pre-chirurgische Eingriffe
- Richten Sie den stereotaktischen Apparat und alle benötigten Materialien. Pre-warm die Heizkissen.
- Legen Sie die Kanüle in seine Unterstützung und prüfen, ob sie gerade ist.
- Schalten Sie das Gasnetz - Mischung aus Luft und Sauerstoff (30-35% des gesamten Flow sollte Sauerstoff).
- Wiegen Sie die Ratte und die Verwaltung der Betäubung. Wir verwenden eine Mischung aus Ketamin (37,5 mg / kg) und Dexmedetomidin (0,25 mg / kg) subkutan injiziert. Für verschiedene Narkose-Protokollen finden Sie Flecknell 4 und Hellebrekers et al. 7.
- Nachdem die Ratte das Bewusstsein verloren, rasieren Kopfbereich geht aus den Ohren, nur zwischen den Augen mit einem elektrischen Rasierapparat.
- Legen Sie die Ratte auf dem Heizkissen, mit der Nase vor der Luftschlauch. Verwenden Sie ein Pulsoximeter, um sicherzustellen, dass die Ratte eine angemessene Blutoxygenierung Ebene (sollte nicht fallen <90%) hat. Bitte folgen Sie den Anweisungen des Herstellers für die richtige Nutzung der Geräte.
- Übernehmen Augencreme (Duratears Z, Alcon) auf beiden Hornhäute zur Austrocknung zu vermeiden.
- Überprüfen Sie die Ratte die Reflexe (tail Reflex oder Zehen-Pinch-Reflex, als in Walantus et al. 8 gezeigt), um sicherzustellen, dass es ausreichend betäubt ist. Wenn die Ratte weiterhin starke Reflexe zeigen, könnte Supplementierung der Narkose erforderlich sein.
- Wenn keine Zehen-Pinch-Reflex wird gezeigt, Ort der Ratte in der stereotaktischen Apparat, passen Sie die Ohr-Bars, so dass es gleich zu lesen auf beiden Seiten zeigt, und legen wieder den Atemschlauch vor dem Tierdurch die Festsetzung es mit der Nase bar. Überprüfen Sie noch einmal, wenn die Ratte zeigt eine Blutoxygenierung von 90% oder höher. Wenn nicht, stellen Sie entweder den Schlauch, eine Annäherung an die Nase, oder erhöhen Sie die Zufuhr von Sauerstoff. Überwachen Sie die Blutoxygenierung Ebene und die Herzfrequenz während der Operation.
- Kontinuierliche Überwachung der Ratte Temperatur mit einem Thermometer rektal (vorzugsweise auf einem Heizkissen angeschlossen) und notieren Sie die Werte am Anfang und am Ende der Operation. Passen Sie die Heizkissen oder eine Decke auf eine Körpertemperatur von 37,5 bis 38,5 ° C zu halten
2. Chirurgie
- Spritzen Sie das Analgetikum. Wir sind mit einem einzigen peri-operative Verabreichung von Carprofen (4,0 bis 5,0 mg / kg subkutan). Für verschiedene Schmerzmittel Protokollen finden Hellebrekers et al. 7.
- Reinigen Sie den rasierten Bereich der ter Haut von der Mitte zu den Haaren Umfang dreimal mit einem Desinfektionsmittel (zB Chlorhexidin 0,5%) und lokal zu injizieren eine Mischung von Lidocain (20 mg / ml) und Adrenalin (5 mg / ml) zur Lokalanästhesie und Vasokonstriktion (um zu verhindern starke Blutungen).
- Machen Sie eine anterior-posteriore Inzision von etwa 2,5 cm auf der Mittellinie der Kopfhaut, und zwar von zwischen den Augen, bis die Rückseite der Ohren. Verwenden Sie 4-6 Bulldogklemmen abzukneifen der Haut und halten den Schnitt zu öffnen. Entfernen Sie alle Bindegewebe mit einem Spatel und / oder Wattestäbchen und reinigen Sie den Bereich um den Schädel Oberfläche freizulegen.
- Prüfen Sie, ob der Kopf Ebene: Erstens finden Lambda und Ort der Führungskanüle genau über dieser Stelle berühren den Schädel. Notieren Sie sich die dorso-ventrale koordinieren. Als nächstes legen Sie die Führungskanüle genau über Bregma, berührt den Schädel, und notieren Sie die dorso-ventrale koordinieren. Diese beiden Koordinaten sollten identisch sein. Ist die Differenz> 0,3 mm, passen Sie die Nase bar zu korrigieren.
- Make zwei kleine Löcher für die Befestigung des Schädels Schrauben mit einem sterilisierten Handbohrmaschine (eine ca. 5 mm anterior der Kanüle Lage in einer der Hemisphären und die anderen 5 mm hinter der Kanüle Lage in der kontralateralen Hemisphäre). Legen Sie zwei sterile Schrauben in die Löcher, bis sie fest verankert sind, ohne vollständig in den Schädel eingesetzt.
- Mit der Führung Kanüle gelegt genau an Bregma, notieren Sie die anterior-posterioren und lateralen Koordinaten. Die korrekte Lage der Führungskanüle Platzierung für jede Region des Gehirns können durch Addieren oder Subtrahieren von Bregma, mit Hilfe eines stereotaktischen Atlas 9-11 berechnet werden.
- Positionieren Sie den Führungskanüle in die richtige Position, leicht berühren den Schädel. Notieren Sie sich die dorso-ventrale koordinieren. Für bilaterale Kanüle Platzierung neben der Kanüle Lage in die andere Hemisphäre zu finden, und erneut ein Rekordergebnis der dorso-ventralen koordinieren. Beide Koordinaten sollten identisch sein (oder unterscheiden <0,3 mm).
- Markieren Sie die Kanüle Standorten auf den Schädel mit einem sterilen Stift und mit der Hand Bohrer, machen die Bohrlöcher, die Überprüfung der Größe und der richtigen Stelle mit Hilfe des Leitfadens Kanüle. Sobald die Löcher sind, verwenden Sie eine sterile Nadel vorsichtig punch den Hirnhäuten zum ungehinderten Einführen der Kanüle zu ermöglichen.
- Legen Sie die Kanüle in das erste Loch und senken Sie es sorgfältig, bis sie die endgültige ventralen koordinieren erreicht. Bereiten Sie den Zahnzement und großzügig auftragen es um die Kanüle und einer oder beide Schrauben, um die Kanüle zu fixieren. Warten Sie, bis der Zement vollständig getrocknet ist. Danach entfernen Sie vorsichtig die Kanüle zu unterstützen, indem Sie die dorso-ventrale bar nach oben.
- Legen Sie die zweite Kanüle in die Unterstützung und gehen Sie auf die Kanüle Lage in die andere Hemisphäre. Legen Sie die Kanüle in das Loch, und wiederholen Sie den vorherigen Schritt. Bedecken Sie die Schrauben und eine große Oberfläche der Kanülen mit dem Zement und bevor der Zement trocken ist, entfernen Sie alle Überschüsse aus der Haut.
- Inject warm (~ 37 ° C) steriler Kochsalzlösung (~ 10 ml / kg, sc) zu Rehydrierung zu gewährleisten.
- Nach der Zement vollständig getrocknet ist, entfernen Sie die Kanüle zu unterstützen und legen Sie eine sterile Nadel in jede Kanüle zur Obstruktion zu verhindern.
- Reinigen Sie die Wunde mit einer sterilen Kochsalzlösung und Naht der Vorder-und Rückseite der Wunde.
- Entfernen Sie das Tier aus der stereotaktischen Apparat, anstelle der Gasschlauch vor seiner Nase. Fahren Sie mit dem Sauerstoffsättigung und Körpertemperatur überwachen.
- Wenn eine injizierbare Betäubungsmittel mit Dexmedetomidin verwendet wird, injizieren ihre Antagonisten Atipamezol (0,25 mg / kg, sc) und warten, bis das Tier erwacht (ca. 5 Minuten).
- Legen Sie die Ratte in eine Erholung Käfig. Zur Vermeidung von Unterkühlung, platzieren Sie den Käfig in einem Brutschrank bei 28 ° C oder auf einem Heizkissen in einem Ort, wo man das Tier für mindestens eine Stunde beobachten können, vor der Rückgabe an das Vivarium Raum.
3. Post-OP-Pflege
- Während die ersten 4 Tage nach der Operation, überwachen die Ratte Genesung, indem sie täglich Aufzeichnungen über Gewicht und andere Beobachtungen über den Zustand des Tieres im Labor Logbüchern oder "Tierschutz Tagebücher".
- Tiere, die deutliche Zeichen für eine Krankheit, Infektion der Wunde, Verlust von Körpergewicht oder andere Anzeichen verminderter Wohlbefinden zu unterziehen besondere Sorgfalt zeigen: z. B. eine zusätzliche Dosis von Schmerzmitteln zu post-operativen Schmerzen, eine Mischung aus Pulver Nahrung und Wasser zu minimieren Zusätzlich zu den Standard chow zur Förderung der Ratte den Appetit, und / oder eine subkutane Injektion von Kochsalzlösung auf Rehydrierung zu unterstützen.
- Wenn die Ratte zeigt keine Verbesserung nach diesen Eingriffen, oder der Verlust von Körpergewicht> 15% (im Vergleich zu vor der Operation das Gewicht), das Opfer das Tier mit einer Überdosis des Narkosemittels (humane Endpunkt).
- Ratten müssen in der Regel für mindestens 7 Tage vor Beginn der Verhaltensexperimente erholen.
4. Repräsentative Ergebnisse
jove_content "> Um festzustellen, ob die verschiedenen Änderungen an unseren chirurgischen Eingriff, insbesondere im Hinblick auf zusätzlichen Sauerstoff und die kontinuierliche Überwachung von Blutoxygenierung Ebenen, Herzfrequenz und Körpertemperatur, das Tier das Überleben erweitert und verbessert den allgemeinen Zustand nach der Operation, verglichen wir die Nicht-Überlebensrate von 20 Kohorten von Tieren (bestehend aus 20 Ratten pro Stück), dass eine Operation unterzogen, nachdem wir diese Änderungen umgesetzt mit dem Nicht-Überlebensrate von 24 Kohorten (20 Ratten pro Stück) mit dem Standard-Protokoll betrieben. Wie in Abbildung 1a , die Nicht-Überlebensrate war signifikant in der Stichprobe der Kohorten, die mit dem modifizierten Protokoll (P <0,05; Mann-Whitney-U-Test, zwei tailed) betrieben wurde reduziert. Außerdem ist, wie in Abbildung 1b, post-chirurgische Gewichtsverlust gezeigt von Ratten mit dem modifizierten Protokoll betrieben wurde ebenfalls signifikant reduziert, um die von Ratten, die mit dem Standardverfahren (post-operativen Tag 1 betrieben Vergleich: P <0,05; postoperativen Tag 2: p <0,01; postoperativen Tag 3: P = 0,17; Student t-Tests).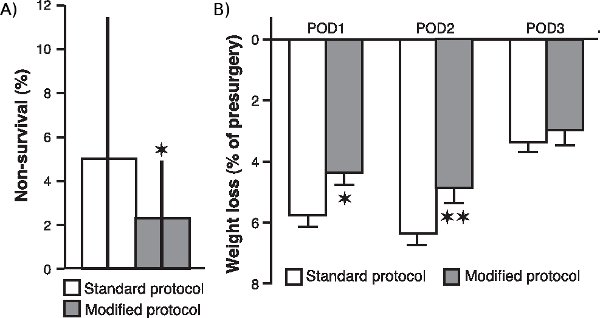
Abbildung 1. Effect von chirurgischen Modifikationen auf Nicht-Überlebensrate und postoperativen Gewichtsabnahme. (A.) Non-Überlebensrate von Ratten, die mit dem modifizierten Protokoll betrieben werden, dass von Ratten mit dem Standard-Protokoll betrieben verglichen. Die Nicht-Überlebensrate (Median ± Interquartilbereichs) wurde als Prozentsatz der Ratten berechnet, pro Gruppe von 20 Ratten, die nicht überlebt haben Chirurgie. * P <0,05, Mann-Whitney-U-Test wurden zwei tailed (n = 20 Kohorten für die modifizierten Protokoll und 24 Kohorten für das Standard-Protokoll). (B.) Gewichtsverlust (Mittelwert ± SEM in Prozent des vor der Operation Gewicht) während der ersten (POD1), zweiten (POD2) und dritten (POD3) postoperativen Tag. * P <0,05, ** P <0,01, Student t-Test (n = 60 pro Gruppe).
Diskussion
Der Hauptzweck dieses Video-Präsentation ist es, Verhaltens-Neurowissenschaftler mit den Grundprinzipien der stereotaktischen Chirurgie vertraut zu machen. Forscher, die bereits gute Ergebnisse erzielen stereotaktischen Operation könnte auch aus diesem Video profitieren und betrachten einige der verfahrenstechnischen Verbesserungen für den Einsatz im eigenen Labor. Eine ständig wachsende Wissen über die Optimierung von chirurgischen Techniken 1-3, die Entwicklung neuer Anästhetika und Analgetika für de...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren danken Dr. Peter Gerrits für die Zeichnungen in dem Video verwendet.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | ||
| Alcohol 70% | VWR | ||
| Antisedan (Atipamezol) | Orion | ||
| Atropinsulfat 0,5 | Pharmachemie BV | ||
| Bulldog hämostatische Klemme | Aesculap | ||
| Kanülen | Component Supply Co. | ||
| Chlorhexidin 0,5% | AppepPharma | ||
| Reinigungspulver | Alconox | ||
| Cotton-Sticks | Hartmann BV | ||
| Dexdomitor (Dexmedetomidin) | Orion | ||
| Drill | Dremel 8000 | ||
| Duratears Z | Alcon | ||
| Durogrip Naaldvoerder unterhalten 130mm | Aesculap | ||
| Durotip fijne schaar ret.sp / st 110 mm | Aesculap | ||
| Gaze | Medicomp (5x5) | ||
| Heizkissen | Harvard Apparatus | ||
| Insect Pins (Stilette) | Entosphinx (Tschechische Republik) | ||
| Ketamin 10% (Ketamin) | Alfasan | ||
| Micro-Halsted gerader Spitze | Aesculap-vet | ||
| Molinea | Hartmann BV | ||
| NaCl 0,9% | Baxter | ||
| Nadeln (25G) | Terumo | ||
| Oximeter | Edan Instruments, Inc. | ||
| Pentobarbital | Pharmazie der UMCG | ||
| Rimadyl | Pfizer | ||
| Skalpell Nr. 23 | Swann Morton | ||
| Scalpelholder NR. 4 133 mm | Aesculap | ||
| Schraubendreher | konventionelle Hardware Store | ||
| Simplex Rapid (Zahnzement) | Kemdent | ||
| Schädel Schrauben | Component Supply Co. | ||
| Spachtel | VWR | ||
| Spongestan spezielle | Johnson & Johnson | ||
| Stereotacts | Kopf Instruments | ||
| Chirurgische Pinzette 100mm | Aesculap | ||
| Nahtmaterial Safil 5 / 0 | Aesculap | ||
| Spritze 10 ml | Omnifix | ||
| Spritze 1ml | Terumo | ||
| Spritze 5ml | Omnifix | ||
| Xylocain (Lidocain / Adrenalin) | Astra Zeneca |
Referenzen
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress?. Altern. Lab Anim. 33, 119-127 (2005).
- Stokes, E. L., Flecknell, P. A., Richardson, C. A. Reported analgesic and anaesthetic administration to rodents undergoing experimental surgical procedures. Lab Anim. 43, 149-154 (2009).
- Flecknell, P. A. . Laboratory Animal Anaesthesia - A Practical Introduction for Research Workers and Technicians. , (2009).
- . DIRECTIVE 2010/63/EU OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , (2010).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable Stereotaxic Surgery in Rodents. J. Vis. Exp. (20), e880-e880 (2008).
- Hellebrekers, L. J., Booij, L. H. D. J., Flecknell, P. A., Van Zutphen, L. F. M., Baumans, V., Beynen, A. C. Anaesthesia, analgesia and euthanasia. Principles of Laboratory Animal Science. , 277-311 (2001).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J. Vis. Exp. (6), e236-e236 (2007).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (1986).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Swanson, L. W. . Brain Maps: Structure of the Rat Brain. , (1992).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten