Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Kutane Leishmaniose in der Rückenhaut von Hamstern: ein nützliches Modell für das Screening von Drogen leishmanientötende
In diesem Artikel
Zusammenfassung
Optimierung der experimentellen Hamster-Modell für kutane Leishmaniose durch intradermale Injektion von Leishmania Promastigoten an der dorsalen Haut. Dieser Ansatz ist sinnvoll, während der Inokulation, Follow-up, Charakterisierung von Läsionen, die Anwendung von Behandlungen und den Erhalt von klinischen Proben. Locomotion, die Suche nach Nahrung und Wasser, sind Spiel-und sozialen Aktivitäten erhalten.
Zusammenfassung
Traditionell werden Hamster experimentell in der Schnauze oder dem Fußballen geimpft. Doch in diesen Seiten ein Geschwür nicht immer auftritt, ist die Messung der Größe der Läsion ein hartes Vorgehen und Tieren zeigen, Schwierigkeiten zu essen, atmen und weil der Läsion zu bewegen. Um die Hamster-Modell für Haut-Leishmaniose, jungen erwachsenen männlichen und weiblichen Goldhamster zu optimieren (Mesocricetus auratus) wurden intradermal an der dorsalen Haut mit 1 bis 1,5 x l0 7 Promastigoten der Leishmania-Spezies und das Fortschreiten der später Läsionen injiziert wurden für bis zu bewertenden 16 Wochen nach der Infektion. Der Goldhamster wurde ausgewählt, weil es als das adäquate Modell für Bio-Medikamente gegen Leishmania bewerten, da sie anfälliger für Infektionen durch verschiedene Arten sind. Kutane Infektion von Hamstern kommt es zu chronischen, aber kontrollierte Läsionen, und eine klinische Entwicklung mit ähnliche Symptome wie beim Menschen beobachtet. Deshalb, o die Einrichtungf das Ausmaß der Infektion durch Messen der Größe der Läsion nach Anspruch Bereich der Verdickungen und Geschwüre möglich ist. Dieser Ansatz hat seine Vielseitigkeit und einfache Handhabung bei der Impfung bewiesen, Follow-up und Charakterisierung von typischen Läsionen (Ulzera), Anwendung von Behandlungen durch verschiedene Arten und den Erhalt von klinischen Proben nach unterschiedlichen Behandlungen. Durch die Nutzung dieser Methode die Qualität des tierischen Lebens in Bezug auf Fortbewegung, die Suche nach Nahrung und Wasser, Spiel-und sozialen Aktivitäten isalso erhalten.
Protokoll
1. Die Infektion von Hamstern
1. Tiere
Inzucht weiblichen und männlichen Goldhamster (Mesocricetus auratus), 6-8 Wochen mit einem Gewicht von 140-160 g verwendet werden. Sie werden mit dem Tierhaus untergebracht, in der temperaturgeführten Unterkunft, gefüttert mit Standard-Nager-Trockenfutter und mit Wasser ad libitum. Alle Verfahren, die Tiere werden von der institutionellen Ethikkommission für Experimentelle Tiere zugelassen. Vor der experimentellen Infektion mit Leishmania-Parasiten dermotropic Tiere geschlechtlich sind, markiert und gewichtet nach standardisierten Verfahren. Für Geschlechtsbestimmung werden die Tiere für Besonderheiten wie zB die Visualisierung der Mamillarlinie und der kurzen anogenitalen Abstand bei Frauen oder die Visualisierung von Hoden und einen größeren Abstand zwischen Anus und Vorhaut bei Männern kontrolliert. Dann werden die Tiere durch Ohrlochstechen oder durch Färbung eine Fläche von der Haut mit einem Tupfer eingeweicht markiertin Pikrinsäure. Für Ohr Perforation, nach Reinigung mit 70% igem Alkohol wird das Ohr durchbohrt mit einem Ohr Punsch für Nagetiere. Eine Region mit Blutgefäßen ist zu vermeiden. Sedation mit einer Mischung von 9.01 Ketamin (50 mg / kg) und Xilacine (20 mg / kg) intraperitoneal in einem Volumen von 260-25-300μl G-Nadel wird empfohlen. Schließlich sind Tiere, indem sie in eine Falle oder Box, die auf einer Präzisionswaage gewogen bedingt ist.
2. Parasiten
Promastigoten der dermotropic Leishmania-Arten, wie L. amazonensis, in zweiphasigen Nowy MacNeal-Nicolle (NNN) Kulturmedium bei 26 ° C Metazyklisch (stationären) Phase Promastigoten (5 Tage) areused um die Hamster zu infizieren. Kurz gesagt, Parasiten geerntet, zweimal mit Phosphat-gepufferter Saline (PBS), gezählt und auf 1 x 10 7 (bei Männern) bzw. 1,5 x 10 7 (bei Frauen) Parasiten in 0,1 ml PBS zur Impfung männliche oder weibliche jeweilsjedoch kann die Impfkulturen Größe entsprechend der Leishmania-Spezies (Verfahren nicht in der Video gezeigt) zu variieren.
3. Die experimentelle Infektion
Eine Hautfläche wird vor der Impfung rasiert. Kurz gesagt wurden die anästhesierten Tieren in Bauchlage platziert und mit einer Schere, wird das Haar zwei Zoll von der Basis des Schwanzes entfernt. Nach dem Aufräumen der rasierte Bereich mit steriler Kochsalzlösung der Parasit Inokulum wird intradermal, bis eine Papel gebildet injiziert.
4. Klinische Follow-up
Die Tiere werden alle überwacht 7 Tage bis zu 4 - 6 Wochen nach der Impfung für die Erscheinung der Läsion. Kurz werden die Tiere in einer Falle immobilisiert und der beimpfte Hautpartie wird palpiert. Dann wird die Verhärtung Bereich des Ulkus ausgebildet abgegrenzt und die Breite und die Länge des Geschwürs mit einer digitalen Schieblehre gemessen.
2. Die Behandlung von Hamstern
1. Adminwaltung der Verbindungen
Der Behandlungsplan beginnt, wenn die Tiere Ulzerationen (4-6 Wochen nach der Inokulation) entwickelt haben. Die Tiere werden in Gruppen von 5-6 Tieren für jeden zu testenden Verbindung verteilt. Die Verbindungen können topisch, oral, intramuskulär oder intraläsionale Wege verabreicht werden. Vor der Anwendung von Medikamenten, sind Hamster betäubt und die Läsion Fläche gereinigt wird mit Kochsalzlösung oder PBS. Wenn die Verbindung über die topische oder intraläsionale angelegt wird, werden die Hamster in Fallen, die den Bereich freizulegen zu behandeln, während, wenn die Verbindung oral oder intramuskulär verabreicht wird die Hamster sicher durch die Basis des Halses befestigt werden können immobilisiert. a) Die topische Anwendung: die Verbindung auf der Läsion isapplied und nach wenigen Minuten wird das Tier auf die cage.b zurückgegeben) Für die intramuskuläre Injektion, das Medikament wird injiziert (200 ul maximal) durch die semitendinous oder semimembranous Muskeln der Hinterläufe. c) Für die orale Verwaltungtion, wird das Medikament an das Tier (200 ul Maximum) durch oro-Magen-Sonde 14G verbunden ist mit einer 1 ml Spritze bereitgestellt. d) Für intradermale Injektion der Wirkstoff (100 ul Maximum) allmählich an der Basis des Geschwürs mit einem 26G Nadel mit dem Kegelrad Hinstellen injiziert. Der gesamte Bereich der Läsion wird durch Drehung der Nadel bedeckt. Die Behandlungen werden täglich während 10-20 Tagen verabreicht wird, entsprechend der definierten therapeutischen Schema.
2. Klinische Follow-up
Weil in diesem experimentellen Modell die Wirksamkeit neuer leishmanientötende Verbindungen gemäß der Heilung und Vernarbung der Läsionen nach der Behandlung bestimmt wird, wird eine klinische Überwachung jedes einzelnen Tieres wöchentlich am Ende der Anwendung der Verbindung und bis zu drei Monate nach getan. Während der Überwachung wird die Art der Wunde beschrieben, und die Verhärtung und Ulcusfläche gemessen mit einer digitalen Schieblehre. Das Vorhandensein von Läsionen in verschiedenen Regionen derImpfstelle sowie das Auftreten von Rezidiven der Läsion wird ebenfalls beschrieben und registriert. Alle zwei Wochen werden die Tiere gewogen und Läsionen abgebildet sind. Die Tiere werden täglich zu überwachen beobachtet: a) Aussehen (Haare, Koordination-, Temperatur-, Augen, Position der Ohren, Pflege, Stuhlgang, Vorhandensein von Aszites, Agitation und Dehydration) und b) Verhalten (wach, aufmerksam, neugierig, aufmerksam , bleibt bei der Gruppe, freut sich auf Essen und Trinken, und schwer zu fangen). Der Ort der Anwendung der Verbindung wird auch auf das Vorhandensein von Hyperämie, Entzündung und beißenden und Haarentfernung beobachtet.
Hamster sind auch an Tag 45 Blut abgenommen nach dem Ende der Behandlung, um die hämatologischen und serologischen Werte, die mit Toxizität der Verbindungen (siehe unten) in Zusammenhang gebracht werden zu bestimmen.
Die Wirksamkeit jeder Behandlung wird beurteilt Vergleich der Läsion Größen vor und nach Behandlungen mit folgender Punktzahl system: ausgehärtet (Heilung von 100%-Bereich und ein vollständiges Verschwinden der Läsion); klinische Verbesserung (Reduzierung der Größe der Läsion in> 50% der Fläche); klinischen Versagen (Erhöhung der Größe der Läsion); Rückfall auf der Läsion nach der Aushärtung). Am Ende der Studie werden die Tiere durch Inhalation von CO2 vorherige Betäubung getötet. Nach dem Tod werden die erforderlichen Proben für parasitologische, histologische und serologische Analyse entnommen.
3. Parasitologische Prüfungen
Die Anwesenheit von Leishmania in Proben aus der Haut (Läsion oder Narbe), ist Leber, Milz und Niere direkt durch die Untersuchung Ausstriche mit Giemsa 1 und histopathologischen Untersuchung dieser Gewebe (siehe unten) gefärbt bestimmt.
Der Parasit Belastung in der Läsion Website wird von der Grenze Verdünnungsassay nach Titus und Kollegen (1985) 2 geschätzt. Kurz gesagt wird ein kleines Stück des entfernten GewebesVon jedem Tier, gewogen und homogenisiert in kaltem PBS-Lösung mit einer Spritze Kolben. Die erhaltene Suspension wird bei 600 g für 10 min bei 4 ° C zentrifugiert Danach werden die Überstände verworfen und die Pellets werden in RPMI 1640-Medium mit 1% Antibiotika und 10% fötalem Kälberserum resuspendiert. Hundert l der Suspension werden zu jedem der 96 Löcher auf die Mikrotiterplatte mit NNN Medium überlagert mit 50 ul Schneiders-Medium überführt und gehalten bei 26 ° C Die Anzahl der lebenden Parasiten in jeder Probe wird von der höchsten Verdünnung, bei der Promastigoten durch Prüfung unter einem inversen Mikroskop nachgewiesen werden jede Woche für einen Monat bestimmt.
4. Histopathologische Untersuchung von Haut-Läsion (oder Narbe) und anderen Geweben
Ein drittes Stück der Biopsie aus der Haut, Leber und Niere entnommen wird, in 10% Formalin fixiert und in Paraffin eingebettet. Proben aus Milz und Herz können auch bearbeitet werden. Five Mikron Abschnitte der festen Gewebe wurden mit haemotoxilin-Eosin gefärbt und unter einem optischen Mikroskop mit 200X, 400X oder 1000X Ölimmersion, um die Mikro-Architektur, die Eigenschaften des zellulären Infiltrats, und die Anwesenheit oder Abwesenheit von Parasiten zu untersuchen. Mikroaufnahmen getroffen werden und digitalen Bildern eingefangen.
5. Bewertung der Toxizität der Behandlung
Toxische Wirkung der Verbindung beruht auf dem physikalischen Verhalten und Zustand der Tiere gemäß der Parameter während des klinischen Follow-up (siehe oben) überwacht basiert. Die Toxizität wird auch nach hämatologischen und metabolischen Parameter in Blutproben und histopathologischen Veränderungen in Gewebeschnitten mit haemotoxilin-Eosin gefärbt beobachtet, wie oben beschrieben bestimmt.
Blutproben werden aus dem Herzen, vorzugsweise die Kammer aufgenommen. Um hämatologischen Test wird Blut auf EDTA antikoagulierten Röhrchen überführt und verarbeitet nachum Protokolle für komplettes Blutbild zu standardisieren. Zur serologischen Tests wird das Blut auf 1,5 Eppendorfgefäße überführt und zentrifugiert, um das Serum für die Analyse der Stoffwechselprodukte Kreatinin, ALT und BUN-Spiegel gemessen unter Verwendung von Kodak Ektachemdry Chemie 3 zu erhalten.
6. Datenanalyse
Daten von behandelten und unbehandelten Tieren verglichen werden mittels ANOVA-Test. Die Signifikanz wird bei p <0,05 festgelegt.
4. Repräsentative Ergebnisse
Zusammenfassung
Der Hamster-Modell der kutanen Leishmaniose wurde mit dem Ziel, mit diesem Modell in der Wirksamkeit von Arzneimitteln Screening verbessert. Entwicklung von Läsionen und parasitologische Parameter wurden bei der Erstinfektion in der dermalen Haut von Hamstern untersucht. Inbred weibliche und männliche Goldhamster (Mesocricetus auratus), 6-8 Wochen, wurden intradermal mit 1 x 10 7 (für Männer) oder 1,5 x 10 7 (für Frauen) metacycl injiziertIC (stationäre Phase) Promastigoten von L. amazonensis. Knötchen erschienen 20 bis 35 Tage pi, mit Geschwüren bilden nach 4-6 Wochen pi Nach der Infektion wurde gegründet, die Wirksamkeit von fünfwertigen Antimon (SBV) in zwei Dosen evalauted wurde. Hamster wurden in drei Gruppen von jeweils 5 Tieren randomisiert und behandelt mit Meglumin antimonsaurem bei 80 oder 120 mg SBV / kg täglich während 10 Tagen intramuskulär. Die dritte Gruppe wurde intramuskulär mit PBS als Placebo behandelt wurden. Eine Gruppe von drei Tieren waren unbehandelt und als negative Kontrolle. Die Antwort auf jede Behandlung wurde 3 Monate nach dem Ende der Behandlungszeit folgt.
1. Klinischer Verlauf nach L. amazonensis Infektion der Goldhamster (Mesocricetus auratus)
Hamster in der dorsalen Haut infiziert konsequent zu entwickeln klinisch manifeste Ulzerationen der Epidermis bei 4-6 Wochen nach der Infektion. Die Läsionen beginnen mit kleinen Knötchen und Geschwüre enden, dassZunahme der Größe nach der Zeit nach der Infektion und erreichen, was als eine optimale Größe für die Bewertung der Wirkung von experimentellen Arzneimitteln durch die vierten bis sechsten Woche nach der Infektion (18,99 bis 54,7 mm 2 bei 4 Woche und 35,55 bis 92,71 mm 2 bei 6 Wochen) (Abbildungen 1, 2). Die Läsionen anschließend ein Geschwür offensichtlich für bis zu 20 wk nach der Infektion, zu welcher Zeit wurden die Versuche beendet (Abbildung 1) beibehalten.
Eine Infektion mit L. amazonensis hat keinen Einfluss auf das Körpergewicht von Hamstern, die von 104,9 bis 124,69 gr 129,71 und 134,02 gr bis in infizierten und nicht infizierten Hamstern, (p> 0,05, ANOVA) variiert. Die Tiere nahmen im Durchschnitt 25,58 ± 5,98% des Körpergewichts während der Studie. Die Seric Werte von Kreatinin und Alanin-Aminotransferase (ALT) und Blutbild Parameter waren ähnlich zu den Referenzen Werte in nicht infizierte und Leishmania infizierten Hamstern. Nur die Brötchen-Harnstoff-Stickstoff (BUN)-Ebene war eineugmented in 60% der infizierten Tiere.
Histopathologische Analyse von Läsionen bei Hamstern mit L. infiziert amazonensis zeigten Unterschiede im Zusammenhang mit diesen nicht-infizierten Tieren. Im Allgemeinen zeigen Hautbiopsien von Hamstern nicht infizierten keine entzündliche Reaktion oder eine histologische Veränderungen (Abbildung 3a), während diejenigen mit L. infiziert amazonensis entwickeln eine granulomatöse Dermatitis und reichlichen Anwesenheit von Makrophagen infiltriert die Dermis (Abbildung 3b). Histopathologische Analyse von Geweben von Hamstern mit L. infiziert amazonensis und mit Meglumin antimonsaurem in Dosen von 80 und 120 mg SBV / kg / Tag während 10 Tagen zeigte Veränderungen verbunden, um die Infektion Prozess vergleichbar, die sich in der Kontrollgruppe (infizierte und unbehandelt). Im Allgemeinen zeigten Hautproben von Hamstern ein leichtes Maß an Plasmozyten (20%) und PMN (80%) Zellen durch moderate Infiltration von Lymphozyten (80%) begleitet, und eine milde (20%) oder schwerer (80%) infiltration von Makrophagen (Tabelle 2). Diese Beobachtungen zu einer Diagnose der granulomatösen Dermatitis, einer entzündlichen Ereignis, das die darunter liegende Dermis und Muskeln beeinträchtigt entsprechen. Dies ist die wichtigste Läsion an der Infektion, die mit dem schweren Manifestation der kutanen Leishmaniose bei allen Tieren in der Studie ist. Dieser Verein wurde statistisch korreliert, wenn der Chi-Quadrat nach Pearson, die ergab p <0,05. Nieren-Proben von 60-100% der Tiere zeigten eine mäßige Hyperplasie in der Nierenrinde und Glomeruli durch leichte Atrophie der Nieren in 75% der Tiere begleitet. Diese Beobachtungen sind mit Membran proliferativen glomerulonefritis, eine Diagnose, die zuvor auf eine Infektion durch Infektion verbundene weitere Leishmania-Spezies. Statistische Verein war groß mit einem Chi-Quadrat nach Pearson p <0,05. Die Leber von 40-100% der Tiere in allen Gruppen zeigte leichte vakuolären Veränderungen in den Leberzellen, was sein kann Associated auf physiologische Prozesse wie hepatocytic Anhäufung von Glykogen. Andere Lebergewebe Anomalien wie Verfettung, Fibrosen und Staus an der Infektion entsprechen. Andere Beobachtungen, wie kompaktiert in Hepatozyten, cardiomegalies, Gegenwart von Einschlüssen intrazytoplasmatische Eosinophile, sowie die Vakuolisierung von Zellen in den Harnröhrchen nicht statistisch (p> 0,05), um eine toxische Wirkung der getesteten Verbindung und geeignet sind, aufgrund eines physiologischen Vorgangs bei Hamstern.
2. Die therapeutische Wirksamkeit von Meglumin antimonsaurem im Hamster-Modell
Der klinische Phänotyp infizierten Hamstern zu unterschiedlichen Zeitpunkten nach der Behandlung ist in Tabelle 1 zusammengefasst. Die Behandlung mit intramuskuläre Meglumin antimonsaures in einer Dosis von 120 mg Antimon-/ kg / Tag während 10 Tagen betrug hochwirksame induzierenden vollständige Rückbildung des L. amazonensis Läsionen bei allen Tieren (Abbildung 4). Der Prozentsatz der Heilung betrug 100% innerhalb der 2 und 8 Wochen nach der Behandlung Zeit. Doch nach drei Monaten das Rezidiv der Läsion wurde in 20% von Hamstern beobachtet. Wenn Meglumin antimonsaurem bei 80 mg SBV / kg Körpergewicht verabreicht wurde, wurde vollständige Heilung nur bei 3 Tieren beobachtet. In den beiden anderen Tieren die Läsion verringerte sich um 33,9 und 69,0%, bzw. (Abbildung 5). Nach drei Monaten, L. amazonensis blieb in der Haut der Tiere mit Meglumin antimonsaures in einer Dosis von 80 mg SbV / kg / Tag behandelt wurden und nur eines der Tiere mit 120 mg Antimon-/ kg / Tag Meglumin antimonsaures behandelt. Ein Härtungsmittel intramuskuläre Dosis von 120 mg Antimon-/ kg / Tag während 10 Tagen bestimmt.
Mit dem Grenzverdünnung Test zeigten die geschätzte Zahl der Parasiten eine signifikante Reduktion bei der behandelten Gruppe mit Meglumin antimonsaurem im Vergleich zu negativen (unbehandelten) Kontroll-und Fahrzeug (Placebo) behandelten Gruppe (p <0,001). Lebende Parasiten (0,4 bis 1Wurden 6 Parasiten pro mg Haut) in der Läsion von unbehandelten Tieren nachgewiesen und die mit PBS behandelt. Ein Tier mit 120 mg / kg / Tag (Abbildung 5b) und zwei Hamster mit 80 mg / kg / Tag (Abbildung 5c) behandelt wurden: Parasiten wurden nur von diesen Tieren, die nicht auf die Behandlung mit Meglumin antimonsaurem ansprachen isoliert. Kein Unterschied in der Parasitenbelastung von Hamstern, die nicht nach dem Empfang Meglumin Antimonit im Vergleich zu jenen Tieren unbehandelt oder mit PBS ergab härten beobachtet.
In der Histopathologie von Hautbiopsien von Hamstern mit intramuskulären Meglumin antimonsaurem bei 120 mg SBV / kg / Tag behandelt wurden keine Parasiten beobachtet werden; wenige Makrophagen und Lymphozyten infiltriert die Dermis zu sehen sind (Abb. 6a, 6b). In Gegenteil, wenn Hamster mit Meglumin antimonsaures wurden bei 80 mg SbV / kg / Tag, granulomatöse Dermatitis mit reichlich vorhandene und Makrophagen infiltriert die Dermis behandelt umfassend beobachtet (6c, 6d).
3. ToxizitätMit dem gleichen Schema für therapeutische Wirksamkeit Studie zur Toxizität von Meglumin antimonsaurem bei 80 und 120 mg SBV / kg Körpergewicht wurde ausgewertet. Allgemeine Gesundheitszustand und das Körpergewicht wurden bis zu 3 Monate nach der letzten Dosis überwacht. Die Behandlung mit hatte keinen Einfluss auf das Körpergewicht von Hamstern, die von 104,9 bis 124,69 gr 129,71 und 134,02 gr bis in infizierten und nicht infizierten Hamstern variiert jeweils. Die Tiere nahmen im Durchschnitt 27,59 ± 4,22% des Körpergewichts während der Behandlung und 28,74 ± 2,26% während des Follow-up (p> 0,05, ANOVA). Gewichtsverlust wurde in keiner Gruppe der Behandlung (Daten nicht gezeigt) beobachtet. Die Seric Werte von Kreatinin und Alanin-Aminotransferase (ALT) und Blutbild Parameter waren ähnlich zu den Referenzen Werte bei unbehandelten und behandelten Meglumin antimonsaurem Hamster. Nur die Brötchen-Harnstoff-Stickstoff (BUN)-Ebene wurde in 20% der behandelten Tiere vermehrt.
Histopathological Analyse von Geweben von Hamstern mit L. infiziert amazonensis und mit Meglumin antimonsaurem in Dosen von 80 und 120 mg SBV / kg / Tag während 10 Tagen zeigten keine Veränderungen verbunden, um Medikamententoxizität.

ein Phosphat-gepufferter Saline, b Tage nach der Behandlung.
Tabelle 1. Klinischen Phänotyp von L. amazonensis experimentell Hamster nach der Behandlung mit Meglumin antimonsaurem infiziert
Die Wirksamkeit jeder Behandlung wurde beurteilt Vergleich der Läsion Größen vor und nach Behandlungen mit dem folgenden Score-System: Heilung (Heilung von 100%-Bereich und ein vollständiges Verschwinden der Läsion); klinische Verbesserung (Reduzierung der Größe der Läsion in> 50% der Fläche); klinischen Versagen (Erhöhung der Größe der Läsion); Rezidiv (Reaktivierung der Läsion nach der Aushärtung).

A: Zeichen fehlen; NA: nicht anwendbar; m: mild; M: mittel, S: schwere, PMN: neutrophilen Granulozyten; NSL: Keine signifikante Läsion; GDM: Granulomatous Dermatomyositis; PID: pyogranulomatöse Dermatitis. 1. Lymphangiektasie, 2. Mineral-ähnlichem Material.
Tabelle 2. Histopathologie der Haut von Hamstern mit experimentell infiziert L. amazonensis und mit Meglumin antimonsaurem
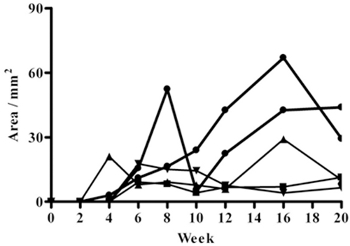
Abbildung 1. Verlauf der Hautveränderung Entwicklung nach der Infektion bei Hamstern intradermal mit 1 bis 1,5 x 10 7 L. geimpft amazonensis metazyklisch (stationäre Phase) Promastigoten während 20 Wochen. Y-Achse repräsentiert die Ulcusfläche in mm.
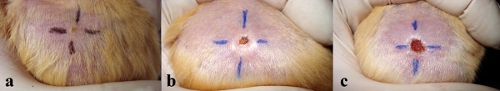
Abbildung 2. Photographyic Geschichte der Entwicklung der ulzeröse Läsion in der Rückenhaut eines Goldhamster nach intradermale Inokulation von 10 x 10 7 bei 2 Wochen (a), 4 Wochen (b) und 6 Wochen (c).

Abbildung 3 Skin von (a) nicht-infizierten Hamstern und unbehandelten Biopsie:. Keine entzündliche Reaktion weder signifikante histologische Veränderungen beobachtet wird, (b) und unbehandelten infizierten Hamster: granulomatöse Dermatitis mit Anwesenheit von Riesenzellen (Pfeil und Sternchen) und reichlich Parasiten (schwarz Pfeile) und Makrophagen (weiße Pfeile) Infiltration der Dermis. Hämatoxylin-Eosin-Färbung 400x.

Abbildung 4. Fotogeschichte des klinischen Ansprechens von Hamstern mit L. infiziert amazonensis und mit intramuskuläre Meglumin antimonsaures bei 120 mg Antimon-/ kg / Tag durin g von 10 Tagen. Die Bilder zeigen Erscheinungsbild der Läsion vor der Behandlung (a), am Ende der Behandlung (Tag 10) (b) und während der Nachuntersuchung: Tag 30 (c), 60 (d) und 90 (e) nach Behandlung.
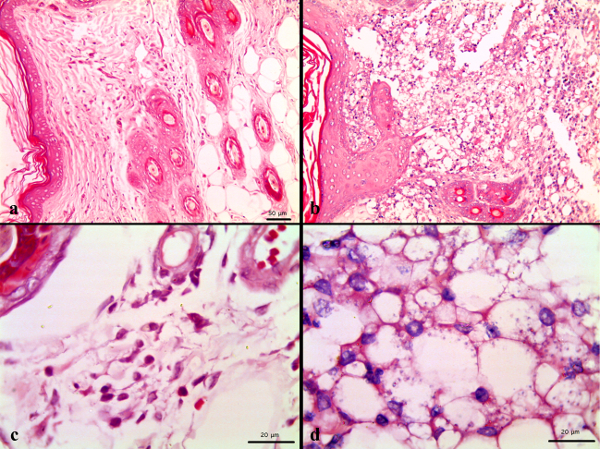
Abbildung 5. Wirksamkeit der Meglumin antimonsaurem bei der Behandlung von kutanen Leishmaniose bei Hamstern. Goldhamster wurden mit L. infiziert amazonensis in der dorsalen Haut. Nach 6 Wochen nach der Infektion waren unbehandelt (a) oder intramuskulär zehn Tage lang mit PBS allein (b), Meglumin antimonsaures 120 mg Antimon-/ kg / Tag (c) oder 80 mg SbV / kg / Tag (d) behandelt. Grafiken zeigen den Prozentsatz der Verringerung der Größe der Läsion am Ende der Behandlung (Tag 0), und an den Tagen 15, 30, 60 und 90 des Follow-up nach dem Ende der Behandlung. p <0,001 für 120 oder 80 mg SBV / kg / Tag vs Fahrzeug und nicht Behandlung.
"/>
6. Haut von Hamstern, infiziert und mit intramuskuläre megumine antinmoniate bei 120 mg Antimon-/ kg / Tag (a, b) und 80 mg SbV / kg / Tag (c, d) Biopsie. Präsenz der knappen Makrophagen und Lymphozyten infiltrieren die Dermis. Keine Parasiten beobachtet werden. Hämatoxylin-Eosin Färbung 200x (a), 1000x (c) granulomatöse Dermatitis mit reichlichen Anwesenheit von Makrophagen infiltriert die Dermis umfassend (c);. Schaum-Makrophagen mit phagozytierten Parasiten. Hämatoxylin-Eosin Färbung 200x (b), 1000x (d).
Diskussion
Kutane Leishmaniose ist endemisch in den Tropen und Neotropis. Es wird oft als eine Gruppe von Krankheiten aufgrund der vielfältigen Spektrum an klinischen Manifestationen, die von kleinen kutanen Knötchen auf grobe Schleimhautgewebe Zerstörung Bereich bezeichnet. Die meisten verfügbaren Medikamente sind teuer, erfordern lange Behandlungsschemata und immer wirkungsloser werden, erfordern die Entdeckung neuer Medikamente.
Das Maus-Modell ist weit verbreitet, aber einige Nachteile. Ein hoc...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
COLCIENCIAS und dem Zentrum für Entwicklung von Produkten gegen Tropenkrankheiten - - CIDEPRO Diese Studie wurde durch Zuschüsse aus dem Ausschuss für Forschung an der Universität von Antioquia (CODI), der kolumbianischen Instituts für Entwicklung der Wissenschaft und Technologie unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Typ | Firma | Katalog-Nummer |
| Ketamin | Reagens | Holliday-Scott SA | |
| Xilacine | Reagens | Synthese | |
| PBS | Reagens | GIBCO | 14190-136 |
| Digitaler Messschieber | Ausrüstung | Fischer | 15-077-958 |
| Giemsa | Reagens | SIGMA | GS1L-1L |
| Formalin | Reagens | Nova Labor | 11273 |
| Paraffin | Reagens | Pechiney Plastic Packaging | PM-996 |
| Haemotoxilin | Reagens | Nova Labor | 10870103 |
| Eosin | Nova Labor | 10870203 | |
| Kodak Ektachem Trockenchemie | Ausrüstung | Kodak Ektachem | DT-60 |
| Meglumin antimonsaurem | Reagens | Aventis | |
| Mikroskopie | Ausrüstung | Nikon | YS2-T |
Referenzen
- WHO. Control of the leishmaniasis. Report of a Meeting of the WHO Expert Committee on the Control of Leishmaniasis WHO. 949, (2010).
- Titus, R. G., Marchand, M., Boon, T., Louis, J. A. A limiting dilution assay for quantifying Leishmania major in tissues of infected mice. Parasite Immunol. 7, 545-555 (1985).
- Reynolds, K. M. The Kodak Ektachem dry layer technology for clinical chemistry. Upsala. J. Med. Sci. 91, 143-146 (1986).
- Handman, E., Ceredig, R., Mitchell, G. F. Murine cutaneous leishmaniasis: disease patterns in intact and nude mice of various genotypes and examination of some differences between normal and infected macrophages. Australian J. Exp. Biol. Med. Sci. 57, 9-29 (1979).
- Hanson, W., Chapman, W., Waits, V., Lovelace, J. Development of Leishmania (Viannia) panamensis lesions and relationship of numbers of amastigotes to lesion area antimony-treated and untreated hamsters. J. Parasitol. 77, 780-783 (1991).
- Henao, H. H., Osorio, Y., Saravia, N. G., Gómez, A., Travi, B. Efficacy and toxicity of pentavalentantimonials (Glucantime and Pentostam) in an American cutaneous leishmaniasis animal model: luminometry application. Biomédica. 24, 393-402 (2004).
- Travi, B. L., Martinez, J. E., Zea, A. Antimonial treatment of hamsters infected with Leishmania (Viannia) panamensis: assessment of parasitological cure with different therapeutic schedules. Trans. R. Soc. Trop. Med. Hyg. 87, 567-569 (1993).
- Hommel, M., jaffe, C. L., Travi, B., Milon, G. Experimental models for leishmaniasis and for testing anti-leishmanial vaccines. Ann. Trop. Med. Parasitol. 89, 55-73 (1995).
- Travi, B. L., Osorio, Y., Saravia, N. G. The inflammatory response promotes cutaneous metastasis in hamsters infected with Leishmania (Viannia) panamensis. J. Parasitol. 82, 454-457 (1996).
- Travi, B. L., Osorio, Y. Failure of Albendazole as an alternative treatment of cutaneous Leishmaniasis in the hamster model. Memorias Instituto Oswaldo. 93, 515 (1998).
- Travi, B. L., Osorio, Y., Melby, P. C., Chandrasekar, B., Arteaga, L., Saravia, N. G. Gender is a major determinant of the clinical evolution and immune response in hamsters infected with Leishmania spp. Infect Immun. 70, 2288-2296 (2002).
- Osorio, Y., Melby, P. C., Pirmez, C., Chandrasekar, B., Guarín, N., Travi, B. L. The site of cutaneous infection influences the immunological response and clinical outcome of hamsters infected with Leishmania panamensis. Parasite Immunol. 25, 139-148 (2003).
- Osorio, Y., Bonilla, D. L., Peniche, A. G., Melby, P. C., Travi, B. L. Pregnancy enhances the innate immune response in experimental cutaneous leishmaniasis through hormone-modulated nitric oxide production. J. Leukoc. Biol. 83, 1413-1422 (2008).
- Espitia, C. M., Zhao, W., Saldarriaga, O., Osorio, Y., Harrison, L. M., Cappello, M., Travi, B. L., Melby, P. C. Duplex real-time reverse transcriptase PCR to determine cytokine mRNA expression in a hamster model of New World cutaneous leishmaniasis. BMC Immunol. 22, 11-31 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten