Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Beurteilung der Replikation und Beta-Zellfunktion in adenoviral-transduzierten Isoliert Nager Islets
In diesem Artikel
Zusammenfassung
Dieses Protokoll erlaubt es, Faktoren, die funktionelle Betazellmasse modulieren, um potentielle therapeutische Ziele für die Behandlung von Diabetes zu finden identifizieren. Das Protokoll besteht aus einem optimierten Verfahren zur Insel Replikation und Beta-Zellfunktion in isolierten Ratteninseln nach Manipulation der Genexpression mit Adenoviren zu beurteilen.
Zusammenfassung
Glukosehomöostase wird hauptsächlich durch die endokrine Hormone Insulin und Glucagon gesteuert, sekretiert von der Pankreas-Beta und Alpha-Zellen. Funktionelle Betazellmasse wird durch die anatomische Betazellmasse sowie der Fähigkeit der Betazellen zu einer Nährstoffbelastung reagieren bestimmt. Ein Verlust der funktionellen Betazellmasse ist zentral für beide Hauptformen des Diabetes 1-3. Während die sinkende funktionale Betazellmasse ergibt sich aus einer Autoimmun-Attacke beim Typ 1 Diabetes, bei Typ 2 Diabetes entwickelt sich dieser Dekrement sowohl aus der Unfähigkeit der Beta-Zellen gegenüber Insulin angemessen absondern und die Zerstörung der Beta-Zellen aus einem Kader von Mechanismen. Daher sind Bemühungen um eine funktionale Betazellmasse wieder vorrangig für die bessere Therapie und mögliche Heilmittel für Diabetes.
Es sind Bemühungen im Gange, um molekulare Signalwege, die ausgenutzt, um die Replikation zu stimulieren und verbessern die Funktion der Beta-Zellen identifizieren kann.Im Idealfall würde therapeutische Ziele verbessern sowohl Beta-Zell-Wachstum und Funktion. Vielleicht noch wichtiger ist jedoch zu erkennen, ob eine Strategie, die Beta-Zellen stimuliert das Wachstum auf Kosten der Beeinträchtigung der Beta-Zellen-Funktion (wie mit einigen Onkogene) und umgekehrt wird.
Durch die systematische Unterdrückung oder Überexpression der Expression von Zielgenen in isolierten Ratten-Inseln, kann man potenzielle therapeutische Ziele für die Erhöhung funktionale Betazellmasse 4-6. Adenovirus-Vektoren können, um effizient überexprimieren oder Knockdown Proteine in isolierten Ratteninseln 4,7-15 eingesetzt werden. Hier präsentieren wir eine Methode, um die Genexpression Nutzung adenoviralen Transduktion zu manipulieren und zu bewerten Inselchen Replikation und Beta-Zellfunktion in isolierten Ratten-Inseln (Abbildung 1). Diese Methode wurde bereits auf neue Ziele, die Beta-Zell-Vermehrung oder Funktion modulieren 5,6,8,9,16,17 zu identifizieren.
Protokoll
1. Adenovirale Transduktion und Kultivierung von Ratteninseln
- Vorbereiten einer 6-Well-Gewebekultur nicht beschichteten Platte durch Zugabe von 2 ml Medium (RPMI 1640 Medium mit 8 mM Glukose, 10% fötales Rinderserum, 50 Einheiten / ml Penicillin und 50 ug / ml Streptomycin), um die erforderliche Anzahl von Brunnen. Zum Beispiel kann ein typisches Experiment erfordert drei Vertiefungen - jeweils für einen nicht-Viruskontrolle, ein Virus (zB, GFP-exprimierende Adenovirus), und die experimentelle Gruppe.
- Erwärmen Sie die Platte auf 37 ° C, indem Sie ihn in eine Gewebekultur-Inkubator für mindestens 30 min.
- Unmittelbar nach Ratte Inselisolierung 18,19, Platz 100-200 Inselchen in einzelnen Wells der 6-well Non-Gewebekultur beschichteten Platte. Sechzig Inseln sind für die Insulinsekretion und Thymidineinbau Assays erforderlich. Die übrigen Inseln können zur RNA-Isolierung für Untersuchungen der Genexpression oder Proteinisolierung zum Immunoblotting verwendet werden.
[Hinweis: Von diesem Punkt an, folgen Sie bitte institutionellen Protokolle für die Behandlung, Verwendung und Entsorgung biologischer Gefahrenstoffe.]
- Die Platte vorsichtig schwenken, um die kleinen Inseln in die Mitte des Brunnens zu bringen.
- Pipettieren Sie die Adenovirus direkt auf den kleinen Inseln in der Mitte des Tellers. Verwenden 100-500 Multiplizitäten der Infektion (MOI, das Verhältnis von Zielzellen, um virale Plaque-bildenden Einheiten).
- Lassen Sie die kleinen Inseln Rest für 5 min.
- Die Platte wird in der Gewebekultur-Inkubator (37 ° C, 5% CO 2).
- Nach 24 h wurde die Platte vorsichtig schwenken, um die Inseln zu den Zentren der Brunnen bringen und übertragen Sie die kleinen Inseln mit einer Mikropipette P200 zu einem neuen Brunnen mit frischem Medien. Wenn die Inseln an der Platte werden, können sie leicht mit der Pipettenspitze abgelöst werden.
[Hinweis: Um eine ausreichende Transduktion Effizienz überprüfency, die Verwendung eines Kontrollvirus GFP exprimieren vorteilhaft ist, als Inseln kann dann über der konfokalen Mikroskopie, um das Eindringen des Adenovirus in der Insel Kern zu überprüfen abgebildet werden.]
- Kultur die Inseln für eine zusätzliche 24-72 h, je nach dem gewünschten Timing des Experiments von der Optimierung Pilotstudien. Zum Beispiel kann Induktion einer proliferativen Antwort erfordern Zeiten im Bereich von 24-72 h oder Herunterregulierung von dem Gen von Interesse kann 48 oder 72 Stunden benötigen. Übertragen Sie die Inseln an die frische Medien jeden Tag.
- Für die letzten 24 h des Experiments, Kultur der Inseln in einem Medium, 1 Ci [Methyl-3 H] -thymidine/ml Medien (in der Regel 1 ul Thymidin / ml Medium).
[Hinweis: Von diesem Punkt an, folgen Sie bitte institutionellen Protokolle für die Behandlung, Verwendung und Entsorgung von radioaktivem Material.]
2. Insulin-Sekretion-Assay
- Bereiten Sie dieSekretion-Assay-Puffer (SAB) 10X-Stammlösung (1,14 M NaCl, 47 mM KCl, 12 mM KH 2 PO 4, 11,6 mM MgSO 4) und CaCl 2 100x Stocklösung (0,25 M CaCl 2). Diese Stammlösungen können im Voraus geplant werden und bei Raumtemperatur gelagert.
- Frisch zubereiten 50 ml des Arbeits-SAB (5 ml 10X SAB, 1 ml 1 M HEPES, 0,5 ml 100X CaCl 2, 0,28 ml 35% BSA, 0,11 g NaHCO 3 und sterilem Wasser auf 50 ml) in einem 50-ml konischen Röhrchen und warm bis 37 ° C, indem man in einem 37 ° C im Wasserbad.
- 10 ml der Arbeits-SAB in einem 15-ml-Erlenmeyerkolben eingewogen und mit 66,8 ul 2,5 M D-Glucose, um die hohe Glucose (16,7 mM) SAB vorzubereiten.
- In 44,8 ul 2,5 M D-Glucose, um die restlichen 40 ml der Arbeitslösung SAB, um die niedrige Glukose (2,8 mm) SAB vorzubereiten.
- Beschriften Sie drei 1,7-ml-Röhrchen für jede Vertiefung der Platte mit 6 Vertiefungen und 1 ml Phosphat-gepufferter Salzlösung (PBS).
[Hinweis: Da die Inseln radioaktiv sind, folgen Sie bitte institutionellen Protokolle für die Behandlung, Verwendung und Entsorgung von radioaktivem Material.]
- Platz 20 Inselchen in jedes Mikrozentrifugenröhrchen. Machen jeden Versuch, vergleichbar große Inselchen, um jeden Mikrozentrifugenröhrchen hinzuzufügen. Zum Beispiel kann jedes Rohr enthalten 5 kleine, 10 mittlere und 5 großformatige Inseln (siehe Abbildung 1).
[Anmerkung: Islets visualisiert werden kann entweder mit einem Stereoskop sezieren oder einen Standard-Mikroskop.]
- Nachdem die Inseln auf der Unterseite des Rohres durch die Schwerkraft (~ 2 min) gelöst ist, absaugen PBS mit einer Mikropipette und zu verwerfen.
[Anmerkung: Als Alternative zur Abwicklung durch die Schwerkraft, die Rohre können bei 300 xg für 1 min zentrifugiert werden.]
- Für Vorinkubation, fügen Sie 400 ul des niedrigen glucose SAB, stellen Sie die Rohre (mit ihren Mützen offen) in die Gewebekultur-Inkubator (37 ° C, 5% CO 2) und Pre-Inkubation für 60 min. Saugen Sie die Vorinkubation niedrige Glukose SAB und entsorgen.
- Für basale Insulinsekretion, fügen Sie 400 ul des niedrigen Glukose SAB, stellen Sie die Rohre (mit ihren Mützen offen) in die Gewebekultur-Inkubator (37 ° C, 5% CO 2) und Inkubation für 60 min. Sammeln Sie die niedrige Glukose SAB und sparen für die Insulin-Radioimmunoassay.
- Für stimulierte Insulinsekretion, fügen Sie 400 ul der hohen Glukose-SAB, stellen Sie die Rohre (mit ihren Mützen offen) in die Gewebekultur-Inkubator (37 ° C, 5% CO 2) und Inkubation für 60 min. Sammeln Sie die hohe Glukose SAB und sparen für die Insulin-Radioimmunoassay.
3. Thymidineinbau Assay
- 1 ml PBS; nachdem die Inseln auf dem Boden des Rohres durch die Schwerkraft niedergelassen haben, saugen Sie den PBS mit einer Mikropipette, zu verwerfen, und wiederholen Sie dieseSchritt einmal.
- Fügen Sie 500 ul eiskalter Trichloressigsäure (TCA, 10% w / v) und Inkubation auf Eis für 30 min.
- Zentrifugieren bei 16 000 × g für 3 min bei 4 ° C
- Saugen Sie das TCA, fügen Sie 80 ul 0,3 N NaOH, und inkubieren Sie für 30 Minuten bei Raumtemperatur. Während dieser Zeit kräftig Wirbel die Proben für 5-10 Sekunden alle 10 min.
- 4 ml Econo-sichere Zählen Cocktail bis 7 ml Flüssigkeitsszintillationszählung Röhren.
- Dann werden 50 ul der Probe auf die Szintillationszählung Rohr, Röhrchen verschließen, kurz schütteln, und zählen in einem Flüssigkeits-Szintillationszähler.
- Messung der Proteinkonzentration unter Verwendung des Bicinchoninsäure (BCA)-Probe und 10 ul Probe gemäß dem Protokoll des Herstellers.
4. Datenanalyse
- Führen Sie die Insulin-Radioimmunoassay nach dem Protokoll des Herstellers.
- Normalisieren der Insulinsekretion und Thymidineinbau Daten mit dem Protein Konzentration.
5. Repräsentative Ergebnisse
Ein Beispiel für das Experiment zu Insel Replikation und Beta-Zell-Funktion in Ratteninseln Beurteilung wird in 2 gezeigt. Dieses Beispiel zeigt, dass die adenovirale Überexpression von hypothetischen "Gene # 6" robust stimuliert Inselchen Replikation ohne dass Beta-Zellfunktion. In der oberen Platte, zeigen die Ergebnisse aus der Thymidin-Einbau-Assay dass eine Erhöhung der Expression von "Gene # 6" erhöht DNA-Synthese, wie durch den Einbau von Thymidin gemessen. Da die meisten der Zellen in der Ratte Beta-Inselzellen sind, ist es wahrscheinlich, dass dieser Anstieg der Thymidin-Einbau eine Erhöhung in der Beta-Zell-Replikation zeigt. Allerdings müssen bestätigende Experimente durchgeführt, um fest zu etablieren dies werden. In der Bodenplatte, zeigen die Ergebnisse aus der Insulinsekretion Assay dass die Überexpression von "Gene Nr. 6" ergab keine Änderung eines der primären Beta-Zell-Funktionen, dh insulin Sekretion bei niedrigen und hohen Glucose. Die Qualität der Inselisolierung und die Gesundheit der Inseln nach der Behandlung mit Adenoviren erhält fachen Anstieg der Insulinsekretion bei niedrigen und hohen Glucosekonzentrationen angegeben. Bei Erhöhung der Expression von "Gene # 6" gestörte beta-Zell-Funktion, würde dies wahrscheinlich als eine Abnahme in der Insulin bei hohen, stimulatorische Glucosekonzentrationen (16,7 mM) sezerniert reflektiert werden. Eine Dosis-Wirkungs-Kurve für verschiedene Glucosekonzentrationen könnte auch durchgeführt werden.
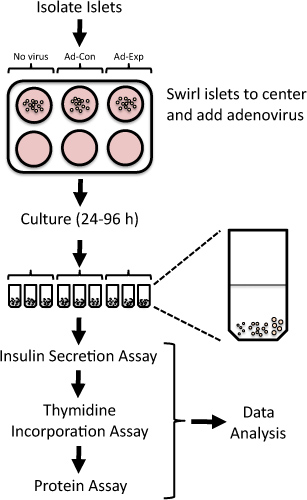
1. Überblick Protokoll Insel Replikation und Beta-Zell-Funktion in isolierten Ratteninseln nach adenoviralen-vermittelten Änderungen in der Genexpression. Frisch isolierte Ratteninseln sind Adenoviren für 24 h ausgesetzt und dann bis zu 96 h kultiviert. Thymidin-Einbau in der letzten 24 h beurteilt, gefolgt von der Messung der Insulinsekretion beiniedrige und hohe Glukose.
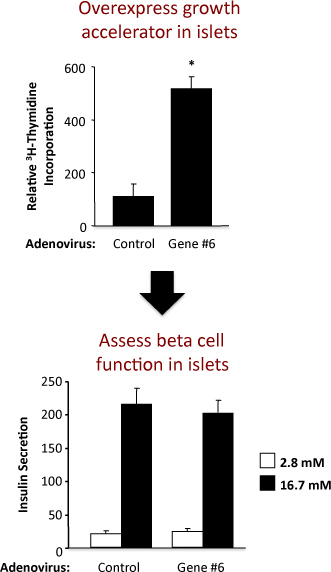
2. Ergebnisse aus einem Experiment unter Verwendung eines Kontroll-Adenovirus und ein Adenovirus-Überexpression eines hypothetischen Gens als "Gene # 6" bezeichnet. Das obere Feld zeigt das Thymidin-Einbau und die Bodenplatte der Insulinsekretion.
Diskussion
Einrichtung Wege, die moduliert werden, um die Replikation stimulieren und die Funktion der Beta-Zellen können relevant sind beiden Hauptformen von Diabetes. Da funktionale Betazellmasse ist abhängig von der Existenz und Funktion von Insulin-sezernierenden Zellen, die Beurteilung dieser Determinanten gleichzeitig hat seine Vorteile. Dieses Protokoll beschreibt eine optimierte Protokoll zum Identifizieren, ob die Überexpression oder Unterdrückung eines Proteins an Veränderungen in der funktionellen Betazellmasse
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von DK078732 Zuschuss von der NIH (bis PTF) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| RPMI 1640 Medien | Gibco | 11879 | |
| Penicillin / Streptomycin | Gibco | 15140 | |
| 6-Well-Platte | BD-Falcon | 35-1146 | Non-TC behandelt |
| [Methyl-3 H]-Thymidin | Perkin Elmer | NET027Z001MC | 1 mCi / ml |
| Mikro-Zentrifugenröhrchen | Denville | C2170 | 1,7 ml |
| NaCl | Sigma | 59888 | |
| KCl | Acros | 42409 | |
| KH 2 </ Sub> PO 4 | Acros | 20592 | |
| MgSO 4 | Acros | 41348 | |
| CaCl 2 | Acros | 34961 | |
| HEPES | Sigma | H0887 | 1 M Lösung |
| 35% BSA | Sigma | A7979 | |
| NaHCO 3 | Acros | 42427 | |
| d-Glucose | Sigma | G8769 | |
| TCA | Fisher Scientific | SA9410-1 | 10% w / v |
| NaOH | Acros | 12426 | |
| Szintillationszählung Rohr | Sarstedt | 58,536 | 7 ml, PP |
| Szintillationszählung Tubenkappe | Sarstedt | 65,816 | |
| Econo-Safe Zählen Cocktail | RPI | 111175 | |
| Insulin-RIA | Siemens | TKIN2 | |
| BCA Assay Kit | Thermo Scientific | 23250 | |
| Ausrüstung | |||
| Zentrifugieren | Eppendorf | 5415R | |
| Szintillationszählung Röhrchenständer | Sarstedt | 93.1431.001 | |
| Flüssigkeits-Szintillationszähler | Perkin Elmer | Tri-Carb 2910TR |
Referenzen
- Ferrannini, E. beta-Cell function in subjects spanning the range from normal glucose tolerance to overt diabetes: a new analysis. J. Clin. Endocrinol. Metab. 90, 493-500 (2005).
- Weyer, C., Bogardus, C., Mott, D. M., Pratley, R. E. The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus. J. Clin. Invest. 104, 787-794 (1999).
- Keenan, H. A. Residual insulin production and pancreatic ss-cell turnover after 50 years of diabetes: Joslin Medalist Study. Diabetes. 59, 2846-2853 (2010).
- Bain, J. R., Schisler, J. C., Takeuchi, K., Newgard, C. B., Becker, T. C. An adenovirus vector for efficient RNA interference-mediated suppression of target genes in insulinoma cells and pancreatic islets of langerhans. Diabetes. 53, 2190-2194 (2004).
- Fueger, P. T. Trefoil factor 3 stimulates human and rodent pancreatic islet beta-cell replication with retention of function. Mol. Endocrinol. 22, 1251-1259 (2008).
- Schisler, J. C. Stimulation of human and rat islet beta-cell proliferation with retention of function by the homeodomain transcription factor Nkx6.1. Mol. Cell Biol. 28, 3465-3476 (2008).
- Chan, C. B. Overexpression of uncoupling protein 2 inhibits glucose-stimulated insulin secretion from rat islets. Diabetes. 48, 1482-1486 (1999).
- Cozar-Castellano, I., Takane, K. K., Bottino, R., Balamurugan, A. N., Stewart, A. F. Induction of beta-cell proliferation and retinoblastoma protein phosphorylation in rat and human islets using adenovirus-mediated transfer of cyclin-dependent kinase-4 and cyclin D1. Diabetes. 53, 149-159 (2004).
- Icyuz, M. Adenovirus infection activates akt1 and induces cell proliferation in pancreatic islets1. Transplantation. 87, 821-824 (2009).
- Kaneto, H. Activation of the hexosamine pathway leads to deterioration of pancreatic beta-cell function through the induction of oxidative stress. J. Biol. Chem. 276, 31099-31104 (2001).
- Antinozzi, P. A., Berman, H. K., O'Doherty, R. M., Newgard, C. B. Metabolic engineering with recombinant adenoviruses. Annu. Rev. Nutr. 19, 511-544 (1999).
- Newgard, C. B., Becker, T. C., Berman, H. K., O'Doherty, R. M. Regulation of overexpressed hexokinases in liver and islet cells. Biochem. Soc. Trans. 25, 118-122 (1997).
- Becker, T. C., BeltrandelRio, H., Noel, R. J., Johnson, J. H., Newgard, C. B. Overexpression of hexokinase I in isolated islets of Langerhans via recombinant adenovirus. Enhancement of glucose metabolism and insulin secretion at basal but not stimulatory glucose levels. J. Biol. Chem. 269, 21234-21238 (1994).
- Csete, M. E. Adenoviral-mediated gene transfer to pancreatic islets does not alter islet function. Transplant Proc. 26, 756-757 (1994).
- Csete, M. E. Efficient gene transfer to pancreatic islets mediated by adenoviral vectors. Transplantation. 59, 263-268 (1995).
- Meng, Z. X. Activation of liver X receptors inhibits pancreatic islet beta cell proliferation through cell cycle arrest. Diabetologia. 52, 125-135 (2009).
- Ronnebaum, S. M. A pyruvate cycling pathway involving cytosolic NADP-dependent isocitrate dehydrogenase regulates glucose-stimulated insulin secretion. J. Biol. Chem. , (2006).
- Milburn, J. L. Pancreatic beta-cells in obesity. Evidence for induction of functional, morphologic, and metabolic abnormalities by increased long chain fatty acids. J. Biol. Chem. 270, 1295-1299 (1995).
- Szot, G., Koudria, P., Bluestone, J. Murine Pancreatic Islet Isolation. J. Vis. Exp. (7), e255 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten