Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
LWL-Implantation für chronische optogenetische Stimulation des Hirngewebes
In diesem Artikel
Zusammenfassung
Die Entwicklung Optogenetik bietet nun die Mittel zur Stimulierung genau genetisch definierten Neuronen und Schaltungen, sowohl In vitro Und In vivo. Hier beschreiben wir die Montage und Implantation eines faseroptischen für chronische Fotoanregung des Hirngewebes.
Zusammenfassung
Aufklärung Muster neuronaler Konnektivität ist eine Herausforderung sowohl für Grundlagenforschung und der klinischen Neurowissenschaften. Elektrophysiologie ist der Goldstandard für die Analyse von Mustern der synaptischen Verbindungen, aber gepaart elektrophysiologischen Aufnahmen können sowohl umständlich und experimentell begrenzen. Die Entwicklung Optogenetik eine elegante Methode, um Neuronen anzuregen und Schaltungen eingeführt, sowohl in vitro als auch in vivo ein 2,3. Durch Ausnutzung zelltypspezifisch Promotoraktivität zu Opsin Expression in diskreten neuronale Populationen anzutreiben, kann man exakt stimulieren genetisch definierten neuronalen Subtypen in verschiedenen Schaltungen 4-6. Nun beschriebenen Methoden zu Neuronen, einschließlich elektrischer Stimulation und / oder pharmakologische Manipulationen, stimulieren sind oft Zelltyp wahllosen, invasiv und kann das umgebende Gewebe zu beschädigen. Diese Einschränkungen verändern könnten normale synaptische Funktion und / oder Schaltung Verhalten. Darüber hinaus wird durchdie Art der Manipulation sind die derzeitigen Methoden oft akuten und Terminal. Optogenetik bietet die Möglichkeit, Nervenzellen in einer relativ harmlosen Weise zu stimulieren, und bei genetisch gezielt Neuronen. Die Mehrzahl der in vivo Studien an Optogenetik derzeit eine optische Faser durch eine Kanüle implantiert 6,7 geführt, jedoch enthalten Beschränkungen dieses Verfahrens geschädigt Hirngewebe mit wiederholten Einführen einer optischen Faser, und potentielle Bruch der Faser in der Kanüle. Angesichts der wachsenden Gebiet der Optogenetik, ist eine zuverlässige Methode der chronische Stimulation notwendig Langzeitstudien mit minimalen Sicherheiten Gewebeschäden zu erleichtern. Hier stellen wir unseren modifizierten Protokoll als Video Artikel, das Verfahren wirksam und elegant in Sparta et al ergänzen. 8 für die Herstellung eines faseroptischen Implantats und dessen dauerhafte Befestigung auf dem Schädel narkotisierten Mäusen, sowie die Montage der FaserKoppler Verbinden des Implantats an einer Lichtquelle. Das Implantat, mit optischen Fasern, um eine Festkörper-Laser verbunden ist, ermöglicht eine effiziente Methode, um chronisch photostimulate funktionelle neuronale Schaltkreis mit weniger Gewebeschädigung 9 mit kleinen abnehmbaren, Haltegurte. Dauerhafte Fixierung der LWL-Implantate sorgt für konsistente, langfristige in vivo optogenetische Studien neuronaler Schaltkreise in wach, verhalten Mäusen 10 mit minimaler Gewebeschädigung.
Protokoll
* Alle Materialien zusammen mit den jeweiligen Herstellern und / oder Lieferanten sind unter dem Protokoll aufgeführt.
Ein. Montage von Implant
- Vorbereitung einer Mischung aus wärmehärtbaren faseroptischen Epoxid durch Zugabe von 100 mg Härter zu 1 g Harz.
- Zuschneiden und etwa 35 mm von 125 um mit Faseroptik 100 um Kern durch erziehlt sie mit einer keilförmigen Spitze Carbid Schreiber. Positionieren Sie den Schreiber senkrecht zur Glasfaser-und Gäste in einem einzigen, unidirektionale Bewegung. Schneiden der Faser komplett beschädigen den Faserkern.
- Legen Sie eine LC Keramikring mit einem 127 um trugen in den Schraubstock, wies konvexen Seite nach unten.
- Legen Sie die Glasfaser in die Zwinge. Faseroptischer sollte ohne größeren Kraftaufwand und geringfügig über die konvexe Ende der Hülse (1a) abstehen.
- Einen Tropfen wärmehärtbaren Glasfaser Epoxy dem flachen Ende und Wärme mit Heißluftpistole bis Epoxy schwarz wird. Das Epoxid solltefüllen die Ferrule, wie es erhitzt wird und vor der Härtung. Das Epoxidharz sollte innerhalb von ~ 1 min konstanter Wärmezufuhr zu heilen.
- Entfernen jeglicher Epoxy entlang den Seiten der Hülse, so wird es Schnittstellenvorrichtung mit dem Kuppler zu behindern.
- Polieren der konvexen Ende der Hülse unter Verwendung eines LC faseroptischen Polierscheibe (FOPD) auf Aluminiumoxid Polieren Blätter auf dem Polierkissen (Abb. 1b). Stellen kreisförmige Rotation Muster und polieren auf vier Noten in der folgenden Reihenfolge: 5, 3, 1 0,3 um Korn.
- Ausschneiden des faseroptischen am flachen Ende auf die entsprechende Länge, dass sie die Region von Interesse zielt. Die Länge kann mit dem stereotaktischen Atlas sein.
- Testen des Implantats durch den Anschluss an den Laser über den Koppler Schnur unten beschrieben. Die polierte Ende des Implantats in die Hülse des Kopplers eingesetzt und sollte direkten Kontakt mit der gegenüberliegenden Hülse zu machen. Das Implantat sollte in der Lage sein zu 10 mW Lichtleistung beizubehalten, gemessen an der Spitze des the Implantat Faser. Eine schlechte Implantat wird eine schwache Brennpunkt nahe der Spitze des faseroptischen.
- Bewahren Sie die fertigen Implantate (Abbildung 1c) in Schaum bis zur Verwendung.
2. Versammlung der Fiber Optic Coupler Cord
- Vorbereitung einer Mischung aus wärmehärtbaren faseroptischen Epoxy wie oben.
- Zuschneiden und eine geeignete Länge von 220 um mit Faseroptik 200 um Kern durch erziehlt sie mit einer keilförmigen Spitze Carbid Schreiber. Die Länge der Faser sollte es der Maus frei bewegen um das Gehäuse zu ermöglichen, aber nicht die Maus durch die Faser zu kauen.
- Legen des faseroptischen in eine Länge von Schlauch Furkation etwas länger als die faseroptischen Länge. Der Schlauch sollte einen Innendurchmesser wenig größer als der Glasfaser.
- Streifen ~ 25mm an einem Ende des LWL und legen Sie sie in das Metall Ende eines Multimode FC MM Ferrulenmontage mit 230 um Bohrung bis zum Anschlag. Der LWL sollte ragen durch die ferrule Ende (Abbildung 2a).
- Sichern Sie die Verbindung mit Cyanacrylat (Sekundenkleber) an der Metall Ende. Decken Sie die Verbindung mit einem Anschluss-Boot und polieren Sie die Aderendhülse mit einem FC FOPD. Stellen kreisförmige Rotation Muster und Politur auf vier Klassen in der folgenden Reihenfolge: 5, 3, 1, 0,3 um grit (Abbildung 2b).
- Streifen und stecken Sie das andere Ende des LWL in einem LC Keramikring (230 um id Bohrung) mit der konvexen distalen Ende. Geben Sie einen Tropfen Epoxy dem flachen Ende und erhitzen, bis geheilt.
- Polieren der konvexen Ende der Hülse unter Verwendung eines FC FOPD auf Aluminiumoxid Polieren Blatt wie oben beschrieben.
- Schieben eines LC Ferrule Hülse über dem konvexen Ende der Hülse bis zum Mittelpunkt der Hülse.
- Ort Schrumpfschlauch über die Furkation Schlauch und Muffe und Wärme zu sichern und schützen die Verbindung (Abbildung 2c).
- Testen des Kopplers durch Anschließen an der Laserquelle und Messen des Lichts output durch den Koppler mit einem Spektralphotometer. Der Lichtverlust zwischen dem Laserausgangssignal und dem gemessenen Kopplerausgang sollte 30% nicht übersteigen.
3. Chirurgische Implantation
* Dies ist ein Spitzen-only Verfahren. Instrumente sind steril aber Handschuhe müssen nicht sein, aufgrund der ständigen Manipulation zwischen den Instrumenten und Geräten.
- Anästhesieren die Maus mit einer intraperitonealen Injektion Ketamin / Xylazin Gemisch 100 und 10 mg / kg unter Verwendung eines 30-Gauge-Nadel.
- Rasur der Kopfhaut mit Klipper. Wischen Sie die Kopfhaut mit 70% igem Alkohol Betasept wischen (4% Chlorhexidin-Lösung) für zwei Minuten und wiederholte einmal gefolgt.
- Platzieren Sie die Maus in der sterotaxic rig und sichern den Kopf, so dass der Schädel Ebene ist. Bewerben Augensalbe die Augen zu Trockenheit und postoperative Schmerzen zu verhindern. Aufrechterhaltung der Narkose mit Isofluran verflüchtigten (1-3% mit Sauerstoff abhängig vom physiologischen Zustand des mou verdünntse, die kontinuierlich durch Reaktion auf ein Schwanz Pinch überwacht werden sollten).
- Machen Sie einen Schnitt durch die Mittellinie der Kopfhaut, Aussetzen des Schädels aus den Augenhöhlen Lambda. Beiseite schieben Bindegewebes wie nötig.
- Verwenden Serafin Klammern zurück zu halten die Haut und pflegen einen Zugriff auf den Schädel (Abb. 3a).
- Ätzen eines karierten Muster über der Oberfläche des Schädels mit einem Zahnstocher. Waschen Sie Schmutz weg mit steriler Kochsalzlösung. Gründlich trocknen.
- Bewerben Wasserstoffperoxid (3%) der exponierten Schädel mit einem Wattestäbchen für ~ 2-3 Sek. Mikroporen zu schaffen. Waschen mehrfach und gründlich trocknen. Alternativ können Anker in das Kranium eingeschraubt werden, wie in Sparta et al. (2012).
- Auch waschen etch ein kariertes Muster über den Schädel mit einem Zahnstocher und weg Schmutz mit Kochsalzlösung. Gründlich trocknen.
- Verwendung eines rotierenden Werkzeugs, einen kleinen Bohrlochring Kraniotomie (<1 mm Durchmesser) mit einer sterilen Bohrkrone(Autoklaviert) über dem Bereich von Interesse von der stereotaktischen Atlas kalibriert Bregma und Lambda ermittelt. Achten Sie darauf, die Dura Bruch oder Beschädigung jedes Gewebe. Abwaschen Schutt und gründlich trocknen.
- Legen Sie die LWL-Ferrule (Implantat) in den Sondenhalter und eine Verbindung zum stereotaktischen Arm.
- Positionieren Sie das Implantat an Ort und Stelle direkt über der Region von Interesse mit der stereotaktischen Arm (Abbildung 3b). Wenn Einführen der optischen Faser in das Hirngewebe, sollte die Faser langsam mit einer Geschwindigkeit von ~ 2 mm / min vorangetrieben. Die Zwinge sollte auf den verbleibenden Schädel ruhen.
- Bereiten Sie eine Mischung von Zahnzement. Die Mischung sollte eine ausreichend niedrige Viskosität, um bequem über die Schädeldecke anzuwenden. Mischung wird nutzbar für 2-4 min.
- Verwendung einer sterilen Zahnstocher, eine dünne, gleichmäßige Schicht Dentalzement über den Schädel und auf das untere Teil des Implantats. Die Basisschicht der Dentalzement sollte so viel Fläche auf dem Schädel abzudecken, wiemöglich. Lassen Sie die zahnärztliche Zement in Kontakt mit der Haut der Maus stammen. Dies führt zu einer erhöhten Schwierigkeiten bei der Vernähung sowie Reizungen der Maus führen. Wenn der Dentalzement in Kontakt mit der Haut in Berührung kommen wird, damit sie teilweise zu trocknen, so dass die gesamte Schicht von Zement off-Einstellung kann vor geschält werden.
- Lassen Sie es vollständig trocknen.
- Gelten auch Schichten von Zahnzement, um einen kleinen Hügel über dem Schädel und um das Implantat zu bilden, so dass jede Schicht vollständig trocknen (Abbildung 3c). Lassen ~ 3-5 mm der konvexen Ende der Hülse frei von Zement für eine glatte, ungehinderte Verbindung zu ermöglichen.
- Naht der Kopfhaut über die Hügel von Zahnzement und um das Implantat mit sterilen Einweg-Seide geflochtene Nahtmaterial (6-0) mit einem C22 Nadel. Entfernen Sie nach 7 Tagen. Optional: Verwenden Vet Bond für zusätzliche Bindung nach Naht. Achten Sie darauf, minimal Vet Bond verwenden. Excess kann zu schweren Hautschäden durch Kratzen führen.
- SOFORTy nach der Operation sollte Maus subkutan mit Ketprophen (5 mg / kg) injiziert werden, um postoperative Schmerzen verringern. Dies sollte 24 Stunden später wiederholt werden. Anwenden topischen Analgetika (Bupivacain) und Antibiotika (Neosporin) an die Haut angenäht und um die Basis des Implantats.
- Platzieren Sie die Maus in einem Käfig über eine Heizdecke für die Wiederherstellung aus der Narkose. Platzieren Sie die Maus in einem sterilen, postoperative Erholung Käfig. Die Erholung Käfig sollte enthalten keine Betten, um die Temperatur zu halten und zu vermeiden Ersticken. Die Maus kann zur ursprünglichen Käfig oder einen neuen Käfig einmal wach zurückzusenden.
Ordnungsgemäßen Montage des faseroptischen Kopplers Implantat und führt zu einer minimalen Verlust Photonen zwischen der Lichtquelle und dem Ende des Faseroptik in der Region des Interesses. Gut polierten Lichtwellenleiter sollte Licht in einem einheitlichen, konzentrischen Kreis (Abbildung 2d) zu übertragen. Bei sorgfältiger Implantation und Nähen, verursacht das Implantat keinen sichtbaren Irritationendie Maus und kann anstelle für Langzeituntersuchungen (Abbildung 3d,> 1 Monat, unveröffentlichte Beobachtungen) bleiben ohne nennenswerte Degradation des LWL oder die Menge des übertragenen Lichts. Unsachgemäße Implantation oder Nähen kann Reizungen und kann in der Maus Verkratzen durch seine Kopfhaut führen, Aussetzen der Dentalzement oder Bruch der Hülse aus der Dentalzement aufgrund einer persistierenden Manipulation. Eine schematische Darstellung des zusammengefügten Systems kann in 4 gesehen werden.

Abbildung 1. Montage von implantierbaren Faseroptik. (A) Der LWL in die Hülse eingesetzt ist, geringfügig überragt dem konvexen Ende durch die Pfeilspitze angezeigt. (B) Die konvexe Ende der Ferrule poliert wird unter Verwendung eines auf FOPD zunehmend feineren Qualitäten von Polieren Blatt. (C) Die fertige implantierbare Faser optic. Klicken Sie hier für eine größere Abbildung zu sehen .

Abbildung 2. Montage der LWL-Koppler verwendet werden, um das Halteseil Faseroptische Drehverbindung mit dem Implantat. (A) LWL Kleben durch die Ferrulenbaugruppe. (B) Die Ferrule Seite der Anordnung in die FOPD und poliert mit zunehmend feineren Qualitäten von Papier Polieren eingefügt. (C) Die Ferrule Hülse über die Ferrule eingepasst und befestigt mit Schrumpfschlauch. (D) Das fertige LWL-Koppler sollte einen konzentrischen Licht mit minimalem Verlust Photon.

Abbildung 3. Chirurgische Implantation der Faseroptik. (A) Die gesamte Oberfläche des Cranium ausgesetzt ist und Bindegewebe gelöscht wird. (B) Der faseroptische Implantat in Position mit dem stereotaktischen Arm gehalten. (C) Dentalzement aufgebracht Befestigen des faseroptischen Implantat zum Schädel. (D)> 1 Monat nach der Implantation ist die Haut rund um das Implantat verheilt und es gibt keine Anzeichen von Irritation.
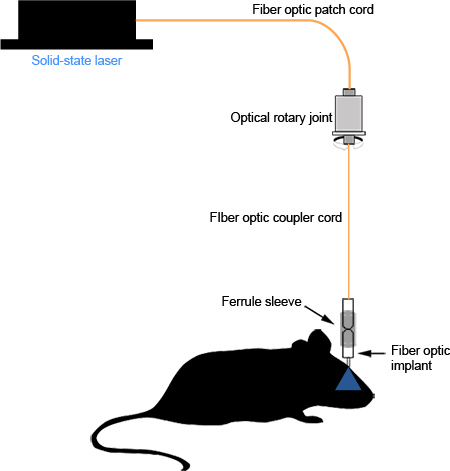
Abbildung 4. Schematische Darstellung des funktionalen Systems
Access restricted. Please log in or start a trial to view this content.
Diskussion
Optogenetik ist eine leistungsstarke neue Technik, die eine beispiellose Kontrolle über spezifische neuronale Subtypen ermöglicht. Dies kann ausgenutzt werden, um modulieren neuronalen Schaltkreise mit anatomischen und zeitliche Präzision werden, unter Vermeidung der Zelltyp wahllosen und invasive Wirkung elektrischer Stimulation durch eine Elektrode. Implantation von Lichtwellenleitern ermöglicht eine konsistente, chronische Stimulation von neuronalen Schaltkreisen über mehrere Sitzungen an wachen, verhalten Mäus...
Access restricted. Please log in or start a trial to view this content.
Danksagungen
Wir möchten bestätigen, dass diese Technik wurde ursprünglich von Sparta et al., 2012 beschrieben und wurde leicht für den Einsatz im Labor geeignet.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz oder Equipment | Firma | Katalog # | Kommentare |
| LC Ferrule Sleeve | Precision Fiber Products (PFP) | SM-CS125S | 1,25 mm ID |
| FC MM vormontierten Stecker | PFP | MM-CON2004-2300 | 230 um Ferrule |
| Miller FOPD-LC Disc | PFP | M1-80.754 | Für LC Aderendhülsen |
| Furcation Schlauch | PFP | FF9-250 | 900 um od, 250 um id |
| MM LC-Stick Ferrule 1,25 mm | PFP | MM-FER2007C-1270 | 127 um ID Bohrung |
| MM LC-Stick Ferrule 1,25 mm | PFP | MM-FER2007C-2300 | 230 umID Bohrung |
| Hitzehärtbaren Epoxidharz, Härter und Harz | PFP | ET-353ND-16OZ | |
| FC / PC und SC / PC Stecker Polierscheibe | Thorlabs | D50-FC | Für FC Aderendhülsen |
| Digitale optische Leistung und Energiemessgerät | Thorlabs | PM100D | Spektrophotometer |
| Polierschwamm | Thorlabs | NRS913 | 9 "x 13" 50 Durometer |
| Aluminiumoxid Läppen (Polieren) Sheets: 0,3, 1, 3, 5 mm Körnung | Thorlabs | LFG03P, LFG1P, LFG3P, LFG5P | |
| Standard Hard Cladding Multimode Fiber | Thorlabs | BFL37-200 | Low OH, 200 &mgr; Core, 0,37 NA |
| Fiber Stripping Tool | Thorlabs | T10S13 | Clad / Coan: 200 um / 300 um |
| Quarz / Quarz-Optical Fiber | Polymicro Technologies | FVP100110125 | High-OH, UV Enhanced, 0,22 NA |
| 1x1 Fiberoptic Rotary Joint | doric Objektive | FRJ_FC-FC | |
| Mono Fiberoptic Patchkabel | doric Objektive | MFP_200/230/900-0.37_2m_FC-FC | |
| Schrumpfschlauch, 1/8 Zoll | Allied Electronics | 689-0267 | |
| Heißluftgebläse | Allied Electronics | 972-6966 | 250 W; 750-800 ° F |
| Wattestäbchen Applikatoren | Puritan Medical Products Company | 806-WC | |
| VetBond Gewebekleber | Fischer Scientific | 19-027136 | |
| Flash-Prothesenkunststoff | Yates Motloid | ColdPourPowder + Liq | |
| BONN Miniature Irisschere | Integra Miltex | 18-1392 | 3-1/2 "(8,9 cm), gerade, 15 mm Klingen |
| Johns Hopkins Bulldog Clamp | Integra Miltex | 7-290 | 1-1/2 "(3,8 cm), gebogen |
| MEGA-Torque Elektro Lab Motor | Vektor | EL-S | |
| Panther Burs-Ball Nr. 1 | Clarkson Laboratory | 77,1006 | |
| Violet Blue Laser System | CrystaLaser | CK473-050-O | Wellenlänge: 473 nm |
| Laser Power Supply | CrystaLaser | CL-2005 | |
| Dumont Nr. 2 Laminektomie Pinzetten | Fine Science Tools | 11223-20 | |
| Sonde | Fine Science Tools | 10140-02 | |
| 5 "Straight Hemostat | EXCELTA | 35-PH | |
| Vise mit gewichteten Basis | Altex Electronics | PAN381 |
Referenzen
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neuronal activity. Nat Neurosci. 8, 1263-1268 (2005).
- Arenkiel, B. R. In Vivo Light-Induced Activation of Neural Circuitry in Trangenic Mice Expressing Channelrhodopsin-2. Neuron. 54, 205-218 (2007).
- Gradinaru, V. Molecular and cellular approaches for diversifying and extending optogenetics. Cell. 141, 165-16 (2010).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57, 634-660 (2008).
- Arenkiel, B. R., Ehlers, M. D. Molecular genetic and imaging technologies for circuit based neuroanatomy. Nature. 461, 900-907 (2009).
- Zhang, F. Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat. Protoc. 5, 439-456 (2010).
- Adamantidis, A. R., Zhang, F., Aravanis, A. M., Deisseroth, K., de Lecea, L. Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature. 450, 420-424 (2007).
- Sparta, D. R. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nature Protocols. 7, 12-23 (2012).
- Stuber, G. D. Excitatory transmission from the amygdala to nucleus accumbens facilitates reward seeking. Nature. 475, 377-380 (2011).
- Liu, X. Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature. 484, 381-385 (2012).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten