Method Article
Mit Mikrofluidik-Chips für Live-Imaging-und Studienverletzungs Antworten in
In diesem Artikel
Zusammenfassung
Drosophila-Larven sind eine attraktive Modellsystem für Live-Bildgebung aufgrund ihrer schein Kutikula und leistungsfähige Genetik. Dieses Protokoll beschreibt, wie man eine Single-Layer-PDMS-Gerät, genannt die "Larve Chip" für die Live-Darstellung von zellulären Prozessen in Nervenzellen des 3. Larvenstadium Drosophila-Larven nutzen.
Zusammenfassung
Live-Imaging ist eine wichtige Technik zur Untersuchung von zellbiologischen Prozesse, aber das kann in lebenden Tieren schwierig sein. Die lichtdurchlässige Kutikula der Drosophila Larve macht es zu einem attraktiven Modellorganismus für die Live-Imaging-Studien. Allerdings ist eine wichtige Herausforderung für die Live-Imaging-Techniken, um nicht-invasiv zu immobilisieren und positionieren Sie ein Tier auf dem Mikroskop. Dieses Protokoll stellt eine einfache und leicht zu bedienen Verfahren zur Immobilisierung und Abbildung Drosophila-Larven auf einem Polydimethylsiloxan (PDMS) Mikrofluidik-Vorrichtung, die wir die "Larve Chip" nennen. Die Larve Chip besteht aus einem eng anliegenden PDMS Mikrokammer, die mit einer dünnen Deckglas, das auf Antrag eines Vakuums über eine Spritze, lähmt das Tier und bringt ventralen Strukturen wie der Nervenstrang, segmentalen Nerven und Körper angebracht ist, besteht Wandmuskulatur, in unmittelbarer Nähe zu dem Deckglas. Dies ermöglicht eine hochauflösende Abbildung und wichtigsten ist, vermeidet die Verwendung von anesthetics und Chemikalien, die die Untersuchung eines breiten Spektrums von physiologischen Prozessen erleichtert. Da Larven leicht erholen sich von der Immobilisierung, können sie leicht auf mehrere Imaging-Sitzungen unterzogen werden. Dies ermöglicht eine Längsschnittstudien über die Zeit Kurse von Stunden bis Tagen. Dieses Protokoll beschreibt Schritt-für-Schritt, wie man den Chip und wie man den Chip für die Live-Darstellung von neuronalen Ereignisse im 3. Larvenstadium nutzen vorzubereiten. Diese Veranstaltungen sind die schnellen Transport von Organellen in Axonen, Calcium-Reaktionen auf Verletzungen und Zeitraffer-Studien über den Handel mit Foto-Cabrio-Proteine über lange Strecken-und Zeitskalen. Eine weitere Anwendung des Chips ist es, regenerative und degenerative Antworten auf axonalen Verletzungen zu studieren, so dass der zweite Teil dieses Protokoll beschreibt ein neues und einfaches Verfahren für verletzte Axone in peripheren Nerven durch eine segmentale Nervenquetschung.
Einleitung
Die Fruchtfliege, Drosophila melanogaster, ist als Modellorganismus für die über 100 Jahre genutzt worden und hat maßgeblich an der Definition grundlegender Signal-und Entwicklungswege, die von Wirbellosen die menschliche konserviert sind erwiesen. Live-Imaging ist ein wichtiger Ansatz zur Untersuchung zellulärer Mechanismen, und das einfache Körperplan und transluzente Kutikula der Drosophila Larve macht es zu einem attraktiven System für Live-Aufnahmen, insbesondere, da es viele genetische Werkzeuge zur Expression von fluoreszenzmarkierten Proteine in bestimmten Zelltypen zur Verfügung.
Eine wichtige Herausforderung für die Live-bildgebenden Verfahren ist nichtinvasiv zu immobilisieren und positionieren Sie ein Tier für die Mikroskopie. Konventionelle Ansätze umfassen Immobilisierung Dissektion 1,2 oder der Einsatz von Chloroform, die beide das Tier zu töten. Die Anästhetika Ether 4 und Isofluran 5-8 wurden ebenfalls verwendet. Anästhetika während viele Vorteile, Sie hemmen auch die neuronale Aktivität und wichtige Physiologie (einschließlich der Herzschlag) 11.09, daher kann der Prozess studierte beeinflussen und erzeugen Stress auf das Tier. Es gibt auch Bedenken hinsichtlich menschlicher Sicherheit für die Arbeit mit Äther und Isofluran.
Wir haben eine drogenfreie Methode, um Drosophila-Larven in einer einzigen Schicht PDMS-Mikrofluidik-Vorrichtung, die wir die "Larve Chip" 12 nennen immobilisieren entwickelt. Dieses Protokoll beschreibt, wie einholen oder die Larve Chip, und wie man es für die Live-Bildgebung in der Früh inszeniert 3. Larvenstadium zu nutzen. Der Chip besteht aus einem eng anliegenden Mikrokammer, die auf Antrag eines Vakuums über eine Spritze, lähmt das Tier über sanfte mechanische Kraft zusammen. Die Immobilisierung Verfahren bringt ventralen Strukturen wie der Nervenstrang, segmentalen Nerven und Muskeln Körperwand, in unmittelbarer Nähe zu einem Deckglas. Dies ermöglicht eine hochauflösende Abbildung solcher Strukturen mit hoher numerischer Apertur (hohe Vergrößerung) Ziele.
Vorteile der Larve Chip gegenüber anderen herkömmlichen Techniken gehören die folgenden: (i) Die Nutzung der Larve Chip ersetzt die Verwendung von Chemikalien, so dass für in-vivo-Bildgebung von narkotisierten Tieren. (Ii) Larven wieder sofort nach der Entlassung aus dem Chip (im Gegensatz zu einem 2 Stunden Erholungszeit für Isofluoran 8,13). Dies ermöglicht für die Bildgebung über weite Zeitskalen, von Millisekunden bis Minuten, Stunden und Tage. (Iii) Die Verwendung von PDMS, die ein gasdurchlässiges Material ist, kann zur kontinuierlichen Diffusion von Sauerstoff / Luft von der Umgebung in den Larvenkörper. (Iv) Der Chip ist einfach und sicher zu bedienen ist, und (v) sie wiederverwendbar ist, und kann bei minimalen Kosten hergestellt werden.
Zusätzlich zu Anleitungen zur Verwendung der Larve Chip wird dieses Protokoll stellen mehrere Beispiele für die Anwendung auf neuronale Ereignisse 3. Larvenstadium zu studieren. Dazu gehören Live-Aufnahmen von Axonal Transport-, Calcium-Reaktionen auf Verletzungen und Zeitraffer-Studien über den Handel mit Foto-Cabrio-Proteine über lange Strecken-und Zeitskalen.
Eine weitere Anwendung der Chip ist, um neuronale Antworten auf axonale Schädigung zu untersuchen. Damit wird ein weiteres Verfahren (in Teil 3) für verletzte Axone in peripheren Nerven durch eine segmentale Nervenquetschung beschrieben. Dieser einfache Test kann sowohl schnell und reproduzierbar unter einer Standard Dissektion Stereomikroskop, das für viele Tiere in der gleichen Zeit verarbeitet werden können durchgeführt werden. Zellulären Reaktionen auf die Verletzung durch Live-Bildgebung in der Larve Chip untersucht werden.
Protokoll
1. Machen die PDMS-Chip
Um ein PDMS-Chip von der SU-8-Form zu machen, folgen Sie den Schritten von 1,1 bis 1,7. Wenn ein Chip ist auf-Hand, muss aber für den Einsatz zusammengebaut, mit Schritt 1.8.
- Mischen Sie 45 g PDMS-Basis und 4,5 g Härter (10:1 Verhältnis) von einem PDMS-Kit in einem kleinen Einweg-Kunststoff-Behälter und mischen Sie sie gründlich mit einem Kunststoff-Rührstab.
- Platzieren des Behälters in einem Vakuumbehälter (z. B. einem Exsikkator) für 10 Minuten, um alle Luftblasen zu entfernen.
- Legen Sie die SU-8-Form an der Unterseite von einem Durchmesser von 150 mm Kunststoffschale und füllen langsam die PDMS-Mischung auf die Form. Achten Sie darauf, um Blasen zu erzeugen, während Gießen der PDMS.
- Cure die PDMS in einem Ofen (oder Inkubator) bei 650 ° C für 4 Stunden.
- Entfernen Sie die ausgehärtete PDMS/SU-8 Form aus dem Ofen und lassen Sie es für ein paar Minuten abkühlen.
- Mit einer Rasierklinge, schneiden Sie die ausgehärteten PDMS entlang dem Rand der SU-8-Form und trennen es von SU-8-Form.
- Teilen Sie die PDMS-PlattePDMS in einzelne Chips unter Verwendung einer Rasierklinge.
- Mit einer 21 G Nadel Abgabe, stoßen ein Loch in der Vakuumanschluss (in 1A dargestellt) der PDMS-Chip.
- Nehmen Sie eine 23 G Dispensnadel und drehen Sie die Nadelspitze von der Basis ein paar Mal zu brechen die Nadelspitze von der Lock-Ansatz.
- Legen Sie die 23 G Nadelspitze in einem kleinen Stück Polyethylenschlauch, so dass der Schlauch bedeckt mindestens einen Millimeter von der Nadel. Dann nutzen einer Rasierklinge, um die überschüssige Schlauch von der Nadel weg geschnitten. Dies erzeugt einen Kunststoffring, um ein Ende der Nadel, die eine Dichtung geschaffen werden, wenn in der Vakuumeinlaßöffnung eingeführt wird.
- Zur Verwendung mit einem Umkehrmikroskop (Fig. 1B und 2A-B): Legen Sie die 23 G Nadelspitze in die Öffnung des Vakuumanschlusses. Für die Verwendung mit einem aufrechten Mikroskop (1C und 2C-D): Sack ein zweites Loch auf der Seite des PDMS-Chip mit einer 21 G dispensing Nadel, wird diese Öffnung einen Zugang zu der ersten Bohrung von der Seite. Dann legen Sie die 23 G Nadelspitze mit Schlauch-Ring in den Seitenloch. Legen Sie ein Stück doppelseitiges Klebeband über der Spitze des PDMS-Chip, um das obere Loch (Abbildung 1C) zu versiegeln.
- Nehmen ein Stück Polyethylenschlauch, der etwa 20 cm lang ist. Verbinden einer Seite der Rohrleitung auf der Nadelspitze, die in der Vakuumöffnung eingesetzt ist.
- Die andere Seite der Rohrleitung zu einem der Häfen von einem 3-Wege-Ventil (siehe '3-Wege-Hahn "in der Liste der Materialien)
- Bringen Sie einen 20-ml-Spritze in einen der beiden verbleibenden Ports. Der letzte Port ist für die Umwelt.
2. Mit der Larve Chip für Live-Imaging
- Reinigen Sie die PDMS-Chip mit transparentem Klebeband. Bringen Sie ein Stück Klebeband an der Unterseite des Chips. Stellen Sie sicher, das Band wird die gesamte Oberfläche PDMS berühren, und dann ziehen Sie das Klebeband.
- Wiederholen Sie den Schritt 2-3x um sicherzustellen, dass es zukeine Partikel oder Öl (aus früheren Experimenten erhalten) auf der Oberfläche des PDMS-Chip. Da die PDMS-Chip ist wiederverwendbar, ist es sehr wichtig, Ölreste zu entfernen, da es die Adhäsion von PDMS an Glas auswirken und zu einer unzureichenden Abdichtung.
- Übertragen frühen (dh Nahrungssuche) 3. Larvenstadium in eine Petrischale Wasser enthält. (Die Nahrungssuche 3. Larvenstadium Larven sind in der Lebensmittel-, anstatt der Seite der Kulturfläschchen). Baden Sie die Larven im Wasser zu Kulturmedium zu entfernen.
- Nehmen Sie ein sauberes Deckglas und legen Sie einen kleinen Tropfen Halocarbonöl 700 in der Mitte.
- Mit einer Pinzette vorsichtig abholen eine saubere, Früh inszeniert 3. Larvenstadium aus dem Wasser (die Larve sollte ~ 3,5-4 mm lang sein). Legen Sie das Tier kurz auf einem leichten Tuch oder Papiertuch, um überschüssiges Wasser zu entfernen, und dann legen Sie es auf den Ölverlust. Der Tropfen sollte klein genug sein, so dass die Luftröhre der Larven nicht beschichtet sein. Lassen Sie die Larve stay auf der Öltropfen für 10 sek.
- Entfernen Sie die Larve aus dem Öltropfen und legen Sie es auf eine saubere Glasdeck dann.
- Übertragen Sie die Larve zu einem anderen Deckglas sauber. Dieser Schritt entfernt überschüssiges Öl.
- Achten Sie auf die Larve Orientierung. Für die Abbildung der Nervenleitung und segmentale Nerven, sollte die Bauchseite Larve auf dem Deckglas sitzen. Seiner dorsalen Seite, gekennzeichnet durch zwei Längs Trachealtuben, sollte nach oben zeigen. Hinweis: Dies ist die Ausrichtung der Larve zieht natürlich.
- Legen Sie vorsichtig die PDMS-Chip auf der Larve. Die Larve sollte Mitte Mitte der Mikrokammer ausgerichtet ist, mit seinem Schwanz in Richtung der Vakuumöffnung ausgerichtet ist. Achten Sie darauf, dass die Larve nicht die Ränder der Kammer zu berühren. Dies ist besonders wichtig für die vorderen und hinteren Luftröhrenanschlüssen. Hinweis: Dieser Schritt wird am besten unter einem Stereomikroskop durchgeführt.
- Drücken Sie die PDMS-Chip gegen die Deckglas, um eine gute Abdichtung zu erreichen. Stellen Sie sicher, dass die Larve ist völligdurch die Mikrokammer, wenn der PDMS-Chip berührt den Deckglas eingeschlossen.
- Schalten Sie die 3-Wege-Ventil auf, so dass die Spritze Luft aus der PDMS-Mikrokammer (durch die Rohrleitung) zu ziehen, um ein Vakuum zu erzeugen.
- Mit einer Hand halten Sie die PDMS-Chip / Deckglas fest. Mit der anderen Hand den Spritzenkolben zu ziehen. Ziehen 2-2,5 ml Luft, bis ein Widerstand in der Spritze Griff fühlte, um Vakuum zu erzeugen. Das Vakuum erzeugt eine dichte Abdichtung zwischen der PDMS-Chip, Öl und Deck Schnittstellen und die Beweglichkeit der Larve.
- Schaltet das Ventil ab, so dass die PDMS-Chip wird von der Spritze von der Umgebung isoliert. Als Ergebnis wird eine relativ stabile Unterdruckniveau in der Mikrokammer, ohne die Notwendigkeit zum Halten des Spritzenkolbens gehalten.
- Überprüfen Sie die Larve unter dem Stereoskop, um sicherzustellen, dass der gesamte Tierkörper im Inneren der Mikrokammer platziert und dass das Tier unbeweglich. Die Luftröhre sichtbar sein soll. Der Rest derPDMS-Chip soll in Kontakt mit dem Deckglas sein. Hinweis: Siehe Abb. 2E und 2F Beispiele für Tiere in der Chip korrekt immobilisiert. Einige Fehlorientierungen sind in den 2G und 2H gezeigt.
- Legen Sie die Larve Chip (PDMS-Chip + Deckglas) auf dem Mikroskop. Die Larve Chip, der Schlauch und der Spritze sollte sorgfältig behandelt werden, um ein Ablösen des PDMS-Chip aus dem Deckglas zu vermeiden. Für einen aufrechten Mikroskop, fixieren Sie die 'top' Seite des Chips auf den Mikroskoptisch mit doppelseitigem Klebeband (Abbildung 1C).
- Verwenden Sie eine Hoch vergrößerndes Objektiv (Öl-Immersion, 40-63X wird empfohlen), um die Struktur (en) des Tieres von Interesse zu finden und führen die Bildgebung. In einigen Fällen kann eine geringere Vergrößerung erforderlich ist, um den gewünschten Bereich für die Abbildung vor dem Umschalten auf eine stärkere Vergrößerung identifizieren.
- Wenn Bildgebung abgeschlossen ist, das Vakuum durch Umschalten des Ventils in die Positiondas heißt zur Umgebung hin offen.
- Lösen Sie die PDMS-Chip aus dem Deckglas. Die Larve sofort beweglich sein.
- Verwenden einer Pinzette, um die Larve aus dem Mikrokammer entfernen und sanft Ort die Larve auf einem Traubensaft Agar-Platte für die Verwertung.
3. Induktion einer Nerv Crush Verletzung Larven segmentalen Nerven
- Folgen Sie Schritt 2.3 zu isolieren frühen inszenierten 3. Larvenstadium des gewünschten Genotyp. Wie in Schritt 2.3 beschrieben tauchen die Larven im Wasser, um die Nahrung zu entfernen.
- Verwenden Sie ein Standard-fly CO 2-Betäubung entfernt, mit CO 2-Pad gehalten unter einem Stereomikroskop Dissektion, um die Larven zu unterwerfen. Die Larven werden sollte immotile nach der Platzierung auf CO 2-Pad für 1-2 min.
- Jetzt legen Sie eine einzelne Larve narkotisierten auf einen Traubensaft-Agar-Platte unter dem Stereomikroskop. Schalten Sie das Tier Bauchseite bis zu den Bauchmark visualisieren und segmentalen Nerven durch Kutikula ( Abbildung 3). Stellen Sie sicher, dass die Larve ist völlig unbeweglich.
- Mit Dumostar Nummer-5 Pinzetten, kneifen die segmentalen Nerven dicht durch die Kutikula für 5-10 sek. Wenn das richtig gemacht wird, bleibt die Kutikula intakt und die Körperwand nicht durchstoßen wird. Anmerkung: Die Verletzung kann in verschiedenen Positionen entlang der anterior-posterioren Körperachse durchgeführt werden, solange die Bauchmark, der Speicheldrüsen und Darm nicht beschädigt werden. Die effektivste Verletzung Lage ist am Ende der 3. Abdominalsegments, wie in Fig. 3D gezeigt. Verletzung an diesem Ort die Schäden am Nerven und ist am einfachsten zu töten, ohne das Tier zu reproduzieren.
- Nach der Verletzung, schalten Sie das Tier, so dass ihre Bauchseite nach unten auf das Traubenplatte. Es sollte in der Lage, seinen Kopf zu bewegen und zu essen. Wenn die Verletzung erfolgreich war, dann ist die hintere Hälfte der Larve wird gelähmt.
- Halten Sie die verletzten Tiere auf der Traubensaft-Agar-Platte bei 25 &Nr. 176, C für die gewünschte Zeit nach dem Versuchsziel. Für Motoneuronen, beginnt der proximalen Stumpf innerhalb von 8-10 Stunden Verletzungs 14 sprießen, und der distale Stumpf beginnt innerhalb von 6-8 Std. 15 degenerieren. Für die Klasse IV da sensorischen Neuronen, beginnt der proximalen Stumpf in 4-6 Stunden, und der distalen Stumpf Start sprießen in 3-4 Stunden nach der Verletzung degenerieren. Hinweis: Die mit entsprechenden Gal4 Treiber und fluoreszierenden Reporter kann das Sprießen und Degeneration in der Larve Chip beobachtet werden (zum Beispiel siehe Abbildung 6).
Ergebnisse
Die Larve Chip aus einer einzigen Schicht PDMS Block (PDMS ein Chip), dessen Aufbau schematisch in Fig. 1 dargestellt umfasst. (Siehe auch die ergänzenden DXF-Datei für die Gestaltung Ihrer eigenen Form). Die Larve Mikrokammer, Vakuumanschluss und Umfangskanäle (Fig. 1A) sind 140 um Vertiefungen in der PDMS-Chip. Der Chip wird auf der Oberseite eine aufge frühen inszenierten 3. Larvenstadium, die auf einem Deckglas mit Öl (1B und 1C) ruht. Das Öl-Glas-Grenzfläche zwischen dem Deckglas und PDMS-Chip ermöglicht eine Dichtung bei Anwendung einer milden Vakuum angelegt werden. Diese Dichtung fängt die Larven in der Kammer, und da die frühen inszenierten 3. Larvenstadium ist etwas dicker als die Kammer, Dichtungs die Kammer schafft einige physikalische Verengung auf das Tier, effektiv Immobilisierung und die Einschränkung ihrer Bewegung. In diesem Zustand immobilisiert, bestimmte ventralenKörperstrukturen, wie beispielsweise die Bauchmark und segmentale dicht gedrängt, Deckglas. Dies ist für die Bildgebung von Vorteil, da im immobilisierten Zustand können diese Strukturen in der Arbeitsabstand von 40X und 63X Ziele liegen. Nachdem das Vakuum aufgehoben wird, kann die Larve leicht aus der Mikrokammer entfernt werden, so dass zusätzliche Experimente durchgeführt werden. Diese rein mechanische Immobilisierung Ansatz kann 90% der Larven leben nach kontinuierlichen Immobilisierung Zeiten von bis zu 1 Stunde 12 zu halten.
Das Vakuum wird durch eine einfache 20-ml-Spritze, damit die gesamte Einheit leicht aus einem Stereomikroskop, wobei die Positionierung in der Kammer durchgeführt wird, um eine konfokale oder Epifluoreszenz-Mikroskop, wobei die Bildgebung durchgeführt wird, zu transportieren erstellt. Die Spritze ist mit dem Vakuumanschluss über Polyethylenschlauch und 23 G Dosiernadeln (mit Verriegelungsnaben entfernt) verbunden ist, wie in Schritten von 1,6 bis 1,14 beschrieben. Für inverse Mikroskope, der Schlauchund die Spritze über der Oberseite des Chips (1B, 2A und 2B) verbunden ist. Für aufrechte Mikroskope sind, werden sie über einen Anschluss an der Seite des Chips (Fig. 1C, 2C und 2D) verbunden ist. Die Konfiguration für inverse Mikroskope ist etwas einfacher zu bedienen. Die Spritze gezogen wird, um ein leichtes Vakuum (etwa 10 psi), die das Öl-Glas-PDMS-Schnittstelle verbindet, um eine dichte Abdichtung zwischen dem Deckglas und der PDMS-Vorrichtung zu bilden, Einfangen und Immobilisieren der Larve in der Kammer zu erzeugen.
Die Platzierung der Larve in der Mikrokammer (Schritte von 2,7 bis 2,10 in dem Protokoll) ist entscheidend für eine wirksame Immobilisierung und Überleben (2E-H). Wenn das Tier zu groß ist für die Kammer, (2G), oder ob der Kopf oder die Luftröhre werden zwischen dem Rand der Kammer und den Deckeln gefangenLippe (1H), dann ist es unwahrscheinlich, dass das Verfahren zu überleben.
Die folgenden sind mehrere Beispiele für die Verwendung der Larven Chip zu verschiedenen zellulären Reaktionen in den Neuronen zu untersuchen (Fig. 4-7, Film-und Film-S1 S2).
Imaging von schnellen axonalen Transport: Die Larve Chip wurde zur Abbildung der Kinesin-vermittelten Transport von synaptischen Vesikeln innerhalb der einzelnen peripheren Axonen (Abbildung 4 und Film-S1) verwendet Die anterograde (~ 1,0 um / sec) und retrograde (~ 0,8 um / sec. ) Bewegung dieser Vesikel können leicht von Filmen auf einem sich drehenden Scheibe konfokalen Mikroskop untersucht werden gesammelt.
Positionieren des Tieres für die Lasermikrochirurgie:. Eine sensorische Neuron Dendriten unter Verwendung eines gepulsten UV-Farbstoff-Lasers (Fig. 5 und Film-S2) durchtrennt Protokolle für die Verwendung von tseine Methode für die Mikrochirurgie kann an anderer Stelle 16,17 gefunden werden. Die effiziente Immobilisierung Technik ermöglicht schnellen Zeitmaßstab Änderungen in der verletzten Neuronen, wie z. B. Änderungen der intrazellulären Calcium (die genetisch kodierten Ca 2 +-Indikator GCamp3.0 18 erkannt), detektiert und gemessen werden (Abbildung 5).
Studium der regenerativen und degenerativen Reaktionen auf Verletzungen: Wenn das Tier darf zwischen Imaging-Sitzungen ruhen, die Larve Chip dann verwendet, um zelluläre Ereignisse, die über einen großen Bereich von Zeitskalen auftreten, zu untersuchen. Zum Beispiel haben sowohl "regenerative" und degenerative Antworten auf axonalen Schädigung, die über einer Zeitskala von 15 Stunden stattfinden, in der Larve Chip (Abbildung 6) abgebildet werden. In diesem Beispiel wurden die Axone von Motoneuronen oktopaminergen über die segmentale Nervenquetschung (Abbildung 3), in Teil 3 des Protokolls beschrieben verletzt. Das proximale Axon Stumpf,die neuen Keimen unterzogen, und die distalen Axone, die Krampfadern bilden und werden dann durch den Prozess der Waller-Degeneration fragmentiert, können abgebildet und studierte in verschiedenen Zeitabständen werden nach der Verletzung.
Tracking-photoconvertible fluoreszierende Proteine im Laufe der Zeit in vivo: Die Entwicklung der photoconvertible fluoreszierende Proteine, deren Fluoreszenz ändert irreversibel bei der Einwirkung von UV-Licht) erlaubt es, spezifisch zu markieren eine Teilmenge von Proteinen innerhalb einer Zelle, und verfolgen das Schicksal der markierten Proteine im Laufe der Zeit 19 , 20. Dieses Verfahren wird am häufigsten in Zellkultur durchgeführt, jedoch mit der Larve Chip kann genetisch codierten Proteinen innerhalb photoconvertible definierten Zellen in vivo zu verfolgen. Als Beispiel zeigen wir, dass Denda2-α-Tubulin-Fusionsprotein, ausgedrückt in Klasse IV da sensorischen Neuronen können in Zellkörpern photokonvertiertem werden (7A und 7 B). Der Transport der photokonvertiertem Proteine können dann über die Zeit verfolgt werden: innerhalb von zwei Tagen konnten wir eine erhebliche Menge an Protein in den photokonvertiertem Axonterminalen der sensorischen Neuronen, die ~ 1 mm von der ursprünglichen Position im Zellkörper (Abbildungen liegen erkennen 7A und 7C).
Alle beschriebenen Beispiele (Fig. 4-7 und Filme S1 und S2) unter Verwendung eines sich drehenden Scheibe konfokalen System, bestehend aus einer Nipkow CSU10 Scanner und einer C9100-50 EMCCD Kamera abgebildet, montiert auf einem Axio Observer mit 63X (1,5 NA) Öl-Objektiv, und angetrieben mit Volocity Erfassungssoftware.
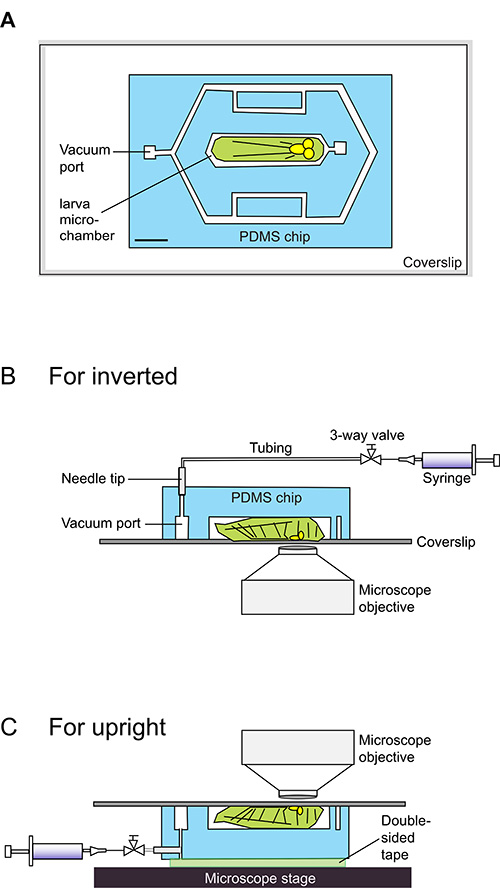
Fig. 1 ist. Schematische Karikaturen für die Verwendung der Larve Chip.
(A) Die Larve Chip des PDMS-Chip, in hellblau angedeutet, auf einem Deckglas geklebt zusammen. Der Chip enthält 140 um dicke mikrofluidischen Kanälen, in weiß angezeigt. Der zentrale Mikrokammer ist für die eng anliegen eine frühe inszeniert 3. Larvenstadium Drosophila Larve (in hellgrün cartooned). Eine DXF-Datei mit genauen Abmessungen, die verwendet werden, um die Form zu entwerfen als Zusatzdaten vorgesehen. Maßstabsbalken = 1,5 mm. (BC) Side-Blick von Schaltplänen für das Laden einer Larve in eine Larve Chip. Die Larve sitzt Bauchseite nach unten auf einem Deckglas, und sein Körper in der Mikrokammer 140 um tief liegt. Eine 20 ml-Spritze mit der Vakuumeinlaßöffnung verbunden ist und verwendet wird, um ein leichtes Vakuum zu induzieren. Die Halocarbonöl-PDMS-Glas-Grenzfläche durch das Vakuum in eine dichte Abdichtung, die die Larven in der Mikrokammer einschränkt gebunden. Diese Dichtung ist leicht rückgängigdurch Ablassen des Drucks aus der Spritze, wonach das Tier gewinnt sofort Motilität. Für aufrechte Mikroskope (B) wird die Spritze Vakuum über Polyethylen-50 Schlauch von der Oberseite des Chips verbunden. Für inverse Mikroskope (C), werden diese Verbindungen von der Seite des Chips gefertigt, während der 'top' der Chip mit dem Mikroskoptisch über doppelseitiges Klebeband befestigt.
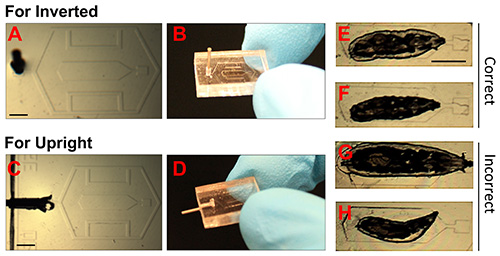
Abbildung 2. Bilder von PDMS-Chips und korrekte Positionierung der Larve.
(AD). Fotografien zeigt PDMS-Chips für invertierte und aufrechte Mikroskope. Der 23 G Abgabe Nadelspitze in die Vakuumanschluss eingesetzt worden ist, welche Verbindung über Schläuche ermöglicht, Vakuum (Spritze). Maßstabsbalken = 1,5 mm. (EH). Hellfeld-Bilder immobilisiert Drosophila-Larven. E und F zeigen Beispiele für richtig immobilisiert Tiere. Der kleinere Tier in F ist bevorzugt, wenn mehrere Bilder über lange Zeiträume (> 12 h) wird durchgeführt. G zeigt ein Tier, das zu groß ist, und H zeigt einen kleinen Tier, das nicht korrekt positioniert ist. Maßstabsbalken = 1,5 mm. Klicken Sie hier für eine größere Ansicht.
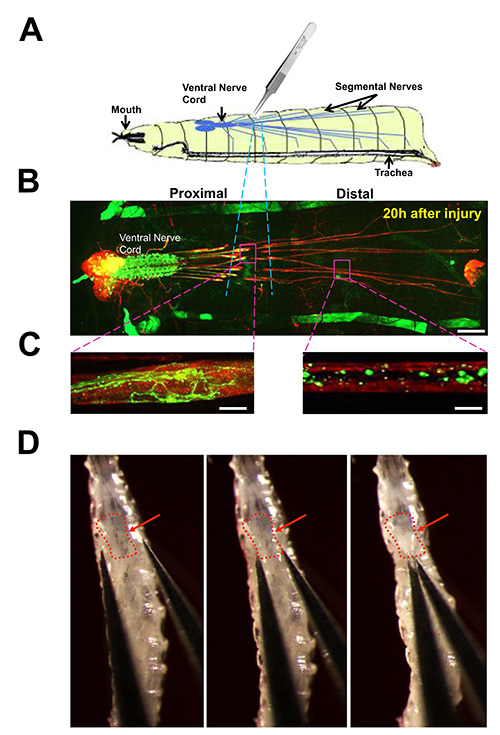
Abbildung 3. Nerve Quetschverletzung der segmentalen Nerven in Drosophila-Larven.
(A) Cartoon des Nervenquetschung-Assay. Die segmentalen Nerven in einem 3. Larvenstadium durch das Einklemmen des ventralen Nagelhaut mit der Nummer 5 Zange zerkleinert. (B) Ansicht der Larvennervensystem von einem Tier seziert 20 Stunden nach Nervenquetschung. Immunfärbung für neuronale Membranen mit anti-HRP-Antikörper (rot) zeigt die Hirnlappen, Bauchmark und Nerven, die lange Segmentmotoneuronen und sensorischen Neuronen Axone enthalten. Eine Teilmenge der einzelnen Motoneuronen werden durch die Expression von UAS-mCD8-GFP (grün) mit dem m12-Gal4-Treiber bezeichnet. Zellkörper und Dendriten von dieser Neuronen liegen in der Bauchmark, während ihre Axone zu Körperwand Muskeln über die segmentalen Nerven. (Dieser Treiber treibt auch die GFP-Expression in Muskel 12 für jeden Larven hemisegment, die zusammen als Vorwärts-Rückwärts-Streifen auf beiden Seiten des Tieres zu sehen). Der durch das Gedränge beschädigt ist mit blauen gestrichelten Linien markiert. Maßstabsbalken = 70 um. (C) Close up Blick auf die beschädigte Axone, 20 Stunden nach der Verletzung. Links: Dieproximalen Axon erfahren hat sprießen und neues Wachstum. Rechts: das distale Axon ist fragmentiert, mit wenig Rest GFP aufgrund Waller-Degeneration und die Räumung von Schutt. Maßstabsbalken = 10 um. (D) Bilder von der Nervenquetschung in einem frühen 3. Larvenstadium. Der rote Pfeil zeigt auf das Bauchmark. Die Lage des Knautsch ist in Richtung der Unterseite des 3. Segments, die in dem Protokoll Text (Protokoll 3) beschrieben. Die Bilder in D wurden ursprünglich in J. veröffentlicht Cell Biol. 191, 211-223, doi:.. 10,1083 (2010) Klicken Sie hier für eine größere Ansicht.
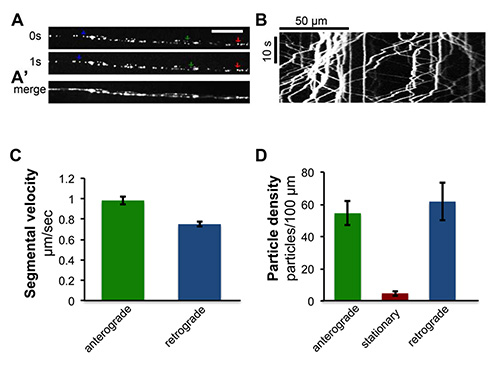
4. Zeitraffer-Bildgebung des axonalen Transport peptiderger synaptischen Vesikeln. DieANP ANF getaggt mit GFP, UAS-GFP-ANF 21 Ratten wurde innerhalb bestimmter Motoneuronen mit der Vorabend-RRa-Gal4 Treiber 22 ausgedrückt. Live-Darstellung von segmentalen Nerven zeigt den schnellen Transport von ANF-GFP-markierten Axone in peptiderge Bläschen. Siehe auch Film-S1. (A) Einzelbilder der Motoneuron-Axone von Live-Zeitraffer-Bildgebung. Grüne, rote und blaue Pfeile zeigen Beispiele von anterograde, stationäre und retrograden Vesikel auf. Maßstabsbalken = 5 um. (A ') Einzelzeitrahmen aus dem Film wurden mit ImageJ verschmolzen. (B) A kymograph von Zeitraffer-Bildgebung von ANF-GFP Transport erzeugt wird, wurde aus einer Sammlung von Einzelbildern überspannt eine Minute erzeugt Aufnahmezeit mit der "Multiple Kymograph 'Plug-in für ImageJ 23. (C) Quantifizierung der gemittelte Segmentgeschwindigkeiten, die von den Hängen des segmentierten Spuren in Kymographen berechnet. Der grüne Balken Präsentationts anterograde Segmentgeschwindigkeit (n = 543) und der blaue Balken zeigt retrograde Segmentgeschwindigkeit (n = 548) von Vesikeln von 10 Kymographen. (D) Quantifizierung der Partikeldichte. Partikeldichte wurde durch die Anzahl der anterograde (in grünen Balken dargestellt), stationär (im roten Balken dargestellt) und retrograde (in blauen Balken dargestellt) Teilchen pro 100 um Axon Länge von 10 Kymographen gemessen. Die Daten in dieser Abbildung wurden auch vorher in Ghannad-Rezaie et al, PLoS One 7 (1), e29869, doi:. 0.1371/journal.pone.0029869 (2012).
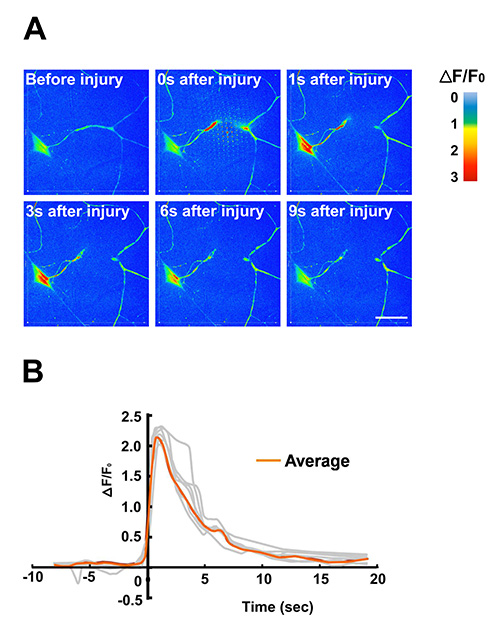
5. Die Nutzung der Larve Chip für Laser-Mikrochirurgie-und Calcium-Bildgebung.
Ein Dendrit aus der Klasse IV sensorischen Neuronen wird durch mit Hochleistungslaserimpulse von einem gepulsten UV-Farbstoff-Laser durchtrennt. Protokolle für den Einsatz dieser Methode für die Mikrochirurgie an anderer Stelle 16 gefunden werden. Die effektive Immobilisierung in der Larve Chip ermöglicht schnelle Veränderungen der intrazellulären Kalziumspiegel durch Live-Bildgebung untersucht werden. In diesem Beispiel wurde die genetisch kodierte Kalzium-Indikator GCaMP3.0 in Klasse IV dendritischen Verzweigung (C4da) sensorischen Neuronen mit der PPK-Gal4-Treiber ausgedrückt. (A) Zeitraffer-Bilder der GCaMP3.0 Intensität nach der Farbe gefärbt waren falsch Intensitätsskala, um die Änderungen in der Intensität über die Zeit zeigen. Einzelbilder wurden aus einem Zeitraffer-Film (Movie S2) auf einer sich drehenden Scheibe konfokalen Mikroskop abgebildet mit 5 Bildern / s in Reaktion auf Laser-Mikrochirurgie extrahiert. (B) Quantifizierung der Kalziumdynamik. Die normalisierte fache Änderung der soma GCaMP3.0 Fluoreszenzintensität (ΔF/F0) von einzelnen Neuronen wurde gegen die Zeit aufgetragen (n = 7, grau dargestellt). Der gemittelte ΔF/F0 wurde in orange dargestellt. Der Spitzen Anstieg von GCaMP3.0 Intensität wurde zwischen 1-2 sec nach der Verletzung beobachtet. Der Hintergrund wurde aus dem Roh-G-CaMP3.0 Fluoreszenzintensität subtrahiert. Die Daten in dieser Abbildung wurden auch vorher in Ghannad-Rezaie et al, (2012) PLoS One 7 (1):. E29869. doi: 10.1371/journal.pone.0029869 12.
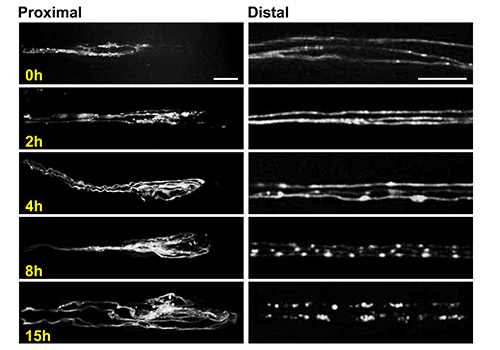
Abbildung 6. Imaging Axonsprossung und Degeneration mit der Larve Chip. Repräsentative konfokale Bilder des proximalen Stumpf (links) und distalen Stumpf (rechts) oktopaminergen Motoneuron Axone zu verschiedenen Zeitpunkten nach der Nervenquetschung. Bilder wurden in ähnlichen Positionen genommen, wie in Fig. 3C gezeigt. Diese Neuronen sind durch die Expression eines UAS-mCD8-RFP Transgen mit der TDC-markierten2-Gal4-Treiber 24,25. Die Zellkörper dieser Neurone liegen in der Bauchmark 24. Drei individuelle Axone können innerhalb einer einzigen segmentale Nerven gesehen werden, und sind leicht voneinander gelöst werden. Dies ist eine ideale Situation für die Untersuchung von individuellen zellulären Ereignissen, wie beispielsweise die Fragmentierung der degenerierenden Axone, die innerhalb von 15 h für diesen Neuronen ist. Die Bilder wurden von lebenden Tieren mit der Larve Chip 63X Vergrößerung auf einer sich drehenden Scheibe konfokalen Mikroskop erreicht. Maßstabsbalken = 10 um für linke Platten (proximalen Stümpfe) und 20 um für Rechts-Platten (distalen Stümpfe). Klicken Sie hier für eine größere Ansicht.
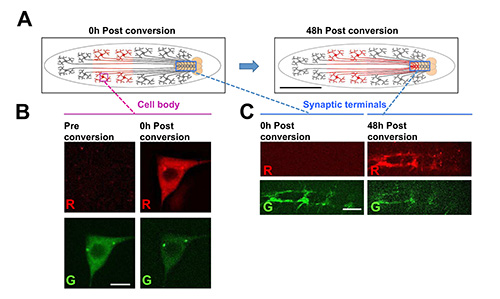
Abbildung 7. Mit der LarveChip photokonvertiertem fluoreszierende Proteine über lange Zeiten und Entfernungen in lebenden Tieren zu verfolgen.
In diesem Beispiel wird ein Fusionsprotein aus dem fluoreszierenden Protein photoconvertible Dendra2 19, fusioniert an α-Tubulin aus einem UAS-Dendra2-α-Tubulin-Transgen in Klasse IV dendritische Verzweigung (C4da) sensorischen Neuronen exprimiert wird, mit der ppk-Gal4 Treiber 26. (A) Schematische für die Photo Experiment. Die Zellkörper der Neuronen C4da liegen in der Peripherie und erweitern Axone durch segmentalen Nerven Synapsen im Nervenstrang bilden. Die Dendra2-α-Tubulin in einer Teilmenge der Zellkörper in der hinteren Hälfte des Tieres zu Photo durch UV-Beleuchtung für 6 Sekunden unter Verwendung eines Standardfilters mit DAPI-Hg-Lampe (links Cartoon) unterworfen. Nach der Zeit, kann die photokonvertiertem Dendra2-α-Tubulin an den Synapsen im Bauchmark nachgewiesen werden. Dies zeigt, dass die Tubulin-Protein wurde trantrug über eine lange Strecke (von ~ 1-2 mm). Maßstabsbalken = 1 mm (B) Beispiel Bilder von Dendra2-α-Tubulin in einer Klasse IV sensorischen Neuronen Zellkörper vor und nach der Photo. Maßstabsbalken = 5 um. (C) beispielsweise Bilder von Synapsen für Klasse IV sensorischen Neuronen entweder 0 h oder 48 h nach der Photo der Zellkörper. Das spezifische Erscheinungsbild der photokonvertiertem Dendra2-α-Tubulin an den Synapsen nach der Zeit bedeutet, dass das Protein von der Zelle zurück Körper Axon-Terminus. Photo und Imaging zu allen Zeitpunkten wurde in der Larve Chip durchgeführt. Maßstabsbalken = 15 um. Klicken Sie hier für eine größere Ansicht.
Film-S1. Lasermikrochirurgie und Kalzium-Imaging eines C4da Neurons. Ein gepulster UV-Laser wurde verwendet, um eine prim schneidenary dendritischen Zweig. Laser Trennung induziert einen raschen Anstieg der GCaMP Intensität, die an der Stelle der Verletzung begann und reiste zum Zellkörper. UAS-GCaMP3.0 18 wurde mit der C4da spezifischen ppk Gal4-Treiber 26 ausgedrückt. Die Filme waren falsch gefärbt, um die relativen Intensitäten der GCaMP3.0 anzuzeigen. Die Zeitraffer-Bildgebung wurde mit drehenden Scheibe konfokalen Mikroskopie mit 5 Bildern / s durchgeführt.
Film-S2. Schneller axonalen Transport von ANF-GFP in Motoneuronen.
Die Ratte ANP ANF getaggt mit GFP, UAS-ANF-GFP-21, wurde innerhalb bestimmter Motoneuronen mit der Vorabend-RRa-Gal4 Treiber 22 ausgedrückt. Der Transport dieser peptiderge Vesikel innerhalb Larven segmentalen Nerven auf der Larve Chip bei 300 ms / Frame mit einer drehenden Scheibe konfokalen Mikroskop abgebildet.
Ergänzende Abbildung 1 (DXF-Datei)
DXF-Datei für Silikonform Fertigung. Die Datei wird zum negativen Photoresist-Maske (dunkel eingereicht Maske für SU-8) auf einem 4-Zoll-Silizium-Wafer ausgelegt. Die zweite Reihe enthält 5 Formen für die Herstellung der Larve Chips in diesem Protokoll verwendet. Jeder dieser Chips (in Zeile 2) enthalten einen ~ 5,4 mm x 1,5 mm Kammer entwickelt, um ein frühes Stadium 3. Larvenstadium passen. Die erste Zeile (Zeile 1) eine größere Kammer (~ 5,4 mm x 2 mm), während die dritte Zeile (Zeile 3) eine kleinere Kammer (~ 4,4 mm x 1,5 mm) enthält. Diese können mit Larven von größeren und kleineren Größen jeweils verwendet werden. Maßstabsbalken = 2 mm.
Diskussion
Herstellen oder Erhalten der Larve Chip:
Die Larve Chip besteht aus einem PDMS-Block (genannt die "PDMS-Chip") zu einem Deckglas angebracht. Das Protokoll in Schritt 1 beschreibt das Verfahren zur Herstellung und Verwendung Larve Chips, unter der Annahme einer SU-8-Form verfügbar ist. Die SU-8-Form wird durch fotolithographisch Strukturieren einer 140 um dicken SU-8 Fotolackschicht auf einem Silizium-Wafer (für Details siehe Ghannad-Rezaie et al. 12) mikro. Da die Mikrofabrikation des SU-8-Form erfordert den Zugriff auf spezielle Ausrüstung, wir empfehlen es von einem Mikrofabrikationsstätte (zB. LNF die Einrichtung an der Universität von Michigan 14) oder aus einer Gießerei, indem sie ihnen das Chip-Design, die bereitgestellt wird als ergänzende Datei. Wenn man das Design der PDMS-Chip (zB für den Einsatz mit Larven in verschiedenen Größen), eine CAD-Software, die DXF-Dateien (zB Autocad) Griffe ändern will, kann verwendet werden. Ein SU-8 Form kann auch in-house folgenden Anweisungen in Mondal gemacht werden et al. Kann 27 Viele Leser finden es bequemer, einfach eine Probe zu erhalten PDMS-Chip zu versuchen, die Technik vor der Herstellung ihrer eigenen Chips. Dies wird auf Wunsch frei zugänglich gemacht werden.
Die Nutzung der mikrofluidischen "Larve Chip" für die Live-Bildgebung:
Das Immobilisierungsverfahren in der Larve Chip vermeidet die Verwendung von Anästhetika, sondern beinhaltet Druck über das Anlegen eines Vakuums, um die Bewegung des Tieres zu beschränken. Während Tiere Immobilisierung auf dem Chip für mehrere Stunden 12, eine kürzere Immobilisierung Zeitraum (5-15 min) überleben wird empfohlen. Das ist genug Zeit für die Abbildung vieler zellulärer Ereignisse von Interesse, einschließlich Änderungen der intrazellulären Kalzium, oder schnellen axonalen Transport. Dies ist auch genügend Zeit für die gewünschten Manipulationen in lebenden Tieren, wie z. B. laserbasierte Mikrochirurgie, Photobleichen und photoconverSion.
Um Ereignisse in Längsrichtung über einen längeren Zeitraum in einem einzigen Tier zu studieren, können Tiere in den Chip mehrfach platziert werden und abgebildet, durch Ruhezeiten getrennt. Traubensaft-Agar-Platten sind ideal zum Ausruhen zwischen Imaging-Sitzungen, da sie eine einfache Nahrungsquelle und Feuchtigkeit. Mehrere Imaging-Sitzungen, beeinflussen Überlebens von Larven bis zu einem Grad, da jede Sitzung ein gewisses Risiko für eine Beschädigung des Tieres (siehe Teil 2 der Fehlersuche, unten). Tiere können routinemäßig> 5 Mal im Laufe von zwei Tagen mit einer mehr als 50% Überlebensrate abgebildet werden. Da die Tiere nicht betäubt, gesund und beweglich sind sie sofort nach der Freigabe des Vakuums in den Chip. Es besteht daher keine Notwendigkeit für Erholungszeit zwischen den Bilderzeugungseinheiten, so dass der zeitliche Abstand zwischen den Sitzungen ist flexibel und kann zu den Zielen des Experiments angepasst werden.
Fehlersuche:
Die häufigste technische istverklagt Larve mit Chip und empfohlenen Lösungen sind die folgenden:
(1) Das Tier wird zu viel in Bewegung. Zu viel Mobilität können mit den bildgebenden Ziele stören. Die häufigsten Gründe dafür in der Larve Chip sind a) das Tier ist zu klein für den Chip, oder b) der Unterdruck während der Immobilisierung Schritt aufgebracht gefährdet ist. Die in diesem Protokoll beschriebenen Larve Chip soll für frühe inszeniert 3. Larvenstadium. Die optimale Größe für das Tier ist 3,5-4 mm in der Länge (entlang der anterior-posterioren Achse). Um sicherzustellen, dass der Unterdruck ausreichend ist, ziehen die Spritze 2-2,5 ml, oder bis ein Widerstand in den Griff zu spüren. Ein Hinweis, dass das Vakuum arbeitet, ist, daß kleine Blasen in dem Umfangskanal kann gesehen werden, die sich langsam in Richtung der Vakuumquelle. Ein weiteres Indiz ist, dass das Deckglas sollte immer mit dem Chip zu reisen, wenn der Chip das Heben von oben (und das ist die empfohlene Methode für den Transport der KammerSobald die Larven positioniert ist und das Vakuum eingeschaltet ist). Das Vakuum kann beeinträchtigt werden, wenn sich Risse in dem Schlauch, oder wenn Öl in den Schlauch. Dies kann einfach durch den Austausch des 23 G Abgabe Nadelspitze und Polyethylen-Schlauch 50 (von 1,6 bis 1,14 Schritte) angesprochen werden.
(2) Das Tier stirbt nach Bildgebung in den Chip. Das Verfahren soll die minimale Belastung auf das Tier zu verursachen, und Tiere von Wildtyp-Genotyp haben eine> 90% Überlebensrate, selbst nach einer Stunde der Immobilisierung auf dem Chip 12. Da einige Genotypen weniger elastisch, um dem Stress der Chip sein, prüfen Sie zunächst, dass Wildtyp-Tieren (z. B. Kanton S) überleben die Immobilisierung Technik. a) Die häufigste Ursache für die Letalität falsche Positionierung der Larve (siehe Abbildungen 2G-H). Wenn Teile der Nagelhaut, Kopf-oder Luftröhre sind nicht ganz in der Kammer, dann beschädigte während der Immobilisierung werden kann, und eineLarven, die zu groß für den Chip (> 4 mm) ist es weniger wahrscheinlich ist, zu überleben. b) Eine weniger häufige Ursache für Letalität ist die Verwendung von zu viel Druck oder Vakuum beim Laden des Chips. Wenn sie richtig in dem Chip positioniert ist, wird der Druck durch das Vakuum erzeugt wird gut vertragen. Doch übermäßiger Druck, entweder aus dem Vakuum oder in der Anfangsphase der Positionierung des Tieres kann ein Problem sein. Am besten ist es, den Grad der Druck empirisch durch Versuche mit Wildtyp-Larven in der richtigen Größe notwendig zu lernen. c) Wenn zu viel Halocarbonöl deckt Luftröhre des Tieres das Tier möglicherweise haben Probleme mit der langfristigen Überlebens. Das Öl spielt mehrere wichtige Rollen in der Chip: es ist wichtig für die Erzeugung des Vakuums, die Optik bei der Abbildung, und es wirkt Austrocknung in den Chip. Jedoch überschüssige Öl zu vermeiden. (Dies kann auch zu führen, in der Öl-Schlauch und Spritze, Kompromisse bei der Vakuum). Die vorgeschlagenen Protokoll Mäntel nur der Bauchseite der Larve mit Öl, dann removes überschüssige Öl durch die Platzierung der Larve auf ein sauberes Deckglas vor der Übertragung auf die endgültige Deckglas für die Bildgebung. d) Phototoxizität von der Bildgebungssitzung erlebt werden. Wie bei jedem Live-Imaging-Anwendung, ist es ideal, um kurze Belichtungszeiten mit geringer Intensität Laserlicht, das am besten mit einer hochempfindlichen Kamera oder Detektor erreicht wird, verwenden. Versuchen Sie, Beleuchtung mit UV-Licht zu minimieren, einschließlich Breitspektrum-Licht erzeugt durch Hg-Lichtquellen.
Weitere Fragen und künftige Richtungen:
Da diese Methode nicht Anästhetika zu nutzen, setzt das Herz des Tieres zu schlagen. Das schafft eine gewisse unvermeidbare Mobilität, die Bildgebung in einigen Orten mehr als andere betroffen. Die Beispiele hier zeigen, dass das Bauchmark, segmentalen Nerven und Körperwand kann leicht ohne Störung durch den Herzschlag abgebildet werden. In Fällen, in denen der Herzschlag Bildgebung betrifft, können die regelmäßigen Bewegungen manchmal mit korrigiert werdenin der Analyse-Software (zum Beispiel die Bildstabilisator-Plugin für ImageJ). Das funktioniert gut, wenn einzelne Objekte werden auf einer schnellen Zeitskala (zB ~ 1 um / s für den schnellen axonalen Transport) oder auf einem sehr langsamen Zeitskala (Minuten bis Stunden) bewegt. Allerdings, wenn das Objekt (e) von Interesse bewegen sich mit einer Reihe von Geschwindigkeiten und Richtungen, kann es schwieriger sein, für die Heartbeat-induzierte Bewegungen zu korrigieren.
Ein weiteres Problem ist leichter Variabilität in der Optik von Tier zu Tier oder zwischen mehreren Bild Sitzungen des gleichen Tieres in den Chip. Je tiefer das Objekt von Interesse ist im Tier, desto größer ist diese Veränderung sein wird. Segment Nerven und das Bauchmark sind in der Regel zu tief im Tier dann in regelmäßigen Mikroskop abgebildet werden. Der milde Druck in der Larve Chip erlebt schiebt diese Strukturen jedoch sehr nah an der Nagelhaut und Deckglas. Der genaue Abstand dieser Strukturen aus dem Deckglas werden kleine Abweichungen von tr habenial vor Gericht. Die Variation für Objekte schließen die Kutikula, wie die Zellkörper der sensorischen Neuronen, ist geringer. Es ist daher wichtig, insbesondere für Messungen der Intensität, um eine große Anzahl von Tieren und unabhängigen Versuchen zur Berücksichtigung der Variabilität in der Optik verwenden.
Während die hier gezeigten Beispiele haben sich auf Prozesse in Nervenzellen konzentriert, sollte der Ansatz zugänglich für jede Struktur in dem Tier, das innerhalb der Fokustiefe des Mikroskopobjektivs bringbar Bildgebung. Dies schließt die Schuppenschicht, Körperwand Muskeln, und ihre NMJs. Trachea auf der ventralen Seite des Tieres und möglicherweise Teile des Verdauungstrakts möglicherweise auch abgebildet werden. Das Tier kann auch mit seiner dorsalen Seite in Richtung der Deckglas für kurzfristige Abbildung von Strukturen in der Nähe der dorsalen Oberfläche positioniert werden. Die Fähigkeit, Bildstrukturen tief in das Tier durch den Arbeitsabstand des Mikroskopobjektivs verwendet begrenzt. Strukturen wie imaginal Scheiben sind unzugänglich hoher Vergrößerung (zB 40x) Ziele.
Die in diesem Protokoll beschrieben Larve Chips für Larven im frühen 3. Larvenstadium (im Größenbereich von 3,5 bis 4 mm) ausgelegt. Doch viele interessante Fragen erfordern Bildgebung bei verschiedenen Larvenstadien. Kleinere Chips bis 2. Larvenstadium oder größere Chips aufnehmen zu spät 3. Larvenstadien unterbringen kann einfach mit dem gleichen Prinzip gestaltet werden. (Ergänzungs Abbildung 1 enthält eine leicht modifizierbar DXF-Datei für die Herstellung von Silikonformen mit veränderten Kammergrößen). Das einfache Prinzip der reversiblen Dichtung könnte auch auf andere Organismen, wie C. angewendet elegans oder Zebrafisch, mit der Haupt Variante die Kammergröße. Eine sinnvolle zukünftige Richtung ist es, einen Chip, viele Tiere auf einmal zu immobilisieren können, zu Screening-Zwecken verwenden zu entwerfen. Doch für diese, würde der Entwurf benötigen deutlich anders zu seinaus dem aktuellen Gerät, in dem die Fragen der Positionierung des Tieres in der Chip muss mit für jedes Tier unabhängig behandelt werden.
Die Nervenquetschung Assay zur Untersuchung Verletzungen Antworten in Larven peripheren Nerven:
Die für die Larven segmentale Nerven hier beschriebenen Nervenquetschung Assay ist eine einfache Methode für die Einführung einer Verletzung von peripheren Axonen in Drosophila. Die Vorteile dieser Methode sind: a) ist es einfach, mit Standardwerkzeugen in einer Drosophila-Labor (ein Stereomikroskop CO 2-Quelle und Pinzetten) gefunden zu führen, b) kann es schnell für viele Tiere durchgeführt werden, so dass die biochemische Analyse der Nervenstränge nach Verletzung führbar 14, c) die molekularen und zellulären Antworten auf diese Verletzungen sind hoch reproduzierbar 14,15,28 und kann verwendet werden, um Prozesse, die ebenfalls wichtig sind wirbel Neuronen 29,30 entdecken.
Alternative Methoden für verletzte Nervenzellen ist es, focueinen Hochleistungslaser, beispielsweise einem gepulsten UV-oder Femtosekundenlaser, um ein Axon durch Laser-Mikro 17,31-33 abzutrennen. Die Larve Chip ist eine ideale Methode für die Positionierung des Tieres für solche Mikrochirurgie. Wegen der geringen Unterschiede in der Optik zwischen Studien, wie oben diskutiert, das laserbasierte Verfahren kann schwieriger sein, in Larven zu reproduzieren, insbesondere Larven segmentalen Nerven. Außerdem erfordert Laser bezogen axonale Schädigung mehr Zeit, um jedes Tier zu positionieren, damit es schwieriger, in großem Maßstab (mit einer großen Anzahl von Tieren) zu leiten.
Fehlersuche:
Die am häufigsten aufgetretenen technischen Problem aus der Nervenquetschung ist der Tod von Schäden an inneren Organen. Bei der Durchführung des zu vernichten, ist es wichtig, nicht zu kneifen die Bauchmark, Speicheldrüsen, oder Darm. Es ist auch wichtig, die Kutikula durchstoßen. Diese Probleme werden am besten, indem die Zange in einem 45 ° Winkel zu der Kutikula surfac vermiedene (siehe Abbildung 3).
Die Qualität der Zange hat einen großen Einfluss auf die Wirksamkeit der Andrang und das Überleben danach. Wir empfehlen Dumostar Nummer 5 Pinzette. Um ihre Schärfe behalten, müssen die Zange mit Vorsicht behandelt werden, nicht für andere Zwecke verwendet und ersetzt, sobald sie stumpf oder verbogen werden.
Die Größe des Tieres können auch Einfluss auf die Wirksamkeit der Andrang. Kleine Tiere (weniger als 3 mm in der Länge) sind viel weniger wahrscheinlich, um die Schädigung zu überleben. Bei großen Tieren (wandernde 3. Larvenstadium), ist es schwieriger, die Nerven zu lokalisieren und Schäden an den größeren Speicheldrüsen und Darm zu vermeiden, und es ist weniger Zeit, um Verletzungen Antworten vor der Verpuppung zu studieren. Die Nervenquetschung am effektivsten im frühen 3. Larvenstadium durchgeführt (das sind ~ 3-4,5 mm in der Länge entlang der anterior-posterioren Achse).
Die Nahrungsquelle, die das Tier bei erhöhten beeinflussen können, dieStärke der Nagelhaut und das Überleben nach dem Gedränge. Es wird empfohlen, Tiere in der Lebensmittel von einem Standard-Hefe-Glucose-Rezept zu erhöhen.
Die beste Methode für das Lernen, wie man das Gedränge effektiv tun ist, um zu üben auf viele Tiere, erst mit dem primären Ziel, das Überleben (und nicht Verpuppung) 24 Stunden nach dem Gedränge. Anfänger haben in der Regel eine geringe Überlebensrate (zB 10%), aber sobald die Technik gelernt haben, können die Überlebensraten zu erreichen ~ 90%.
Weitere Fragen und künftige Richtungen:
Der Andrang Assay bietet eine leistungsfähige Methode, um das Keimen der proximalen Axon zum Ort der Verletzung und die Degeneration von Axonen und Synapsen distal der Verletzungsstelle zu studieren. Während die Preise der Degeneration variieren zwischen den verschiedenen Neuronentypen, sie sind sehr gut reproduzierbar innerhalb eines bestimmten Neuronentyp und bietet Beweis für die Reproduzierbarkeit der Verletzung Assay.
Im Gegensatz dazu ist die "regenerative" keimenAntwort im proximalen Axone beobachtet ist schwieriger zu studieren. Alle Axone in der segmentalen Nerven initiieren umfangreiche sprießen Nähe zum Ort der Verletzung (zum Beispiel siehe Abbildung 6 und Abbildung 3). Aber das Ausmaß der Keimung kann von Neuron zu Neuron variieren und ist schwer zu quantifizieren. Nach mehr fokalen Läsionen einzelner Motoneurone in Segment Nerven durch Verwendung eines UV-gepulste Farbstofflaser eingeführt wird, kann ein ähnlicher Grad und Variabilität in Keimen beobachtet werden. Wir interpretieren, dass die nondiscriminate Direktionalität der Keimung aufgrund der Abwesenheit von Führungssignale in den Segment Nerven. Im Gegensatz dazu sensorischen Nervenbahnen durch Laser Nähe ihrer Zellkörper verletzt zogen neuen axonalen Wachstums in der gleichen Richtung wie der Axon 34 verloren. Axone in dieser Region des Tieres wahrscheinlich präziser Positionsinformation zur Führung der regenerierenden Axonen ausgesetzt. Das Umfeld, in segmentalen Nerven ist unwahrscheinlich, viel resemblan habence für die Umwelt, dass die Axone ursprünglich während ihre Führung im Embryo navigiert, daher ist nicht zu erwarten, um Informationen müssen regenerierenden Axone führen.
Eine weitere Einschränkung für die Untersuchung der Regeneration mit Hilfe der segmentalen Nervenquetschung Test ist, dass verletzte Axone sensorischen und Motoneuronen haben noch einen deutlichen Abstand zu (0,25-1 mm), um ihr Ziel zu erreichen, und einen begrenzten Zeitrahmen (<3 Tage) vor der Tier erfährt decken Verpuppung. Eine aktuelle Studie hat eine genetische Manipulation der prothoraciotropic Hormon-Rezeptor, der die Dauer des 3. Larvenstadium Larvenstadium 35 verdreifacht identifiziert. Diese Manipulation wird der Zeitrahmen für die Untersuchung der Wiederherstellung und die Degeneration von Nervenzellen nach Verletzungen deutlich zu verlängern, bis 9 anstelle von 3 Tagen. Dies kann lange genug, um neue Ereignisse, wie Wiederverbindung eines verletzten Axons mit postsynaptischen Ziel beobachten, vor allem, wenn die Schädigung induziert wird, in der Nähe der synaptischen Ende.
Offenlegungen
Die Autoren erklären, keine finanziellen Interessen konkurrieren.
Danksagungen
Diese Arbeit wurde von der National Science Foundation (Grant-Nummer 0842701 IOS-CAC) und das National Institute of Health (R00MH080599 BY, R21 NS062313 NC und NS069844 CAC) unterstützt. Wir möchten James Schutt, Emily Han, und Leni Truong für den technischen Support zu bestätigen, und die Bloomington Stock Center für Fluglinien. Alle wurden die Chips in der Nanofabrikation Lurie Einrichtung an der Universität von Michigan hergestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5 mm Polyethylene tubing | Fisher Scientific | 14-170-11B | Polyethylene tubing, I.D. = 0.023 in O.D. = 0.038 in |
| 1 mm Polyurethane tubing | Fisher Scientific | BB521-63 | Polyurethane tubing, I.D. = 0.063 in O.D. = 0.125 in |
| Barb to barb connector | Bio Rad | 732-8300 | 0.8 mm barb to barb connector |
| 3-way Stopcock valve | Bio Rad | 732-8104 | Screw on valve for the syringe |
| Syringe (20 ml) | Fisher Scientific | 14-817-33 | Screw on 20 ml syringe for generating vacuum |
| Dispensing needles, 23 G (0.4 mm I.D., 0.6 mm O.D.) | McMaster-Carr | 75165A684 | Needle for outlet connection |
| Dispensing needles, 21 G, (0.6 mm I.D., 0.8 mm O.D.) | McMaster-Carr | 75165A679 | Needle for outlet connection |
| Halocarbon oil | Sigma | H8898 | Halocarbon oil 700 |
| Dumostar Number 5 Forceps | Roboz | RS-498 | For nerve crush |
| PDMS Kit (Base and curing agent) | Ellsworth | 184 SIL ELAST KIT 0.5KG | Dow Corning Sylgard 184 Silicone Encapsulant 0.5 kg Kit Clear |
| Glass Coverslips | Fisher Scientific | 12-544-C | 24 mm x 40 mm (thickness according to recommendation for your microscope objective) |
| Disposable Plastic Cup (9 oz) | |||
| Plastic coffee stirrer stick | |||
| Razor Blade | |||
| Grape juice agar plates | See http://cshprotocols.cshlp.org/content/2007/4/pdb.rec10925 for recipe |
Referenzen
- Pilling, A. D., Horiuchi, D., Lively, C. M., Saxton, W. M. Kinesin-1 and Dynein are the primary motors for fast transport of mitochondria in Drosophila motor axons. Mol. Biol. Cell. 17, 2057-2068 (2006).
- Gunawardena, S., et al. Disruption of axonal transport by loss of huntingtin or expression of pathogenic polyQ proteins in Drosophila. Neuron. 40, 25-40 (2003).
- Miller, K. E., et al. Direct observation demonstrates that Liprin-alpha is required for trafficking of synaptic vesicles. Curr. Biol. 15, 684-689 (2005).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
- Fuger, P., Behrends, L. B., Mertel, S., Sigrist, S. J., Rasse, T. M. Live imaging of synapse development and measuring protein dynamics using two-color fluorescence recovery after photo-bleaching at Drosophila synapses. Nat. Protoc. 2, 3285-3298 (2007).
- Schmid, A., et al. Activity-dependent site-specific changes of glutamate receptor composition in vivo. Nat. Neurosci. 11, 659-666 (2008).
- Fuentes-Medel, Y., et al. Glia and muscle sculpt neuromuscular arbors by engulfing destabilized synaptic boutons and shed presynaptic debris. PLoS Biol. 7, (2009).
- Andlauer, T. F., Sigrist, S. J. Building an imaging chamber for in vivo imaging of Drosophila larvae. , Cold Spring Harb. Protoc. 476-480 (2012).
- Sandstrom, D. J. Isoflurane reduces excitability of Drosophila larval motoneurons by activating a hyperpolarizing leak conductance. Anesthesiology. 108, 434-446 (2008).
- Sandstrom, D. J. Isoflurane depresses glutamate release by reducing neuronal excitability at the Drosophila neuromuscular junction. J. Physiol. 558, 489-502 (2004).
- Mondal, S., Ahlawat, S., Rau, K., Venkataraman, V., Koushika, S. P. Imaging in vivo neuronal transport in genetic model organisms using microfluidic devices. Traffic. 12, 372-385 (2011).
- Ghannad-Rezaie, M., Wang, X., Mishra, B., Collins, C., Chronis, N. Microfluidic chips for in vivo imaging of cellular responses to neural injury in Drosophila larvae. PloS one. 7, (2012).
- Schmid, A., Sigrist, S. J. Analysis of neuromuscular junctions: histology and in vivo imaging. Methods Mol. Biol. 420, 239-251 (2008).
- Xiong, X., et al. Protein turnover of the Wallenda/DLK kinase regulates a retrograde response to axonal injury. J Cell Biol. 191, 211-223 (2010).
- Xiong, X., Collins, C. A. A conditioning lesion protects axons from degeneration via the Wallenda/DLK MAP kinase signaling cascade. J. Neurosci. 32, 610-615 (2012).
- Byrne, A. B., Edwards, T. J., Hammarlund, M. In vivo Laser Axotomy in C. elegans. J. Vis. Exp. (51), (2011).
- Williams, W., Nix, P., Bastiani, M. Constructing a Low-budget Laser Axotomy System to Study Axon Regeneration in C. elegans. J. Vis. Exp. (57), (2011).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
- Chudakov, D. M., Lukyanov, S., Lukyanov, K. A. Tracking intracellular protein movements using photoswitchable fluorescent proteins PS-CFP2. 2, 2024-2032 (2007).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nat. Biotechnol. 24, 461-465 (2006).
- Rao, S., Lang, C., Levitan, E. S., Deitcher, D. L. Visualization of neuropeptide expression, transport, and exocytosis in Drosophila melanogaster. J. Neurobiol. 49, 159-172 (2001).
- Fujioka, M., et al. Even-skipped, acting as a repressor, regulates axonal projections in Drosophila. Development. 130, 5385-5400 (2003).
- Rietdorf, J., Steitz, A., Heidelberg, E. Linear unmixing macro for ImageJ. European Advanced Light Microscopy Network. , (2004).
- Koon, A. C., et al. Autoregulatory and paracrine control of synaptic and behavioral plasticity by octopaminergic signaling. Nat. Neurosci. 14, 190-199 (2011).
- Yarali, A., Gerber, B. A Neurogenetic Dissociation between Punishment-, Reward-, and Relief-Learning in Drosophila. Front. Behav. Neurosci. 4, (2010).
- Kuo, C. T., Jan, L. Y., Jan, Y. N. Dendrite-specific remodeling of Drosophila sensory neurons requires matrix metalloproteases, ubiquitin-proteasome, and ecdysone signaling. Proc. Natl. Acad. Sci. U.S.A. 102, 15230-15235 (2005).
- Mondal, S., Ahlawat, S., Koushika, S. P. Simple Microfluidic Devices for in vivo Imaging of C. elegans, Drosophila. J. Vis. Exp. (67), (2012).
- Xiong, X., et al. The highwire ubiquitin ligase promotes axonal degeneration by tuning levels of nmnat protein. PLoS Biol. 10, (2012).
- Shin, J. E., et al. Dual leucine zipper kinase is required for retrograde injury signaling and axonal regeneration. Neuron. 74, 1015-1022 (2012).
- Watkins, T. A., et al. DLK initiates a transcriptional program that couples apoptotic and regenerative responses to axonal injury. Proc. Natl. Acad. Sci. U.S.A. 110, 4039-4044 (2013).
- Hammarlund, M., Nix, P., Hauth, L., Jorgensen, E. M., Bastiani, M. Axon regeneration requires a conserved MAP kinase pathway. Science. 323, 802-806 (2009).
- Guo, S. X., et al. Femtosecond laser nanoaxotomy lab-on-a-chip for in vivo nerve regeneration studies. Nat. Methods. 5, 531-533 (2008).
- O'Brien, G. S., Rieger, S., Martin, S. M., Cavanaugh, A. M., Portera-Cailliau, C., Sagasti, A. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J. Vis. Exp. (24), (2009).
- Stone, M. C., Nguyen, M. M., Tao, J., Allender, D. L., Rolls, M. M. Global up-regulation of microtubule dynamics and polarity reversal during regeneration of an axon from a dendrite. Mol. Biol. Cell. 21, 767-777 (2010).
- Miller, D. L., Ballard, S. L., Ganetzky, B. Analysis of synaptic growth and function in Drosophila with an extended larval stage. J. Neurosci. 32, 13776-13786 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten