Method Article
Myelin Oligodendrozyten Glykoprotein (MOG
In diesem Artikel
Zusammenfassung
Experimentelle Autoimmun-Enzephalomyelitis (EAE) ist ein etabliertes Tiermodell für multiple Sklerose. C57BL / 6 Mäuse mit Myelin-Oligodendrozyten-Glykoprotein (MOG)-Peptid 35-55 (MOG 35-55) immunisiert, was zu einer aufsteigenden schlaffen Lähmung durch autoreaktive Immunzellen im zentralen Nervensystem verursacht. Protokolle für die Krankheitsinduktion und Überwachung diskutiert.
Zusammenfassung
Multiple Sklerose ist eine chronisch neuroinflammatorische demyelinisierende Erkrankung des zentralen Nervensystems mit einem starken neurodegenerative Komponente. Während die genaue Ätiologie der Erkrankung ist noch unklar, werden autoreaktive T-Lymphozyten haben eine zentrale Rolle in der Pathophysiologie spielen. MS-Therapie ist nur teilweise wirksam, so weit und Forschungsanstrengungen fortsetzen, um unser Wissen über die Pathophysiologie der Erkrankung zu erweitern und neue Behandlungsstrategien zu entwickeln. Experimentelle Autoimmun-Enzephalomyelitis (EAE) ist das am häufigsten Tiermodell für MS teilen viele klinische und pathophysiologische Funktionen. Es gibt eine breite Vielfalt von EAE-Modellen, die unterschiedliche klinische, immunologische und histologische Aspekte der menschlichen MS reflektieren. Aktiv-induzierten EAE bei Mäusen ist die einfachste Modell mit induzierbaren robuste und reproduzierbare Ergebnisse. Es ist besonders für die Untersuchung der Wirkungen von Drogen oder von bestimmten Genen mit Hilfe transgener Mäuse durch Autoimmun Neuroi herausgefordert geeignetnflammation. Daher werden die Mäuse mit ZNS-Homogenate oder Peptide von Myelin-Proteinen immunisiert. Aufgrund der niedrigen immunogene Potential dieser Peptide werden starke Adjuvantien verwendet. EAE Suszeptibilität und Phänotyp abhängig von der gewählten Antigen und Nagetier-Stamm. C57BL / 6 Mäuse sind das häufig verwendete Stamm für transgene Maus Konstruktion und reagieren unter anderem auf Myelin-Oligodendrozyten-Glykoprotein (MOG). Das immunogene Epitop MOG 35-55 in komplettem Freund-Adjuvans (CFA) vor der Immunisierung und Pertussis-Toxin ausgesetzt wird am Tag der Immunisierung appliziert und zwei Tage später. Mäuse entwickeln eine "klassische" selbst beschränkt monophasische EAE mit aufsteigend schlaffe Lähmung innerhalb 9-14 Tage nach der Immunisierung. Mäuse werden täglich mit einer klinischen Scoring-System für 25-50 Tage ausgewertet. Besondere Überlegungen für die Pflege Entnahme von Tieren mit EAE sowie Anwendungsmöglichkeiten und Grenzen dieses Modells werden diskutiert.
Einleitung
Multiple Sklerose (MS) ist eine chronische entzündliche demyelinisierende Erkrankung des zentralen Nervensystems, wobei die Zerstörung der Oligodendrozyten und Neuronen resultiert in heterogenen und Akkumulieren der klinischen Symptome. MS wird als prototypische Autoimmunerkrankung des zentralen Nervensystems (ZNS) angesehen und Tiermodelle entwickelt worden, um Licht auf die komplexe Pathogenese vergießen. Darüber hinaus sind die aktuellen Therapien nur teilweise wirksam und zielen vor allem auf die entzündliche Phase der Krankheit, während die neurodegenerative Komponente ist wahrscheinlich die größte Herausforderung für zukünftige therapeutische Ansätze 1,2.
Während die genaue Ätiologie der Erkrankung ist noch unklar ist, wird eine Autoimmunreaktion gegen Epitope auf der Myelinscheide der Axone im ZNS angenommen, um den Ausbruch der Krankheit zu provozieren. Dysregulation des Immunsystems, genetische Anfälligkeit und Umweltfaktoren (z. B. Infektionen, Vitamin D), um es glaubenEinfluss zentrale Aspekte der pathophysiologischen Mechanismen von MS.
Drei verschiedene Arten von Tiermodellen sind derzeit für die Erforschung der pathologischen Mustern der MS etabliert: Viral-Modelle wie Theiler murinen Enzephalomyelitis Virus (TMEV), Modelle von toxischen Stoffen wie Cuprizon induziert und schließlich verschiedene Varianten der experimentellen autoimmunen Enzephalomyelitis (EAE) 3, 4. Obwohl sie alle Funktionen von MS zu imitieren, sie unterscheiden sich enorm in den zugrunde liegenden pathologischen Merkmale wie die Beteiligung des adaptiven Immunsystems. EAE ist die häufigste Tiermodell, wie es ist besonders nützlich, um neuroinflammatorischen Wege zu untersuchen und dient als "proof-of-principle"-Modell für die Wirksamkeit neuer Behandlungsstrategien oft 5,6. EAE kann in vielen verschiedenen Tiere (zB Mäuse, Ratten, miniswine, Meerschweinchen, Hühner, oder Primaten) induziert werden. Allerdings haben sich die Mäuse am häufigsten verwenden, Arten, die zumindest teilweise istden Ausbau von anspruchsvollen Repertoire transgenen oder Knockout-Mäusen 7.
Die Pathophysiologie der EAE wird auf die Reaktion des Immunsystems gegen Gehirn-spezifischen Antigenen. Diese Reaktion führt zu Entzündung und Zerstörung der Buch Antigen-Strukturen, was zu neurologischen und pathologischen Merkmale, die vergleichbar denen bei MS-Patienten beobachtet. Drei verschiedene Ansätze unterschieden werden: Aktiv-induzierten EAE (AEAE, aktive Immunisierung), passiv übertragenen EAE (peae; Übertragung von enzephalitogenen Zellen von einem immunisierten Tier), und vor kurzem spontane EAE Mausmodellen (SEAE), die die Untersuchung von Autoimmun ermöglichen Mechanismen ohne exogene Manipulation. Der einfachste Modell ist induzierbaren AEAE bei Mäusen was in schnelle und robuste Ergebnisse. Dieses Modell wird als der "Goldstandard" der neuroimmunologischen Tiermodellen von vielen Forschern im Bereich 8 betrachtet.
Für AEAE Induktion, das Tiermit einer subkutanen Injektion einer Emulsion, bestehend aus dem ausgewählten Antigen immunisiert und komplettem Freund-Adjuvans (CFA), begleitet von einer intraperitonealen Injektion von Pertussis-Toxin am Tag der Immunisierung und zwei Tage später. Folglich werden Myelin-spezifischen T-Lymphozyten in der Peripherie aktiviert und in das CNS durch die Blut-Hirn-Schranke. Beim Eintritt in das ZNS werden T-Zellen durch lokale Infiltration und Antigen-präsentierende Zellen, was in nachfolgenden Entzündungskaskaden, die Beteiligung von anderen Zellen wie Monozyten oder Makrophagen und schließlich in Demyelinisierung und axonalen Zelltod 9 aktiviert. Je nach der Immunisierungsprotokoll und Kombination der Maus-Stamm (z. B. C57BL / 6, SJL / J, Biozzi) und Antigen (zB Myelin-Oligodendrozyten-Glykoprotein (MOG), basisches Myelinprotein (MBP), Myelin-Proteolipidprotein (PLP)), die Krankheit Natürlich kann eine akute, chronische progressive oder mit schubförmig remittierenden Krankheitsverlauf zu nehmen.
C57BL / 6 Mäuse wurden am häufigsten verwendete Stamm transgener Mäuse Konstruktion werden und eine wachsende Vielzahl von Knockout oder transgenen Mäusen ist. Wir beschreiben ein Protokoll für die Immunisierung von C57BL / 6 Mäusen, die mit MOG-Peptid 35-55 10, die in einem einphasigen EAE mit ersten Symptome nach 9-14 Tage, maximal Krankheit etwa 3-5 Tage nach Krankheitsbeginn und langsam und Teilsymptom Erholung führt in den nächsten 10-20 Tage. Als das immunogene Potential der MOG 35-55 Peptid allein nicht ausreicht, um Krankheit zu induzieren, sind Hilfsstoffe wie CFA erforderlich. Es wird angenommen, daß die Komponenten des CFA aktivieren mononukleären Phagozyten Induktion der Phagozytose dieser Moleküle und die Sekretion von Zytokinen. Dies führt zur Verlängerung der Anwesenheit von Antigenen und einem effizienteren Transport dieser an das lymphatische System. EAE-Induktion wird durch Anwendung von Pertussis-Toxin (PT), die unter anderem vorgeschlagen worden, zu modulieren erleichtertdie Blut-Hirn-Schranke und die immunologische Reaktionsfähigkeit selbst 11. Nach Induktion der Krankheit, ist besondere Vorsicht für die tägliche Auswertung der Mäuse Krankheitssymptome eingenommen werden.
Protokoll
1. Allgemeine Kommentare für Maus-Experimente
- Alle Experimente mit Mäusen sollten in Übereinstimmung mit den Richtlinien des jeweiligen institutionellen Tierpflege und Verwendung Ausschuss durchgeführt werden.
- Halten Sie die Mäuse unter pathogen-freien Bedingungen und ermöglichen ihnen den Zugang zu Nahrung und Wasser ad libitum haben. Hinweis: Es ist wichtig, Alter und Geschlecht passenden Mäusen in Versuchsgruppen zu verwenden, da die Anfälligkeit für Krankheiten können mit dem Alter und Geschlecht variieren.
- Je nach den gewählten Versuchsbedingungen kann ein Schein-immunisierten Kontrollgruppe betrachtet, bei dem MOG 35-55 Peptid wird von beiden PBS ohne Antigen oder einem nonencephalitogenic Peptid ersetzt werden.
- Bitte beachten Sie, methodische Aspekte vor Beginn der Experimente (siehe auch unten). Wir empfehlen, ein oder zwei Beobachter blind für EAE Scoring einzubeziehen.
2. Vorbereitung der MOG 35-55 Emulsion
- 200 &mgr; l einer 1:1-Verhältnis von MOG 35-55 Peptidlösung und CFA sollte jeder Maus injiziert werden. Es ist ein gewisser Verlust der viskosen Emulsion während der Vorbereitung und Injektion. Daher bereiten 1.5-2x der benötigten Menge. Berechnen des Gesamtvolumens der Emulsion und durch 2 für die erforderlichen Mengen sowohl MOG 35-55 Peptidlösung und CFA.
- Verdünnen lyophilisierten MOG 35-55 in ddH 2 O zu einer Endkonzentration von 2 mg / ml. Wir verwenden in der Regel 200 ug MOG 35-55 Peptid pro Maus. Dieser Betrag wird in 100 ul der Stammlösung enthalten sind. Die Peptidlösung bei -20 ° C gelagert werden
- Legen Sie den Inhalt der 1 Fläschchen trocknet Mycobacterium tuberculosis H37RA (100 mg) in einem Mörser.
- Boden mit Mörser und Stößel, um eine dünne Pulver zu erhalten.
- 10 ml inkomplettem Freund-Adjuvans, eine 10 mg / ml Stammlösung CFA, die bei 4 ° C gelagert werden können, erhalten
- Vor der Immunisierung verdünnen CFA Stammlösung WitzIFA h bis zu einer Endkonzentration von 2 mg / ml. Mischen Sie gründlich vor jedem Gebrauch, um Partikel zu suspendieren und betrachten einige Volumenverlust der viskosen Lösung während der experimentellen Präparaten.
- Mischen 1:1 mit MOG 35-55 Peptid-Lösung, bis die Endkonzentration von 1 mg / ml erreicht wird.
ACHTUNG: Wärme getötet Mycobacterium tuberculosis stimuliert die angeborene Immunantwort. Einatmen, Verschlucken und Berührung mit der Haut und Augen.
- Vorkühlung Lösungen auf Eis.
- Auszuarbeiten 1 ml von 2 mg / ml CFA und 1 ml 2 mg / ml Lösung MOG 35-55 in zwei 2 ml-Spritzen. Berechnen der Anzahl von Spritzen nach Bedarf die Anzahl der immunisierten Tiere.
ACHTUNG: Vermeiden Sie unbedingt nähen während der Herstellung des Adjuvans, wie es Granulome verursachen oder Autoimmunreaktionen induzieren. - Verwenden Sie eine 27 G Kanüle für die MOG 35-55 Lösung und einer 20 G Kanüle zur CFA. Vermeiden Sie Luftblasen und verbinden Sie die beiden Spritzen mitrei-Wege-Ventil.
- Senden Sie die Emulsion aus einer Spritze in die andere und gründlich für mindestens 10 min eine gute Emulsions ist ein entscheidender Schritt. Near-schließen Sie die Drei-Wege-Ventil zum Emulgieren unterstützen. Die Lösung sollte weiß, steif und viskose ohne Phasentrennung sein.
- Emulsion kann mehrere Tage vor der Immunisierung gespeichert werden. Warten, mindestens 30 min nach der Herstellung der Emulsionen zu beobachten, ob sie stabil sind. Vor der Immunisierung ziehen Sie die Lösung in eine von zwei Spritzen und schließen Sie eine 27 G Kanüle.
- Auszuarbeiten 1 ml von 2 mg / ml CFA und 1 ml 2 mg / ml Lösung MOG 35-55 in zwei 2 ml-Spritzen. Berechnen der Anzahl von Spritzen nach Bedarf die Anzahl der immunisierten Tiere.
3. Herstellung von Pertussis Toxin
- Verschiedene Mengen von Pertussis-Toxin ist in der Literatur, die auch abhängig von der Art der Verabreichung (z. B. intravenös oder intraperitoneal) gefunden werden. Unser Labor verwendet 400 ng Pertussis-Toxin in 200 &mgr; l PBS intraperitoneal am Tag der Immunisierung und zwei Tage später. ACHTUNG: Pertussis-Toxin hat viele biologische Wirkungen. Einatmen, Verschlucken und Berührung mit der Haut und den Augen vermeiden.
- Rekonstituieren 50 ug von Pertussis-Toxin in 500 ul ddH 2 O für eine 100 ug / ml Stammlösung. Lagern bei 4 ° C
- Verdünnen 1:50 mit PBS. 200 ul enthalten nun 400 ng PBS. Vorbereitung der erforderlichen Menge von Spritzen und berücksichtigen eine zusätzliche überschüssige Volumen von ~ 100 &mgr; l für jede Nadelansatz.
4. Tier Immunisierung
- Bitte beziehen Sie sich auf die institutionelle Pflege der Tiere und die Verwendung Ausschuss für spezifische Kriterien für die erforderliche kurzfristige Euthanasie. Unser Labor verwendet kurze Betäubung mit Isofluran während andere Protokolle wie Ketamin / Xylazin-Injektion oder Halothan kann auch möglich sein. Warten für Anästhesie und verwenden Sie einen vorderen Fuß Zehe Prise, um das Niveau der Anästhesie zu beurteilen.
- Stellen Sie sicher, dass die Immunisierung wird von einer erfahrenen Person durchgeführt, um Stress für die Tiere zu minimieren und eine optimale Immunisierung zu gewährleisten.
- Injizieren Sie 100 ul von Antigen / CFA-Emulsion subkutan in zwei verschiedenen Standorten auf jeder Hinterflanke. Stellen Sie sicher, dass ein Knollenmasse bildet sich unter der Haut, die während des gesamten Experiments bestehen sollte.
- Injizieren Sie 200 ul von Pertussis-Toxin intraperitonelly.
- Stellen Sie sicher, dass die einzelnen Mäuse können leicht für die tägliche Auswertung identifiziert werden, z. B. durch Farbmarkierungen auf der Schwanzbasis.
- Verwalten Sie eine zweite Dosis von Pertussis-Toxin am zweiten Tag nach der Immunisierung.
5. EAE Überwachung
- Gewicht und klinischen Score sollte täglich ausgewertet werden. Das Einsetzen von EAE typischerweise mit Gewichtsverlust, der als Indikator für die Aktivität der Erkrankung verwendet werden kann. Bitte beziehen Sie sich auf die institutionelle Tierpflege und verwenden Ausschuss Kriterien vorgeben, wenn einzelne Mäuse haben, um aus den Versuchen genommen werden. Dies sollte bei der Gewichtsverlust 20% des ursprünglichen Körpergewichts oder wenn schwere klinische Symptome (EAE-Score 7 oder schlechter) auftreten überschreitet. Bitte beachten Sie die Wieder beziehenjeweiligen Richtlinien der jeweiligen institutionellen Tierpflege und Verwendung Ausschuss erlaubt maximale Punktzahl.
- Wenn Mäuse klinische Symptome von EAE, ist es wichtig, sicherzustellen, dass die Wasserflasche noch erreicht werden, dass Lebensmittel an der Kabinenboden angeordnet ist.
- Verschiedene Scoring Symptome verwendet werden. In unserem Labor eine Skala von 0-10 wird gegründet.
| Klasse | Klinische Zeichen | Kommentar |
| 0 | Keine klinischen Anzeichen | Normalen Gang, Schwanz bewegt sich und kann angehoben werden, Wraps Schwanz um einen runden Gegenstand, wenn Maus ist an der Basis des Schwanzes gehalten |
| 1 | Teilweise schlaffen Schwanz | Normalen Gang der Schwanzspitze erschlafft |
| 2 | Gelähmt Schwanz | Normalen Gang, Dachschrägen Schwanz |
| 3 | Hinterbeinparese, unkoordinierte Bewegung | Unkoordinierten Gang, Heck hinkt, Hinterbeine reagieren auf Kneifen |
| 4 | Ein Hinterbein gelähmt | Unkoordinierten Gang mit einem Hinterbein Ziehen, Schwanz hinkt, ist ein Hinterbein nicht reagiert zu kneifen |
| 5 | Beide Hinterbeine gelähmt | Unkoordinierten Gang mit beiden Hinterbeine ziehen, Schwanz hinkt, haben beide Hinterbeine nicht reagiert zu kneifen |
| 6 | Hinterbeine gelähmt, Schwäche in den Vordergliedmaßen | Unkoordinierten Gang mit Vorderbeine kämpfen, um Körper, Vorderbeine Reflex nach Kneifen zu ziehen, hinkt Schwanz |
| 7 | Hinterbeine gelähmt, ein Vorderbein gelähmt | Maus nicht bewegen kann, antwortet ein Vorderbein bis zu den Zehen Prise, hinkt Schwanz |
| 8 | Hinterbeine gelähmt, beide Vorderbeine gelähmt | Maus kann sich nicht bewegen, beide Vorderbeine nicht bis Fuß Prise reagieren, hinkt Schwanz |
| 9 | Moribund | Keine Bewegung, Atmung verändert |
| 10 | Tod |
Tabelle 1. Klinische Scoring-System.
Ergebnisse
Nach der Immunisierung haben Mäusen, die täglich für Gewichtsveränderungen und die klinischen Symptome beurteilt werden. Krankheit beginnt in der Regel mit einer Reduktion von Gewicht, das beginnen könnte 1-2 Tage vor der EAE-Symptome sichtbar sind korreliert. Klinische Zeichen der EAE beginnen in der Regel zwischen 9 und 14 Tage nach der Immunisierung. Als Läsionen werden überwiegend an das Rückenmark in MOG-EAE in C57BL / 6 Mäusen lokalisiert, sie entwickeln in der Regel überwiegend motorische Symptome in einer kaudal rostral Muster. Ein beispielhaftes Bild von einem immunisierten Maus mit EAE-Symptome (Note 6) ist in Fig. 1A dargestellt. Einige atypische EAE Symptome können auch auftreten, wie Walzen in axialer drehfest, Partitur gebeugt Aussehen oder Überempfindlichkeit, die nicht in der klassischen EAE reflektiert sind in Tabelle 1 dargestellt. Wie motorischen Symptome sind das Hauptmerkmal in diesem Modell, wird dieser Score uns ein guter Indikator für die Schwere der Erkrankung. Verschiedene Überwachungssysteme (z. B. mit 0 -5 oder 0-6) und komplexer Verbund Partituren Bewertung verschiedener Defizite wurden ebenfalls veröffentlicht. Bitte beachten Sie, dass Mäuse mit schweren Symptomen haben, um aus dem Experiment nach der jeweiligen institutionellen Tierpflege und Verwendung Ausschusses. Mäuse zeigen in der Regel teilweise Erholung der Symptome in den nächsten 10-20 Tage. Ein Vertreter Krankheitsverlauf ist in 1B dargestellt. Es gibt verschiedene Zeitpunkte während EAE, die für die Beurteilung der Zielparameter von Interesse sind. Einige typische Tests, die oft festgestellt werden können, sind sehr kurz beschrieben. Bei maximaler Krankheit, können Mäuse für Zytokin-Produktion oder Proliferation nach Restimulation der isolierten Immunzellen mit MOG 35-55 Peptid in vitro (MOG Recall-Test) ausgewertet werden. Immunzellen können auch aus dem Gehirn und dem Rückenmark von Mäusen mit EAE-Symptome isoliert und weiterverarbeitet werden, z. B. durch Durchflusszytometrie. Die histologische Analyse von Rückenmarksabschnitte können bei Krankheit m durchgeführt werdenaximale Läsion für Last-und Demyelinisierung, während zu späteren Zeitpunkten Marker für Neurodegeneration und neuronalen Zelltod von Interesse sein könnten.
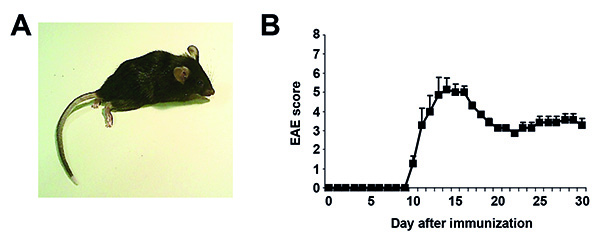
Abbildung 1. Vertreter EAE Ergebnisse. A. Repräsentative Bild von einem immunisierten C57BL / 6 Maus mit EAE-Symptome (EAE Score 6). B. Repräsentative Krankheitsverlauf nach der Immunisierung über 30 Tage. Die Daten werden als Mittelwert und Standardabweichung vom Mittelwert dargestellt (n = 5). Klicken Sie hier für eine größere Ansicht .
Diskussion
Eine Vielzahl von unterschiedlichen EAE-Modellen mit aktiven Immunisierungsprotokolle in den letzten Jahrzehnten beschrieben worden. Während Rattenmodelle sind weit bis vor kurzem verwendet werden, sind Mäuse jetzt zu den beliebtesten Modellorganismus für EAE Forschung. Diese Entwicklung ist unter anderem aufgrund des breiten und ständig wachsenden Repertoire an verfügbaren transgenen Mäusen. Immunisierung von C57BL / 6 Mäusen, die mit MOG-Peptid 35-55 ist eine der am weitesten verbreiteten EAE-Modellen und kann als zuverlässige und reproduzierbare und gut zu handhabende Tiermodell berücksichtigt werden. In vielen neuroimmunologischen Labor, ist MOG 35-55 induzierten EAE als Modell der Wahl etabliert, während andere EAE-Modelle sind für die besonderen experimentellen Fragen verwendet.
Ein kritischer Punkt ist die Planung der Versuchseinstellungen, um sicherzustellen, dass EAE Experimente methodisch korrekt durchgeführt. Für die interne Validität, geblendet Scoring der Krankheitssymptome sehr zu empfehlen. Erfahrungmentellen Gruppen sollte das Alter, das Gewicht-und Sex-Mäusen abgestimmt und sollte zufällig den Behandlungsgruppen zugeteilt werden. Experimente sollten immer in Übereinstimmung mit den Tierschutzvorschriften durchgeführt werden. EAE Studien sind oft zu schwach und müssen statistische Typ-II-Fehler nicht zu berücksichtigen. Daher vor den Experimenten, Probengröße Berechnungen durchgeführt werden. Notwendige Gruppengrößen sind abhängig von der erwarteten Effektgröße. Anhörung eines Sachverständigen für die statistische Analyse könnte, bevor EAE-Experimente berücksichtigt werden.
Einige Einschränkungen des Protokolls müssen im Auge behalten werden. Am wichtigsten ist, ist die Interpretation der Daten AEAE durch die Art der Immunisierung unter Verwendung von Hilfs-und Pertussis-Toxin, die sowohl zusätzliche Einfluß auf die immunologische Reaktion beeinträchtigt haben. Es sollte auch berücksichtigt, dass die MOG-EAE 35-55 Modell zeigt vor allem eine CD4 + T-Zell-Immunantwort angetrieben werden. CD8 + T-Zellen und B-Zellen spieleneine weniger prominente Rolle und alternative Protokolle sollten bei der Bewältigung dieser Zelltypen werden. Die zu erwartende Krankheitsverlauf ist akut, einphasige und Selbst begrenzt. Alternativ kann ein schubförmiger Verlauf der Krankheit auch in alternative EAE-Modellen erreicht werden. Eine weitere wichtige Begrenzung des Protokolls ist eine gewisse Neigung zu der immunologischen Komponente des MS Pathophysiologie. In den letzten Jahren hat sich immer deutlicher gezeigt, dass MS eine starke neurodegenerative Komponente. Der Tod von Oligodendrozyten und Neuronen führt zu einer fortschreitenden Anhäufung von neurologischen Defiziten. Es ist zu berücksichtigen, dass die EAE-Modell möglicherweise nicht vollständig geeignet, um Fragen zu Experiment neurodegenerative Mechanismen von Autoimmunentzündung anzugehen. Alternative Tiermodellen mit Fokus auf ZNS-Pathologie können berücksichtigt werden - z. B. die Cuprizon Modell, das toxische Demyelinisierung Kompromisse ohne Beteiligung des peripheren Immunsystems.
Das beschriebene Protokoll als Grundneuroimmunologischen experimentellen Modell zu betrachten und können für andere Anwendungen modifiziert werden. Die oben beschriebenen experimentellen Verfahren kann leicht auf andere Protokolle, die von EAE-Mäusen unterschiedlicher Stämme aufgetragen werden, oder die Art und Menge des Proteins (z. verwenden PLP 139-151 Peptid-und SJL-Mäusen für eine schubförmig-remittierender EAE Krankheitsverlauf, die sich besonders für die Beurteilung therapeutischer ist Auswirkungen auf die Rückfälle). Das beschriebene Protokoll kann auch für die adoptive Transferexperimente (passive EAE) verwendet werden. In diesem Modell werden C57BL / 6 Mäusen, die mit MOG-Peptid 35-55 und CFA wie oben beschrieben immunisiert. Im Gegensatz dazu wird das Pertussis-Toxin nicht erforderlich. Nach 7-15 Tage, Milz oder Lymphknoten isoliert und Immunzellen in vitro mit MOG-Peptid 35-55 und verschiedene Zytokine, bevor sie in einer neuen Gruppe von Mäusen übertragen C57BL/6se restimuliert. Diese Mäuse entwickeln Empfänger EAE ein paar Tage früher als bei klassischensischen Immunisierung. In-vitro-Bedingungen können für spezifische immunologische Fragen variiert werden (z. B. Polarisation in T H 1 oder T H 17-Zellen).
Manchmal kann niedrige Krankheitshäufigkeit oder schwache Symptome eine experimentelle Herausforderung sein. Einige Empfehlungen für die Fehlersuche sind:
- Schwere der Erkrankung kann mit unterschiedlichen Mengen an Peptid / Maus variiert werden.
- Optimale CFA Konzentration 1-5 mg / ml variieren. Betrachten wir eine Titration von CFA bei der Festlegung der Experimente. Bitte beachten Sie die jeweiligen Richtlinien des jeweiligen institutionellen Tierpflege und Verwendung Ausschuss für zulässig CFA Konzentrationen so viele Vorschriften verbieten CFA-Konzentrationen über 2 mg / ml.
- Es sind verschiedene Verfahren zur Herstellung der Emulsion beschrieben. Alternative Methoden, wie Vortex für 1 Stunde oder Beschallung könnte erwogen werden, wenn schlechte Emulgieren als possib berücksichtigt werdenle Fehlerquelle.
- Alter, Geschlecht, Jahreszeit und Umweltbedingungen in der Tierhaltung sind wichtige Faktoren, die EAE-Anfälligkeit beeinflussen. Es sollte sichergestellt werden, dass die Bedingungen vergleichbar sind unabhängige Experimente.
Wie oben beschrieben, kann die genannte Protokoll als Ausgangspunkt für die adoptive EAE Experimente eingesetzt werden. Dieses Modell ist besonders für die Trennung peripheren und ZNS-Wirkungen einer genetischen Phänotyp (z. B. durch Übertragen encephalitogenen Knockout-Zellen in Wildtyp-Empfängermäuse) und für bestimmte immunologische Fragen wie der Phänotyp der Zellen übertragen gründlich charakterisiert geeignet. Die neueste Entwicklung in EAE Forschung in den letzten Jahren sind T-Zell-Rezeptor transgenen Mäusen. Diese Mäuse entwickeln EAE-Symptome spontan und ohne äußeren Einfluss zu umgehen das Problem der adjuvanten Impfung. Dieses Modell erfordert jedoch große Mengen an Tieren breeding bis ausreichende Gruppengrößen zu gewährleisten. Bewertung der Knockout-Mäuse erfordert Kreuzung vor der EAE-Experimente im Gegensatz zu AEAE. Wie jede Maus entwickelt Krankheitssymptome an einem anderen Tag kann Bewertung der neuen Stoffe ziemlich kompliziert sein. Daher bleibt der Wert der klassischen AEAE für neuroimmunologische unangefochten.
Offenlegungen
Die Autoren erklären, keine finanziellen Interessen konkurrieren.
Danksagungen
Diese Arbeit wurde durch das Interdisziplinäre Zentrum für Klinische Forschung (IZKF) Münster (SEED 12.03, SB) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Female C57BL/6 mice, age 10-12 weeks, ~20 g weight | e.g. Jackson Laboratory, Charles River | ||
| MOG35-55 (MEVGWYRSPFSRVVHLYRNGK) | e.g. Pepceuticals Ltd | Store at -20 °C | |
| Incomplete Freund’s adjuvant (IFA) | e.g. Sigma-Aldrich Co. | F5506 | Store at 4 °C |
| Syringes, 1 ml with 26 G 3/8 in needle | e.g. Becton Dickinson & Co. | 309625 | |
| Syringes, 2 ml | e.g. B. Braun | 7389 | |
| Needles, 25 G 5/8 in and 30 G 1/2 in | e.g. Becton Dickinson & Co., | 305122, 305106 | |
| Three way valve | e.g. B. Braun | 16494 C | |
| Pertussis toxin, lyophilized in buffer | Enzo Life Sciences Inc. | BML-G100 | Store at 4 °C |
| M. tuberculosis H37 RA | BD Difco | 231141 | Store at 4 °C |
Referenzen
- McFarland, H. F., Martin, R. Multiple sclerosis: a complicated picture of autoimmunity. Nat. Immunol. 8, 913-919 (2007).
- Wiendl, H. Neuroinflammation: the world is not enough. Curr. Opin. Neurol. 25, 302-305 (2012).
- vander Star, B. J., et al. In vitro and in vivo models of multiple sclerosis. CNS Neurol. Disord. Drug Targets. 11, 570-588 (2012).
- Pachner, A. R. Experimental models of multiple sclerosis. Curr. Opin. Neurol. 24, 291-299 (2011).
- Bittner, S., et al. The TASK1 channel inhibitor A293 shows efficacy in a mouse model of multiple sclerosis. Exp. Neurol. 238, 149-155 (2012).
- Handel, A. E., Lincoln, M. R., Ramagopalan, S. V. Of mice and men: experimental autoimmune encephalitis and multiple sclerosis. Eur. J. Clin. Invest. 41, 1254-1258 (2011).
- Krishnamoorthy, G., Wekerle, H. EAE: an immunologist's magic eye. Eur. J. Immunol. 39, 2031-2035 (2009).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nat. Protoc. 1, 1810-1819 (2006).
- Fletcher, J. M., Lalor, S. J., Sweeney, C. M., Tubridy, N., Mills, K. H. T cells in multiple sclerosis and experimental autoimmune encephalomyelitis. Clin. Exp. Immunol. 162, 1-11 (2010).
- Mendel, I., Kerlero de Rosbo, N., Ben-Nun, A. A myelin oligodendrocyte glycoprotein peptide induces typical chronic experimental autoimmune encephalomyelitis in H-2b mice: fine specificity and T cell receptor V beta expression of encephalitogenic T cells. Eur. J. Immunol. 25, 1951-1959 (1995).
- Hofstetter, H. H., Shive, C. L., Forsthuber, T. G. Pertussis toxin modulates the immune response to neuroantigens injected in incomplete Freund's adjuvant: induction of Th1 cells and experimental autoimmune encephalomyelitis in the presence of high frequencies of Th2 cells. J. Immunol. 169, 117-125 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten