Method Article
Transgenen Nager Assay zur Quantifizierung von männlichen Keimzellmutantenhäufigkeit
In diesem Artikel
Zusammenfassung
De novo mutations in the male germline may contribute to adverse health outcomes in subsequent generations. Here we describe a protocol for the use of a transgenic rodent model for quantifying mutations in male germ cells induced by environmental agents.
Zusammenfassung
De novo mutations arise mostly in the male germline and may contribute to adverse health outcomes in subsequent generations. Traditional methods for assessing the induction of germ cell mutations require the use of large numbers of animals, making them impractical. As such, germ cell mutagenicity is rarely assessed during chemical testing and risk assessment. Herein, we describe an in vivo male germ cell mutation assay using a transgenic rodent model that is based on a recently approved Organisation for Economic Co-operation and Development (OECD) test guideline. This method uses an in vitro positive selection assay to measure in vivo mutations induced in a transgenic λgt10 vector bearing a reporter gene directly in the germ cells of exposed males. We further describe how the detection of mutations in the transgene recovered from germ cells can be used to characterize the stage-specific sensitivity of the various spermatogenic cell types to mutagen exposure by controlling three experimental parameters: the duration of exposure (administration time), the time between exposure and sample collection (sampling time), and the cell population collected for analysis. Because a large number of germ cells can be assayed from a single male, this method has superior sensitivity compared with traditional methods, requires fewer animals and therefore much less time and resources.
Einleitung
Sporadische DNA-Mutationen in der Keimbahn können zu einer verminderten Fortpflanzungserfolg führen, und wenn geerbt, können genetische Krankheit oder erhöhten Prädisposition für Krebs bei den Nachkommen 1-3 führen. Erhebliche Beweise zeigen, dass ein großer Anteil der de novo Mutationen werden von der väterlichen Keimbahn vererbt 4, und dass die Anzahl von Mutationen in den Nachkommen positiv mit väterlichen Alter zum Zeitpunkt der Empfängnis 5 korreliert. Der höhere Anteil der männlichen Mutationen ist vermutlich eine Folge der Altersunterschied während der Gametogenese zwischen den Geschlechtern, die größere Zahl der Spermatogenese Zellbereiche im Vergleich mit der Anzahl der oogenic Zellteilungen in der weiblichen Keimbahn 2 und eine progressive Abnahme der DNA Reparatureffizienz mit dem Alter bei Männern. All diese Faktoren tragen zu einer erhöhten Wahrscheinlichkeit des Replikationsfehler in der männlichen Keimbahn 6. Doch die Auswirkungen der väterlichen Engagement in Environmental Faktoren auf die Häufigkeit der de novo Mutationen bleibt ungewiss. Dennoch ist eine große Zahl von Umweltfaktoren sind bekannt, Keimzellmutationen in Nagetieren 7 zu induzieren, und es gibt Anzeichen dafür, dass ein Teil dieser Mittel kann auch die menschliche Keimbahn 8 berührt. Trotz dieser Bedenken sind Chemikalien routinemßig auf ihre Fähigkeit, Mutationen in somatischen Zellen für regulatorische Zwecke zu induzieren, und es wird allgemein angenommen, dass somatische Tests ausreichen, um die Keimbahn zu schützen. Daher werden nur selten Chemikalien auf ihre Fähigkeit zur Keimzellmutationen induziert bewertet.
Ein Grund Keimzellmutagenität Tests wurde weitgehend aus dem regulatorischen Entscheidungsprozess weggelassen ist ein Mangel an praktischen Methoden. Traditionelle Nagetier-basierte Methoden, wie die dominant-letale 9 und spezifischen Locus 10 Tests schätzen Keimzellmutationsraten durch Scoring mutierten Phänotypen in Embryonen oder Nachkommen vonEltern ausgesetzt. Diese Tests erfordern die Verwendung einer sehr großen Anzahl von Tieren, die Zeit und die Ressourcen, um statistisch aussagekräftige Ergebnisse zu erhalten.
Obwohl mehrere moderne Methoden zur Quantifizierung von Keimzellmutation haben vor kurzem entstanden, viele leiden Mängel im Hinblick auf ihre Praktikabilität, Effizienz und biologische Relevanz. Zum Beispiel, wiederholen Länge erweitert Mutationen an einfachen Tandem-Repeat (ESTR) Loci in männlichen Keimzellen mit einem einzigen Molekül PCR Ansatz 15 quantifiziert werden. Jedoch kann die Ausführung dieser Methode technisch anspruchsvoll und aufwendig sein, und im Gegensatz zu Punktmutationen, die biologische und gesundheitliche Bedeutung von Veränderungen in der Rapportlänge des sehr instabilen ESTR Loci unklar 16. Moderne Genomsequenzierungstechnologien können eine Fülle von biologisch sinnvolle Daten zu liefern, wenn für das Problem der vererbbare Mutationen 4,17 angewendet, aber die hohen Kosten, hohe Fehlerraten, verbunden Validierung erforderlichMutationen zu bestätigen, und Bioinformatik Herausforderungen immer noch die routinemäßige Anwendung dieser Option in einen Rechtstestkapazität 18 zu begrenzen.
Hier beschreiben wir ein praktisches Verfahren zur Quantifizierung induzierte Mutationen direkt in den Keimzellen des transgenen männlichen Mäusen. Dieses Protokoll ist für die transgene MutaMouse Modell, das mehrere verkettete Kopien eines rekombinanten gt10-Phagenvektor, enthaltend ein in beide Kopien des Chromosoms 3 19 (Figur 1) integriert Escherichia coli lacZ-Reporter-Gen beschrieben.
Dieses Protokoll ist auch für andere transgene Nager (TGR) Modelle, die auf den gleichen Prinzipien (BigBlue Maus und Ratte, Maus oder lacZ-Plasmid, etc.) Oder leicht unterschiedlichen Reportergenen (gpt Delta Maus und Ratte, TGR-Modelle in Lambert et Bewertung al. 20). Diese Methode basiert auf der in einer kürzlich veröffentlichten beschrieben TGR Mutation Assayund überarbeiteten OECD-Prüfrichtlinie 21 und wir uns auf die besondere Überlegungen erforderlich, um Beurteilung von Mutationen in der männlichen Keimbahn wegen der einzigartigen Eigenschaften der Spermatogenese Platz zu erarbeiten. Kurz gesagt beinhaltet der Test ausgesetzt transgenen männlichen Mäusen mit einem mutagenen Substanz, gefolgt von einer Abtastzeit in dem Vorausmutations Läsionen in stabile Mutationen fixiert. Bei der gewählten Abtastzeit werden die Mäuse getötet und Keimzellen entweder aus dem Nebenhoden oder Cauda Samenkanälchen gesammelt. Wie unten diskutiert, können mutagene Effekte in verschiedenen Phasen der Spermatogenese durch die Auswahl der Zeitspanne zwischen Belichtung und Probenentnahme zu bestimmen. Transgenen Einsätze, mehrere Kopien des λ-Phagen-Genoms pro Zelle, werden aus Keimzelle genomische DNA isoliert und in leer λ Phagen λ Kapside Schaffung Infektionsphagenpartikel, die dann verwendet werden, um einen E. infizieren verpackt coli-Wirt. Die infizierten Bakterien auf Selec gewachsentive Medien, die Zellen, die einen Vektor mit einer mutierten Kopie des lacZ aus Zellen, die Wildtyp-lacZ unterscheiden kann. Die mutagene Wirkung der Exposition auf die männliche Keimbahn wird durch Vergleichen der Frequenz des mutanten Transgene zwischen Kontrolle und behandelten Mäusen (2, 20 Lambert et al. Bewertung) bestimmt. Eine große Anzahl von Keimzellen aus einer einzigen Maus untersucht werden, was diesen Test überlegene Empfindlichkeit gegenüber traditionellen Methoden, während die Zahl der Tiere zu reduzieren erforderlich. Und weil keine spezielle Ausrüstung oder Ausbildung erforderlich ist, bietet dieser Test eine praktische und effiziente Möglichkeit für Keimzellmutation Tests in den meisten modernen Toxikologie / molekularbiologischen Laboratorien.
Eine wesentliche Voraussetzung für die wirksame Anwendung der TGR Keimzellmutationstest ist ein Verständnis der Spermatogenese-Zyklus (Abbildung 3). Die Zeit für die Keimzellen der Maus, um von st Fortschritteem-Zellen in den Samenleiter zu Spermatogonien, Spermatozyten, Spermatiden und schließlich Spermien im Nebenhoden (dh. Spermatogenese) ist etwa 49 Tagen fällig. Mutation kann in verschiedenen Phasen des Zyklus auftreten und ist oft spezifische Verbindung. Zwei wichtige Funktionen, die von besonderer Bedeutung für die Mutagenese in männlichen Keimzellen sind die Beendigung der DNA-Synthese während der frühen Meiose und der fortschreitenden Verlust von DNA-Reparaturkapazität 6 während der späten Post Meiose zwei Prozesse, die für die Einleitung und Fixierung erforderlich sind Die meisten Mutationen.
Aufgrund dieser einzigartigen Eigenschaften der Spermatogenese, gibt es drei kritische experimentelle Variablen für die Durchführung der TGR Keimzellmutationstest: (1) die Testverbindung Verwaltungszeit; (2) den Probezeit; und (3) die Auswahl der Keimzellpopulation zur Analyse (Abbildung 3 und Tabelle 1) zu sammeln. Verwaltung Zeit ist die ExperimeNTAL Variable, wie lange die Zielzellen werden mit den Testverbindungen ausgesetzt bestimmt. Die Länge der Applikationszeit kann auch verwendet werden, um Forderungen an spezifische Zelltypen oder Phasen der Spermatogenese Ziel. Zum Beispiel könnte eine einzelne tägliche Verabreichung verwendet werden, um die Wirkungen einer akuten Exposition auf einen bestimmten Zelltyp zu bestimmen. Ebenso kann die Exposition zu einer gesamten Spermatogenese Phase, indem sie auf nur meiotisch Division Spermatozyten oder mitotisch Division Spermatogonien mit einen 2-wöchigen Verabreichung Zeit und eine geeignete Probenahmezeit fokussiert werden, zum Beispiel. Chronische und subchronische Einnahmezeiten werden verwendet, um die Auswirkungen von Langzeitexposition zu bewerten, um eine ausreichende pharmakokinetischen Verteilung der Testverbindung zu gewährleisten, oder zulassen, ausreichende Akkumulation von Mutationen von schwach mutagen (zum Beispiel der 28-tägigen Verabreichung Zeit im OECD-Test empfohlen Richtlinie).
Abtastzeit ist die kritische Größe für die Bestimmung, bei derPhase der Spermatogenese die Zielzellen waren zum Zeitpunkt der Exposition. Die Probenahme bestimmt, wie viel Zeit und damit, wie viel weiter entlang der Spermatogenese Zyklus Zellen nach der Exposition durch geben. Zum Beispiel, um Effekte in der Stammzell Spermatogonien untersuchen, wurde ein Stichprobenzeit> 49 Tage, wenn das Sammeln ausgereifte Spermien erforderlich ist oder> 42 Tage, wenn das Sammeln unreifen Keimzellen aus den Samenleiter, um sicherzustellen, dass alle gesammelten Zellen haben genug Zeit zu haben entwickeln sich aus Stammzellen ausgesetzt. Es ist wichtig zu beachten, daß eine Probenahmezeit von mindestens 70 Tage wäre vorzuziehen, um eine echte Stammzellen Wirkung zeigen, um genügend Zeit für pharmakokinetische Verteilung des Giftstoffes zur Eliminierung von Zellen in späteren Phasen der Spermatogenese ausgesetzt sind, und zur Rechenschaft eine Zeit der vorübergehenden Sterilität, die nach Exposition mit hoch mutagenen Verbindungen 22 6 Wochen auftreten kann ~. Ebenso würde eine Stichprobenzeit von 21 Tagen, die Spermien zu gewährleisten Colleaus den Nebenhoden Cauda cted würde gerade erst abgeschlossen haben Meiose am letzten Tag der Exposition.
Keimzellen als reife Spermien der Cauda Epididymis oder als eine Mischung von verschiedenen Samenbildungszelltypen aus den Samenleiter gesammelt werden. Reifen Spermien bleiben in der Cauda für ~ 3 Tage, die es ermöglichen, relativ genau der Zelltyp oder die Phase der Spermatogenese, aus dem das Sperma stammt für einen bestimmten Versuchsanordnung zu bestimmen. So, die Analyse der Cauda Spermien ermöglicht eine sehr gezielte Untersuchungen von stadienspezifischen Mutationseffekte. Auf der anderen Seite, Zellsuspensionen aus den Samenkanälchen gesammelt enthalten eine Mischung aus verschiedenen Keimzelltypen in unterschiedlichen Phasen der Entwicklung, und bieten somit schlechtere Auflösung der Spermatogenese Phase, in der Mutationen entstanden. Außerdem Zellsuspensionen aus den Samenkanälchen erholt neigen dazu, eine Überrepräsentation von Spermatiden, gefolgt von Spermatozyten, und ver enthalteny wenige Spermatogonien und Stammzellen (diese Anteile werden durch abgestufte weiße Balken in Abbildung 3 dargestellt). Darüber hinaus können Suspensionen von den Samenkanälchen vorbereitet auch verschiedene Körperzellen enthalten. Somit, weil so viele Zelltypen vorhanden sind, Mutationseffekte können durch eine Vielzahl von Nicht-Zielzellen beeinflusst werden. Allerdings Sammeln von Proben aus Samenkanälchen bietet eine kostengünstige Option für die gleichzeitige Screening mehrere Keimzelltypen und einfache Integration von Keimzellanalyse in den OECD-Standardtestprotokoll für die somatische Mutation.
Um es zu wiederholen, je nach Bedarf des Prüfers, Verabreichungszeit, Abtastzeit und der gesammelten Zellpopulation kann eingestellt werden, um die Wirkungen der Exposition in verschiedenen Zelltypen und in verschiedenen Phasen der Spermatogenese abzufragen. Durch die sorgfältige Auswahl dieser Variablen können Experimente zur gezielten mechanistische Studien, oder für weitere allgemeine regulatorische Prüfung so gestaltet werdenZwecken.
Um Kenntnisse im Test erreichen, empfehlen wir den Einsatz einer akuten oralen Verabreichung von 100 mg / kg N-Ethyl-N-nitrosoharnstoff (DEU), gefolgt von einem 70 Tage Abtastzeit als Positivkontrolle. Analyse der Cauda Spermien so zielt Spermatogonien-Stammzellen (Abbildung 3), die typischerweise eine 4-5 fache Erhöhung der Mutationsrate (MF) gegenüber den Kontrollen nach dieser hoch mutagen Dosis DEU. Es sei darauf hingewiesen, dass diese Dosis ist bekannt, Sterilität induzieren 6 Wochen nach der Exposition werden, so kann es keine geeignete Kontrolldosis für kürzere Abtastzeiten werden. Diese Dosis wird auch produzieren eine erkennbare Zunahme in MF in den meisten somatischen Geweben 20. Die nachstehenden Ergebnisse wurden repräsentativ nach einer akuten Exposition +70 Schema mit drei Dosen von ENU bis einschließlich 100 mg / kg erzeugt.
Protokoll
Alle Protokolle mit Tierhaltung, Wartung und Handhabung wurden von Health Canada die Tierpflegekommission genehmigt.
1. Tier Exposures
- Zufällig verteilen transgenen männlichen Mäusen (8-12 Wochen alt) zu Gruppen und Behandlungsgruppen (min = 5 pro Gruppe) .Treat Mäuse mit Testverbindung und entsprechende Kontroll durch eine entsprechende Expositionspfad für das ausgewählte Administrationszeit steuern. Wählen Sie die entsprechende Probenahmezeit entsprechend der Spermatogenese Zelltyp von Interesse (Abbildung 3).
- Nach der Stichprobenzeit, einschläfern Mäuse durch Genickbruch unter Isofluran Anästhesie (oder andere geeignete Methode). Die Hoden vorsichtig ziehen von einem Einschnitt in den Bauch oder Hodensack und der Verbrauch der Cauda Nebenhoden. (Abbildung 4, zu sehen eine detaillierte Video von Nebenhoden Sammlung zu sehen Duselis et al. 24). Alternativ sammeln die Hoden, wenn die Analyse SamenkanälchenS-Zellen. Einfrieren in flüssigem Stickstoff und bei -80 ° C für die spätere Verwendung.
2. Isolierung und Verdauung von Cauda Sperma
- Auftauen Cauda Nebenhoden auf Eis. Die aufgetauten Cauda in eine Petrischale und gründlich mit einem Skalpell oder einer Rasierklinge Blatt vor den Mund.
- Hinzufügen 700 ul Raumtemperatur D-PBS in die Petrischale. Mit einem Weit Bohrung 1000 ul Pipettenspitze, Freigabe Spermien aus der Cauda durch Ziehen und Loslassen der Aussetzung, bis die D-PBS wird trüb mit Sperma (ca. 10 mal). HINWEIS: Um weiter Bohrung Pipettenspitze vorzubereiten geschnitten 2-3 mm vom Ende eines Kunststoffpipettenspitze.
- Filter Suspension durch ein Edelstahl-Sieb-Filter in ein frisches 1,5-ml-Tube. Waschen Sie die Petrischale mit einem zusätzlichen 700 ul D-PBS und Transfer zum gleichen 1,5-ml-Röhrchen durch die Mesh-Filter. Entfernen Mesh, das Röhrchen auf Eis.
- Wiederholen Sie die Schritte 2.1-2.3 für restlichen Proben.
- Spin samplesat 11.000 g für 3 min. Dekantieren Sie vorsichtig Stand. Vermeiden Sie das Pellet aufzurühren.
- 1,0 ml kaltem 1x Kochsalzlösung (SSC). Vortex, bis Pellet wird komplett neu aufgehängt. Dies wird manchmal mehrere Runden von Vortex.
- Werden 15 ul 10% SDS. Invert / kräftig schütteln für 30 Sekunden, um nicht-Samenzellen stören. Auch leichtes Schütteln wird in unzureichend Störungen führen und das Pellet nicht richtig im folgenden Schritt zu bilden.
- Spin bei 11.000 g für 2 min. Eine lockere, "fluffy" Pellet ist ein Hinweis auf unvollständige Störung der Körperzellen durch unzureichende Schütteln in Schritt 2.7. Wenn dies der Fall ist, einfach schütteln Sie die Probe wieder und Respin, bis ein fest Pellet gebildet. Dekantieren Sie vorsichtig Stand. Vermeiden Sie das Pellet aufzurühren. Noch einmal kurz drehen und entfernen verbleibende Überstand mit 200 ul Pipette.
- Fügen Sie 940 ul 0,2 x SSC und kalten Wirbels bis Pellet wird resuspendiert. Das Pellet kann sehr schwierig sein, erneut zu suspendieren und kann mehrere Runden von Vortex zu nehmen. Manchmal Klumpen von sDauerwelle sind unvermeidlich.
- Zugabe von 120 ul β-Mercaptoethanol, 100 ul 10% SDS, 20 ul 0,5 M EDTA, pH 8, und 20 ul Proteinase K (60 mg / ml, frisch hergestellt). Gut mischen und zu verdauen Nacht mit Rotation bei 37 ° C aufweist. Fahren Sie mit Phenol / Chloroform-Extraktion.
3. Phenol / Chloroform-Extraktion von DNA aus Cauda Sperma
HINWEIS: Da der Kern-DNA in der späten Phase Spermatiden und reife Spermien mit Protaminen komplexiert und ist im Vergleich zu der DNA von Körperzellen stark kondensiert, herkömmliche Nukleinsäureisolierung Methoden nicht erzeugen DNA mit ausreichender Ausbeute und Reinheit für die Mutation Assay zur Arbeit effizient. Mehrere Phenol-Chloroform-Extraktionen nach einer aggressiven Verdauung erforderlich sind, freizugeben und zu reinigen Sperma-DNA (basierend auf Methoden aus 15).
- Übertragungs Spermium verdauen in ein 15 ml Polypropylenröhrchen.
- 2 ml Phenol: Chloroform Gemisches (1: 1). Drehen Rohr bei 22 Umdrehungen pro Minutefür 3 min.
- Zentrifuge bei 1.600 g für 10 min und übertragen wässrige obere Schicht zusammen mit der Fuzzy-Grenzschicht zu einem frischen 15 ml Tube.
- Wiederholen Sie die Schritte 3.1.2 und 3.1.3 3x, aber die Änderung der Rotationszeiten bis 3 min, 4 min, 6 min, auf. Auf der letzten Wiederholung, vermeiden Sie die Übertragung einer der "Fuzzy"-Schnittstellenschicht.
- Nach der 4. Extraktion, fügen 70 ul 3 M NaAc, pH 5,2 1 ml wässriger Extrakt und 2 ml Chloroform: Isoamylalkohol (24: 1). Drehen Rohr bei 22 Umdrehungen pro Minute für 12 min.
- Zentrifuge bei 1.600 g für 10 min und übertragen wässrige obere Schicht in ein frisches 15-ml-Tube.
- Fällen DNA durch Zugabe von 2 Volumina absolutem Ethanol und sanft Drehen der Röhre auf seiner Seite mit sanfte Schaukeln.
- Sammeln von DNA-Spooling auf der Spitze eines wärmeversiegelt Weide Pipette. Spülen DNA durch Schwenken der Pipettenspitze in 70% Ethanol und Luft für 5 min.
- Nach der Extraktion lösen DNA-Niederschlag in 40 bis 100 ul Tris-EDTA-Puffer, pH 8. Lagerung bei 4 ° C. Damit der DNA bei 4 ° C für mindestens zwei Tage vor dem Fortschreiten zu lacZ Mutationstest lösen. Wenn Löslichkeit Probleme werden angetroffen, DNA kann weiter bei 65 ° C für 15 min vor der Verwendung aufgelöst werden. Bestimmung der Konzentration der DNA mit einem spectrophotometre bei A 260 und sicherzustellen, dass die Konzentration der gelösten DNA zwischen 200-2.000 ng / ul.
4. Isolierung und Verdauung von Keimzellen von Tubuli seminiferi
- Wenn gefroren, auftauen Hoden auf Eis (ca. 1 Stunde). Transfer Hoden auf eine Mattscheibe.
- Halten Sie ein Ende des Hodens mit einer Pinzette. Am anderen Ende des Hodens, Punktion eine Öffnung in der epithelialen Kapsel mit einer anderen Zange oder ein Paar Dissektion Schere (5A). Drücken Sie die Samenkanälchen durch die Punktion und entsorgen Sie die epithelialen Kapsel (5B).
- Eindd 500 ul Raumtemperatur D-PBS zu den decapsulated Samenkanälchen.
- Winkel eine Geweberolle, so daß ein Ende in Kontakt mit der Platte bei einem Winkel von ungefähr 5-10 ° (5C) (Silikongummi fest über eine frei drehende 5 mm Durchmesser-Edelstahlrohr oder einer ähnlichen Vorrichtung montiert). Ohne Druck auszuüben, sanft bewegen die Walze hin und her über den Tubuli, bis sie abgeflacht sind und die D-PBS wird trüb mit freigesetzten Zellen (etwa 5-10x).
- Einen weiteren hinzufügen 500 ul D-PBS in den Tubuli und sanft über den Tubuli rollen ein paar weitere Male.
- Übertragen der Zellsuspension in ein 1,5 ml Mikrozentrifugenröhrchen bei gleichzeitiger Minimierung der Menge an freistehende Röhrchen übertragen (Figur 5D).
- Wiederholen Sie die Schritte 4,5-4,6 mehr Zellen bei Bedarf zu sammeln.
- Dauert ca. 1 - 2 Minuten für alle versehentlich gesammelt Tubuli, auf den Boden des Röhrchens zu begleichen. Übertragen Sie die D-PBS auf eine fresh 1,5-ml-Röhrchen und hinterließ den abgesetzten Tubuli (ca. 100 ul von D-PBS). Ein kleines Aliquot dieser Suspension kann unter einem Mikroskop (Phasenkontrast) überprüft werden, um die Zusammensetzung der Zellpopulation zu bewerten.
- Spin-Down der Zellen bei 11.000 g für 30 sek. Dekantieren Sie vorsichtig den Überstand, ohne das Pellet zu stören. Das Zellpellet kann bei -80 ° C an dieser Stelle bei Bedarf eingefroren werden.
- Auftauen Zellen, falls erforderlich. Transfer in ein 15 ml Polypropylenröhrchen und Zellen in 5 ml Lysepuffer (10 mM Tris pH 7,6, 10 mM EDTA, 100 mM NaCl, 1 mg / ml Proteinase K, 1% SDS). Verdau über Nacht im Brutschrank mit Rotation bei 37 ° C aufweist.
- Fahren Sie mit Phenol / Chloroform-Extraktion.
5. Phenol / Chloroform-Extraktion von DNA aus Samenkanälchen Keimzellen
HINWEIS: Eine weniger aggressive Extraktion wird verwendet, um Samenkanälchen Keimzellen-DNA zu isolieren, da diese Zelltypen noch nicht fortgeschritten sind durch nuclear Kondensation.
- 5 ml Phenol: Chloroform Gemisches (1: 1) über Nacht Samenkanälchen Zellaufschluss. Drehen Rohr bei 22 Upm für 20 min.
- Zentrifuge bei 1.600 g für 10 min und übertragen wässrige obere Schicht, während die Vermeidung der "Fuzzy"-Schnittstellenschicht, in ein frisches 15-ml-Tube.
- 100 ul 5 M NaCl pro 5 ml wässriger Extrakt (normalerweise 5 ml zurückgewonnen wird)
- 5 ml Chloroform: Isoamylalkohol (24: 1). Drehen Rohr bei 22 Umdrehungen pro Minute für 12 min.
- Zentrifuge bei 1.600 g für 10 min und übertragen wässrige obere Schicht in ein frisches 15-ml-Tube.
- Fällen DNA durch Zugabe von 2 Volumina absolutem Ethanol und sanft rotierenden und Umkehren Röhren.
- Sammeln von DNA-Spooling auf der Spitze eines abgedichteten Weide Pipette. Spülen DNA durch Schwenken der Pipettenspitze in 70% Ethanol und Luft für 5 min.
- Auflösen DNA in 40-100 ul Tris-EDTA-Puffer, pH 8. Lagerung bei 4 ° C. Erlauben DNA bei 4 ° C für ein Minimum von zwei zu lösenTage, bevor Sie mit lacZ Mutationstest (siehe Schritt 3.9). Wenn Löslichkeit Probleme werden angetroffen, DNA kann weiter bei 65 ° C für 15 min vor der Verwendung aufgelöst werden. Bestimmung der Konzentration der DNA mit einem spectrophotometre bei A 260 und sicherzustellen, dass die Konzentration zwischen 200 und 2000 ng / ul.
6. LacZ Mutation Assay
Bakterielle oder Pilzkontamination kann mit Verpackungseffizienz sowie Plaquewachstum und Scoring stören. Es ist daher wichtig, den lacZ-Assay unter Verwendung der geeigneten aseptischen Maßnahmen zur Kontamination des Verpackungsreaktion, Wirtskultur und Wachstumsmedium zu verhindern, durchzuführen.
- Tag vor dem Test: Bereiten Bottom-Agar und-Nacht-Kultur
- Acht Platten (4 Platten, um Mutanten punkten, 4 Platten-Titer zählen) mit 8 ml Boden Agar jeweils pro Probe erforderlich ist (dh., 64 ml pro Probe). Der Boden-Agar ist für beidedie mutierten und Titer Count-Platten. Bereiten Sie ausreichend Boden-Agar für die Anzahl der Proben verarbeitet werden. Aseptisch gießen in 90 mm Petrischalen (8 ml pro Schale) und lassen Agar verfestigt. HINWEIS: Bottom-Agar-Platten bis zu 1 Woche im Voraus vorbereitet werden.
- In einem 50-ml-Röhrchen 10 ml LB-Medium wurden 100 ul 20% Maltose-Lösung, 25 ul Ampicillin (20 mg / ml) und 20 ul Kanamycin (5 mg / ml). Impfen mit E. coli (lacZ - / galE- -) 25 und über Nacht wachsen bei 37 ° C mit 240 rpm schütteln.
- Tag 1: Sub-Kulturzellen
- Teilkulturzellen durch Herstellung einer 1: 100 Verdünnung der Übernachtkultur in frischem LB (keine Antibiotika). Pro Probe ein Volumen von 8 ml Subkultur benötigt wird. Bei 37 ° C unter Schütteln bei 240 rpm für etwa 3,5 Stunden, bis die OD 600 = 1 ist.
- Bei OD 600 = 1, Division Zellsuspension gleichmäßig in 50-ml-Röhrchen und Zentrifugieren bei 1.300 × g bei 15 ° C für 10Minute Überstand entfernen und erneut zu suspendieren Zellen in die Hälfte des ursprünglichen Volumens (dh., 4 ml pro Probe) von LB, enthaltend 10 mM MgSO 4. Setzen Zellen beiseite, bis sie benötigt [Schritt 6.2.4.3].
- Tag 1: Verpackungs DNA in Lambda Phagenpartikel
- Aufwärmen im Wasserbad auf 30 ° C.
- Mit einem Weit Bohrung 10 ul Pipettenspitze, Transfer 4 ul DNA in ein 1,5-ml-Tube. HINWEIS: Dieser Schritt kann einen Tag oder mehr im Voraus durchgeführt werden, um die Vorbereitungszeit zu verringern.
- Wärm dich das erste Rohr (rot) aus einer Phagen-Verpackungsextrakt-Kit (1 Tube für je 2 Proben). Kurz drehen, um Extrakt auf dem Boden des Röhrchens zu sammeln.
- Übertragen 4,8 ul Packungsextrakt aus dem ersten Rohr zu der DNA-Probe und durch vorsichtiges Rühren mit der Pipettenspitze. Kurz Spin-Down-Proben in den Röhrchen. Inkubation für 1,5 Stunden in 30 ° C Wasserbad.
- Wärmen Sie den zweiten (blau) Verpackungsextrakt Rohr (1 Rohr für ~ 15 Proben). Kurz drehen, um Extrakt unten sammelnRohr.
- Übertragen 4,8 ul von Verpackungs Auszug aus der zweiten Röhre auf die DNA-Probe und mischen durch leichtes Rühren. Kurz Spin-Down-Proben in den Röhrchen. Inkubation für weitere 1,5 Stunden bei 30 ° C Wasserbad.
- Resuspendieren verpackten Phagen-Partikel in 500 ul SM-Puffer und Mischen durch Rotation für 30 min bei 20 Upm.
- Nach dem Drehen, kurz Wirbel Proben und Zentrifuge bei 11.000 g für 30 Sekunden, um Proben auf dem Boden des Röhrchen zu sammeln. Phagenpartikel sind bereit für eine Infektion [Schritt 6.2.4].
- Tag 1: Vorbereiten Top-Agar
- Bereiten separaten Top-Agar für die Mikrotiterplatten und mutierten Selektionsplatten. Jede Probe erfordert 4 Mikrotiterplatten und 4-Platten-Mutante. Jede Platte benötigt 8 ml Top-Agar. Hinzufügen des selektiven Agens Phenyl-β-D-galactopyranosid (Gal-P) an die Mutantenselektion Top-Agar allein. Bereiten Sie beide oben Nährböden im Voraus (Tag der Assay) und halten bei 50 ° C, bevor MgSO 4 auf beide oben Nährböden, und PGal, um die Auswahl Agar-Mutante.
- Tag 1: Infektion von Zellen mit verpackten Phagen und Oberflächen
- Beschriften Sie zwei 50-ml-Röhrchen je Probe: 1 "Mutante" Röhren pro Probe und 1 "Titer" tube pro Probe
- Label 8-Agar-Platten pro Probe: 4 "mutierten" Platten pro Probe und 4 "Titer" Platten pro Probe
- Aliquots von 2 ml resuspendiert Zellen [aus Schritt 6.2.1.2] in jedes Röhrchen.
- Fügen Sie 500 ul von verpackten Phagenpartikel [aus Schritt 6.2.2.8], um "mutierten" 50-ml-Tube (mit Zellen). Vorsichtig mischen und Phagenpartikel, um Zellen für 30 min bei Raumtemperatur infiziert.
- Nach 30 min Vortexen infizierten Zellen und übertragen 15 ul der infizierten Zellen, um die entsprechende 50-ml-"Titer" Röhre (enthaltend Zellen).
- Um Platte Titer Probe, 30 ml warmem (50 ° C) "Titer" Top-Agar (NICHT enthalten P-Gal), um "Titer" 50 ml Tube. Sofort distribute Agar / Zellgemisch unter den 4 "Titer"-Platten (~ 8 ml pro Platte). Arbeiten schnell, so dass der Top-Agar nicht in den Pipetten zu kühlen, und versuchen Sie nicht, um Luftblasen einzuführen.
- Plate Die "Mutanten" Proben nächsten. Stellen Sie sicher, P-Gal auf "Mutantenselektion" Top-Agar gegeben. 30 ml warm "Mutantenauswahl" Agar (mit P-Gal) auf "mutierten" 50 ml Tube. Sofort verteilen Agar / Zellgemisch unter den 4 "Mutant" Platten (~ 8 ml pro Platte).
- Platten erlauben, sich zu verfestigen (~ 15 min) dann invertieren und bei 37 ° C über Nacht.
- Tag 2: Zählung der Plaques
- Nach Inkubation über Nacht, zählen die Anzahl der Plaques auf den mutierten und Mikrotiterplatten. Für eine große Anzahl von Plaques, zählen nur einen Teil der Platte, um die Gesamtzahl zu schätzen (zB., Oft ¼ der Titer Platte wird zwischen 100-200 Plaques). Ein Minimum von 100 Plaques pro Platte sollte, wenn cou gezählt werdennting einen Abschnitt der Platte.
- Berechnen Sie die Anzahl der Plaque-bildenden Einheiten (PFU) pro ul der Zellen. Dies wird durch Teilen der Anzahl von Plaques auf den "Titer" Platten durch das Volumen der Zellen ausplattiert (15 ul) durchgeführt.
- Verwenden Sie die Anzahl der PFUs / ul, um die Gesamtzahl der in der PFUs Gesamtvolumen von infizierten Zellen auf den "Mutanten"-Platten (PFU / ul * vernickelt schätzen [2 ml Zellen + 0,5 ml Phagenpartikel verpackt - 15 ul für Mikrotiterplatten] ).
- Schätzen Sie die MF, indem die Gesamtzahl der mutierten Plaques auf den 4 "mutierten" Platten durch die geschätzte Gesamtzahl der PFUs im Gesamtvolumen von infizierten Zellen aus den "Titer" Platten bestimmt gezählt.
- Wenn die spontane lacZ MF ist in der Größenordnung von 3 x 10 -5 in der Kontrollgruppe, wie es für MutaMouse Keimzellen, empfiehlt die OECD-Richtlinie ein Minimum von 125.000 bis 300.000 nicht-mutierten PFUs pro Tier sein Bildschirmed für die Mutation, um einen zuverlässigen Ausgangssignal zu erhalten. Andere transgene Modelle können niedrigere spontane MF, wobei in diesem Fall eine größere Anzahl von PFU erforderlich wäre. Eine statistische Power-Test kann, um die Mindestanzahl von PFU und Tiere erforderlich ist, um die gewünschte Auflösung zu erzielen bestimmen durchgeführt werden. Daten aus mehreren Wiederholungen können gepoolt werden, um diese Anforderung zu erfüllen Mindest PFU, sofern sie nicht signifikant unterschiedlich mutierten Frequenzen zu erzeugen.
7. Statistik
Das Versuchsgerät für die Analyse ist die Maus. Mit diesem Test erzeugten Daten werden in der Regel nicht normal verteilt sind. Als solche wählen statistische Methode zur Analyse auf der Basis der Verteilungscharakteristik der Daten.
HINWEIS: Standard metrische Analysen (. ZB ANOVA) verwendet, wenn entsprechende Datentransformation angewandt wird, um die Varianz der Reaktion in dem Bereich von Beobachtungen auszugleichention. Poisson oder binomische Regressionsanalysen sind oft besser geeignet. Nichtparametrische Analyse kann auch verwendet werden. Wir routinemäßig einzusetzen Poisson-Regression mit der verallgemeinerten linearen Modells Verfahren (dh., Proc GENMOD) in SAS v.9.2 (SAS Institute, Cary, NC), wie von Lemieux et al 26 beschrieben.
Ergebnisse
Mit einer Durchschnittszahl von 200.000 Plaque Plaques pro Tier, die wir in der Regel beobachten eine mittlere Hintergrund MF von rund 2,8 x 10 -5 in männlichen Keimzellen mit einer Standardabweichung von 1,7 x 10 -5 in unserem Kontrollgruppen (basierend auf Daten von acht unabhängigen Experimente). Mit dieser Plakette Zahl, Hintergrundniveau und Varianz, Dosisgruppen mit n = 5 Tiere jeder ausreichend sind, um eine 2-fache Erhöhung der MF mit Strom> 0,8 zu erkennen.
Die Ergebnisse werden in der Regel in tabellarischer oder grafischer Form berichtet. Tabelle 2 und Abbildung 6 zeigen repräsentative Ergebnisse von Cauda Sperma MutaMouse Männer (n = 5 pro Gruppe) zu einem einzigen akuten oralen Dosis von 0, 25, 50 ausgesetzt, und 100 mg / kg N-Ethyl-N-nitrosoharnstoff (ENU), gefolgt von einer 70 Tage Abtastzeit. Diese 70 Tage Zeit erlaubt die Messung der Mutationsereignisse, die in Spermien, die Spermatogonien-Stammzellen bei der Exposition waren aufgetreten ist (Abbildung 3). Typische Plaquedichten auf mutierten und Titerplatten sind in 7 gezeigt. Wie in Tabelle 2 und Figur 6 dargestellt, akute Exposition ENU induzierten eine signifikante dosisabhängige Erhöhung der MF Stammsamenzellen. Die niedrige Dosis induzierte eine signifikante 2,6-fache Erhöhung gegenüber den Kontrollen, die eine Grundlinie von 2,6 MF x 10 -5 hatte. Maximale Induktion trat bei der höchsten Dosis, die eine 4,4-fache Zunahme gegenüber Kontrollen ausgelöst.
Ein Beispiel für diesen Test auf Samenkanälchens Keimzellen durchgeführt in Douglas et al. 27, wobei MF in Röhrchen Keimzellen in verschiedenen Zeitintervallen nach einer 5-tägigen Wiederholungs intraperitoneale Injektion von 50 mg / kg bestimmt ENU gefunden werden. In dieser Studie, die Mutantenhäufigkeit in seminiferi Zellen um bis zu 15 Tage nach der Behandlung und blieb danach konstant.
| Exposicher Regime | Gesammelte Gewebe | Die gesammelten Zelltyp (Zielzelle) | Phase der Zielzelle zu Beginn des Belichtungs | Phasen während der Belichtung weitergegeben |
| Akute + 70 | Cauda | Reifen Spermien | Stammzell | Stammzell |
| 14 + 21 | Cauda | Reifen Spermien | Spermatogonien | Spermatid |
| 14 + 35 | Cauda | Reifen Spermien | Stammzell | Spermatocyte |
| 28 + 3 | Cauda | Reifen Spermien | Spermatocyte | Spermatocyte Spermatid Reifen Spermien |
| Tubuli | Stammzell | Stammzell | Stammzell | |
| Spermatogonien | Spermatogonia | Spermatogonien | ||
| Spermatocyte | Spermatocyte | |||
| Spermatid | Spermatid | |||
| 28 + 49 | Cauda | Reifen Spermien | Stamm cel | Stammzell |
| Tubuli | Stammzell Spermatogonien Spermatocyte Spermatid | Stammzell | Stammzell |
Tabelle 1 Zelltypen und Phasen der Spermatogenese, die von der transgenen Nager-Mutationstest von verschiedenen Versuchsanordnungen ausgerichtet sind.
| Dosisgruppe | Tier # | Mutant PFU | Gesamt PFU | MF (x10 -5) | Avg MF (x 10 -5) | Fache Veränderung | p-Wert |
| Kontrolle | 1 | 5 | 180.245 | 2.8 | 2.6 | 1.0 | - |
| 2 | 4 | 137835 | 2.9 | ||||
| 3 | 11 | 385672 | 2.9 | ||||
| 4 | 2 | 431.396 | 0,5 | ||||
| 5 | 6 | 152413 | 3.9 | ||||
| 25 mg / kg | 6 | 17 | 162.353 | 10.5 | 6.9 | 2.6 | 0,0002 |
| 7 | 14 | 150094 | 9.3 | ||||
| 8 | 4 | 154.401 | 2.6 | ||||
| 9 | 9 | 154.401 | 5.8 | ||||
| 10 | 12 | 196978 | 6.1 | ||||
| 50 mg / kg | 11 | 17 | 155.727 | 10,9 | 9.3 | 3.6 | <0.0001 |
| 12 | 11 | 135847 | 8.1 | ||||
| 13 | 25 | 193.499 | 12,9 | ||||
| 14 | 12 | 133.859 | 9.0 | ||||
| 15 | 14 | 252807 | 5.5 | ||||
| 100 mg / kg | 16 | 26 | 170968 | 15.2 | 11,5 | 4.4 | <0.0001 |
| 17 | 28 | 234.584 | 11,9 | ||||
| 18 | 10 | 145289 | 6.9 | ||||
| 19 | 35 | 292236 | 12,0 | ||||
| 20 | 22 | 190.848 | 11,5 |
Tabelle 2. Die lacZ Mutantenhäufigkeit in Cauda Spermien von transgenen männlichen mEis akut um DEU ausgesetzt, wenn sie Stammsamenzellen (Verwaltungszeit = 1 Tag, Probenahmezeit = 70 Tage) waren. PFU = Plaque-bildenden Einheit, MF = Mutationsrate.
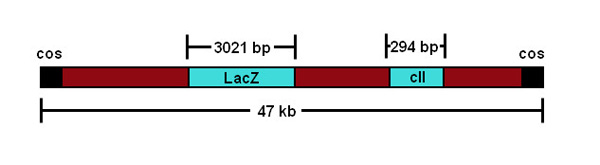
Figur 1 Eine schematische Darstellung des gt10 Phagenkonstrukt.
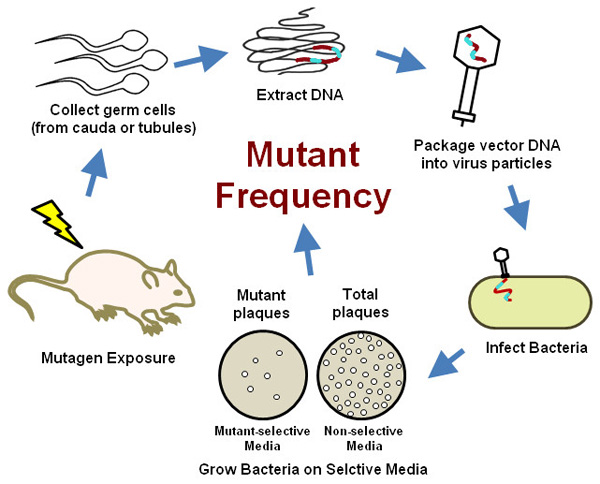
Abbildung 2. Übersicht der transgenen Nager Keimzellmutationstest.
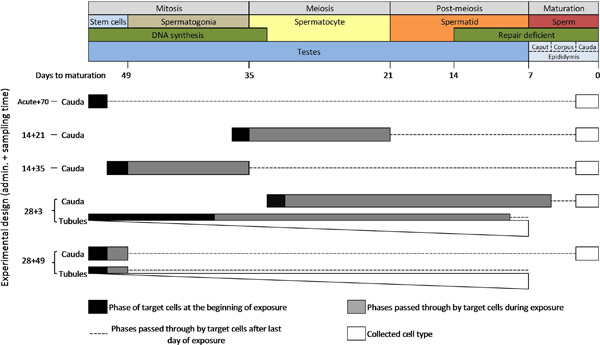
Figur 3 Eine schematische Darstellung der Spermatogenese bei der Maus und die Zelltypen und PHAses, die von der transgenen Nager Mutationstest durch verschiedene experimentelle Designs ausgerichtet sind. HINWEIS: Die weißen Balken repräsentieren absolvierte den relativen Anteil von Zelltypen in Zellsuspensionen aus den Samenkanälchen bereiteten (dh Spermatiden> Spermatozyten> Spermatogonien> Stammzellen). Bitte Klicken Sie hier, um eine größere Version dieser Figur zu sehen.
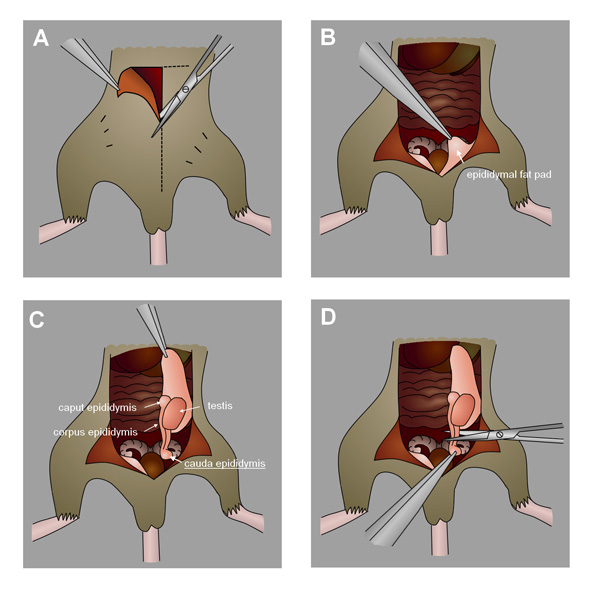
Abbildung 4. Sammlung der Maus Cauda Nebenhoden. A) Einen Einschnitt in den Bauch in Richtung Hodensack. B) Identifizieren Sie die Nebenhodenfettpolster. C) Ziehen Sie die Fettpolster zu ziehen die Hoden und Nebenhoden. D) und die Verbrauch der Cauda Nebenhoden.
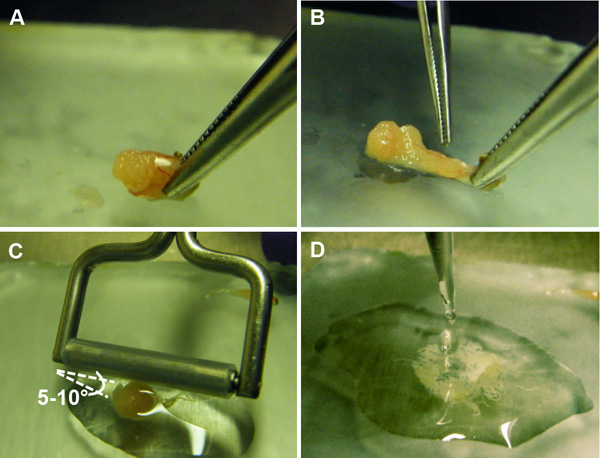
Abbildung 5. Vorbereitung der Aussetzung der Keimzellen aus den Samenleiter. A) ein Schnitt in der epithelialen Kapsel der Hoden hergestellt, Aussetzen der samenführenden Tubuli. B) die Samenleiter werden aus der Kapsel. C) Gewebewalze sanft über den Tubuli geleitet gequetscht bei 5-10 ° Winkel Lösen der Keimzellen innerhalb. D enthielt) Die Keimzellsuspension wird für eine weitere Verarbeitung gesammelt.
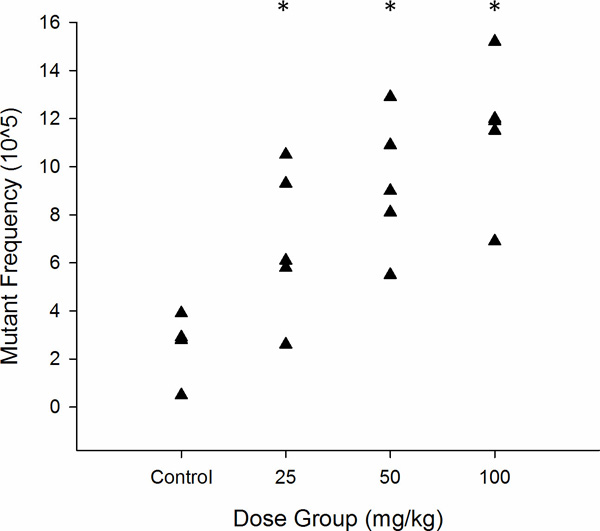
Abbildung 6. Grafische Darstellung der lacZ Mutantenhäufigkeit in MutaMouse Spermien akut wie Stammzellen ausgesetzt ENU (n = 5). JederDreieck steht für die MF von einem Tier. * p <0,05, wie durch Poisson-Regression ermittelt.
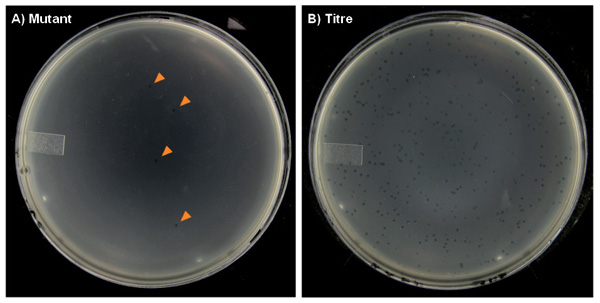
Abbildung 7. Repräsentative Agar-Platten aus der transgenen Nager Mutationstest mit Plaques auf einem Rasen von E. gebildet coli Wirtsbakterien. A) Die "Mutanten"-Platten nur sehr wenige Plaques (mit Pfeilen markiert), insbesondere in den Steuerdosisgruppen, die gelegentlich Null Plaques auf einigen Platten. B) Die "Titer" Platten können Hunderte von Plaques haben.
Diskussion
Im Vergleich zu herkömmlichen Methoden bietet die TGR Keimzellmutationstest eine schnellere, wirtschaftlichere und empfindlicher Mittel zur Quantifizierung Keimzellen in vivo Mutationen induziert. Durch die Bewertung Transgen MF direkt im Sperma, im Gegensatz zu Nachkommen, die Anzahl der Tiere, die Zeit und erforderlich, um die Keimbahn Mutagenität von jeder einzelnen Verbindung beurteilen Ressourcen deutlich reduziert. In Bezug auf die Empfindlichkeit, konnten wir eine signifikante 2,6 fache Erhöhung der Spermatogonien Stammzellen MF nach Exposition mit 25 mg / kg ENU mit nur 5 Tiere pro Dosisgruppe zu erkennen. Im Gegensatz dazu die spezifischen Locus-Test konnte keine signifikante Veränderung der MF an dieser gleiche Dosis mit> 3.000 Mäuse in der exponierten Gruppe und> 500.000 Kontrollmäusen 28 zu erkennen.
Zusätzlich zu seiner Eignung für beide mechanistischen und behördlichen Untersuchungen, bietet diese Methode eine Chance für vergleichende Studien zwischen somatischen und Keimbahn Mutatiauf Raten. Aktuelle Hinweise darauf, dass für einige Agenten Keimzellmutationen können bei niedrigerer Konzentration als für somatische Mutation erforderlich induziert werden. Zum Beispiel längerer N-Hydroxymethylacrylamid, ein Metabolit von der Lebensmittel Karzinogen Acrylamid 12, erhöht sich die Frequenz der dominanten tödliche Keimzellmutationen bei Mäusen ohne die Mikrokernfrequenz in den roten Blutkörperchen, ein traditionelles Maß für somatische Zell zytogenetische Schäden 13. Zusätzlich Exposition von Mäusen zu beiden Mainstream-und Nebenstromtabakrauch Ursachen erhöhte Mutationshäufigkeiten bei Tandem-Repeat-DNA-Loci im Sperma bei Dosen, die nicht Blutmikrokernfrequenz 14 erhöhen müssen. Diese Ergebnisse stellen die Annahme, dass somatische Genotoxizität ist immer Schutz der Keimbahn, und verstärken die Nachfrage nach einer effizienteren und kostengünstiges Mittel, um Keimzellmutationsfrequenz zu quantifizieren. Allerdings ist der Nachweis für die bevorzugte Keimzellmutagene noch schwach, Vor allem wegen des Mangels an verfügbaren Daten für den Vergleich von Mutationsraten in der somatischen und Keimzellgewebe. Die TGR Mutation Assay ermöglicht die parallele Prüfung und Vergleich der induzierten Mutationsraten in mehreren Geweben unter Verwendung der gleichen Transgens. So testen Vergleichs Mutation mit der TGR-Test würde helfen, Datenlücken zu füllen um die Möglichkeit von Präferenz Auswirkungen auf Keimzellen.
Gleichzeitige Beurteilung der somatischen und Keimzelle für regulatorische Mutation Test würde auch die Effizienz zu verbessern, indem die Anzahl der Tiere erforderlich. Die OECD-Richtlinie für die somatische Mutation empfiehlt einen 28-tägigen Verabreichung Zeit, gefolgt von einer dreitägigen Probenahmezeit (28 + 3). Analyse der Cauda Spermien geringe Empfindlichkeit zu diesem Zeitpunkt bieten, da sie meist in den Zellen Spermatozyten und Spermatiden Phasen der Spermatogenese (Abbildung 3) ausgesetzt abzielt. Zellen in diesen Phasen nicht synthetisieren DNA und schrittweise verlieren ihre Fähigkeit zur DNA-Reparatur-6 </ Sup>. Außerdem würde Probenahme Cauda Spermien zu diesem Zeitpunkt nicht zu Mutationen in Spermatogonien und Stammzellen auftreten zu erkennen. So ist die Integration in die 28 + 3 Design, empfiehlt die OECD-Richtlinie Sammeln Keimzellen aus den Samenleiter. Diese gemischte Population enthält Zellen, die aus der DNA-Synthese und Reparatur beherrschen Zelltypen, einschließlich Stammzellen abgeleitet und über den Großteil der Spermatogenese Phasen ausgesetzt. Jedoch wegen der gemischten Charakter dieser Zellen, Samenleiter Zellanalyse bietet keine phasenspezifischen Informationen. Darüber hinaus gibt es die Sorge, dass die Anwesenheit von Nicht-Zielzellen können die beobachteten MF beeinflussen (zB falsch positive Keimzellenmutagen Anrufe durch Verschmutzung von mutierten Körperzellen, oder Verdünnung eines mutierten Keimzelle Signal von DNA-Reparatur-defizienten Keimzellen) . Derzeit gibt es keine ausreichenden Daten zu dem Schluss, ob die Ergebnisse von Samenkanälchen Zellen bei 28 + 3 bieten die gleiche Sensitivität und Spezifität eins Cauda Spermien zu späteren Zeitpunkten. Unser Labor ist derzeit Vergleich induzierten Marktfaktoren in Samenkanälchen Zellen und Spermien der Cauda nach verschiedenen Probenahmezeiten gesammelt, um diesen Punkt eingehen. Wir stellen fest, dass der OECD-Richtlinie schlägt eine alternative Abtastzeit von 28 Tagen langsam teil Geweben wie der Leber, die auch für die Keimzellanalyse sein kann. Dennoch ist immer noch unzureichend verfügbaren Daten, und wir sind derzeit nicht in der Lage, eine einzige experimentelle Design für die gleichzeitige Analyse von Körperzellen und Keimzellen mit der TGR-Mutationstest für regulatorische Prüfung zu empfehlen.
Eine Charakteristik dieses Assays, die beachtet werden sollte, ist, daß Mutationsereignisse werden auf einem nicht-transgene Mäuse bewertet. Jedoch gibt es zahlreiche Beweise dafür, dass das Transgen reagiert auf Umwelt Mutagene in einer ähnlichen Weise, um endogene Gene 20. Zusätzlich, da die genauen Ursachen von unabhängigen Mutationsereignisse sind schwerbeheben, werden die Ergebnisse im allgemeinen als ein Mutantenfrequenz (im Gegensatz zu einer Mutationsfrequenz) angegeben. Die tatsächliche Mutationsfrequenz kann gelöst werden, wenn die Ergebnisse für die klonale Expansion (dh. Der Division und Multiplikation eines einzelnen mutierten Zelle, die zu der beobachteten Häufigkeit von Mutanten Transgen tragen kann), die durch DNA-Sequenzierung korrigiert. Die Sequenzierung der mutierten Transgenen kann durchgeführt werden, um die lacZ-Mutationen zu charakterisieren und zu identifizieren, die Mutanten von klonalen Expansion Ereignissen abgeleitet werden kann, obwohl dies trägt wesentlich zu der Zeit und den Kosten der Analyse. Neben dem lacZ-Gen, theλgt10 transgenen Vektor beherbergt eine alternative temperaturabhängigen mutations Reportergen: eine Variante des λ CII-Gen, das kürzere (294 bp vs das 3021 bp lacZ, Abbildung 1) und leichter zu sequenzieren 29 ist. Sequenzierung erlaubt auch die Analyse der induzierten Mutationsspektrum, die einen Einblick in die mutational Mechanismus der Verbindung in Frage. Ein extremes Beispiel für klonalen Expansion ist das Auftreten eines "Jackpot"-Mutation (dh., Transmutationen in einem sehr frühen Stadium der Entwicklung eines Organs, die zu einer dramatisch erhöhten MF beitragen, manchmal hunderte bis tausende Male größer als Hintergrund). Tiere oder Gewebe mit einem "Jackpot"-Mutation sollte aus der Analyse entfernt werden.
Der Test, die wir beschrieben haben, ist breit anwendbar auf andere TGR-Modellen wie dem BigBlue Maus und Ratte, und der lacZ-Plasmid-Maus, die alle ähnliche Mutation Hafen Reporter-Vektoren (in 20 überprüft). Die große Mehrheit der Keimzelle Studien bis heute durchgeführt, die ähnliche Methoden verwenden fast ausschließlich auf gut charakterisiert Mutagenen, wie DEU-und Strahlentherapie (in 30 prüft) konzentriert. Es wird erwartet, dass mit der jüngsten Veröffentlichung des OECD-Prüfrichtlinie für die TGR-Test, dieser Test wirdimmer beliebter für chemische Screening und regulatorische Bewertung. Einbeziehung der TGR Keimzellmutationstest in einen Regelungstestbatterie wird die bestehende Lücke durch die eine effiziente Bewertung der Mutation Induktion in Keimzellen 11 zu füllen. Darüber hinaus kann dieser Assay verwendet werden, um MF in nahezu jedem Gewebe zu messen, die eine geeignete Einrichtung zum Vergleichen der relativen Empfindlichkeiten der somatischen Zellen und Keimzellen auf die Induktion von Mutationen, die durch Umwelteinflüsse in identischen genetischen Endpunkten werden.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
This research was funded by the Canadian Regulatory System for Biotechnology (CRSB) and Chemicals Management Plan (CMP) initiatives.
Materialien
| Name | Company | Catalog Number | Comments |
| MutaMouse | Covance | - | |
| E. coli (lacZ-/galE-) | Covance | - | See reference 25 in manuscript |
| Chloroform | Caledon | 3001-2-40 | |
| Dulbecco's phosphate-buffered saline (D-PBS) | Gibco | 14190-250 | |
| Ethylenediaminetetraacetic acid (EDTA), 0.5 M, pH 8 | Sigma-Aldrich | 03690 FLUKA | |
| Isoamyl alcohol | Caledon | 2/10/7900 | |
| Lennon LB broth base | Invitrogen | 12780-029 | |
| Stainless steel mesh filter | Sigma-Aldrich | S3770 | |
| Transpack packaging extract | Agilent Technologies | 200220 | |
| β-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Ethyl alcohol, anhydrous (EtOH) | Commercial Alcohols | - | |
| Ampicilin | Gibco | 11593-027 | prepare 20 mg/ml in dH2O |
| Kanamycin | Gibco | 11815-024 | prepare 5 mg/ml in dH2O |
| Phenol | Invitrogen | 15509-097 | Saturate in 0.1 M Tris-HCl as per manufacturers direction |
| Phenyl-β-D-galactopyranoside (P-Gal) | Sigma-Aldrich | P6501 | dissolve 3 g per 10 ml of dimethylformamide |
| Proteinase K | Invitrogen | 25530-031 | prepare 60 mg/ml solution dH2O just before use, 20 µl per sample |
| Sodium acetate (NaAc) | Fisher Scientific | BP333-500 | prepare 3 M solutution, pH 5.2 |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L4390 | prepare 10% solution in dH2O |
| 1 M MgSO4 | 24.6 g MgSO4·7H2O per 100 ml dH2O, autoclave, store at room temperature up to 1 year | ||
| LB Broth | 5.0 g LB base, 6.4 g NaCl per 1 L dH2O. Autoclave and cool | ||
| Saline sodium citrate (SSC) | 150 mM NaCl, 15 mM trisodium citrate, pH 7.0 | ||
| SM Buffer | 5.8 g NaCl, 2.0 g MgSO4·7H2O, 50 ml 1 M Tris-HCl (pH 7.5), 5.0 ml of gelatin (2% w/v), per 1 L dH2O, autoclave, store at room temperature up to 1 year | ||
| TE buffer | 10 mM Tris, 1 mM EDTA, pH 8 |
Referenzen
- Ahmadi, A., Ng, S. C. Fertilizing ability of DNA-damaged spermatozoa. J. Exp. Zool. 284 (6), 696-704 (1999).
- Crow, J. F. The origins, patterns and implications of human spontaneous mutation. Nat. Rev. Genet. 1 (1), 40-47 (2000).
- Nelson, K., Holmes, L. B. Malformations due to presumed spontaneous mutations in newborn infants. N. Engl. J. Med. 320 (1), 19-23 (1989).
- Kong, A., et al. Rate of de novo mutations and the importance of father's age to disease risk. Nature. 488 (7412), 471-475 (2012).
- Michaelson, J. J., et al. Whole-genome sequencing in autism identifies hot spots for de novo germline mutation. Cell. 151 (7), 1431-1442 (2012).
- Marchetti, F., Wyrobek, A. J. DNA repair decline during mouse spermiogenesis results in the accumulation of heritable DNA damage. DNA Repair (Amst). 7 (4), 572-581 (2008).
- Marchetti, F., Wyrobek, A. J. Mechanisms and consequences of paternally-transmitted chromosomal abnormalities. Birth Defects Res. C. Embryo. Today. 75 (2), 112-129 (2005).
- Demarini, D. M. Declaring the existence of human germ-cell mutagens. Environ. Mol. Mutagen. 53 (3), 166-172 (2012).
- Epstein, S. S. Use of the dominant-lethal test to detect genetic activity of environmental chemicals. Environ. Health. Perspect. 6, 23-26 (1973).
- Russell, W. L. X-ray-induced mutations in mice. Cold Spring Harb. Symp. Quant. Biol. 16, 327-336 (1951).
- Singer, T. M., Yauk, C. L. Germ cell mutagens: Risk assessment challenges in the 21st century. Environ. Mol. Mutagen. 51 (8-9), 919-928 (2010).
- Tareke, E., Rydberg, P., Karlsson, P., Eriksson, S., Tornqvist, M. Acrylamide: A cooking carcinogen. Chem. Res. Toxicol. 13 (6), 517-522 (2000).
- Witt, K. L., et al. Mouse bone marrow micronucleus test results do not predict the germ cell mutagenicity of N-hydroxymethylacrylamide in the mouse dominant lethal assay. Environ. Mol. Mutagen. 41 (2), 111-120 (2003).
- Marchetti, F., Rowan-Carroll, A., Williams, A., Polyzos, A., Berndt-Weis, M. L., Yauk, C. L. Sidestream tobacco smoke is a male germ cell mutagen. Proc. Natl. Acad. Sci. U.S.A. 108 (31), 12811-12814 (2011).
- Yauk, C. L., Dubrova, Y. E., Grant, G. R., Jeffreys, A. J. A novel single molecule analysis of spontaneous and radiation-induced mutation at a mouse tandem repeat locus. Mutat. Res. 500 (1-2), 147-156 (2002).
- Niwa, O. Indirect mechanisms of genomic instability and the biological significance of mutations at tandem repeat loci. Mutat. Res. 598 (1-2), 61-72 (2006).
- Campbell, C. D., et al. Estimating the human mutation rate using autozygosity in a founder population. Nat. Genet. 44 (11), 1277-1281 (2012).
- Beal, M. A., Glenn, T. C., Somers, C. M. Whole genome sequencing for quantifying germline mutation frequency in humans and model species: Cautious optimism. Mutat. Res. 750 (2), 96-106 (2012).
- Shwed, P. S., Crosthwait, J., Douglas, G. R., Seligy, V. L. Characterisation of MutaMouse lambdagt10-lacZ transgene: Evidence for in vivo rearrangements. Mutagenesis. 25 (6), 609-616 (2010).
- Lambert, I. B., Singer, T. M., Boucher, S. E., Douglas, G. R. Detailed review of transgenic rodent mutation assays. Mutat. Res. 590 (1-3), 1-280 (2005).
- OECD. . OECD Guideline for the testing of chemicals: Transgenic rodent somatic and germ cell gene mutation assays. , (2011).
- Rodriguez, M., Panda, B. B., Ficsor, G. Testes weight reflect ethylnitrosourea induced histopathology in mice. Toxicol. Lett. 17 (1-2), 77-80 (1983).
- Russell, L. B. Effects of male germ-cell stage on the frequency, nature, and spectrum of induced specific-locus mutations in the mouse. Genetica. 122 (1), 25-36 (2004).
- Duselis, A. R., Vrana, P. B. Harvesting sperm and artificial insemination of mice. J. Vis. Exp. (3), 184 (2007).
- Gossen, J. A., Molijn, A. C., Douglas, G. R., Vijg, J. Application of galactose-sensitive E. coli strains as selective hosts for LacZ- plasmids. Nucleic Acids Res. 20 (12), 3254 (1992).
- Lemieux, C. L., et al. Simultaneous measurement of benzo[a]pyrene-induced pig-a and lacZ mutations, micronuclei and DNA adducts in muta mouse. Environ. Mol. Mutagen. 52 (9), 756-765 (2011).
- Douglas, G. R., Jiao, J., Gingerich, J. D., Gossen, J. A., Soper, L. M. Temporal and molecular characteristics of mutations induced by ethylnitrosourea in germ cells isolated from seminiferous tubules and in spermatozoa of lacZ transgenic mice. Proc. Natl. Acad. Sci. U.S.A. 92 (16), 7485-7489 (1995).
- Russell, W. L., Hunsicker, P. R., Raymer, G. D., Steele, M. H., Stelzner, K. F., Thompson, H. M. Dose--response curve for ethylnitrosourea-induced specific-locus mutations in mouse spermatogonia. Proc. Natl. Acad. Sci. U.S.A. 79 (11), 3589-3591 (1982).
- Swiger, R. R., Cosentino, L., Shima, N., Bielas, J. H., Cruz-Munoz, W., Heddle, J. A. The cII locus in the MutaMouse system. Environ. Mol. Mutagen. 34 (2-3), 201-207 (1999).
- Singer, T. M., Lambert, I. B., Williams, A., Douglas, G. R., Yauk, C. L. Detection of induced male germline mutation: Correlations and comparisons between traditional germline mutation assays, transgenic rodent assays and expanded simple tandem repeat instability assays. Mutat. Res. 598 (1-2), 164-193 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten