Method Article
Flach platt Klima angehoben Plattform: Eine neue Methode zur Kombination von Verhalten mit Mikroskopie oder Elektrophysiologie auf Awake frei bewegen Nagetiere
In diesem Artikel
Zusammenfassung
Diese Methode erstellt eine greifbare, vertraute Umgebung für die Maus zu navigieren und zu erkunden während der mikroskopischen Abbildung oder Einzelzellelektrophysiologischen Ableitungen, die feste Fixierung des Kopfes des Tieres verlangen.
Zusammenfassung
Es ist allgemein anerkannt, dass die Verwendung der Vollnarkose kann die Relevanz der aus einem lebenden Tier Gehirn erhalten oder elektromikroskopische Daten zu untergraben. Darüber hinaus ist die lange aus der Narkose begrenzt die Häufigkeit wiederholter Aufnahme / Bild Episoden in Längsschnittstudien. Daher sind neue Methoden, die stabile Aufnahmen von nicht-narkotisierten Mäusen Verhaltensweisen erlauben würde erwartet, dass die Felder von Mobilfunk-und kognitiven Neurowissenschaften zu fördern. Bestehende Lösungen reichen von der bloßen körperlichen Zwanges, um anspruchsvollere Ansätze wie Linear-und Kugellaufbänder in Kombination mit computergenerierten virtuellen Realität eingesetzt. Hier wird eine neue Methode beschrieben, bei dem ein Kopf-Fest Maus kann um eine Klima angehoben Mobil homecage bewegen und erkunden Sie die Umgebung unter stressfreien Bedingungen. Diese Methode ermöglicht es Forschern, Verhaltenstests (zB Lernen, Gewöhnung oder neuartige Objekterkennung) gleichzeitig mit führenZwei-Photonen-mikroskopische Bildgebung und / oder Patch-Clamp-Aufzeichnungen, die alle in einem einzigen Experiment kombiniert. Dieses Video-Artikel beschreibt die Verwendung des wachen Tier Kopf-Fixierung Gerät (Mobil homecage), zeigt die Verfahren der Tier Gewöhnung, und veranschaulicht eine Reihe von möglichen Anwendungen des Verfahrens.
Einleitung
Ein spannender neuer Trend in den Neurowissenschaften ist es, experimentelle Ansätze für die molekulare und zelluläre Untersuchung der neuronalen Netzwerke im Gehirn wach, verhalten Nagetiere zu entwickeln. Solche Ansätze halten versprechen, neues Licht auf die neurophysiologischen Prozesse, die motorische Funktion, sensomotorische Integration, Wahrnehmung, Lernen, Gedächtnis, sowie Verletzungen Progression, Neurodegeneration und genetische Krankheiten zugrunde liegen, zu vergießen. Darüber hinaus die Aufnahme von wachen Tier Gehirn hält Versprechen in der Entwicklung von neuen therapeutischen Mittel und Behandlungen.
Es gibt ein wachsendes Bewusstsein, dass der Anästhesie, die üblicherweise in der neurophysiologischen Experimenten verwendet wurde, können die grundlegenden Mechanismen der Hirnfunktion beeinflussen, möglicherweise zu einer fehlerhaften Interpretation von experimentellen Ergebnissen führt. So die weit verbreitete Betäubungsmittel Ketamin schnell zu Bildung neuer dendritischen Dornen und verbessert die synaptische Funktion 1; weitere häufig verwendet anesthetic Isofluran-Narkose bei chirurgischen Ebenen komplett unterdrückt spontane kortikale Aktivität bei neugeborenen Ratten und Blöcke Spindel-Burst-Schwingungen in zwei erwachsenen Tieren. Derzeit wird nur eine begrenzte Anzahl von Ansätzen ermöglichen Experimente in nicht narkotisierten Mäusen durch Zwei-Photonen-mikroskopische Bildgebung oder Patch-Clamp-Aufnahmen. Diese Ansätze können in frei beweglichen Kopf und fixierte Präparate aufgeteilt werden.
Die einzigartige Attraktivität eines frei beweglichen Tier Zubereitung besteht darin, dass die Bewertung natürlicher Verhalten, einschließlich Ganzkörperbewegungen während der Fahrt. Ein Weg, um Bild im Gehirn eines sich frei bewegenden Nagetier ist ein miniaturisiertes Head-Mounted-Mikroskop oder Endoskop 3-5 befestigen. Miniaturisierte Vorrichtungen neigen jedoch dazu, begrenzte optische Leistung im Vergleich zur Ziel-basierten Zwei-Photonen-Mikroskopie haben, und können nicht leicht mit Ganzzell-Patch-Clamp-6 kombiniert werden.
Die ExiStachel-Lösungen für Kopf-Fixierung einer wach Nager wurden in erster Linie entweder auf physische Zurückhaltung 7,8 oder auf die Ausbildung der Tier freiwillige Kopfstütze 9 aufweisen verlassen. Ein weiterer beliebter Ansatz ist es, das Tier Gliedmaßen, indem Sie es auf, z. B. eine Kugellaufband 10 zu bewegen; Dieser Ansatz wird häufig mit rechnergenerierten virtuellen Realität kombiniert. Elektrophysiologische Experimente am Kopf fest Mäusen haben meist verwendet, extrazelluläre Ableitungen und wurden zur zentralen Regulierung der Herz-Kreislauf-Funktion 11, Auswirkungen der Narkose auf die neuronale Aktivität 12, die auditive Reaktion im Hirnstamm 13 und 14 Informationsverarbeitung zu untersuchen. Die bahnbrechenden intrazellulären / Ganzzellableitungen an wachen verhalten Tiere wurden in den 2000er Jahren durchgeführt und haben sich auf die neuronale Aktivität, die Wahrnehmung und Bewegung 15-20 bezogenen konzentriert. Etwa zur gleichen Zeit wurden die ersten Studien zur mikroskopischen Abbildung wach Mäuse veröfeingesetzten Ausschusses, in der zwei-Photonen-Mikroskopie wurde in der sensorischen Kortex von Ratten physisch zurückhaltend 7 und an Mäusen auf einer Kugellaufband 21 läuft eingesetzt.
Nachfolgende in vivo Mikroskopie und elektrophysiologischen Studien gezeigt, dass eine Kopffixierung Vorbereitung erfolgreich mit Verhaltensparadigmen basierend auf Vordergliedmaße Bewegungen, Geruchserkennung, Rühren, und leckt 8,22-25 kombiniert werden. Mäuse auf der Kugellaufband gelegt trainiert werden kann, um die virtuelle visuelle Umgebung von einem Computer generiert 10,26 navigieren. Die intrazelluläre / extrazellulären Aufnahmen gezeigt, dass in einem Kopf-fixierten Tier Navigation wie virtuelle Umgebung, die Aktivierung von Hippocampus-Ortszellen nachgewiesen werden 27. In einer virtuellen visuellen Umgebung, Mäuse zeigen normale bewegungsbezogenen Theta-Rhythmus in der lokalen Feldpotential-und Theta-Phasen-Präzession während der aktiven Bewegung 27. Vor kurzem hat die räumliche und zeitliche activity Muster neuronaler Populationen wurden optisch in Mäusen während der Arbeitsspeicher Entscheidungsaufgaben in einer virtuellen Umgebung 28 aufgezeichnet.
Trotz Durchbruch Forschungs aktiviert ist, hat die sphärische Laufband Design einige inhärente Einschränkungen. Zuerst wird das Tier benötigt, um auf einer unbegrenzten Oberfläche einer rotierenden Luft angehoben Ball, der keine greifbaren Hindernisse wie Wände oder Barrieren stellt bewegen. Diese Einschränkung ist nur zum Teil durch die computergenerierten "Virtual Reality" kompensiert werden, weil visuelle Eingabe ist wohl weniger effektiv an Mäusen und Ratten im Vergleich zur taktilen Sinnes (zB Whisker-touch oder lecken), die diese Arten natürlich verlassen auf. Zweitens kann die beträchtliche Krümmung der Kugeloberfläche unangenehm für den Labormäusen zu Fuß auf einem flachen Boden in ihren Käfigen verwendet wird. Schließlich ist die bloße Durchmesser der Kugel (mindestens 200 mm für Mäuse und 300 mm für Ratten) macht die vertikale Größe der sphärischenLaufband-Gerät relativ groß. Dies macht es schwierig, Kugellaufband mit den meisten handelsüblichen Mikroskopie-Setups zu kombinieren, und erfordert oft eine neue Einrichtung rund um das Laufband durch maßgeschneiderte Mikroskop Frames.
Hier wird eine neue Methode beschrieben, bei dem ein Kopf-Fest Maus kann um eine Luft-Mobil homecage angehoben, die einen flachen Boden und Wände bietet greifbare bewegen, und erkunden Sie die physische Umgebung unter stressfreien Bedingungen. Dieser Artikel beschreibt die Verfahren der Maus Ausbildung und Kopf-Fixierung und liefert repräsentative Beispiele, wo Zwei-Photonen-Mikroskopie, intrinsischen optischen Bildgebung und Patch-Clamp-Aufnahmen werden im Gehirn von Mäusen durchgeführt wach verhalten.
Protokoll
Alle hier vorgestellten Verfahren wurden nach den örtlichen Leitlinien für die Tierpflege (Die finnische Gesetz über Tierversuche (62/2006)) durchgeführt. Das Tier-Lizenz (ESAVI/2857/04.10.03/2012) wurde von örtlichen Behörde (ELÄINKOELAUTAKUNTA-ELLA) erhalten. Erwachsene Mäuse (Alter 1-3 Monate, Gewicht 20-40 g) wurden in Gruppenhaltung in Käfigen der zertifizierten Tieranlage der Universität von Helsinki gehalten und mit Futter und Wasser ad libitum zur Verfügung gestellt.
1. Cranial Fenster Implantation
Schädelfenster nach den veröffentlichten Protokollen 29-31 mit geringfügigen Modifikationen implantiert, wie nachstehend kurz beschrieben:
- Sterilisieren der Instrumente, bevor die Schädelfenster Implantation. Aufrechterhaltung steriler Bedingungen während der Operation, um das Risiko von postoperativen Komplikationen zu minimieren.
- Verwalten Sie eine analgetische (Ketoprofen, 2,5 mg / kg) 30 min vor der Operation und 24 Stunden nach der Operation. Einesthetize der Maus unter Verwendung eines Gemisches von Ketamin (80 mg / kg) und Xylazin (10 mg / kg) intraperitoneal injiziert. Der Narkosetiefe durch Einklemmen Pfote regelmäßig zu überwachen. Verwenden Sie ein Heizkissen, um die Körpertemperatur der Tiere in 37,0 ° C zu halten Um die Chirurgie-induzierte Entzündung und Hirnödem reduzieren, verwalten Dexamethason (2 mg / kg) durch subkutane Injektion.
- Bewerben Auge Schmiermittel, um die Augen vor zu trockener schützen. Rasieren Sie den Kopf des Maus und reinigen Sie den rasierten Bereich. Schneiden Sie die Haut mit chirurgische Scheren und Pinzetten entlang der Linie aus dem Genick auf die Stirn. Entfernen Sie das Bindegewebe am Schädel befestigt.
- Langsam und vorsichtig bohren, eine kleine, gut auf der linken Stirnbein mit einem High-Speed-chirurgische Bohrer. Schrauben Sie eine Minischraube (siehe Materialien) in das Bohrloch auch. Führen Sie nicht mehr als ein-und-ein-halb volle Umdrehungen der Schraube.
HINWEIS: Vermeiden Sie die Bereiche, die direkt über den oberflächlichen kortikalen Gefäße befinden. Störung dieser vessel kann zu massiven Blutungen führen. - Um Kraniotomie durchzuführen, bohren Sie ein kreisrundes Fenster (3-3,5 mm Durchmesser) in der rechten Scheitelbein. Einen Tropfen des Cortex-Puffer (125 mM NaCl, 5 mM KCl, 10 mM Glucose, 10 mM HEPES, 2 mM CaCl 2 und 2 mM MgSO 4 in destilliertem H 2 O mit Penicillin 100 Einheiten / ml Streptomycin und 100 &mgr; g ergänzt / ml) und vorsichtig den Teil des Knochens innerhalb des kreisförmigen Fensters zu entfernen.
ANMERKUNG: Um ein fluoreszierendes Protein in einer spezifischen Subpopulation von Zellen zu exprimieren, führen intrakranielle Injektion von Adeno-assoziierte virale (AAV) Vektoren oder andere virale Vektoren an diesem Punkt in dem Verfahren. - Platzieren Sie einen runden Deckglas (# 1.5 Dicke Code) auf der Schädelfenster. Befestigen Sie das Deckglas auf den Schädel mit Polyacryl-Kleber. Legen Sie eine Metallhalterung auf der Oberseite des Deckglases und fixieren Sie es mit der Mischung von Zahnzement und Polyacryl-Kleber.
HINWEIS: Die oben beschriebene Prozedur wird für Schädelfenster optimiertin optischen Abbildungsexperimente verwendet. Um einen "umgekehrten" Schädelfenster für elektrophysiologische Experimente vorbereiten, verwenden Sie eine andere Vorgehensweise. Zuerst kleben Sie die Metallhalterung auf den Schädel. Bohren Sie ein kreisförmiges Fenster in der Öffnung des Inhabers wie im Video veranschaulicht. Alternativ einen kleineren Kraniotomie (weniger als 0,5 mm im Durchmesser) über den interessierenden Bereich zu verhindern oder zu minimieren, die das Gehirn Bewegung 32. Aktualisieren Sie die kortikale Puffer oder einen Tropfen Silikonkleber auf der Schädelfenster, schließen Sie es dann mit einem runden Deckglas. - Nach Abschluss der Operation, legen Sie das Tier in einem Käfig aufgewärmt mit leicht zugänglichen Nahrung und Wasser. Bringen Sie das Tier auf die Gruppe-Gehäusekäfig erst, nachdem es vollständig erholt aus der Narkose. Re verabreichen Analgetikum bei Erfassung keine Anzeichen von Schmerzen, einschließlich Zurückhaltung zu bewegen, essen oder trinken, Gewichtsverlust, Speichelfluss, Piloerektion oder abnormale Atemgeräusche.
2. AnimaL Behandlung
- Nehmen Sie die Maus aus dem Käfig, und halten Sie ihn einfach für 5-10 min. Seien Sie ruhig beim Umgang mit dem Tier vermeiden, ruckartige Bewegungen und Geräusche.
- Nach Umgang mit der Maus zurück in seinen Käfig.
- Wiederholen Sie den Vorgang Handhabung 2-3x mit ungleichen Abständen zwischen Handling Episoden, um die Maus bequem mit dem Experimentator zu machen.
- Nehmen Sie einen kleinen weichen Lappen und wickeln Sie das Tier 2-3x mit ungleichen Abständen.
- Tier sollte ruhig bleiben und sich daran gewöhnt, gewickelt. Wenn die Maus ist aufgeregt und nervös, wiederholen Sie die Handhabungs-und Verpackungsverfahren.
3. Animal Training
- Starten Ausbildung des Tieres in der Mobil homecage am nächsten Tag nach der Gewöhnung an die Handhabung und Verpackung abgeschlossen ist.
- Nehmen Sie das Tier täglich wiegen vor und während der Ausbildung.
HINWEIS: Wenn während der Ausbildung, das Tier mehr als 10% seines Gewichtes verliert, sollte es von t auszuschließenexperimentiert er. - Stellen Sie die vertikale Position des Kopfes Fixierung Arm des mobilen homecage Gerät, um die Größe des Tieres trainiert entsprechen. Die Lufteinlaß der Vorrichtung zu dem Standard-Labordruckluftaustritt (typischerweise entweder ein Tank oder eine Luftpumpe, die einen ausreichend hohen Druck und die Geschwindigkeit der Luftströmung liefert, dh etwa 5 bar und 300 l / min).
- Wickeln Sie das Tier in einem Lappen.
- Legen Sie die Metallhalterung, die den Kopf des Tieres befestigt ist, in die Kopffixierung Arm fest und befestigen Sie es mit den Schrauben. Schalten Sie den Luftstrom und stellen Sie sicher, dass der Luftstrom optimal ist kostenlos Flotation des Luft-homecage angehoben. Lassen Sie das Tier in die mobile homecage durch Entfernen der Lappen.
- Das Tier Rausch gewöhnen, eine konstante Belastung durch Umgebungsgeräusche (zum Beispiel unter Verwendung der Radio-oder aufgezeichneten Musik und Sprache) in allen Trainings sowie während der Experimente.
- Dährend die erste Trainingseinheit, halten Sie den Raum Licht für die erste Stunde, dann schalten Sie das Licht aus, bis zum Ende der Trainingseinheit.
- Nach 2 Stunden der Ausbildung in der mobilen homecage, lassen Sie das Tier von Kopf-Fixierung und wieder in seinen Käfig mit einem Vorrat an Wasser und Nahrung. Lassen Sie es für mindestens 2 Stunden unter Ruhebedingungen.
- Reinigen Sie das Mobil homecage nach jeder Trainingseinheit mit einer 70% igen Ethanollösung und spülen Sie es mit Leitungswasser. Genießen sie das Wasser mit Einweg-Papiertuch und trocknen Sie das Mobil homecage vor dem nächsten Einsatz.
- Führen aufeinanderfolgenden Trainingseinheiten für 2 Stunden, mit dem Raumlicht ausgeschaltet, während das Tier trainiert wird.
- Führen Sie das Training zweimal täglich.
- Nach 8 bis 12 Trainingssitzungen den Tier in einer experimentellen Sitzung für bis zu 2 Stunden zu einer Zeit.
HINWEIS: Bei längeren Trainingseinheiten, die mehr als 1-2 Stunden dauern, in Erwägung ziehen, die Maus, with Trinkwasser, die entweder manuell oder mit einer Pipette Halter auf das mobile homecage Rahmen befestigt geliefert werden kann. Alternativ kann Wasser ad libitum Verwendung des Tieres, indem viskosen Tropfen Hydrogel direkt auf die Wände des mobilen homecage geliefert werden.
HINWEIS: Denken Sie daran, die Tiere jeden Tag vor dem Training, um jegliche chronischer Stress Auswirkungen wiegen. Ausschließen eines Tieres aus dem Experiment, wenn zu irgendeinem Zeitpunkt, Stressreaktionen wie Einfrieren, Stimmgebung, oder Stress-induzierte Diarrhoe zeigt es.
4. Anwendungen
- Zwei-Photonen-Imaging in Awake Maus Navigieren Mobile Homecage
- Montieren Sie den mobilen homecage. Überprüfen Positionen der Brücke und Kopffixierung Arm.
- Wickeln Sie das ausgebildete Tier in einem Lappen. Legen Sie das Tier in der mobilen homecage. Klemmen Sie den Metallhalter in den Kopf Fixierung Arm. Entfernen Sie die Lappen.
- Reinigen Sie die implantierten Deckglas vor Staub miteine 70% ige Ethanollösung und lassen Sie sie trocknen.
- Geben Sie einen Tropfen Immersionsflüssigkeit auf dem Cover Klasse. Vorzugsweise verwenden eine viskose Lösung, denn Wasser schnell verdunsten.
- Legen Sie das Mobil homecage Gerät mit der ausgebildeten Tier unter dem Mikroskop (sofern Sie eine zweite, identische Gerät, das in der Mikroskopie Setup stationär ist zu haben).
- Führen Sie die Bild entweder mit einem Maß oder einen handelsüblichen Laser-Scanning-Mikroskop-Bildgebungssystem mit einem gepulsten Femtosekunden-Infrarot-Laser ausgestattet.
- Finden Sie die Region von Interesse mit der Weitwinkel-Modus des Fluoreszenzmikroskops. Verwenden Sie lange Passfilter zu Hirngefäßsystem zu bewerten und wählen Sie das entsprechende Zielgebiet nach Prüfung der Muster der Blutgefäße.
- Um das Bild zu kortikalen Gefäß injizieren eine 1% ige Lösung von 70.000 MW Texas Red-konjugiertem Dextran (oder dessen Analogon), entweder in die Schwanzvene injiziert, während das Tier in dem Lappen während immobilisiert, oder die retroorbitalTier in der Mobil homecage positioniert. Tune die Zwei-Photonen-Laser bis 860 nm und verwenden Sie die Bandpassfilter (590-650 nm), das emittierte Licht zu sammeln. Verwenden Sie die 515 bis 560 nm Emissionsfilter, um die feinen Details der neuronalen Morphologie oder Verwendung neuronaler Aktivität zu bewerten, beispielsweise transgenen Mäusen, die YFP oder die Ca 2 +-express - empfindliche fluoreszierende Protein GCaMP3 in einer Subpopulation von Neuronen unter der Thy1-Promotors.
- Verwenden Sie eine geeignete Software für die Bildaufnahme.
- Nach der Abbildung, lassen Sie die Tier aus dem Kopf-Fixierung Arm durch Lösen der Schrauben. Bringen Sie das Tier in seinen Käfig und lassen Sie es mindestens 2 Stunden vor dem Start des nächsten Bildgebungssitzung auszuruhen.
- Bewahren Sie die Koordinaten jeder Region of Interest (ROI) für die anschließende Re-Imaging. Bild die gleiche ROIs über die Zeit und stellen Koordinaten jedesmal die Bildüberlappung zu maximieren.
- Analysieren Sie die Bilder und machen Sie dreidimensionale Rekonstruktionen unter Verwendung eines geeigneten Softw(z. B., ImageJ, etc.).
- Eigen Optical Imaging in Awake Maus Navigieren Mobile Homecage
- Montieren Sie den mobilen homecage unter der Bildaufnahme die Kamera einer intrinsischen optischen Abbildungs-Setup.
- Wickeln Sie das ausgebildete Tier in einem Lappen. Legen Sie das Tier in der mobilen homecage. Klemmen Sie den Metallhalter in den Kopf Fixierung Arm.
- Reinigen Sie die implantierten Deckglas vor Staub mit einer 70% igen Ethanollösung und lassen Sie sie trocknen.
- Geben Sie einen Tropfen Glycerin auf den implantierten Glas und bedecken Sie es mit einer 8-mm-Runddeckglas.
- Platzieren eines Manipulators mit dem Luft-Blasrohr entgegengesetzt zu der kontralateralen vibrissa.
- Stellen Sie die Position der Hochgeschwindigkeitskamera und sie auf der kortikalen Gefäßsystem.
- Verwenden Sie grünes Licht (Filter 546BP30) ohne Kamera Filter, um die Gefäße Karte zu erwerben.
- Konzentrieren Sie sich tiefer in die Rinde, etwa 400 Mikrometer unter der kortikalen Oberfläche.
- Um das Bild zu ter Blutoxygenierung pegelabhängige (BOLD) optisches Signal, legen Sie die 590LP Filter vor der Kamera und beleuchten die Rinde mit rotem Licht (Filter 630BP30).
- Einstellen der Beleuchtung der kortikalen Oberfläche, so daß sie gleichmäßig durch den interessierenden Bereich verteilt sind, vermieden Belichtung. Einstellen der Beleuchtungsstärke, so daß der interessierende Bereich innerhalb der 70-90%-Segment des Kamera dynamischen Bereich fällt.
- Verwenden LongDaq Bildaufnahme-Software, um Bilder von der Kamera zu sammeln.
- Verwenden Bildaufnahmefrequenz von 1 bis 10 Hz (dh zwischen 1 und 10 Bilder pro Sekunde) für Experimente mit Niederfrequenzstimulation (0,05 Hz).
- Schalten Sie das Raumlicht, um eine Beeinträchtigung der intrinsischen optischen Signals zu verhindern.
- Lassen Sie mindestens 30 Minuten für die Maus auf das mobile homecage anzupassen.
- Bild der Baseline-Aktivität während einer 6-Minuten-Episode ohne Stimulation.
- Um evozierte c aufnehmenortical Aktivität stimulieren vibrissa in einem 10 sec sec an/10 OFF-Modus (0,05 Hz Stimulation) mit einer hohen Frequenz (25 Hz) Zug von Luft Züge für den Gesamtzeitraum von 6 min.
- Nach der Bildaufnahme, lassen Sie die Maus vom Kopf Fixierung Arm und zurück in seinen Käfig.
- Verwenden Sie keine zusätzlichen Datenfilterung für Frequenz, da die Amplituden der Reizantworten in der Regel wach Tiere relativ hoch zu sein, was zu einer hervorragenden Signal-Rausch-Verhältnis.
- Konvertieren Sie die erhaltenen Sätze von Bildern in *. Tif-Dateien Stapel und sie weiter zu analysieren, zB unter Verwendung der Open-Source-FIJI-Software (ImageJ). Subtrahieren Sie die Grundlinie spontane Aktivität aus den während vibrissa Stimulation mit dem Bild Calculator Tool erhalten Rahmen. Alternativ Filterdaten in der Frequenzdomäne unter Verwendung geeigneter Software.
- Patch-Clamp-Aufnahmen im Erwachet Maus Navigieren Mobile Homecage
- Montieren Sie den mobilen homecage.
- Wickeln Sie das ausgebildete Tier in einem Lappen. Verabreichen Trimethoprim (5 mg / kg) und Sulfadoxin (25 mg / kg), um bakterielle Infektionen zu vermeiden. Legen Sie das Tier in der mobilen homecage. Klemmen Sie den Metallhalter in den Kopf Fixierung Arm.
- Reinigen und desinfizieren Sie die implantierte Zahnzement "cap" und Deckglas mit einer 70% igen Ethanollösung oder 0,5% Chlorhexidindigluconat und trocknen lassen.
- Langsam und vorsichtig die Glasabdeckung von der Metallhalterung.
- Aktualisieren Sie die kortikale Puffer mit Penicillin, Streptomycin und reinigen die Schädelfenster vor Schmutz mit einem sterilen blutstillende Tampons.
- Legen Sie die Masseelektrode in die kortikalen Puffer.
- Legen Sie die Elektrophysiologie heads in einem Mikromanipulator.
- Fabrizieren Pipetten von Borosilikatglas, mit dem Ziel an der Spitze Widerstand im Bereich von 6,5 bis 8.5MΩ. Füllen Sie die Patch-Pipette mit einem intrazellulären Lösung. Die Zusammensetzung der Patchpipettenlösung istFolgende (in mM): 8 KCl, 111 K-Gluconat, 0,5 CaCl 2, 2 NaOH, 10 Glucose, 10 HEPES, 2 Mg-ATP und 5 BAPTA wurde der pH auf 7,2 mit KOH eingestellt. Die Membranpotential Werte müssen für eine berechnete Diffusionspotentials von -12 mV 33 korrigiert werden.
- Ziel die Region von Interesse mit stereotaktischen Koordinaten, und schnell bewegen die Elektrode in das Gehirn, während die Aufrechterhaltung der starken positiven Druck auf die Pipettenspitze. Nach der Dura mater Penetration und Positionierung der Pipette, messen Sie die Spitze Widerstand und entsorgen Sie die Elektroden, die eine Erhöhung der Widerstand von mehr als 10 bis 15%, um die Erfolgsrate der nachfolgenden Schritte verbessern zu zeigen.
- Reduzieren Sie die positiven Druck auf die Hälfte zu Schwellungen des umgebenden Hirngewebe zu vermeiden. Weitere Schritte sind ähnlich zu dem Standard "blinden Fleck"-Protokoll. Um ein Neuron aus aufnehmen zu finden, senken Sie die Spitze in das Gehirn stufenweise, bis ein Neuron in einer engen proximit erkannty der Pipettenspitze, wie durch eine charakteristische zeitliche Abfolge von Elektrodenimpedanzänderungen angezeigt. Der Schlüssel Indikator für das Vorhandensein eines Neurons eine monotone Zunahme der Elektrode Widerstand über mehrere aufeinander folgende Schritte vorwärts der Pipette (typischerweise ein Anstieg von 20% in der Pipette Widerstand über drei 2-um-Schritte).
- Um einen Kontakt mit der Giga gezielte Neuron bilden, gelten ein Unterdruck und Hyperpolarisation der Pipette.
- Anwenden eines kurzen Impulses eines größeren Unterdrucks an die Zelle, um die Gesamtzellkonfiguration herzustellen. Fahren Sie die Elektrode 2-3 um eine gute Abdichtung zu halten.
- Nehmen Sie spontane oder evozierte Aktivität während einer gewünschten Zeit, bis zu 20-40 min.
- Nach der Aufnahme, entfernen Sie die Pipette aus dem Gehirn.
- Aktualisieren Sie die kortikale Puffer oder einen Tropfen Silikonkleber auf der Schädelfenster, dann kleben ein rundes Deckglas auf der Oberseite des Metallhalter.
- Lassen Sie die animal aus dem Kopf Fixierung Arm durch Lösen der Schrauben. Rückgabe das Tier in seinen Käfig für wenigstens einen Tag vor der nächsten Aufnahme.
- Analyse von Daten mit beispielsweise dem FitMaster Software.
- Habituation-Entwöhnung Duft-Test im Erwachet Maus Navigieren Mobile Homecage
- Anfügen einer sauberen Baumwollstück (2 x 2 cm) in Leitungswasser eingetaucht, um die Innenseite der Wand des beweglichen homecage Verwendung eines zweiseitigen Klebebandes. Teilen den Mobil homecage Wand in vier Zonen, indem Farbmarkierungen auf der Außenseite der Wand, so daß das Stück Baumwolle ist in der Mitte des "Zielzone" befindet. Befestigen Sie das Tier in der headholder Arm gegen die Wand-Segment gegenüber der "Ziel"-Zone und lassen Sie es auf das mobile homecage 30 min anzupassen.
- Nehmen wir ein anderes sauberes Baumwoll und nass ist es mit ein paar Tropfen der 1%-Vanille-Extrakt. Ersetzen Sie die sauberen Baumwoll auf dem mobilen homecage Wand mit der ein Tragen des vanilla Geruch. Präsentieren Sie den Geruch für 5 min. Verfolgen Sie die Bewegungen des Mobil homecage während der Präsentation Zeitraum Geruch. Schätzen Sie die Höhe der Zinsen an den Geruch, indem die kumulative Zeit, die das Tier vor der "Ziel"-Zone in Bezug auf die Gesamtzeit der mobilen homecage Bewegung verbringt.
- Wiederholen Sie die 5-Minuten-Anwendungssitzung dreimal mit dem Duft von Vanille, mit einer 5-Minuten-Intervall inter-Sitzung. Verwenden Sie ein frisches Stück "Vanilla"-Baumwolle in jeder Sitzung.
- Präsentieren Sie das Tier mit einer sozial bedeutsamen Geruch während der letzten, fünften Sitzung. Befeuchten Sie ein sauberes Stück Baumwolle mit einigen Tropfen Urin (am Vortag von einem Tier des anderen Geschlechts erhalten) und legen Sie sie in der Mitte der Zielzone für 5 min.
- Novel Geruch Anerkennung wach Maus bewegen das Mobil homecage
- Teilen die Wand in vier Zonen, indem Farbmarkierungen auf der äußeren Seite des mobilen homecage Wand. Attach zwei saubere Baumwollstücke (2 x 2 cm) in Leitungswasser eingetaucht, um die Innenseite der Wandung in der Mitte der Zonen einander (als Zielzone und der Zielzone 1 mit 2 bezeichnet) gegenüberliegen. Befestigen Sie das Tier in der headholder Arm vor einer Wandsegment außerhalb der Zielzone und lassen Sie es auf das mobile homecage 30 min anzupassen.
- Ersetzen Sie beide Stücke Baumwolle mit den frischen,:. Ort ein Stück Baumwolle nass mit der 1%-Vanille-Extrakt, die Zone 1 Ziel und eine weitere Nass mit Leitungswasser auf Zone 2 Ziel Nehmen Sie das Video von der mobilen homecage Bewegungen für 10 Minuten während der Geruch Präsentation Sitzung. Berechnen der Geruch behandelnden als der Prozentsatz der Zeit, die das Tier gegenZielZone verbringt 1 relativ zu der kumulativen Zeit verbracht zugewandt Zonen 1 und 2.
- Nach einem 10 Minuten Intervall, legen ein anderes Paar von Applikatoren auf der homecage Wand für den nachfolgenden Zeitraum von 10 min. Legen Sie die "Vanilla"-Baumwolle in der Zielzone 1 und Baumwolle Applikator nass mit 1% Bananen extract in der Zielzone 2. Machen Sie eine Videoaufzeichnung der mobilen homecage Bewegungen. Errechnen bevorzugt neuartige Geruchs als der Prozentsatz der Zeit, die das Tier vor der Wandsegment mit der neuartigen Geruch (Zielzone 2) relativ zu der kumulativen Zeit zugewandten Zonen 1 und 2 verbringt.
Ergebnisse
Die hier vorgestellte Methode wird für die mikroskopische Bildgebung oder Einzelzellelektrophysiologischen Ableitungen an wachen, kopffesten, aber ansonsten frei bewegen und verhalten Mäusen bestimmt. Das Tier kann in zwei Dimensionen in einer realen (im Gegensatz zu virtuellen), Sachanlagen und vertrauten Umgebung, zu bewegen, während Schädel der Tiere ist fest mit dem Kopffixierung Arm fixiert. Gewöhnung der Mäuse in die Luft gehoben-Mobil homecage besteht aus 4-6 Tagen zweimal täglich 2-Stunden-Trainingseinheiten (Abbildung 1). Die ausgebildeten Tiere können dann in den Experimenten sofort verwendet werden. Eine typische Studie umfasst eine Anzahl von Bilderzeugungseinheiten oder Patch-Clamp-Aufnahmen, die in Abständen von einigen Stunden bis zu mehreren Tagen oder Wochen voneinander beabstandet sind. Wichtig ist, optische und elektrophysiologische Aufzeichnungen gleichzeitig mit kognitiven und Verhaltens Stimuli und Anzeigen in einem einzigen Experiment durchgeführt werden.
Um die mechanische Stabilität zu beurteilenMauskopf-Fixierung in der mobilen homecage wurden die Bildsequenzen der kortikalen Gefäße mit fluoreszierenden konjugierten Dextran und der kortikalen Dendriten ausdrücken YFP markierten gesammelt, während die Versuchstiere wurden die Navigation im mobilen homecage (Abbildung 2). Die maximalen Verschiebungen des Gehirns während der Fortbewegung des Tieres nicht überschreiten typischerweise 1-1,5 Mikrometer. Diese Verschiebungen aufgetreten in den horizontalen Richtungen und sehr selten in einem detektierbaren Verschiebung der Abbildungsebene resultiert, überflüssig macht eine Korrektur von Bewegungsartefakten. Stabile Kopf-Fixierung in der mobilen homecage ermöglicht die Quantifizierung der einzelnen dendritischen Dornen an wachen Tieren mit der gleichen Zuverlässigkeit wie bei narkotisierten Mäusen. Dichte dendritischer Fortsätze, Morphologie und den Umsatz während Langzeitstudien mit mehreren Bilderzeugungseinheiten in Abständen von einigen Stunden bis zu mehreren Tagen oder Wochen durchgeführt überwacht werden.
Die Benutzerfreundlichkeit des mi) Zwei-Photonen-Mikroskopie auf den Thy1-GCaMP3 transgenen Mäusen und ii) intrinsischen optischen Signal Bildgebung in Wildtyp-Mäusen: obil homecage für funktionelle optische Bildgebung wurde in somatosensorischen Kortex von Mäusen wach mit zwei Ansätze getestet. Ca 2 +-Imaging wurde in der Schicht 2/3, die Zellkörper der Neuronen viele fluoreszierend markierten, sowie deren Dendriten und Axone (Fig. 3) enthält, durchgeführt. Die Grundstücke der Fluoreszenz-über-Zeit aus ausgewählten Regionen von Interesse (ROI) sind in Abbildung 3 dargestellt ist, zeigen spontane neuronale Aktivität (gemessen als vorübergehende Erhöhung des GCaMP3 Fluoreszenz) bei aktiver Navigation der Maus die in der mobilen homecage. Die optische Bildgebung basierend auf intrinsische Signale ermöglicht die Abbildung der räumlichen Verteilung der funktionellen Domänen. Abbildung 4 zeigt wellenförmige Veränderungen des Blutsauerstoffpegel (an die regionale neuronale Aktivierung), die entlang somatosensorischen Kortex in Reaktion auf v propagiertibrissa Stimulation bei einer Frequenz von 0,05 Hz liegt.
Um Machbarkeit der Patch-Clamp-Aufnahmen mit mobilen homecage zu testen, verwendeten wir 2-3 Monate alten C57BL/6J-Mäusen. Layer 2/3 Neuronen im somatosensorischen Kortex wurden in Ganzzellkonfiguration mit Stromzange-Modus aufgenommen. Patch-Clamp-Aufnahme im Gehirn von Mäusen wach Kopf fest auf mobilen homecage im Wesentlichen der Patch-Clamp in Hirnschnitten blenden. Etwa 50% der Versuche führte zu erfolgreichen Gigaseal Bildung, von denen mehr als 70% ergab stabile Gesamtzellkonfiguration Aufnahme. Vorgänge von Giga Kontaktverluste durch mechanische Verschiebung der Zellen beobachtet. Abbildung 5 zeigt eine 60-Sekunden-Fragment einer repräsentativen 10-Minuten-langen Strom-Clamp-Aufzeichnung mit Episoden von aktiv (Laufen) Maus und passive (Ruhe-) Staaten korreliert.

Abbildung 1. Verfahren Kopf-Fixierung von wachen Mäusen in der mobilen homecage. A) Übersicht über die Klima angehoben homecage Mobildesign und Illustrationen der allgemeinen Konzept. B) Schematische Darstellung eines typischen Versuchszeitleiste. Die Untersuchung beginnt mit der Implantation des Schädelfenster zwei Wochen vor der Gewöhnung die Maus, um die Handhabung und die Verpackung, die durch acht zweimal täglichen Training folgt. Die typische Studie umfasst eine Anzahl von Abbildungseinheiten oder Patch-Clamp-Aufnahmen, die in Abständen von einigen Stunden bis zu mehreren Tagen oder Wochen voneinander beabstandet sind. Beide optische und elektrophysiologische Messungen können parallel mit kognitiven oder Verhaltens Reize und Anzeigen in einem einzigen Experiment durchgeführt werden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
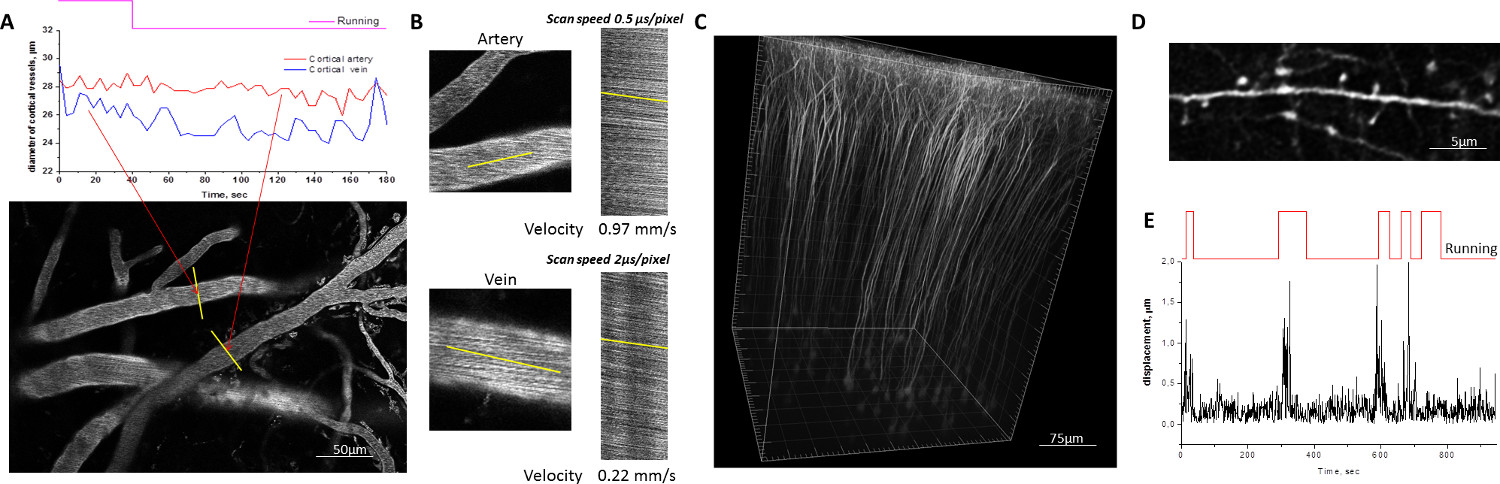
2. Beispiel der Zweiphotonen mikroskopische Bildgebung am wachen Mäusen bewegen das Mobil homecage. A, B) Kortikale Gefäßsystem, mit dem 70 kDa-Texas Red-konjugiertem Dextran markiert. Der Durchmesser der einzelnen Gefäßsegmente wird durch Auftragen im Laufe der Zeit den Verlauf der über das Gefäßlumen während Perioden der Ruhe-und der Maus ausgeführt (A) gezogenen Linien gemessen. Die Rate der Blutfluss in Arterien und Venen wird durch Zeilenabtastung entlang der parallel zur Gefäßwand (B). C, D) Feine Details der neuronalen Morphologie im Gehirn von transgenen Mäusen, die visualisiert YFP in Subpopulation der Ausdruck gezeichneten Linien gemessen Neuronen unter der Thy1-Promotors. Dreidimensionale Rekonstruktion der Pyramidenzellen in der Maus den somatosensorischen Kortex (C). Die Bilder eines dendritischen bRanch in einem wach, verhalten Maus erworben werden, für die Quantifizierung der einzelnen dendritischen Dorn Morphologie (D). E) Quantifizierung von Hirn Bewegung durch Mausbewegungen verursacht ausreichend stabil. Größere Verschiebungen Amplitude korrelieren mit Perioden von der Maus die Lauf. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
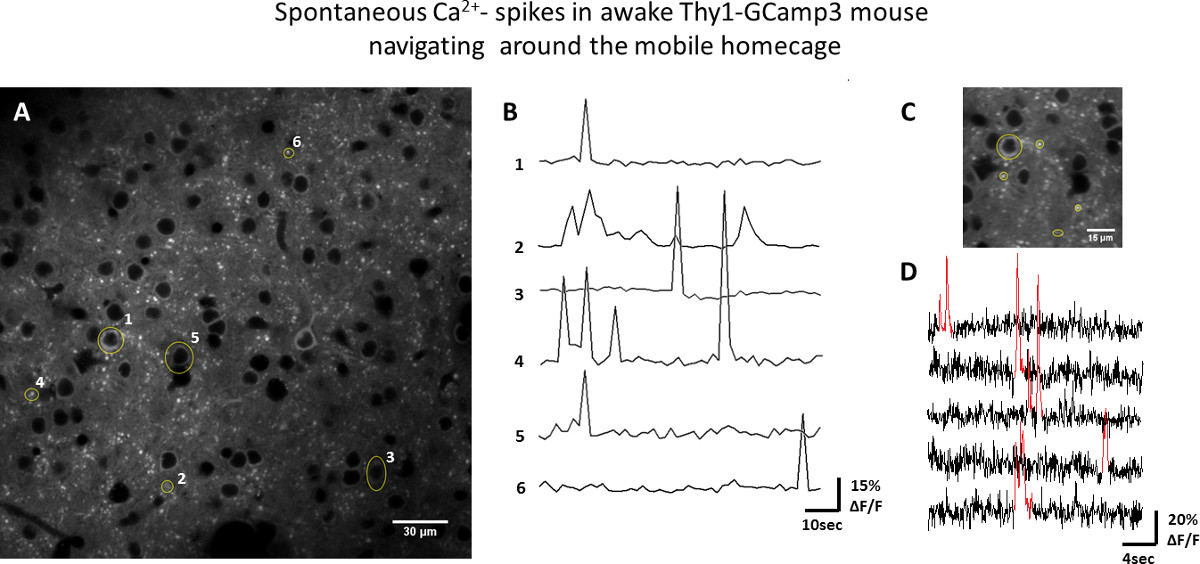
Abbildung 3. Beispiel der neuronalen Aktivität in Bevölkerung wach Thy1-GCaMP3 Maus bewegt, um den mobilen homecage. A) Zwei-Photonen-Bild der kortikalen Schicht II / III-Neuronen. ROIs, zum Beispiel neuronale Zellkörper, Dendriten und Axone sind gelb. B) gezeigt AF / F Spuren der GCaMP3 Fluoreszenz von ROIs in A gezeigt (Zeit series bei 1,5 Sekunden / Bild aufgenommen). C) Zoom-In Bereich auf 65 ms / Frame abgebildet. D) Fluoreszenz von gelb ROIs in C über der Zeit aufgetragen, zeigt die vorübergehende Erhöhungen (rot) in der GCaMP3 Fluoreszenz, die an der Aktion entsprechen Potenzial-induzierte Ca 2 +-Einstrom Episoden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
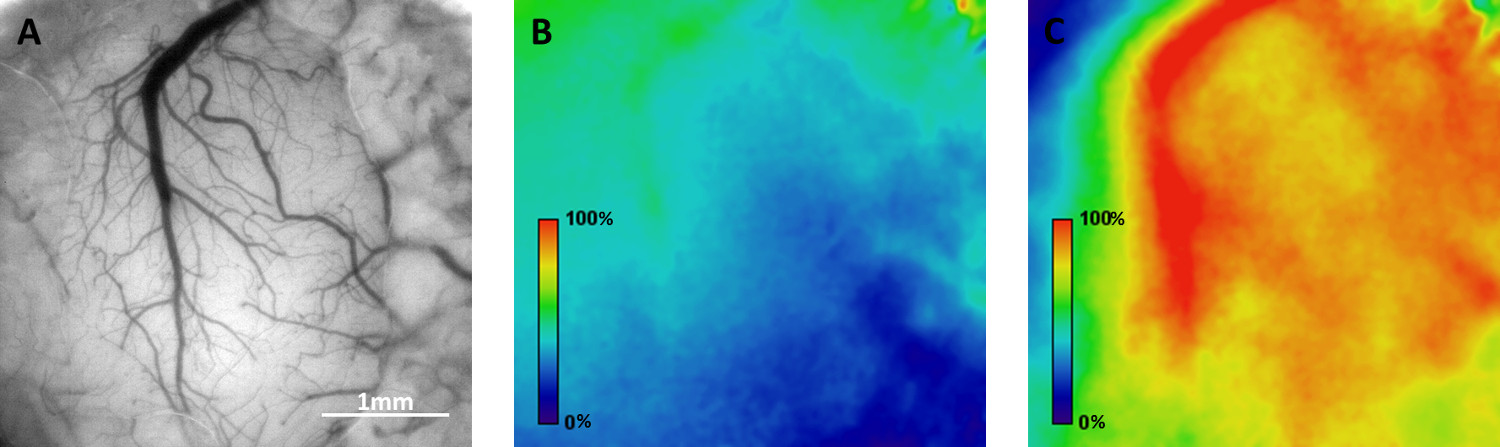
4. Beispiel Abbilden der räumlichen Verteilung der funktionellen Antworten im Kortex einer wachen Maus durch Abbilden der intrinsischen optischen Signale. A) Hellfeld-Blick auf die oberflächlichen Blutgefäße durch die Schädelfenster. B) Magnitude Karte von der Baseline-Aktivität in der mobilen homecage während eines 6-Minuten-Episode. C) Magnitude Karte neuronaler Aktivität entlang somatosensorischen Kortex in Reaktion auf die vibrissa Stimulation mit einer Frequenz von 0,05 Hz ausbreitet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
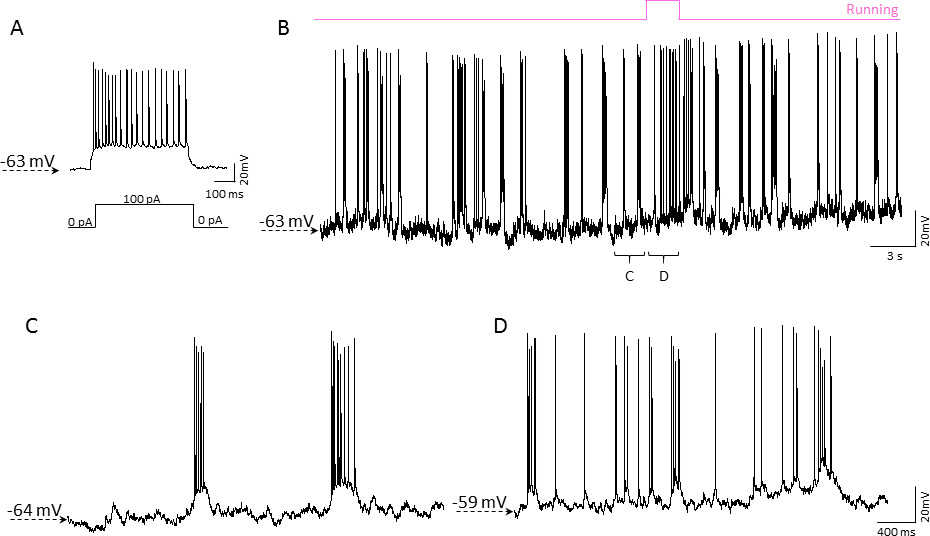
5. Beispiel der Ganzzell-Patch-Clamp-Aufzeichnung in der Rinde einer wachen Maus bewegen das Mobil homecage. A) Strom-Clamp-Aufzeichnung von einem Neuron in der Maus Rindenschicht 2/3. Eine 0,5 sec, 100 pA Strominjektion (unterhalb der Spur angegeben) resultiert in einem Burst von Aktionspotentialen. Die Zelle zeigte Spike Frequenzanpassung charakteristisch für Pyramidenzellen. B) Dauerstrom-Clamp-Aufzeichnungaus dem gleichen Neuron mit der Maus 'Bewegungsaktivität (in rosa über der Kurve dargestellt) korreliert. Repräsentative spontane Aktivität der Schicht 2/3 Neuron in Zeiten der Maus ruhen (C) und Laufen (D). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
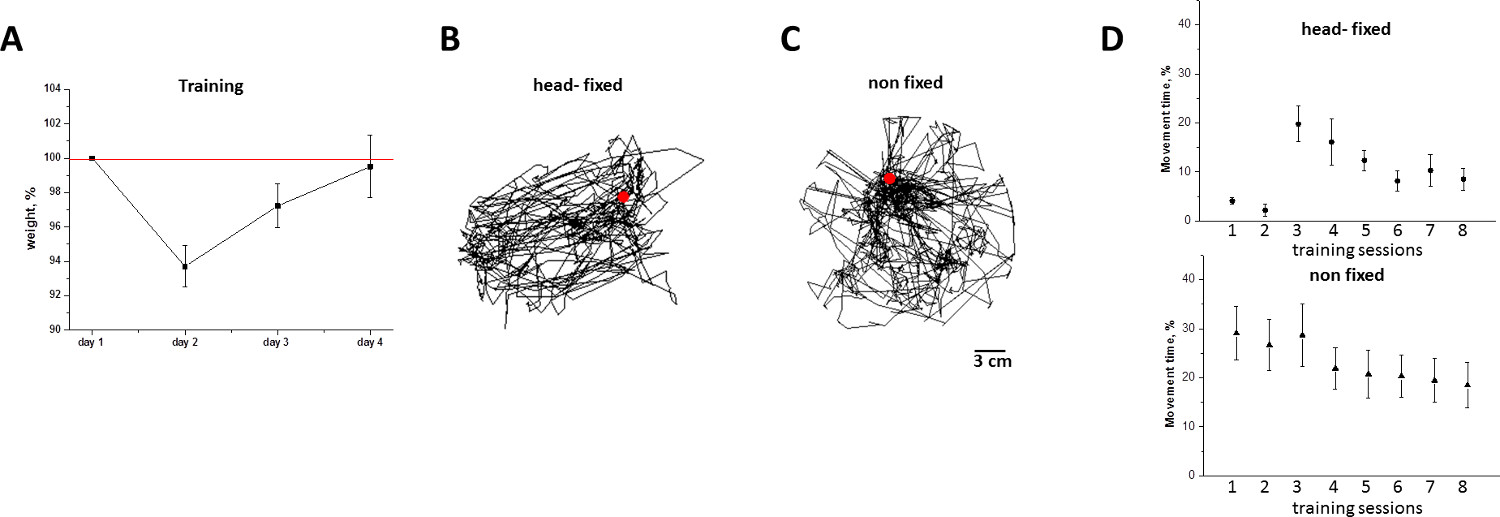
Abbildung 6. Tiergewichtsverlust und Bewegungsaktivität von head-fixed/non-fixed Mäusen während der Trainingseinheiten in der Mobil homecage. A) Tiergewicht (Mittelwert + SD,%) vor dem Training. Beachten Sie, dass die Gewichtsabnahme wird vollständig von der 8.7-ten Trainingseinheit. B) Flugbahn der horizontalen Fortbewegung bezogen auf die mobile homecage der Maus die umgekehrt,die von der verfolgten Bewegung der mobilen homecage während 8. Trainingseinheit. C) Raupenbewegungen eines nicht-Kopf-Fest Maus Erkundung der runden Käfig während der 8. Trainingseinheit. D) Dauer der Kopf fixiert (Kreis) hochgerechnet wurde und nicht fest (Dreieck) Mäuse Bewegung während 1-4 th Tag der Ausbildung (Mittelwert + SD,%). Beachten Sie, dass an Tag 4, zeigen kopffesten Mäusen weder Einfrieren (wie am 1. Tag), noch übermäßige Bewegungsaktivität. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Um Gehirn Physiologie und Pathologie, besser zu verstehen, muss die Forschung auf eine Vielzahl von Vorbereitungskomplexitätsstufen durchgeführt werden, unter Verwendung der am besten geeigneten Techniken für jede Zubereitung. Derzeit werden eine Vielzahl von Methoden der Neurowissenschaften (von Ganzkörper-fMRI-Sub-Organellen STED-Mikroskopie) leicht an narkotisierten Tieren angelegt, während Experimente an wach und Tiere verhalten haben eine erhebliche methodische Herausforderung vertreten.
Hier wird ein neuer Ansatz beschrieben, bei dem ein Labortier, obwohl sie fest Kopf fixiert ist, kann um eine Klima angehoben Mobil homecage bewegen und erkunden Sie die Umgebung unter Sachstressfreien Bedingungen. Der Kopf fest verhalten Tierpräparation hier vorge bietet eine Reihe entscheidender Vorteile. Erstens sind mit dieser Methode erhaltenen elektrophysiologischen oder Bilddaten kompromisslose weder Narkose noch durch Constrain-induzierten Stress. Die Positionierung der Maus in das MobilheimKäfig ist schnell und nicht betäubt das Tier sogar vorübergehend erforderlich. Zweitens sorgt die Klima angehoben homecage die mechanische Stabilität, die nötig ist, um Änderungen in feinen neuronale Morphologie zu quantifizieren und Einzelzell-elektrophysiologische Aktivität in wach Tiere aufzunehmen. Schließlich wird das Mobil homecage Design kompakter im Vergleich zu der sphärischen Laufband, so dass die Positionierung des mobilen homecage unter einer Standard aufrechten Mikroskop für Zwei-Photonen-Bildgebung oder Patch-Clamp-Aufnahme in das Gehirn wach Maus.
Firm Kopf-Fixierung in der mobilen homecage erfordert die Implantation einer speziell entwickelten vierflügelige Metallhalter, mit einer runden Öffnung in der Mitte für optischen oder elektrischen Zugriff auf die zugrunde liegenden Hirnregion. Diese Metallhalter sind an dem Schädel mittels einer Kombination von Klebstoff, Dentalzement und einer kleinen Schraube in den Schädelknochen eingeschraubt angebracht. Dieses chirurgische Verfahren wurde auf der Grundlage einer großen Anzahl von zuvor entwickeltenveröffentlichten Verfahren, und es zeigte sich in einer stabilen und reproduzierbaren Herstellung Schädel Fenster führen. Für in vivo elektrophysiologischen Experimenten eine mondförmige Fenster 34, einer kleinen Größe Kraniotomie (weniger als 0,5 mm) 32 und einem gebohrten glasüberzogene Zubereitung 35 verwendet worden. Hier wurde die "umgekehrte" Schädel Fenster entweder mit einem großen (3,5 mm Durchmesser) oder klein (weniger als 0,5 mm Durchmesser) Kraniotomie implantiert. Minimierung Gehirn Bewegung ist wichtig für stabile Einzelzellableitungen, weshalb es ratsam ist, kleine Größe Kraniotomien für elektrophysiologische Experimente durchzuführen. Nach der Implantation des Schädelfenster für optische Abbildungsexperimente werden die Tiere ließ man mindestens 2 oder 3 Wochen, während dessen die ersten Fenster vorübergehend seine Transparenz verliert und gewinnt es (mit einer Ausbeute von 50-70%, abhängig von erholen der genetische Hintergrund des Mausstamm). Transparenz der Schädelfenster und stabilkeit des Zahnzement "cap" zum Schädel angebracht werden mittels eines regulären Binokular und physikalische Inspektion während der Tierbehandlung überprüft werden. Am Ende der 2-3 wöchigen Erholungsphase sollten diese Tiere, die keine Anzeichen von Rest post-operative Entzündungen oder mechanische Defekte im Zahnzement zeigen aus den Experimenten ausgeschlossen und beendet werden.
Das optimale Alter zum Starten der Ausbildung der Mäuse 2-4 Monate (entsprechend dem Körpergewicht 20-40 g). Bei jüngeren Tieren kann Verankerung des Dentalzement "cap" zum Schädel unzuverlässig sein, die ihre Widerstandsfähigkeit gegenüber mechanischen Belastungen, die durch die Fortbewegung des Kopfes fest Maus in der Mobil homecage auferlegt wird erschwert. Obwohl die männlichen und weiblichen Mäusen gleichermaßen bereit sind, in mobilen homecage navigieren erscheinen, gibt es eine Tendenz zur besseren Prozentsatz der Schädelfenster der Wiedererlangung ihrer Transparenz bei weiblichen Mäusen (Daten nicht gezeigt) zu erreichen. Daher, um to eine ausgewogene Mischung von Geschlechtern in der Kohorte von Tieren für die Bildgebung ausgewählt, Implantation Schädelfenster in etwa 30% mehr männliche Mäuse empfohlen. Soziale Interaktionen sind bekannt für das Wohlbefinden der Tiere zu verbessern und Stress zu reduzieren, daher ist es ratsam, dass Wurf betrieben und parallel geschult und in Gruppenhaltung Käfige zusammengehalten.
Im Gegensatz zu den für den Kugellaufband Vorbereitung 13 veröffentlichten Verfahren, wird die Methode unter Verwendung der mobilen homecage nicht verlangen, Anästhesie der Maus im Moment der Kopf-Fixierung. Dieser Unterschied ist wichtig, weil es um jegliche Restwirkungen, die sogar eine kurze und "Licht" Anästhesie Episode ist wahrscheinlich auf die physiologischen Messungen kurz nach erhalten haben. In der Tat, auch wenn in den Studien, in denen Kopf-Fixierung wurde unter Vollnarkose durchgeführt und die eigentlichen Experimente wurden nach einer kurzen Wartezeit 13 gestartet, kann man nichtauszuschließen, mögliche langfristige Auswirkungen des kurzen Narkose Episode auf den experimentellen Daten. Andere Studien haben auf Wasserentzug für die systematische Gewöhnung der Tiere, um die Fixierung Kopf verlassen und zur Belohnung Wasser als Mittel der Motivation, das Tier unbeweglich 36 zu bleiben. Jedoch begrenzt der Lohn-basierte Kopffixierungsmethode der Wahl des anwendbaren Verhaltenstests und, besonders wichtig, ist in einem der etablierten Stimulus-Belohnung Verbände. Im Gegensatz dazu ist die Methode der Maus Gewöhnung an Fixierung in mobilen homecage Kopf nicht verlangen, Wasserentzug und die anschließende Belohnung.
Ergänzung der mobilen homecage mit einem Wasserzufuhrsystem für lang anhaltende Experimente empfohlen. Die Tiertrainingseinheiten und Experimente vorgestellt wurden hier während der Tageszeit (von 08.00 Uhr bis 18.00 Uhr), die physiologisch passive Zeit für die Mäuse, die unter dem Standard-12-Stunden-Lichtplan (li gehalten werden, entspricht getanGHTS auf 6 Uhr und ab 6 Uhr). Da die Wasseraufnahme wird direkt mit der Maus die Aktivität zugeordnet ist, während der passive Zeitraum Mäuse benötigen keine Wasserabgabe, wenn die Dauer eines Ausbildungs / Imaging / Aufnahme-Session hat 2 Stunden nicht überschreiten. Neben der Zeitpunkt und die Dauer der Trainingseinheiten, muss man die Frage nach der optimalen Anzahl der Sitzungen für Gewöhnung der Tiere an mobile homecage gewünschte Adresse. Zu diesem Zweck wurden zwei Kriterien, die zur Belastung durch den Kopf der Fixierung induzierten zu bewerten: i) Gewichtsverlust, und ii) die Bewegungsaktivität Niveau. Wie in Abbildung 6 dargestellt, Gewichtsverlust erreicht das durchschnittliche Niveau von 6% auf die Ausbildung Tag 2, und ist vollständig von Trainingstag 4 (6A) umgekehrt. Im Einklang mit der Dynamik wiegen, wird die Bewegungsaktivität Niveau der kopffesten Tiere am ersten Tag der Ausbildung unterdrückt, sondern stabilisiert durch Training Tag 4 (6D). Basierend auf diesen Messungen Anregungen wirt, die die minimale Dauer der Maus Ausbildungszeit auf mobilen homecage beträgt 4 Tage, wie im Protokoll hiermit beschrieben.
Die Nutzung der Klima angehoben, Flachboden Mobil homecage erlaubt das Hinzufügen von komplexen Aufgaben (sensomotorische, Wahrnehmungs-und kognitiven) zu den Trainings Paradigmen für Kopf-fixierten Mäusen. In der vorliegenden Studie zwei Protokolle von Verhaltenstests werden vorgestellt. Beide Protokolle nutzen Geruch Cues und kann mit Längs Imaging / Aufnahmen in der Maus Kortex kombiniert werden. Obwohl die mobile homecage aus nicht-absorbierende Materialien hergestellt, noch muss man Berücksichtigung möglicher Interferenzen zwischen dem Geruch von dem Gerät und Test Geruch (s) zu nehmen. Ein weiterer Faktor, mit optisch / taktile Signale einer Verhaltens Experiment stören kann, ist die Verbindungsstelle zwischen der Wand und dem Einsatz, die nicht nahtlos und kann daher von dem Tier als Wahrzeichen wahrgenommen werden. Bemerkenswert ist hier, dass, um Tier Kummer während solcher inte minimierenrventions die Platzierung eines Geruchs-präsentierenden Baumwolle auf das mobile homecage Wand, sollte der Experimentator üben, um solche Interventionen so schnell wie möglich durchzuführen und längeren Umgang mit dem Kohlenstoffkäfig. Alternative Strategien für neuartige Geruch / Objektpräsentation sind denkbar, z. B. indem Hydrogel-basierte Lösung, Tropfen oder Objekte (z. B. Futterchips) auf kleine Regale an der inneren Oberfläche des Kohlenstoffkäfigwand auf der Höhe mit Kopf Positionierung des Tieres kompatibel angebracht.
Mobil homecage ermöglicht kopffesten Tiere eine breite Palette von zweidimensionalen Bewegungen einschließlich horizontaler Fortbewegung, situp, Pflege, Rühren, lecken, Nasen-Stossen, Fachvorderpfote Bewegungen und Wand berühren mit Vorderbeine, wie in der vorliegenden Studie dargestellt, um durchzuführen . Mit mobilen homecage und die Protokolle hier vorge können die Forscher die sensomotorische neuronale System mit einem hohen Maß an Kontrolle über sowohl die Stimulation Zustand studierens und die Verhaltens Lese-Outs. Darüber hinaus können Studien der kognitiven Fähigkeiten bei wachen Mäusen während Anlage, räumlichen Navigation und Entscheidungsaufgaben durchgeführt werden.
Es gibt mehrere praktische Beschränkungen dieses Verfahrens. Zunächst wird eine erhebliche Menge an Druckluft benötigt, um die homecage Hebekraft zu erzielen und dauerhafte Experimente durchzuführen. Zweitens die Mobil homecage in ihrer gegenwärtigen Umsetzung nur 18 cm im Durchmesser und eine relativ kleine und einfache Raum im Vergleich zu der virtuellen Realität, wobei eine komplexe Versuchsumgebung ohne räumliche Einschränkungen gestaltet werden daher. Drittens, während Whisker Stimulation und Belohnung basierte hier vorgestellten, wurde ein Gerät verwendet, das die Möglichkeit der Wandkontakt für die Maus beschränkt. Hinzufügen eines externen optischen oder sensorischen Stimulationskanal (z. B. ein Auge gerichteten Lichtprojektor), würde die Gestaltung eine ergonomische und kompakte Vorrichtung im Vergleich zu benötigendie Mehrfachbild-oder Dome-Projektionslösungen, die in der Kugellaufexperimente verwendet wurden.
Zusammenfassend ist die Nutzung der kopffesten Mäuse sich in die Luft gehoben Handy-homecage erleichtert die Studien, die Zell-, Molekular-und Verhaltensebene der Beobachtung und Manipulation in einem einzigen Experiment zu kombinieren. Hier dargestellten speziellen Anwendungen gehören Zwei-Photonen-mikroskopisch visuelle Darstellung, intrinsischen optischen Signal Imaging und Patch-Clamp-Aufnahmen in nicht-narkotisierten Mäusen verhalten. Es wird erwartet, dass dieser Ansatz neue Horizonte in der Experimente an wach, verhalten Maus öffnen und dienen als nützliche Werkzeug für die Medikamentenentwicklung und Grundlagenforschung der Gehirnfunktion.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren danken Prof. Eero Castren für seine wertvolle Kommentare zum Manuskript. Die Arbeit wird durch Zuschüsse aus der Akademie von Finnland, Zentrum für internationale Mobilität von Finnland und finnische Graduate School of Neuroscience (Gehirn und Geist Doctoral Program) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Tweezers, Stainless Steel, 115 mm | XYtronic | XY-2A-SA | |
| Animal trimmer, shaving machine | Aesculap | Isis GT420 | |
| Binocular Microscope | Zeiss | Stemi 2000 | |
| Biological Temperature Controller with stainless steel heating pad | Supertech | TMP-5b | |
| Blunt microsurgical blade | BD | REF 374769 | |
| Borosilicate tube with filament | Sutter Instruments | BF120-69-10 | For patch pipette production |
| Camera | Foscam | FI8903W | Night visibility |
| Carprofen | Pfizer | Rimadyl vet | |
| Dental cement | DrguDent, Dentsply | REF 640 200 271 | |
| Dexamethasone | FaunaPharma | Rapidexon vet | |
| Disposable drills | Meisinger | HP 310104001001008 | |
| Dulbeco’s PBS 10x | Sigma | D1408 | |
| Dumont #5 forceps, 110 mm | FST | 91150-20 | |
| Eyes-lubricant | Novartis | Viscotears | For eyes protection during operation and as viscose solution for immersion |
| Foredom drill control | Foredom | FM3545 | |
| Foredom micro motor handpiece | Foredom | MH-145 | |
| Four-winged metal holder | Neurotar | ||
| Head Holder for Mice | Narishige | SG-4N | Assembled on stereotaxic instrument |
| Hemostasis Collagen Sponge | Avitene, Ultrafoam BARD | Ref 1050050 | |
| Imaris | Bitplane | ||
| Ketamine | Intervet | Ketaminol vet | |
| Kwik-Sil | WPI | ||
| Mai Tai DeepSee laser | Spectra-Physics | ||
| Micro dressing forceps, 105 mm | Aesculap | BD302R | |
| Microelectrode puller | Narishige | PC-10H | Vertical puller for glass pipette production |
| Micromanipulator | Sensapex | ||
| Mini bolt | Centrostyle | Ref. 00343 s/steel M1.0x4.5 | |
| Mobile Homecage | Neurotar | ||
| Multiphoton Laser Scanning Microscope | Olympus | FV1000MPE | |
| Nonwoven swabs, 5 x 5 | Molnlycke Health Care | Mesoft | Surgical tampons |
| Polyacrylic glue | Henkel | Loctite 401 | |
| Round glass coverslip | Electron Microscopy Sciences | 1.5 thickness | |
| Small animal stereotaxic instrument | David Kopf Instruments | 900 | |
| Student iris scissors, straight 11.5 cm | FST | 91460-11 | |
| Xylazine | Bayer Health Care | Rompun vet |
Referenzen
- Li, N., et al. mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists. Science. 329, 959-964 (2010).
- Sitdikova, G., et al. Isoflurane suppresses early cortical activity. Annals of Clinical and Translational Neurology. 1 (1), 15-26 (2013).
- Helmchen, F., Fee, M. S., Tank, D. W., Denk, W. A miniature head-mounted two-photon microscope. high-resolution brain imaging in freely moving animals. Neuron. 31, 903-912 (2001).
- Piyawattanametha, W., et al. In vivo brain imaging using a portable 2.9 g two-photon microscope based on a microelectromechanical systems scanning mirror. Optics letters. 34, 2309-2311 (2009).
- Sawinski, J., Wallace, D. J., Greenberg, D. S., Grossmann, S., Denk, W., Kerr, J. N. D. Visually evoked activity in cortical cells imaged in freely moving animals. Proceedings of the National Academy of Sciences of the United States of America. 106, 19557-19562 (2009).
- Fee, M. S. Active stabilization of electrodes for intracellular recording in awake behaving animals. Neuron. 27, 461-468 (2000).
- Greenberg, D., Houweling, A., Kerr, J. Population imaging of ongoing neuronal activity in the visual cortex of awake rats. Nat Neurosci. 11 (7), 749-751 (2008).
- Fujiwara-Tsukamoto, Y., et al. Reinforcing operandum: rapid and reliable learning of skilled forelimb movements by head-fixed rodents. Journal of Neurophysiology. 108, 1781-1792 (2012).
- Scott, B. B., Brody, C. D., Tank, D. W. Cellular Resolution Functional Imaging in Behaving Rats Using Voluntary Head Restraint. Neuron. 80, 371-384 (2013).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nat Neurosci. 13, 1433-1440 (2010).
- Parry, T. J., McElligott, J. G. A method for restraining awake rats using head immobilization. Physiolog & behavior. 53 (5), 1011-1015 (1993).
- Brecht, M., Schneider, M., Sakmann, B., Margrie, T. W. Whisker movements evoked by stimulation of single pyramidal cells in rat motor cortex. Nature. 427 (6976), 704-710 (2004).
- Van Looij, M. A. J., Liem, S. -. S., van der Burg, H., van der Wees, J., De Zeeuw, C. I., van Zanten, B. G. A. Impact of conventional anesthesia on auditory brainstem responses in mice. Hearing research. 193, 75-82 (2004).
- Hentschke, H., Schwarz, C., Antkowiak, B. Neocortex is the major target of sedative concentrations of volatile anaesthetics: strong depression of firing rates and increase of GABAA receptor-mediated inhibition. The European journal of neuroscience. 21, 93-102 (2005).
- Margrie, T. W., Brecht, M., Sakmann, B. In vivo, low-resistance, whole-cell recordings from neurons in the anaesthetized and awake mammalian brain. Pflugers Archiv: European journal of physiology. 444, 491-498 (2002).
- Crochet, S., Petersen, C. C. H. Correlating whisker behavior with membrane potential in barrel cortex of awake mice. Nat Neurosci. 9, 608-610 (2006).
- Houweling, A. R., Brecht, M. Behavioural report of single neuron stimulation in somatosensory cortex. Nature. 451, 65-68 (2008).
- Poulet, J. F. A., Petersen, C. C. H. Internal brain state regulates membrane potential synchrony in barrel cortex of behaving mice. Nature. 454, 881-885 (2008).
- Bryant, J. L., Roy, S., Heck, D. H. A technique for stereotaxic recordings of neuronal activity in awake, head-restrained mice. Journal of neuroscience methods. 178, 75-79 (2009).
- De Kock, C. P. J., Sakmann, B. Spiking in primary somatosensory cortex during natural whisking in awake head-restrained rats is cell-type specific. Proceedings of the National Academy of Sciences of the United States of America. 106, 16446-16450 (2009).
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large-scale neural activity with cellular resolution in awake, mobile mice. Neuron. 56, 43-57 (2007).
- Hentschke, H., Haiss, F., Schwarz, C. Central signals rapidly switch tactile processing in rat barrel cortex during whisker movements. Cerebral cortex. 16, 1142-1156 (2006).
- Stüttgen, M. C., Rüter, J., Schwarz, C. Two psychophysical channels of whisker deflection in rats align with two neuronal classes of primary afferents. J. neuroscience. 26, 7933-7941 (2006).
- Connor, D. H., Peron, S. P., Huber, D., Svoboda, K. Neural activity in barrel cortex underlying vibrissa-based object localization in mice. Neuron. 67, 1048-1061 (2010).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extend arteriole capacity. Proceedings of the National Academy of Sciences of the United States of America. 108 (20), 8473-8478 (2011).
- Harvey, C. D., Collman, F., Dombeck, D. A., Tank, D. W. Intracellular dynamics of hippocampal place cells during virtual navigation. Nature. 461, 941-946 (2009).
- Chen, G., King, J. A., Burgess, N., O’Keefe, J. How vision and movement combine in the hippocampal place code. Proceedings of the National Academy of Sciences of the United States of America. 110 (1), 378-383 (2013).
- Harvey, C. D., Coen, P., Tank, D. W. Choice-specific sequences in parietal cortex during a virtual-navigation decision task. Nature. 484 (7392), 62-68 (2012).
- Holtmaat, A., et al. Long-term , high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat Protoc. 4 (8), 19-22 (2009).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. J. Vis. Exp. (12), (2008).
- Portera-Cailliau, C., Trachtenberg, J. T., de Paola, V., Svoboda, K., Wilbrecht, L., Holtmaat, A. Imaging Neocortical Neurons through a Chronic Cranial Window. Cold Spring Harbor Protocols. 2012, (2012).
- Garaschuk, O., Milos, R. -. I., Konnerth, A. Targeted bulk-loading of fluorescent indicators for two-photon brain imaging in vivo. Nat Protoc. 1 (1), 380-386 (2006).
- Barry, P. H. JPCalc, a software package for calculating liquid junction potential corrections in patch-clamp, intracellular, epithelial and bilayer measurements and for correcting junction potential measurements. Journal of neuroscience methods. 51 (1), 107-116 (1994).
- Golshani, P., Gonçalves, J. T., Khoshkhoo, S., Mostany, R., Smirnakis, S., Portera-Cailliau, C. Internally mediated developmental desynchronization of neocortical network activity. The Journal of neuroscience. 29 (35), 10890-10899 (2009).
- Polack, P. -. O., Friedman, J., Golshani, P. Cellular mechanisms of brain state-dependent gain modulation in visual cortex. Nat Neurosci. 16 (9), 1331-1339 (2013).
- Schwarz, C., et al. The head-fixed behaving rat--procedures and pitfalls. Somatosensor., & motor research. 27, 131-148 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten