Method Article
Die Verwendung von Durchflusszytometrie, um den Zustand von Chromatin in T-Zellen bewerten
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Durchflusszytometrie kann genutzt werden, um den Zustand des Chromatins innerhalb der T-Zellen zu beurteilen. Dieses Protokoll ermöglicht es Wissenschaftlern, Nachweis Chromatindekondensation während der T-Zellaktivierung durch einen Anstieg in der mittleren Fluoreszenz-Intensität (MFI) von fluoreszierenden Histone H3 Antikörper nachgewiesen interpretieren
Zusammenfassung
Bei einer ordnungsgemäßen Immunantwort zu ruhenden T-Zellen, um ihre Antigen-spezifischen T-Zellrezeptor aktiviert bei Antigenpräsentation. Dies führt zu einer klonalen Proliferation der nur diejenigen T-Zellen, die einen Rezeptor, der das Antigen erkennt, tragen. Chromatindekondensation ist ein Markenzeichen von T-Zell-Aktivierung und ist erforderlich für die T-Zellen auf die Fähigkeit, nach der Antigen proliferieren Eingriff zu erwerben. Diese Änderung in der Chromatin-Kondensation kann unter Verwendung von Antikörpern gegen Histon-Proteine erhöht nachgewiesen werden. Diese Antikörper können in aktivierten T-Zellen nicht auf ihre Epitope in naiven T-Zellen zu binden und sie können. Wir beschreiben, wie Sie gleichzeitig färben T-Zell-spezifische Oberflächenmarker, Spur Lebensfähigkeit mit einem fixierbaren tote Zelle Fleck, und messen Chromatin-Status über die intrazelluläre Färbung der Histone H3 Proteine. Gefärbten Zellen werden durch Durchflusszytometrie analysiert und Chromatinkondensation Status wird als mittlere Fluoreszenzintensität (MFI) der Histone H3 Fleck gemessen. Chromatin Dekondensation während der T-Zell-Aktivierung wird als eine Erhöhung des MFI zeigten
Einleitung
Durchflusszytometrie ist ein Laser-basierte Technologie für die Analyse von mehreren physischen und Leuchtstofflampen Parameter in Zellpopulationen entwickelt. Diese Technologie funktioniert als suspendierte Zellen in einem Fluidstrom, der Begegnung eines Lasers, spannenden fluoreszierenden Markern auf oder innerhalb der Zellen. Diese Marker emittiert dann Licht, das erkannt wird und von Photovervielfacherröhren quantifiziert. Während Durchflusszytometrie ist traditionell verwendet worden, um Populationen von Zellen zu identifizieren, hat es sich als eine nützliche Technologie bei der Untersuchung einer Reihe von Zelleigenschaften, einschließlich Zellmembranintegrität, Protein-Protein-Wechselwirkungen und Protein-Traffic 1-3. Wir haben ein Protokoll, das diese Technologie verwendet werden, um den Zustand von Chromatin in T-Zellen zu erkennen, wie sie in vitro 4 aktiviert werden, ermöglicht. Wir haben auch dieses Protokoll verwendet, um den Aktivierungsmechanismus induzierten Chromatindekondensation von T-Zellen 5 zu untersuchen.
T-Zell-activation und Proliferation sind entscheidend für eine richtige Immunantwort. T-Zellen, eine spezifische Untergruppe von Lymphozyten im Immunsystem, auf korrekte Immunantworten und zur Entwicklung von immunologischen Speicher erforderlich. Aktivierung wird eingeleitet, wenn ein Antigen in Zusammenhang mit der großen Kompatibilität Komplexes an den T-Zellrezeptor (TCR) auf der extrazellulären Oberfläche von ruhenden T-Zellen (in 6 Bewertung) angeordnet dargestellt. Dies löst eine Reihe von dynamischen und hoch geordneten molekularen Ereignisse innerhalb von T-Zellen, die zu einer Erhöhung der intrazellulären Ca2 + -Konzentration 7 und der nukleären Translokation von Transkriptionsfaktoren für die Aktivierung (8-10 bewertet) erforderlich gipfeln. Einmal aktiviert, T-Zellen die Fähigkeit erlangen, um Interleukin-2 (IL-2), ein potenter Wachstumsfaktor, der JAK (Janus Kinase) / STAT nutzt reagieren (Signal Transducer und Aktivator der Transkription) Weg, um klonale Proliferation von aktivierten T-fahren Zellen 11. Kurz gesagt, IL-2-Stimulationresultiert in der Phosphorylierung von STAT-Proteine eine Familie von latenten cytosolischen Transkriptionsfaktoren. Einmal phosphoryliert STAT Proteine dimerisieren, translozieren zum Kern und treiben die Expression von Genen, einschließlich der in der Zellzyklusprogression beteiligt sind. In T-Zellen, IL-2-Signale über STAT5, die für die T-Zellproliferation 12,13 erforderlich.
Um klonalen Expansion von aktivierten T-Zellen zu erreichen, müssen die Zellen, die Antigen-TCR-Eingriff (naive T-Zellen) nicht erlebt haben, einen Mechanismus, um die starke Wirkung von IL-2 zu ignorieren. Dies wird über die Regulierung der Chromatin-Status erreicht. Naive T-Zellen besitzen einen kondensierten Chromatin, das STAT5-DNA Eingriff als Antwort auf IL-2-Stimulation verhindert. Nach der Aktivierung können Chromatin decondenses und STAT5 die Promotoren von Zielgenen zuzugreifen, klonale Proliferation 4 ermöglicht. Interessanterweise ist nicht abhängig von epigenetischen Modifikation Histon protei diese Änderung der Chromatinstruktur Statusns (für eine Übersicht siehe 14), wie wir beobachtet keine globalen Veränderungen in Histon-Modifikation während T-Zell-Aktivierung 4.
Während der Durchführung dieser Untersuchungen entdeckten wir, dass Antikörper gegen Histon-Proteine erhöht hatte auch Schwierigkeiten beim Zugriff auf ihre Epitope in naive Zellen, aber das bei Aktivierung könnte leichter zu binden, deren Epitope 4. Somit dient Antikörper-Bindung an Histone als Auslese für Chromatinkondensation Status. Hier präsentieren wir die Methode der Durchflusszytometrie verwenden, um fluoreszenz konjugiert Histone H3 Antikörper, um Chromatin-Status in T-Zellen zu bewerten erkennen. Chromatin-Kondensation in einer Population von Zellen ist als mittlere Fluoreszenz-Intensität (MFI) von Histon H3-Färbung gemessen. Im Zusammenhang mit der T-Zellaktivierung, der MFI von Histon H3 Färbung zunimmt, bedeutet die Dekondensation Chromatin. Zusätzlich zur Messung der Chromatin-Status über intrazelluläre Histone H3-Färbung, Incorpora dieses Protokoll auchtes Oberflächenfärbung und eine fixierbare Fleck für lebende Zellen und ermöglicht Analyse von Subpopulationen von Zellen.
Protokoll
Diese Studie wurde in strikter Übereinstimmung mit den Empfehlungen in dem Leitfaden für die Pflege und Verwendung von Labortieren der National Institutes of Health durchgeführt. Das Tier Protokoll wurde von der Furman University Institutional Animal Care und Verwenden Committee (: A3242-01 Permit-Nummer) genehmigt. Alle Materialien und Geräte in diesem Protokoll verwendet werden, können in der Tabelle der Materialien und Geräte gefunden werden, während Puffer verwendet werden, können in der Tabelle der Puffer und Lösungen gefunden werden.
1. Einzelzellsuspension von Lymphozyten aus Maus-Milz
- Opfern Mäusen über CO 2 Ersticken. Bestätigen Sie die Euthanasie durch Genickbruch.
Hinweis: Verwenden Sie Milz von zwei 6-8 Wochen alten Mäusen isogenen (zB C57B / 6) des gleichen Geschlechts. Typischerweise werden zwei Milzen verarbeitet. - Sprühen Sie die Tiere ausgiebig mit 70% Ethanol-Lösung und zu orientieren, so dass der Kopf nach links.
- Mit einer Pinzette, heben Sie die Haut des Tieres nach oben und weg von ter Körper. Mit einer Schere, schneiden Sie eine kleine Kerbe durch die Haut in der Nähe des Bauches des Tieres. Mit den Fingern, ziehen Sie jede Seite der Kerbe auf das Bauchfell vom Nacken bis zum Anfang der Hinterbeine aus. Die Milz sollte sichtbar direkt unter dem Bauchfell sein.
- Mit einer Pinzette, heben Sie das Bauchfell und machen einen kleinen Einschnitt, um die Milz aus. Entfernen Sie die Milz mit einer Pinzette und mit einer Schere zu necken Nicht aufge Fett- und Bindegewebe.
- Platzieren der Milz in einem 50 ml konischen Röhrchen mit 10 ml PBS mit 2% fötalem Rinderserum (nachstehend als PBS + 2% bezeichnet). Halten Sie das Röhrchen auf Eis, bis bereit, die Einzelzellsuspension zu beginnen.
Anmerkung: Typische Erholung zwischen 60-90 Millionen Zellen pro Milz und in der Regel werden 2 Millionen Zellen pro Probe benötigt wird. Führen Sie alle folgenden Schritte in einer Gewebekultur Kapuze. - Dekantiert man die Milz in eine sterile 100 mm Gewebekulturschale.
- Erhalten zwei mattierten Objektträger und halten ter gleitet, so daß die beiden Grob mattierte Oberflächen nach innen in Richtung zueinander. Befeuchten Sie die Folien in der PBS + 2% Lösung gegossen in die Petrischale.
- Halten Sie die Milz zwischen den mattierten Oberflächen der Objektträger, mit den Kanten immer noch unter Wasser, und schleifen die Milz sanft, indem die Objektträger hin und her gegeneinander (Abbildung 1A). Die Zellen werden in die Petrischale fallen. Weiter Schleifen, bis alle Zellen wurden veröffentlicht und die Überreste der Milz weiß erscheinen (Abbildung 1B).
- Erstellen Sie die Zellsuspension in einer Pipette und filtern sie langsam durch einen 70 um Filter in ein neues steriles 50 ml konischen Röhrchen. Man beachte, daß kleine Stücke von rotem Fruchtfleisch wird auf dem Filter (2A) vorliegen.
- Wenn der Filter steigt sanft heben ihn leicht die Flüssigkeit durch abtropfen und legen Sie den Filter wieder in das 50 ml konischen Rohr und auch weiterhin zu ermöglichen, diesen Vorgang wiederholen wie nötig. Wenn Verarbeitung von mehr als 5 SPLeens, kann es notwendig sein, in zwei Reihen unterteilen und mit einem neuen Filter für jeden.
- Unter Verwendung der Anschlagabschnitt eines 3-ml-Spritze und drücken Sie vorsichtig das rote Fruchtfleisch mit den restlichen Zellen durch das Sieb (2B). Achten Sie darauf, sowohl die Filter unten und seitlich zu drücken, um sicherzustellen, dass alle roten Pulpa durch den Filter (Abbildung 2c) übergeben.
- In 10 mlof PBS + 2% in die Gewebekulturschale und nutzen diese, um das Rutschen, Spritzenstopper und Teller waschen, um alle verbleibenden Zellen zu gewinnen. Übergeben Sie diese über den gleichen 70 um Zellsieb in die 50 ml konischen Röhrchen. Wiederholen Sie diesen Schritt nach Bedarf.
- Zentrifugieren Sie die gefilterten Zellsuspension bei 300 xg für 5 min bei 4 ° C.
- Vorsichtig dekantieren und den Überstand verwerfen, darauf achten, nicht um das Pellet zu stören. Eine Spurenmenge von PBS + 2% in der Röhre verbleiben. Das Röhrchen und Flick das Pellet, bis das Pellet vollständig resuspendiert.
- Lyse roter Blutkörperchen des Anbietersding 2 ml ACK-Lysepuffer (0,15 M NH 4 Cl, 1 mM KHCO 3, 0,1 mM EDTA, pH 7,2, bei 4 ° C) pro Milz mit dem konischen Rohr und drehen, und das Röhrchen, um sicherzustellen, dass alle Zellen in Kontakt mit der ACK-Puffer. Vorsichtig schwenken die Tube für 1 min bei RT.
- Bringe das Volumen der Zellsuspension auf 50 ml durch Zugabe von PBS + 2% das Rohr, um das ACK-Puffer neutralisiert. Das Röhrchen 10 Mal und Zentrifuge für 5 Minuten bei 300 · g bei 4 ° C. Nach der Zentrifugation abgeschlossen ist, sollte das Pellet weiß (Abbildung 3).
- Vorsichtig dekantieren und den Überstand verwerfen, darauf achten, nicht um das Pellet zu stören. Lassen Sie eine Spurenmenge von PBS + 2% im Rohr, die Kappe der Röhre, und Flick des Pellets, um es wieder zu suspendieren.
- 10 ml der T-Zell-Medium [10% FBS, 10 mM HEPES (pH 7,0), 2 mM GlutaMAX, 1 mM Natriumpyruvat, 1 × nicht-essentiellen Aminosäuren, 1x Penicillin / Streptomycin und 50 mM β-Mercaptoethanol] und ferner das Pellet durch vorsichtigesAuf- und Abpipettieren. Dann filtern die Suspension durch eine neue 70-um-Filter in ein neues 50 ml konischen Röhrchen.
- Verwenden Sie ein anderes 5-10 ml des T-Zell-Medien, um die ursprüngliche Rohr spülen und leiten Sie diese durch die 70 & mgr; m-Filter in das Rohr den Rest der gefilterten Zellen enthält. Wenn die Verarbeitung mehr als zwei Milzen, kann das Volumen der T-Zell-Medium erhöht, um Erholung zu maximieren.
- Halten Sie Zellen auf Eis, bis bereit, gefärbt werden. Zellen sollten gezählt und die Lebensfähigkeit abgerufen.
- Um Zellen zu zählen, zu kombinieren 3 ml von Zellen mit 24 ml PBS + 2% und 3 ml 0,4% Trypanblau. Legen Sie 10 ml dieser in jede Kammer eines verbesserten Neubauer Zählkammer. Lebensfähigkeit, wie durch Trypanblau-Ausschluss bewertet, liegt typischerweise zwischen 85-95%.
2. Die Lebensfähigkeit und Oberflächenfärbung
- Pellet-Zellen durch Zentrifugation für 10 min bei 300 × g bei 4 ° C. Die Zellen in T-Zell-Medium auf eine Konzentration von 1 x 10 7 Zellen / ml. Transfer 2 Millionen Zellen (100 ml) in eine Vertiefung einer U-Boden-96-Well-Gewebekulturplatte.
- Zentrifugieren Sie die Platte mit 96 Vertiefungen für 10 Minuten bei 300 × g bei 4 ° C.
- Entfernen Sie den Überstand aus jeder Vertiefung durch Schwenken Flüssigkeit im Well-Platte in die Spüle (das Zellpellet wird in der gut bleiben) und tupfte die Platte auf einem sauberen Papiertuch. Die Zellen werden durch Resuspendieren in 200 & mgr; l PBS, gefolgt von Zentrifugation bei 300 · g für 10 min bei 4 ° C. Führen Sie alle Waschanlagen auf diese Weise wenn nicht anders angegeben.
Hinweis: Verwenden Sie keine PBS + 2%, wie es mit der fixierbaren PI-Färbung stören. - Entfernen Sie den Überstand durch Schwenken der Platte und mit 100 ml frisch zubereitet kommerziellen Flecken (zB fixierbar rote tote Zelle Färbung) in jede Vertiefung.
- Machen Sie den Fleck durch Verdünnen der Reaktivfarbstoff Stammlösung 1:10 in DMSO, gefolgt von einer Verdünnung von 1:10 in PBS. Die Platte bei 4 ° C für 30 min lichtgeschützt.
- Zentrifugieren Sie die pEnde für 10 Minuten bei 300 × g bei 4 ° C. An diesem Punkt vorwärts, führen alle Arbeiten mit der Platte mit der Gewebekultur Haube Licht aus.
- Entfernen Sie den Überstand durch Ausklopfen der Platte und dann mit 100 ml Fc-Block-Lösung. Machen Fc-Block-Lösung, die durch Verdünnen Fc-Block-Stammlösung 1: 100 in PBS.
- Verdünnter Antikörper für Oberflächenfärbung in PBS verwendet werden (beispielsweise anti-CD4- oder anti-CD8) und 100 ml in jede Vertiefung. Inkubieren Sie die Platte mit 96 Vertiefungen für 30 Minuten bei 4 ° C vor Licht geschützt.
Hinweis: Oberflächenflecken Antikörper sollten für eine optimale Leistung titriert werden. Typischerweise eine 1: 200 oder 1: 400 Verdünnung, nach den Angaben des Herstellers durchgeführt.
3. intrazelluläre Färbung für Histone H3
- Nach der Inkubation der Oberfläche Flecken, waschen Sie die Zellen zweimal in PBS.
- Nach dem letzten Waschen werden 100 ul 4% Paraformaldehyd in jede Vertiefung. Inkubieren der Platte mit 96 Vertiefungen 5 min bei RT. Machen Sie 4% Paraformaldehyd durch verding 16% Paraformaldehyd in PBS. Machen Sie dieses frisch.
- In PBS waschen Sie die Zellen zweimal.
- Machen Perm / Blocks-Lösung (stock Perm Lösung PBS + 2% + 0,02% Triton X-100, bei 4 ° C) durch die Kombination von 2 ml normales Kaninchenserum pro 100 ml stock Perm-Lösung. Machen Sie genug für 60 ml / Probe.
- In 40 ml Perm / Blocks zu jeder Probe gut und gut mischen durch vorsichtiges Auf- und Abpipettieren, kümmert sich nicht um Blasen zu machen. Inkubieren der Platte bei Raumtemperatur für 45 Minuten im Dunkeln. Sparen restlichen Perm / Blocks für Schritt 3.6.
- Verdünnen Sie fluoreszenz konjugierten Histon H3K4me1-Antikörper in Perm / Blocks Lösung in Schritt 3.5 vorbehalten, und fügen Sie 10 ul dieser Verdünnung in jede Vertiefung. Mix durch vorsichtiges Auf- und Abpipettieren. Inkubieren der Platte mit 96 Vertiefungen im Dunkeln für 1 Stunde bei 4 ° C.
Hinweis: Verwenden Sie ein H3K4me1 Antikörper konjugiert mit dem R-Phycoerythrin Konjugation Kit gemäß Herstellerangaben. - Zweimal in PBS + 2% wasche die Zellen.
- Resuspendieren der Zellen in 200mgr; l PBS + 2% und übertragen Sie die Proben auf FACS-Röhrchen für die Durchflusszytometrie-Analyse. Die Proben können bei 4 ° C im Dunkeln gelagert werden. Um optimale Ergebnisse zu analysieren die Proben innerhalb von zwei Tagen. Einzeln gefärbte Proben können als Durchflusszytometrie Kompensationskontrollen verwendet werden.
Ergebnisse
Lymphozyten aus einer C57B / 6 Maus wurden in eine Einzelzellsuspension nach dem Protokoll verarbeitet und unter Verwendung eines Standard-Zählkammer gezählt. Zellen wurden in dreifacher Ausführung bei 2 x 10 6 / ml in T-Zellmedium in 15 ml konischen Röhrchen beimpft und unbehandelt gelassen oder mit 1 mg / ml löslichem anti-CD3-Antikörper (Klon 4C11) für 3 Stunden stimuliert bei 37 ° C in ein Standard-Gewebekultur-Inkubator. Tote Zellen wurden gefärbt und dann wurden die Zellen dann mit FITC-CD8 und APC-CD4-Antikörpern nach dem Protokoll färbten Oberfläche. Histon Zugänglichkeit wurde mittels Durchflusszytometrie (Abbildung 4) analysiert. In beiden naiven CD4 + und CD8 + T-Zellen ist die mittlere Fluoreszenzintensität (MFI) niedrig ist, was bedeutet, einen kondensierten Chromatin Zustand. Als Zellen werden mit Anti-CD3-Antikörper aktiviert die MFI steigt signifikant (p <0,001, Student t-Tests), die anzeigt, dass Chromatin hat dekondensiert.
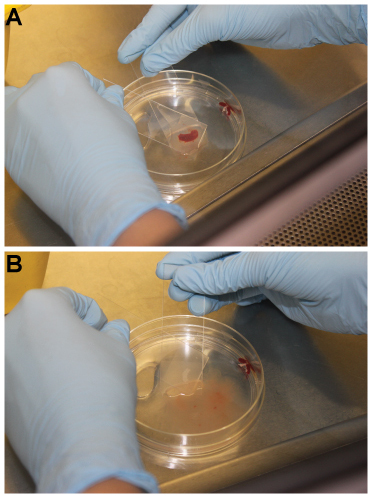
Abbildung 1. Technik zur Verarbeitung von Milz in eine Einzelzellsuspension mit gefrostet Objektträger. (A) Die Milz ist gegen die mattierten Oberflächen von zwei Objektträger gedrückt. (B) Die Objektträger werden vor und zurück gegeneinander Freigabe Lymphozyten in eine 100 mm Petrischale, bis die Reste der Milz sind weiß bewegt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Abbildung 2. Unter Verwendung einer Spritze Anschlag zu drücken verbleibenden roten Pulpa durch eine 70 mm Zellsieb. (A) nach einem der Milz verbleibenden Red Zellstoff i S in einer Einzelzellsuspension verarbeitet und durch die 70 mm-Zellsieb geleitet. (B) der Anschlagbereich einer 3 ml-Spritze verwendet wird, um vorsichtig auf verbleibenden roten Pulpa durch die Zelle Sieb. (C) Nach der Verwendung der Spritze sollte es praktisch keine roten Pulpa im Zellsieb der linken Seite. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3. ACK Lyse von roten Blutkörperchen. (A) Die Zentrifugation eines aus einer einzigen Mäusemilz vor der Lyse ACK generiert Einzelzellsuspension. (B) Nach dem ACK Lyse der roten Blutkörperchen, sollte das Zellpellet weiß sein.bekommen = "_ blank"> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
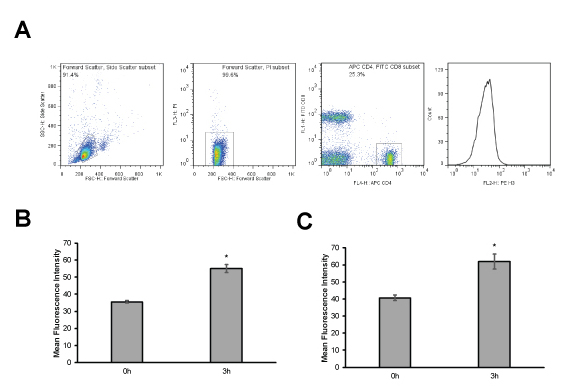
Abbildung 4. Repräsentative Ergebnisse des Protokolls. (A) Gating-Schema verwendet, um Chromatin Status in CD4 + T-Lymphozyten zu analysieren. (B und C) T-Zellen wurden unbehandelt gelassen oder mit 1 mg / ml löslichem anti-CD3-Antikörper für 3 h (dreifach) aktiviert. Zellen wurden dann mittels Durchflusszytometrie analysiert, um die Kondensation des Chromatins der CD4 + Zellen (B) und CD8 + Zellen (C) zu bestimmen. Daten sind die Mittelwerte ± Standardabweichung der mittleren Fluoreszenzintensität von H3K4me1 Färbung. * p <0.001 (Student-t-Test) Bitte klicken here um eine größere Version dieser Figur zu sehen.
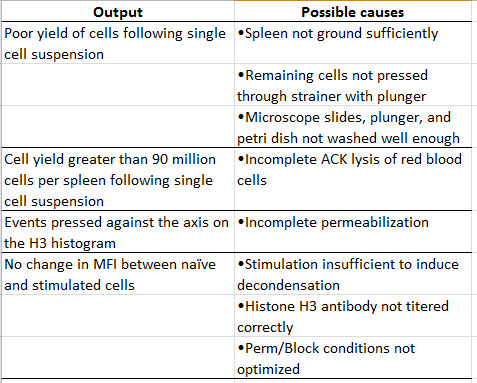
Tabelle 1:. Fehlersuche eine Übersicht über häufig auftretende Probleme und mögliche Lösungen.
Diskussion
Entwickelten wir ein Protokoll, das für die Beurteilung der Chromatin-Kondensation in T-Zellen ermöglicht. Es beruht auf der einfachen Beobachtung, dass Histone H3 Antikörper nicht deren Epitope leicht in naiven Zellen zuzugreifen, sondern auf T-Zell-Aktivierung, sind dieselben Antikörper in der Lage, ihre Epitope binden. Durch Vergleich des MFI von Histon H3 Färbung zwischen den Behandlungsgruppen, kann der relative Grad der Kondensation oder Dekondensation bestimmt werden. Wir haben dieses Protokoll verwendet, um relative Kondensations Status während Thymozyten-Entwicklung und während der T-Zellaktivierung 4 zu bestimmen. Wir haben auch dieses Protokoll verwendet, um die Mechanismen, die die Dekondensation Prozess 5 steuern zu untersuchen.
Dieses Protokoll beruht auf der Verwendung eines Histon H3 Antikörper an Chromatinkondensation Zustand zu detektieren. Da es keine globale Veränderungen in Histon-Modifikation während T-Zell-Aktivierung 4, sind wir in der Lage, eine H3K4me1-Antikörper verwenden, um Chromatin bewertenStatus dieses Protokolls. Haben wir Antikörper gegen unmodifiziertes Histone H3 angehoben verwendet wird; war jedoch der erzeugte Signal viel schwächer insgesamt. Nach unserer Erfahrung Antikörper gegen modifizierte Histone H3 angehoben funktionieren besser in der Immunfluoreszenz und Durchflusszytometrie-Tests, während Antikörper gegen Histone H3 unmodifizierten besser funktionieren in Western-Blot. Es ist zu beachten, dass es auch möglich, Antikörper gegen andere Histonproteine angehoben zu verwenden, obwohl wir es nicht versucht werden.
Die Perm / Blocks und Histone H3 Antikörper-Schritte sind die wichtigsten Schritte in dem Protokoll. Die Höhe der Perm / Blocks-Lösung verwendet wird, muss jedes Mal die Aktie Perm-Lösung hergestellt wird optimiert werden. Dies kann durch den Vergleich von verschiedenen Verdünnungen der Stammlösung durchgeführt werden. Ein typisches Experiment beinhaltet den Vergleich Chromatin Status in naiven T-Zellen, mit denen für 3 Stunden (Figur 4) aktiviert. Man sollte die Verdünnung, die die größte Veränderung gegenüber produziert in MFI wählender Zeitraum analysiert. Die Stammlösung kann in PBS + 2% verdünnt werden, um Perm / Blocks ige ersten nach dem Schritt 3.4 Resuspendieren der Zellen in so viel wie 100 ml PBS + 2% und dann das Perm / Blocks in Schritt 3,5 zu verringern. Ein ähnliches Pilotversuch sollte verwendet werden, um verschiedene Verdünnungen des fluoreszenz konjugierten Histone H3 Antikörper jedes Mal eine neue Charge der Antikörper markiert ist zu testen. Diese Schritte sind besonders kritisch für eine erfolgreiche Detektion von Kondensation Unterschiede frühen T-Zell-Aktivierung (beispielsweise innerhalb 3 h Aktivierung). Gelegentlich gibt es Zellen, die nicht bekommen, permeabilisierten und somit nicht mit der Histone H3 Antikörper färben. Dies kann passieren, wenn die Zellen nicht gut resuspendiert beim Hinzufügen des Perm / Blocks oder der Perm / Blocks ist nicht stark genug. Diese Zellen werden als Ereignisse gegen die Achse gedrückt wird, wenn die Visualisierung ein Histogramm der Histone H3 Färbung angezeigt. Da diese Ereignisse die Gesamt MFI neigen, können diese Ereignisse von der Analyse von Gatin weggelassen werdeng die Normalverteilung der Histone H3-positiven Zellen. Zusätzliche Unterstützung finden Sie in der Fehlersuche (Tabelle 1) festgestellt werden.
Die Aufnahme eines festlegbaren tote Zelle Fleck ermöglicht die Bewertung der Lebensfähigkeit der Zellen in dem Assay. Das ist absolut entscheidend beim Manipulieren von T-Zell-Aktivierung, weil bestimmte Reize können Zelltod zu induzieren. In einem solchen Fall kann der Histone H3 Histone Antikörper in toten Zellen unterschiedlich binden als lebende Zellen, was zu einer Fehlinterpretation der Ergebnisse.
Dieses Protokoll ist für die Verwendung in 96-Well-Plattenformat ausgelegt, wodurch eine Hochdurchsatzanalyse von Chromatin-Status. Eine Milz einer 6-8 Wochen alten weiblichen Maus wird in der Regel ergeben 60-90 Millionen Zellen unter Verwendung des Protokolls. Da das Färbeprotokoll erfordert 2 Millionen Zellen pro Probe, kann man leicht testen mehrere Behandlungsgruppen und Zeitpunkten, in dreifacher Ausführung mit einer einzigen Milz auf einer einzelnen Platte mit 96 Vertiefungen. Es ist möglich, perform das Protokoll mit weniger Zellen pro Probe; jedoch aufgrund der Anzahl der Zentrifugationsschritte und die inhärente Verlust von Zellen bei jedem dieser Schritte, ist es nicht ratsam, die Anzahl der Zellen, die durch viel niedriger. Wir haben erfolgreich die Protokoll mit 1 Million Zellen pro Probe beendet.
Wir verwendeten dieses Protokoll, um Chromatin Status in CD4 + T-Helferzellen und CD8 + cytotoxischen T-Zellen zu untersuchen. Dies ist möglich, weil das Protokoll umfasst Standardoberflächenfärbung. Das Protokoll könnte leicht zur Untersuchung von Chromatin in anderen Lymphozyten-Subpopulationen unter Verwendung von Antikörpern gegen Population spezifischen Oberflächenmarker angepasst werden. Dieses Protokoll kann auch leicht an andere Zelltypen, solange Antikörpern, die relevanten Oberflächenmarker geeignet sind verfügbar und ordnungsgemäße Fixierung / Permeabilisierung Bedingungen bekannt sind.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen.
Danksagungen
Dieses Projekt wurde durch Zuschüsse aus den National Institutes of Health (5 P20 RR016461 und 8 P20 GM103499) unterstützt, der National Science Foundation (EPS-0.903.795). Weitere Unterstützung durch Furman University Research und berufliche Entwicklung und Furman Vorteil Awards zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 100mm tissue culture dish | BD Biosciences | 353003 | |
| Precleaned frosted microscope slides | Fisher Scientific | 12-550-343 | |
| Sterile cell strainer, 70mm nylon mesh | Fisher Scientific | 22363548 | |
| 3mL syringe, Luer-Lok tip | BD | 309585 | |
| Falcon 50mL polypropylene conical tube | Corning | 352098 | |
| LIVE/DEAD fixable red dead cell stain kit | Life Technologies | L23102 | Life Technologies sells versions of this kit with different colors |
| Fc Block | BD Biosciences | 553142 | |
| 16% paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| Triton X-100 | Fisher Scientific | BP151-100 | |
| Normal rabbit serum | Sigma-Aldrich | R9133 | |
| Anti-H3K4me1 antibody | Abcam | ab8895 | |
| R-Phycoerythrin conjugation kit | Abcam | ab102919 | Alternatively, the LYNX rapid RPE kit from AbD Serotec can be used |
Referenzen
- Bravo-Ferrada, B. M., et al. Study of surface damage on cell envelope assesed by afm and flow cytometry of lactobacillus plantarum exposed to ethanol and dehydration. J Appl Microbiol. , (2015).
- Agola, J. O., et al. Quantitative Bead-Based Flow Cytometry for Assaying Rab7 GTPase Interaction with the Rab-Interacting Lysosomal Protein (RILP) Effector Protein. Methods Mol Biol. 1298, 331-354 (2015).
- Toh, W. H., et al. Application of flow cytometry to analyze intracellular location and trafficking of cargo in cell populations. Methods Mol Biol. 1270, 227-238 (2015).
- Rawlings, J. S., Gatzka, M., Thomas, P. G., Ihle, J. N. Chromatin condensation via the condensin II complex is required for peripheral T-cell quiescence. EMBO J. 30, 263-276 (2011).
- Lee, M. D., Bingham, K. N., Mitchell, T. Y., Meredith, J. L., Rawlings, J. S. Calcium mobilization is both required and sufficient for initiating chromatin decondensation during activation of peripheral T-cells. Mol Immunol. 63, 540-549 (2015).
- Paul, W. E. . Fundamental immunology. , (2013).
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7, 690-702 (2007).
- Isakov, N., Altman, A. Protein kinase C(theta) in T cell activation. Annu Rev Immunol. 20, 761-794 (2002).
- Macian, F. NFAT proteins: key regulators of T-cell development and function. Nat Rev Immunol. 5, 472-484 (2005).
- Hogan, P. G., Chen, L., Nardone, J., Rao, A. Transcriptional regulation by calcium, calcineurin and NFAT. Genes Dev. 17, 2205-2232 (2003).
- Rawlings, J. S., Rosler, K. M., Harrison, D. A. The JAK/STAT signaling pathway. J Cell Sci. 117, 1281-1283 (2004).
- Ihle, J. N. STATs: signal transducers and activators of transcription. Cell. 84, 331-334 (1996).
- Moriggl, R., et al. Stat5 is required for IL-2-induced cell cycle progression of peripheral T cells. Immunity. 10, 249-259 (1999).
- Kouzarides, T. Chromatin modifications and their function. Cell. 128, 693-705 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten