Method Article
Hydroponics: ein vielseitiges System Nährstoff Allocation und Pflanzen Reaktionen auf die Nährstoffverfügbarkeit und Belastung durch toxische Elemente zu studieren
In diesem Artikel
Zusammenfassung
Here, we present an easy-to-follow protocol to establish a successful hydroponic system for plant nutrition studies. This protocol has been extensively tested in Arabidopsis and can easily be adapted to other plant species to study specific nutritional requirements or the effect of non-essential elements on plant growth and development.
Zusammenfassung
Hydroponischen Systeme wurden als eine der Standardmethoden für Pflanzenbiologie Forschung genutzt und werden auch in der kommerziellen Produktion für mehrere Kulturen, darunter Salat und Tomaten verwendet. Innerhalb der Pflanzenforschungsgemeinschaft wurden zahlreiche hydroponischen Systeme wurden entwickelt, um Pflanzen Reaktionen auf biotischen und abiotischen Stress zu studieren. Hier präsentieren wir eine hydroponischen Protokoll, das leicht in Laboratorien interessiert in Fortsetzung der Studien über Pflanzenmineral Ernährung umgesetzt werden können.
Dieses Protokoll beschreibt die hydroponischen System im Detail und die Herstellung von Pflanzenmaterial für erfolgreiche Experimente eingerichtet. Die meisten Materialien in diesem Protokoll beschrieben ist, kann außerhalb der wissenschaftlichen Versorgungsunternehmen zu finden, die Einrichtung für hydroponischen Experimente weniger teuer und bequem.
Die Verwendung eines hydroponischen Wachstumssystem ist besonders vorteilhaft in Situationen, wo die Nährmedien gut kontrolliert werden müssen, und wenn intakte roOTS müssen für Downstream-Anwendungen geerntet werden. Wir zeigen auch, wie Nährstoffkonzentrationen modifiziert werden, um Pflanzen Antworten auf beide essentielle Nährstoffe und toxische, nicht wesentliche Elemente induzieren.
Einleitung
Pflanzen zählen zu den wenigen Organismen , die alle erforderlichen Metaboliten aus anorganischen Ionen synthetisieren kann, Wasser und CO 2 , um die Energie von der Sonne 1 eingefangen werden. Hydroponik ist ein Verfahren zum Züchten von Pflanzen, die die Vorteile dieser Tatsache nimmt durch alle Nährstoffe, in ihre anorganischen Form, in einer flüssigen Lösung mit oder ohne festen Medien. Hydroponischen Systeme wurden von Wissenschaftlern für die Erkundung Nährstoffbedarf und auch die Toxizität von einigen Elementen in Arabidopsis und anderen Pflanzenarten 2-5 ausgiebig genutzt. Zum Beispiel Berezin et al. 3, Conn et al. 4 und Alatorre-Cobos et al. 2 verwendet hydroponischen Systeme und verschiedene Pflanzenarten , darunter Tomaten und Tabak, 2-4 ausreichend pflanzliche Biomasse für mineralische Analyse zu erzeugen. Industrielle Anwendungen der Hydroponik wurden auch für Nutzpflanzen wie Tomaten und Salat 6 entwickelt. Hier wir outline die Verwendung von Hydrokultur im Rahmen der Forschung, mögliche Variationen in zur Verfügung stehenden Methoden und schließlich ein System präsentieren, die leicht skalierbar und nützlich für Forschungslabors interessiert sich für das Studium Pflanzenmineral Ernährung sein kann.
Hydroponischen Systeme ermöglichen eine einfache Trennung von Wurzelgewebe und eine präzise Steuerung der Nährstoffverfügbarkeit
Hydroponik bietet mehrere Vorteile gegenüber Boden-basierten Systemen. Wenn aus dem Boden entfernt wird, wird oft Wurzelgewebe mechanisch Gewebeverlust oder Beschädigung geschert verursachen. Dies gilt insbesondere für die Feinwurzelstrukturen wie Seitenwurzeln und Wurzelhaare. Hydroponischen Systeme, die eine weniger invasive Trennung von Wurzel- und Sprossgewebe keine inerte Partikel Medien nutzen können.
In Bodensystemen, die Bioverfügbarkeit von Nährstoffen Veränderungen in der gesamten Bodenmatrix als Nährstoffe binden an Bodenpartikel Mikroumgebungen innerhalb des Bodens zu schaffen. Dieses heterogeneity könnte ein zusätzliches Maß an Komplexität in Experimenten, um eine genaue Kontrolle über die externe Konzentration von Nährstoffen oder anderen Molekülen hinzuzufügen. Im Gegensatz dazu ist die hydroponische Lösung homogen und kann problemlos im gesamten Verlauf des Experiments ersetzt werden.
Varianten von hydroponischen Systemen
Alle hydroponischen Kulturen stützen sich auf eine Nährlösung wesentlichen Elemente der Anlage zu liefern. Zusätzlich zu den Nährstoffen, müssen die Wurzeln auch eine stetige Versorgung von Sauerstoff. Wenn Wurzeln anoxischen geworden sind sie nicht in der Lage und Metaboliten Transport 7 auf den Rest des Pflanzenkörpers aufzunehmen. Hydroponischen Systeme können klassifiziert werden je nachdem, wie sie liefern Sauerstoff und andere Nährstoffe zu den Wurzeln: die Sauerstoffzufuhr durch die Lösung mit Luft (klassische hydroponics) sättigt, durch die Wurzeln nicht zu allen Zeiten eingetaucht, oder indem man die Wurzeln vollständig ausgesetzt werden die Luft (aeroponics) 8. In Hydroponik,Nährlösung kann vor seiner Verwendung und verändert häufig mit Luft gesättigt werden, oder Luft kann kontinuierlich in der Lösung über den Lebenszyklus der Anlage 9 zugeführt werden. Alternativ können Pflanzen auch auf inerten Medien gezüchtet werden (beispielsweise Steinwolle, Vermiculit oder Blähton) und durch Eintropfen Lösung durch das Medium zu benetzen und Trockenzyklen ausgesetzt oder periodisch das Substrat in die Nährlösung eingetaucht 10. In aeroponics werden Wurzeln mit der Nährlösung besprüht Austrocknung zu verhindern.
Nachteile von hydroponischen Systemen
Obwohl hydroponischen Kulturen klare Vorteile gegenüber Boden-basierte Systeme bieten, gibt es einige Überlegungen, die anerkannt werden müssen, wenn die Daten zu interpretieren. Zum Beispiel hydroponischen Systemen belichten Pflanzen Bedingungen, die als nicht-physiologischen gesehen werden kann. Daher erfasst Phänotypen oder Pflanzen Antworten hydroponischen Systemen mit in der Größe variieren kann when Pflanzen werden in alternativen Systemen (beispielsweise Böden oder Agar-basierten Medien) gezüchtet. Diese Überlegungen sind nicht einzigartig für hydroponische Systeme; Differential Antworten können auch beobachtet werden , wenn Pflanzen in verschiedenen Bodenarten 11,12 angebaut werden.
Das folgende Protokoll liefert eine Schritt-für-Schritt-Anweisungen, wie ein hydroponischen System in einem Labor einzurichten. Dieses Protokoll wurde für Arabidopsis thaliana (Arabidopsis) optimiert; jedoch ähnlich oder in einigen Fällen identische Schritte verwendet werden können, andere Arten wachsen.
Protokoll
1. Sämling Kinderzimmer
- Vapor-Phase Sterilisation von Arabidopsis Samen
- Gießen Samen (40-50 mg) in 1,5 ml Zentrifugenröhrchen. (Siehe Abbildung 1 für eine geeignete Samenvolumen, ~ 50 & mgr; l). Beschriften Sie jedes Rohr mit Bleistift (Tinte während der Sterilisation abklingen kann). Legen Sie jedes markierte Rohr, Deckel öffnen, in einem Exsikkator 13.
- Platzieren Sie den Exsikkator in einem aktiven Abzugshaube und schließen des Ventils Exsikkator.
- Aliquotieren 100 ml Bleiche (NaClO 6,15%) in einen 250-ml-Becher und legen Sie sie dann in den Exsikkator gestellt.
- Schnell 3 ml 12 M Salzsäure zu der Bleiche eine Transferpipette. Schnell den Deckel des Exsikkator schließen, wenn die Reaktion schnell abläuft. Ermöglichen die Sterilisation für 4 h (Markierung ein Rohr mit Tinte und zum Sehen des Tinten verblassen hilft weg zu visualisieren, dass eine ausreichende Menge an Chlorgas erzeugt worden ist), um fortzufahren.
ACHTUNG: Chlorgas ist giftig; Griffseine Rückstände mit zusätzlichen Sicherheitsvorkehrungen in einem funktionalen Abzug durchführen. Kontakt lokalen Behörden oder besuchen Sie die Website des Environmental Health and Safety Department - University of Missouri (ESH-MU) 14 für die chemische Sicherheit und Richtlinien für die Verwendung einer Abzugshaube: https://ehs.missouri.edu/chem/. - Fünfzehn Minuten vor der Sterilisation abgeschlossen ist (3,75 h) ist, schalten Sie eine Laminar-Flow-Haube und reinigen Sie die Oberfläche 70% Ethanol verwendet wird.
- Nach 4 Stunden der Sterilisation das Ventil zu öffnen, kurz den Deckel des Exsikkator im Inneren der Dunstabzugshaube, entfernen Sie das Bleichmittel, entfernen und entsorgen Sie es nach institutionellen Verfahren. Dieser Schritt wird ein großer Teil der Chlordämpfe freisetzen. Verschließen Sie die Sterilisationskammer und bringen sie in die Laminar-Flow-Haube. Öffnen Sie den Deckel weit und belüften die sterilisierten Samen für ca. 40 min. Nach dieser Zeit verwenden die Samen sofort oder an einem trockenen Ort lagern.
Hinweis: Vapor-Phase Sterilisation von Samen wird empfohlen, aber andere Methoden such als alternative wäscht mit Ethanol, Bleiche und Wasser , wie in Alatorre-Cobos et al. 2 sind gleichermaßen effizient.
- Kulturmedien für Saatgut Keimung
Hinweis: Die Kulturmedien in diesem Schritt hergestellte ¼ Murashige und Skoog (MS) mit Vitaminen 15.- In 450 ml VE-Wasser (VE-Wasser), 0,55 g MS-Medium plus Vitamine, 0,3 g MES (4-Morpholinethansulfonsäure Hydrat) und einen magnetischen Rührstab in ein 1 L Becherglas.
- Auflösen und pH-Wert auf 5,7 unter Verwendung von NaOH und dann 3,5 g Phytoagar hinzuzufügen. Die Lösung wird für weitere 5 Minuten gerührt.
- Gießen Sie die gesamte Lösung in einen Messzylinder geben und DI-Wasser bis zu 500 ml. Autoklav diese 500 ml Lösung, mit der magnetischen Rührstab im Inneren, um einen 1 l autoklavierbare Flasche mit.
- Nachdem die Lösung autoklaviert wurde, rühren Sie die Lösung für 7-10 min den Magnetrührer in der Flasche verwendet wird.
- Nachdem die Medien abgekühltauf 50-60 ° C, die Medien in Platten unter sterilen Bedingungen gießen und lassen Sie es zu verfestigen. Platten können für die spätere Verwendung in dem Kühlraum gelagert werden.
- Seed Plattierung
- Schalten Sie den laminaren Strömungshaube 15 min vor der Verwendung, und die Oberfläche mit 70% Ethanol gereinigt werden. Die folgenden Punkte sind erforderlich: sterile Samen, Filterpapier, Zahnstochern, Mikropore Band und ¼ MS-Platten.
- Legen Sie die sterilen Samen auf einem sterilen Filterpapier. Etwas nass ein Ende eines sterilen Zahnstocher (mit sterilem Wasser oder durch die ¼ MS Medien Stossen). Verwenden Sie diese durchfeuchtet Ende die Samen aus dem Filterpapier zu holen und dann legen sie auf die Medienoberfläche.
- Verbreiten die Samen über die Platte bei einer Dichte von etwa 1 Samen pro cm 2 (Abbildung 2). Dann Mikropore Band verwenden, um die Platte Deckel Plattenkörper befestigt zu halten. Diese Art von Band hilft, eine Verunreinigung zu verhindern, während der Gasaustausch zwischen der Luft und dem Mikroklima ermöglicht inside die Platte.
- Vor der Keimung, stratify Samen durch die Platten zwei Tage im Kühlraum zu halten von Licht bedeckt.
- Nach Schichtung, legen Sie die Samen in einer Wachstumskammer oder an einem Ort mit optimalen Wachstumsbedingungen (23 ° C, 16 Stunden Licht / 8 Stunden Dunkelheit und 60% relativer Luftfeuchtigkeit für Arabidopsis). Pflanzgut für Hydroponik 10-12 Tage nach der Keimung bereit sein.
Anmerkung: Während der Keimung kann es zu erheblichen Kondensation unter dem Deckel der Platte, Ertrinken zu verhindern, das überschüssige Wasser sollte unter sterilen Bedingungen in einer laminaren Strömungshaube verworfen werden.
2. hydroponischen-Setup und Transplantationsprozess
- hydroponischen Lösung
Anmerkung: Wie in der Einleitung erwähnt, Pflanzen spezifischen Ernährungsbedarf haben können Arabidopsis wurde mit der Nährlösung in Tabelle 1 gezeigten 16 Abhängig von den Lieferanten erfolgreich gezüchtet, die..hat keinen Einfluss auf die Eigenschaften der Nährlösung aufgeführten Salze haben hier können unterschiedliche Wassergehalt (hydratisiert) und solche Alternativen verwenden, solange die Molarität konstant gehalten wird.- Herstellung der Stammlösungen jedes macronutrient in verschiedenen Flaschen (Tabelle 1) und alle Spurenelemente außer Fe-EDTA in einer sterilen Flasche (Sterilisieren durch Filtration unter Verwendung von 0,22 & mgr; m - Membranen). Immer Fe-EDTA schließlich hinzu, wenn die Lösung zu mischen. Bereiten Sie eine 10-fach Nährlösung im Vorfeld des Versuchs aber Autoklaven und lagern bei 4 ° C. Die Verwendung oder die Nährstoffe nur ändern, wenn der Nährstofflösung Raumtemperatur erreicht hat.
- Topfen
- Bereiten Pflanzenhalter und hydroponischen Behälter
- Einen Einschnitt im Schaum, läuft entlang seiner Länge mit einer Rasierklinge (siehe Abbildung 3). Bereiten Sie einen Stecker pro Pflanze.
- Flüssig-Autoklav Schaumrohr Stopfen in DI-Wasser getränkt.
- Schneiden Sie die Schaumstoffplatte in kleinere Bretter, um sicherzustellen , dass die Breite und Länge von Schaumstoffplatten sind 0,5 bis 1,0 cm weniger als Größe des Behälters (siehe Abbildung 4).
- Verwenden Sie einen Korkbohrer Löcher auf der Schaumplatte zu erstellen. Die Dichte der Pflanzen sollten idealerweise 1 Pflanze pro 10 cm 2 gleichmäßig verteilt werden. Diese Dichte wird die Pflanzen ordentlich voneinander getrennt; jedoch sind höhere Dichten möglich und werden nicht den Erfolg der Experimente nicht aus. Sicherstellen , dass die Größe der Löcher entspricht der Größe der Stecker (siehe Abbildung 4).
- Füllen Sie die Behälter mit der Nährlösung. Stellen Sie sicher, dass die Tiefe der Lösung für die Wurzelentwicklung (mindestens 5 cm) ausreichend ist. Dann legen Sie sorgfältig die Schaumstoffplatten auf die Oberfläche der Lösung.
- Einrichten des Luft-Pumpensystem zu Sauerstoff in die Lösung bereitzustellen (siehe Abbildung 5).
Hinweis: Füllen Sie das hydroponischen Behälter mit Nährlösung die same Tag Sämlinge transplantiert werden. Abdecken der Seiten des Behälters aus Licht wird dazu beitragen, das Algenwachstum zu verhindern.
- Sämling Übertragung von Platten Hydroponiksystem
- Verwenden Sie kleine Pinzette vorsichtig jeden Sämling ziehen aus dem Medium Platte und legen Sie die Wurzel entlang der Schnitt des Schaums Rohrstopfen. Vorsichtig stecken Sie den Sämling in den Schaumbrett legen Sie dann das Brett zurück in den hydroponischen Behälter des Schaumrohr zu halten. Siehe Abbildung 6 für entsprechende Manipulation.
- Bereiten Pflanzenhalter und hydroponischen Behälter
3. hydroponischen Experimente
- Nährlösung Austausch und Manipulation
- Nährlösung Ersatz
- Um die Nährlösung ersetzen, bereiten Sie frisches hydroponischen Lösung, wie in Schritt 2.1 beschrieben. Entfernen Sie die Schaumstoffplatte enthält Pflanzen aus dem hydroponischen Behälter und legen Sie sie in einem temporären Container gefüllt mitWasser oder hydroponischen Lösung.
- Entsorgen Sie die alte Lösung, spülen Sie den Behälter kurz dreimal mit VE-Wasser. Fügen Sie den frisch zubereiteten hydroponischen Lösung in diesem Behälter und legen Sie vorsichtig den Schaum Bord mit Pflanzen wieder in den hydroponischen Behälter. Ersetzen Sie die hydroponischen Lösung zweimal pro Woche.
- Ändern der Nährstoffzusammensetzung der hydroponischen Lösung
- Stellen Sie die Zusammensetzung der hydroponischen Lösung in Tabelle 1 gezeigt , um die endgültige Konzentration eines Elements von Interesse zu modifizieren. Beispielsweise Eisen (Fe) -Mangel, Ändern der hydroponischen Lösung zu verringern, die Konzentration von Fe-EDTA zu induzieren. Fügen Sie eine Reihe von Kontrollpflanzen angebaut auf voll (oder voll) hydroponischen Lösung, ohne jegliche Modifikation, zum Vergleich.
- Um die Nährlösung mit einem toxischen Element manipulieren, zunächst eine unabhängige Vorratslösung des gewünschten giftiges Element herzustellen, vorzugsweise 1,000x konzentriert. Benutze einenPipette die hydroponischen Lösung mit dem toxischen Element an der gewünschten Endkonzentration unter Verwendung des 1,000x konzentrierte Lager zu Spike.
- Zum Beispiel, um 3 l hydroponischen Lösung zu machen , 20 & mgr; M Cadmium enthält, um eine 0,5 M CdCl 2 Lager vorbereiten, und 120 & mgr; l der 0,5 M CdCl 2 Lager in den 3 L hydroponischen Lösung hinzuzufügen. Fügen Sie ein Steuersatz von Pflanzen auf hydroponics ohne CdCl 2 zum Vergleich angebaut.
ACHTUNG: Giftige Elemente wie Cadmium, Arsen und Blei sind sehr gefährlich für die menschliche Gesundheit und die Umwelt. Bitte kontaktieren Sie die lokalen Behörden oder besuchen Sie die Webseite des EHS-MU (https://ehs.missouri.edu/train/chemical.html) 14 für Umwelt- und Gesundheitssicherheitsrichtlinien vor der Durchführung von Experimenten.
- Nährlösung Ersatz
- Instrumentensterilisation für den nächsten Experimente
- Da fast das gesamte Material kann den hydroponischen einrichten vorzubereiten verwendet werdenReinigen wieder verwendet, um die verschiedenen Teile mit verdünnter Bleiche (NaClO 0,6%).
- Nachdem er mit Bleich Spülen, spülen Sie alle Materialien gründlich mit VE-Wasser. Behälter, Schaumplatten und Aquarium Blase Steine in einem trockenen Platz für die zukünftige Verwendung. Schaumstoffstöpsel sind bereit für die Wiederverwendung nach den Wurzeln zu entfernen und im Autoklaven behandelt werden.
Ergebnisse
In diesem Abschnitt werden die Ergebnisse von zwei Arten von Experimenten, hier die Hydroponiksystem beschriebenen, dargestellt. Im ersten Experiment wurde die Nährlösung verschiedenen Konzentrationen von Zink zu erhalten, modifiziert. Wir modifiziert auch die Nährlösung durch Zugabe von nicht-letalen Konzentrationen des toxischen Elements Cadmium (Abbildung 7). Im zweiten Experiment verwendeten wir induktiv gekoppelte Plasma - 1 optische Emissionsspektrometrie (ICP-OES) die elementare Zusammensetzung der Wurzeln und Blätter von Pflanzen in der hydroponischen Lösung , die Cadmium (Abbildung 8) gewachsen zu messen. Dieses Experiment veranschaulicht die Vorteile der separat Wurzeln und Blätter zu erhalten.
Experiment 1
Arabidopsis - Keimlinge (Col-0) wurden in der hydroponischen System in pr beschrieben gezüchtetotocol Schritte 1 und 2. Die Pflanzen wurden für eine Gesamtmenge von 3 Wochen wachsen gelassen , bevor mit verschiedenen Zinkkonzentrationen (7A-B) oder eine nicht-letale Konzentration an Cadmium (7C) behandelt. Sechs Tage nach der Behandlung, Pflanzen bei hohen Zinkkonzentrationen gewachsen (> 42 & mgr; M) zeigte , verzögerte Wachstum durch Toxizität zu Zn, während Pflanzen ohne zusätzliche Zink auch Wachstum zeigen verzögert hinzugefügt im Vergleich zu Pflanzen angebaut mit 7 & mgr; M Zn 2+. Abbildung 7 auch das zeigt Reduktion der Sprosswachstum, das Wurzelwachstum und chlorotisch Blatt Symptome typisch für Cadmium (7C) ausgesetzt Pflanzen.
Experiment 2
Col-0 Pflanzen wurden wie in den Schritten 1 und 2. Nach zwei Wochen der nicht modifizierten (voll) Lösung wurde mit 80 ml der hydroponischen Lösung, enthaltend 20 uM Cd ersetzt beschrieben gezüchtet. Nach 72 Stundens, wurden Wurzelgewebe durch Übertragung des gesamten Schaumplatte mit Pflanzen in ein neues Gefäß, das 80 ml 20 mM Tris (pH 8,0) und 5 mM EDTA gewaschen. Diese Lösung wird die Schwermetalle an der Oberfläche des Wurzel gebunden entfernen. Die Pflanzen wurden in dem EDTA enthaltenden Lösung auf einem Rotationsschüttler für 5 Minuten inkubiert. EDTA-Lösung wurde dann mit 80 ml VE-Wasser ersetzt und Pflanzen wurden für weitere 5 Minuten auf dem Rotationsschüttler inkubiert. Dieser Spülschritt mit DI-Wasser wurde zweimal wiederholt. Nach dem Spülen wurden 1 für ICP-OES unabhängig und verarbeitet geernteten die Pflanzen mit DI - Wasser, Blatt und Wurzelgewebe. 8 zeigt , daß die elementare Zusammensetzung der Blätter aus Wurzeln verschieden ist, wo macronutrients (Ca, K und Mg) in Blattgewebe vorhanden sind, in höherer Konzentration im Vergleich zu den Wurzeln. Auf der anderen Seite, Spurenelemente, wie beispielsweise Zn und Fe in Wurzeln bevorzugt akkumuliert. Die Konzentration des nicht-essentiellen Element Cadmium wurde festgestellt, hallo zu sein gher in Wurzeln Triebe verglichen.
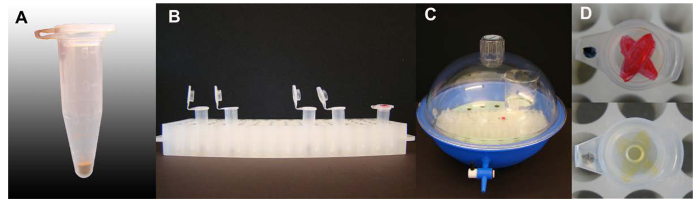
Abbildung 1. Vapor-Phase Sterilisation von Arabidopsis Samen. (A) Menge an Arabidopsis Samen pro 1,5 ml Zentrifugenröhrchen. (B) Rohre Samen mit Kappen offen in der Rohrgestellhalter bereit für die Sterilisation enthält, ein Rohr mit einer farb markiert auf der Kappe enthalten ist. (C) Sterilisation eingerichtet in einem Exsikkator, Deckel und Ventil geschlossen. (D) Die Tinte-Markierung auf dem Deckel eines Rohres in den Samen Sterilisationsprozess mit einer starken Farbe der Tinte Zeichen vor und nach der Sterilisation enthalten. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
files / ftp_upload / 54317 / 54317fig2.jpg "/>
Abbildung 2. Seed Beschichtungsschritt. (A) Die Samen werden auf sterilisierte Papier gelegt vor dem Beschichten. Eine sterilisierte Zahnstocher wird auch für diesen Schritt erforderlich. (B) leicht benetzen das Ende des Zahnstocher mit den Medien oder Wasser auf der Seite des Mediums Platte. (C) Die Samen werden bewegt MS Platten auf ¼. (D) Eine ideale Dichte von Samen ist ≈1 Samen / cm 2. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
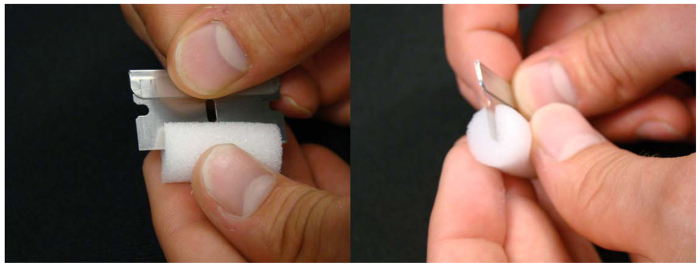
Abbildung 3. Schaum Stecker verwendet Sämlinge in der Nährlösung zu halten. Ein Schnitt auf die Hälfte des Schaumrohr Stecker hilft bei Verpflanzung von Platten in die Hydroponik den Sämling zu halten.Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 4. Schaumbrett Vorbereitung. (A) Überprüfen Sie die Größe der Vorlage Schaumplatte mit der Behältergröße vor Schaumplatten in großen Mengen vor. Zwei kleine Löcher in der Mitte des Schaumplatte aus machen es einfacher ist, den Schaum mit einer Pinzette zu halten und zu handhaben. (B- C) Ein Korkbohrer wird verwendet , um Löcher auf der Schaumplatte zu erstellen. (D) Überprüfen Sie den richtigen Sitz zwischen dem Schaumrohr Stecker und Löcher auf der Schaumplatte erstellt. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

. Abbildung 5. Luftpumpeneinstellung für hydroponischen Experiment von oben-Ansicht (A) und Seitenansicht (B) Die Zahlen zeigen: 1 - Pumpe Zufuhr von Luft; 2 - Kunststoffschlauch um die Luftpumpe mit dem Ventilsystem verbindet den Luftstrom zu steuern; 3 - das Ventilsystem; 4 und 5 - Kunststoffschlauch das Ventilsystem mit Blasensteinen für die Belüftung zu verbinden; 6 und 7 -. Blasensteine (für Aquarien verkauft) Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 6. Übertragung von Pflanzgut zur hydroponischen Systems. (A) Verwenden Sie Pinzette einen Sämling aus dem Medium Platte zu nehmen. (B) Platzieren Sie den Sämling root entlang der Einschnitt auf der Schaumrohr Stecker. (C) Setzen Sie den Schaumstoffschlauch Stecker in die Schaumplatte. (D) Ein ausgefülltes Schaumbrett Einstellung mit Sämlinge bereit , auf die Nährlösung platziert werden. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abbildung 7 Nährlösungen können modifiziert werden , Mangel oder toxischen Wirkungen von Elementen zu testen , 4 Wochen alte Arabidopsis hydroponically gezüchtet 6 Tage nach der Behandlung. (AB) Pflanzen angebaut und mit 0, 7, 14, 21, 28, 35, 42, und 50 & mgr; M Zn. Pflanzen bei hohen Zn-Konzentrationen gewachsen (> 42 & mgr; M) zeigen verzögertes Wachstum (Toxizität), während Pflanzen ohne Zn auch (Nährstoffmangel) zeigen verzögerte Wachstum im Vergleich hinzugefügt zu Pflanzen angebaut mit 7 uM Zn 2+. (C) Pflanzen in Abwesenheit (links) oder in Gegenwart von 20 & mgr; M Cd in der Nährlösung (Bild nach 6 Tagen Cd Belichtung aufgenommen wurde) gezüchtet. Cadmium Exposition induziert Chlorose und reduziert das Wachstum. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
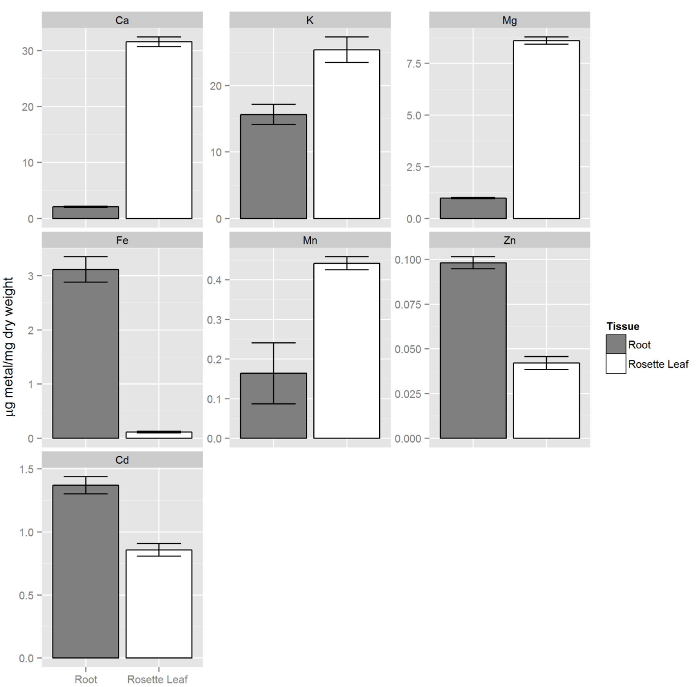
Abbildung 8. Die Elementarzusammensetzung von Wurzeln und Sprossen von Pflanzen angebaut hydroponically. Shoots mehr macronutrients enthalten (Ca, K, Mg) im Vergleich zu den Wurzeln , während die essentiellen Mikronährstoffen Zink und Eisen sind konzentrierter in Wurzeln. Auch die nicht-essentielle Element Cadmium wird vorzugsweise in den Wurzeln angesammelt. Die Fehlerbalken stellen die 95% Konfidenzintervall (n = 14, Sprossen und n = 9, Wurzeln)._upload / 54317 / 54317fig8large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
| Art der Nährstoff | Salz / Reagenz | Konzentration in hydroponischen Lösung | Einheit |
| macronutrient | KNO 3 | 1,250 | mM |
| macronutrient | KH 2 PO 4 | 0,625 | mM |
| macronutrient | MgSO 4 | 0,500 | mM |
| macronutrient | Ca (NO 3) 2 | 0,500 | mM |
| Micronutrient | H 3 BO 3 | 17,500 | uM |
| Micronutrient | MnCl 2 | 5,500 | uM |
| Micronutrient | ZnSO 4 | 0,500 | uM |
| Micronutrient | Na 2 MoO 4 | 0,062 | uM |
| Micronutrient | NaCl 2 | 2,500 | uM |
| Micronutrient | CoCl 2 | 0,004 | uM |
| Micronutrient | FeEDTA | 12,500 | uM |
Tabelle 1 Effektive Konzentration von Nährstoffen in der hydroponischen Lösung.
Diskussion
Die Gesundheit der Sämlinge für Hydroponik verwendet ist einer der wichtigsten Faktoren für den Erfolg eines hydroponischen Experiments beiträgt. Sterilisation von Instrumenten, Samen und Kulturmedien auch eine wichtige Rolle bei der Verringerung der Gefahr einer Kontamination spielen und einen guten Start für die Pflanzen zur Verfügung stellen, bevor sie in den hydroponischen System transplantiert werden. Eine Arbeitsumgebung mit Einrichtungen wie einem Autoklaven, Dunstabzug, Kühlraum (4 ° C), und Wachstumsraum mit kontrollierten Bedingungen (Lichtintensität und Temperatur) ist notwendig für eine gute Versuchsanordnung.
Die Frische der Nährlösung bestimmt auch die Pflanzengesundheit und wiederum bestimmt den Erfolg eines hydroponischen Experiment. Da Wasser verdunstet unter schneller direkte Beleuchtung, wird die Konzentration von Salzen aufgrund einer Verringerung der Gesamtlösungsvolumen verändern; Daher ist es am besten, die hydroponischen Lösung mindestens zweimal in der Woche zu ändern. Wenn jedoch große, tiefe Behältermit einer Luftpumpe ausgestattet werden verwendet, es nicht kann notwendig sein, die Nährlösung für Experimente zu ersetzen, die von kurzer Dauer sind. Beachten Sie, dass im Fall von Arabidopsis wir Magenta Gefäße verwendet (77 mm Breite x 77 mm Länge x 97 mm Höhe) , aber andere, größere Behälter auch verwendet werden kann , um größere Anlagen aufzunehmen.
Für die Forscher interessiert an Pflanzennährstoffe, bieten hydroponischen Experimente eine einzigartige Kulisse Anlage Phänotypen und Reaktionen auf verschiedene Nährstoffverfügbarkeit 17 zu testen. Durch die Manipulation der Konzentrationen der Elemente von Interesse, können die Forscher verschiedene Experimente zu testen, um die Auswirkungen der Suffizienz, Mangel oder toxische Konzentrationen von essentiellen und nicht-essentiellen Nährstoffen eingerichtet. Gegenüber dem Boden-basierten System stellt die hydroponische System eine homogenere Nährmedium für die Pflanzen mit einem geringeren Risiko von bodenbürtigen Krankheiten. Darüber hinaus können sowohl Wurzel- und Sprossgewebe leicht geerntet und getrennt werdenfür weitere Analysen auf spezifische Pflanzengewebe.
In der repräsentativen Abschnitt stellten wir zwei Beispiele, bei denen ein einfaches hydroponischen System wurde für genauere Untersuchungen über Pflanzenernährung. In dem ersten Beispiel von Pflanzen auf einem Zink Konzentrationsgradienten wächst, konnten wir das Niveau der Steuerung zu veranschaulichen, die auf Nährstoffzusammensetzung unter Verwendung dieses hydroponischen System erreicht werden kann. Pflanzen mit 7 uM Zn gewachsen wuchs viel stärker im Vergleich zu den Pflanzen in 50 & mgr; M Zn gewachsen, während Pflanzen angebaut, ohne zusätzliche Zn auf Pflanzen verglichen wurden verkümmert zugegeben mit 7 uM Zn gewachsen. Dies war aufgrund der Länge der Zeit teilweise die Pflanzen unter ausreichenden Bedingungen wachsen gelassen wurden; früheren Entfernen von Zn aus den Medien ist wahrscheinlich stärker Zink-Mangelerscheinungen zu induzieren. Anwendung des gleichen Prinzips, konnten wir Toxizität zu induzieren, die nicht-essentielle Metall verwendet, Cadmium, von dem bekannt ist das Pflanzenwachstum zu beeinträchtigen.
In dieser Sekundebeispielsweise die Elementzusammensetzung von Col-0 Wurzeln und Sprossen, behandelt mit 20 & mgr; M Cd 72 h wurde durch ICP-OES bestimmt. Wir fanden Unterschiede in allen erfassten Metalle zwischen Wurzeln und Sprossen. Makroelemente wurden in höheren Konzentrationen in den Trieben relativ zu den Wurzeln gefunden, während Eisen und Zink waren reichlicher in Wurzeln gefunden. Cadmium gefolgt ein Muster ähnlich wie Eisen und Zink, konzentrierter in Wurzeln im Vergleich zu Sprosse ist. Diese Daten untermauern die Idee , dass Blätter und Wurzeln bieten verschiedene Informationen über den ionome Zustand der Anlage und müssen daher beide Gewebe separat analysiert werden Mineralstoffernährung und Komposition an der ganzen Pflanze Ebene zu verstehen. Neben ICP-OES verschiedene spektroskopische Methoden wie Atomabsorptionsspektroskopie (AAS) oder induktiv gekoppelter Plasma - Massenspektrometrie (ICP-MS) können auch die Elementzusammensetzung (ionome) von Pflanzengeweben 18-20 zu messen , verwendet werden.
In einem Hydroponischesc Versuch, die Symptome und Phänotypen von Pflanzen auf unterschiedliche Nährstoffbedingungen reagieren stellen den Anfang dessen, was in mehr ausgeweitet werden könnte erarbeitet Analysen wie Genexpression (Transkriptom) und Proteinmenge (Proteomics). Diese -omic Techniken sind der Schlüssel pflanzlichen Stoffwechsel zu integrieren , indem sie Prozesse in einer gewebespezifischen Weise berücksichtigen.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
This research was supported by the University of Missouri Research Board (Project CB000519) and the US National Science Foundation (IIA-1430428 to DMC). Nga T. Nguyen was supported by the Vietnam Education Foundation Training Program (Exchange visitor program No. G-3-10180). We also thank Roger Meissen (MU Bond Life Sciences Center) for his assistance and expertise during the video recording and editing sessions.
Materialien
| Name | Company | Catalog Number | Comments |
| For seed sterilization | |||
| Bleach | The Clorox Company | NA | The regular bleach www.cloroxprofessional.com |
| Hydrochloric acid | Fisher Scientific | A144-500 | |
| Desiccator body | Nalgene | D2797 SIGMA | Marketed by Sigma-Aldrich |
| Desiccator plate | Nalgene | 5312-0230 | Marketed by Thermo Scientific |
| For one quarter MS medium preparation | |||
| MES | Acros Organics | 172591000 | 4-Morpholineethanesulfonic acid hydrate |
| Murashige and Skoog (MS) | Sigma-Aldrich | M0404-10L | |
| KOH | Fisher Scientific | P250-500 | |
| Phytoagar | Duchefa Biochemie | P1003.1000 | |
| Square plate | Fisher Scientific | 0875711A | Disposable Petri Dish With Grid |
| For seed plating | |||
| Filter paper | Whatman | 1004090 | |
| Toothpick | Jarden Home Brands | NA | |
| Aluminum foil | Reynolds Wrap | NA | Standard aluminum foil |
| Micropore tape | 3M Health Care | 19-898-074 | Surgical tape; Marketed by Fisher Scientific |
| For hydroponic solution preparation | |||
| KNO3 | Fisher Scientific | BP368-500 | |
| KH2PO4 | Fisher Scientific | P386-500 | |
| MgSO4 | Fisher Scientific | M63-500 | |
| Ca(NO3)2 | Acros Organics | A0314209 | |
| H3BO3 | Sigma | B9645-500G | |
| MnCl2 | Sigma-Aldrich | M7634-100G | |
| ZnSO4 | Sigma | Z0251-100G | |
| Na2MoO4 | Aldrich | 737-860-5G | |
| NaCl2 | Fisher Scientific | S271-1 | |
| CoCl | Sigma-Aldrich | 232696-5G | |
| FeEDTA | Sigma | E6760-100G | |
| “Stericup & Steritop” bottle | Milipore Corporation | SCGVU02RE | Micronutrient container www.milipore.com |
| For root wash buffer preparation | |||
| EDTA | Acros Organics | A0305456 | |
| Tris | Fisher Scientific | BP154-1 | |
| For hydroponic setup | |||
| Autoclavable foam tube plug | Jaece Industries Inc. | L800-A | Identi-Plugs fit to holes with 2R = 6-13 mm |
| Foam Board | Styrofoam Brand Dow | ESR-2142 | Thickness is 1/2 inches |
| Cork borer | Humboldt | H-9662 | Cork Borer Sets with Handles, , Plated Brass Set of 6, 3/16" to 1/2" OD Size |
| Air pump | Aqua Culture | MK-1504 | |
| Air pump | Marketed by Wal-mart Stores, Inc. | ||
| Airline tubing and aquarium bubble stones | Aqua Culture | Tubing: 928/25-S | |
| Airline tubing and aquarium bubble stones | Marketed by Wal-mart Stores, Inc. | Stone: ASC-1 | |
| Other | |||
| Ethanol | Fisher Scientific | A995-4 | Reagent Alcohol |
| Cadmium Chloride (CdCl2) | Sigma-Aldrich | 10108-64-2 | |
Referenzen
- McDowell, S. C., et al. Elemental Concentrations in the Seed of Mutants and Natural Variants of Arabidopsis thaliana Grown under Varying Soil Conditions. PLoS ONE. 8, 1-11 (2013).
- Alatorre-Cobos, F., et al. An improved, low-cost, hydroponic system for growing Arabidopsis and other plant species under aseptic conditions. BMC Plant Biol. 14, 69-69 (2014).
- Berezin, I., Elazar, M., Gaash, R., Avramov-Mor, M., Shaul, O., Asao, T. The Use of Hydroponic Growth Systems to Study the Root and Shoot Ionome of Arabidopsis thaliana. Hydroponics - A Standard Methodology for Plant Biological Researches. , (2012).
- Conn, S. J., et al. Protocol: optimising hydroponic growth systems for nutritional and physiological analysis of Arabidopsis thaliana and other plants. Plant Methods. 9, 4-4 (2013).
- Kopittke, P. M., Blamey, F. P. C., Asher, C. J., Menzies, N. W. Trace metal phytotoxicity in solution culture: a review. J. Exp. Bot. 61, 945-954 (2009).
- Gent, M. P. N. Composition of hydroponic lettuce: effect of time of day, plant size, and season. J. Sci. Food Agric. 92, 542-550 (2012).
- Gibbs, J., Turner, D. W., Armstrong, W., Darwent, M. J., Greenway, H. Response to oxygen deficiency in primary maize roots. I. Development of oxygen deficiency in the stele reduces radial solute transport to the xylem. Funct. Plant Biol. 25, 745-758 (1998).
- Zobel, R. W., Del Tredici, P., Torrey, J. G. Method for Growing Plants Aeroponically. Plant Physiol. 57, 344-346 (1976).
- Chang, D. C., Park, C. S., Kim, S. Y., Lee, Y. B. Growth and Tuberization of Hydroponically Grown Potatoes. Potato Research. 55, 69-81 (2012).
- Resh, H. M. . Hydroponic Food Production : A Definitive Guidebook for the Advanced Home Gardener and the Commercial Hydroponic Grower, Seventh Edition. , 199-292 (2012).
- Sharma, H. K., Chawan, D. D., Daiya, K. S. Effect of different soil types on plant growth, leaf pigments and sennoside content in Cassia species. Pharmaceutisch weekblad. 2, 65-67 (1980).
- Strojny, Z., Nowak, J. S. Effect of different growing media on the growth of some bedding plants. Acta horticulturae. 19, 157-162 (2004).
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods Mol Biol. 2, 87-103 (2006).
- . Chemical Safety Environmental Health and Safety - University of Missouri Available from: https://ehs.missouri.edu/ (2013)
- Murashige, T., Skoog, F. A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures. Physiol. Plant. 15, 473-497 (1962).
- Lee, D. A., Chen, A., Schroeder, J. I. ars1, an Arabidopsis mutant exhibiting increased tolerance to arsenate and increased phosphate uptake. Plant J. 35, 637-646 (2003).
- Pii, Y., Cesco, S., Mimmo, T. Shoot ionome to predict the synergism and antagonism between nutrients as affected by substrate and physiological status. Plant Physiol. Biochem. 94, 48-56 (2015).
- Baxter, I. Ionomics: studying the social network of mineral nutrients. Curr. Opin. Plant Biol. 12, 381-386 (2009).
- Baxter, I. Ionomics: The functional genomics of elements. Brief Funct Genomics. 9, 149-156 (2010).
- Salt, D. E. Update on plant ionomics. Plant Physiol. 136, 2451-2456 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten