Method Article
Ursprünglicher experimenteller Ansatz zur Beurteilung Transport Kraftstoff Stabilität
In diesem Artikel
Zusammenfassung
Oxidationsstabilität von Kraftstoffen hat eine Sorge für die zukünftige Entwicklung von Kraftstoffen werden. Diese Arbeit stellt eine originelle Methode , die von IFP Energies Nouvelles entwickelt für die Beurteilung der Kraftstoffstabilität unter Verwendung von zwei verschiedenen Reaktoren. Diese Methode wurde erfolgreich eine eingehende Verständnis der Oxidationskinetiken und Wege der Modellmoleküle und kommerzielle Brennstoffe zu gewinnen angewandt.
Zusammenfassung
Die Untersuchung der Kraftstoffoxidationsstabilität ist ein wichtiges Thema für die Entwicklung zukünftiger Kraftstoffe. Diesel und Kerosin Kraftstoffsysteme haben eine Reihe von technologischen Veränderungen erfahren zu ökologischen und wirtschaftlichen Anforderungen gerecht werden. Diese Entwicklungen haben in zunehmend schwierigen Betriebsbedingungen, deren Eignung für konventionelle und alternative Kraftstoffe zur Folge muss angegangen werden. Beispielsweise als Biodiesel eingeführt Fettsäuremethylester (FAME) sind anfälliger für Oxidation und kann zur Bildung von Ablagerungen führen. Obwohl mehrere Methoden existieren Brennstoffstabilität (Induktionsperiode, Peroxiden, Säuren und unlösliche Stoffe) zu bewerten, kann keine Technik eine die Echtzeit-Oxidationsmechanismus zu überwachen und die Bildung von Oxidationszwischenprodukte zu messen, die zur Bildung von Ablagerungen führen kann. In diesem Artikel haben wir eine fortschrittliche Oxidationsverfahren (AOP), basierend auf zwei existierenden Reaktoren. Dieses Verfahren ermöglicht die Simulation verschiedener Oxidationsbedingungen und dem Monitoring der Oxidations Fortschritte durch die Mittel makroskopischer Parameter wie Gesamtsäurezahl (TAN) und erweiterte analytische Methoden wie Gaschromatographie gekoppelt mit der Massenspektrometrie (GC-MS) und Fourier-Transformations-Infrarot - abgeschwächter Totalreflexion (FTIR-ATR). Wir wandten AOP erfolgreich eine eingehende Verständnis der Oxidationskinetiken eines Modellmolekül (Methyloleat) und den kommerziellen Diesel und Biodiesel-Kraftstoffen zu gewinnen. Diese Entwicklungen stellen eine Schlüsselstrategie für die Kraftstoffqualitätsüberwachung während der Logistik und On-Board-Nutzung.
Einleitung
Oxidationsstabilität ist ein Kriterium, Kraftstoffqualität für die Bewertung. Die Oxidationsstabilität eines Kraftstoffs kann durch verschiedene Verfahren, wie beispielsweise Induktionsperiode, Peroxiden, Säuren und unlösliche Bestandteile beobachtet werden. Die Induktionsperiode (IP) ist die Zeit zu Beginn des Oxidationsverfahrens, in dem die Reaktionen langsam sind, aufgrund einer geringen Konzentration an Reaktionszwischenprodukte oder die Anwesenheit von Antioxidantien.
1 stellt einen vereinfachten Mechanismus der Oxidation von Kohlenwasserstoffen. Als 1,2 berichtet, folgt die Oxidation von Kohlenwasserstoffen in der flüssigen Phase , die hauptsächlich einen radikalischen Mechanismus. Sie geht nach drei Schritten: Einleitung, die Ausbreitung und Kündigung. Während der Initiierungsschritt werden freie Radikale durch Wasserstoffabstraktion von der anfänglichen Kohlenwasserstoff (RH) oder der Zersetzung von Hydroperoxiden bereits in dem Brennstoff (R1a-c) gebildet ist. Die Zugabe von Di-Sauerstoff zu den gebildeten Radikale führt zu Peroxid Formation gemäß der Reaktion (R2). Die Ausbreitungs Schritt geht in erster Linie durch die Peroxid-Route. Das Peroxid reagiert mit dem gebildeten Ausgangskohlenwasserstoff durch Wasserstoffabstraktion oder durch Zugabe Herstellung Hydroperoxide oder Polyperoxide nach Reaktionen (R3a) und (R3b), respectively. Die Zersetzung von Hydroperoxiden erzeugt verschiedene oxygenierte Produkte, vor allem Alkohole, Carbonyle, Epoxiden und Alkanen (R4). Der Abbruchschritt tritt auf, wenn stabile Produkte durch freie Radikale Rekombination (R5-R7) ausgebildet sind. In dieser Arbeit wurde ein Verfahren entwickelt, den Oxidationsprozess unter Verwendung von zwei vorhandenen Oxidationsreaktoren zu überwachen.

Abbildung 1. Vereinfachte Mechanismus der Kohlenwasserstoff - Oxidation Der Mechanismus stellt globalisierten Schlüsselschritte der Oxidation von Kohlenwasserstoffen , darunter mehrere bekannte Schritte:. Initiation Ausbreitung und Terminierung. This Zahl wurde mit freundlicher Genehmigung von 8 Copyright 2015 American Chemical Society. nachgedruckt Bitte klicken hier , um eine größere Version dieser Figur.
Die beschleunigte Oxidation wurde unter Verwendung eines Rancimat Vorrichtung (Reaktor 1) durchgeführt. Dieses Gerät ist für den Standardtest von FAME und FAME haltigen Dieselkraftstoff nach der Norm EN 15751 3 verwendeten Reaktor 1 mit zwei Heizblöcke ausgestattet:.. Heizblock A und Heizung Block B Jeder Heizblock enthält 4 Reaktionsgefäße, nummeriert von 1 bis 4, bis 4 Messzellen verbunden. Ein Teil der flüchtigen Spezies, bei der Oxidation erzeugt wird, durch die zirkulierende Luft mitgerissen und durch eine Messzelle, die mit destilliertem Wasser gefüllt erfasst. Die Variation der Wasserleitfähigkeit Signal wird kontinuierlich überwacht. Die Induktionsperiode (IP) durch einen plötzlichen Anstieg der Leitfähigkeit a gekennzeichnetssociated insbesondere mit flüchtigen Säurespezies. Weitere Einzelheiten über die Standardmethode kann an anderer Stelle 4,5 gefunden werden.
Die PetroOXY Vorrichtung (Reaktor 2) wurde ebenfalls eine beschleunigte Kraftstoff-Oxidationstest verwendet auszuführen. Dieses Gerät ist für die Messung der Oxidationsstabilität von Mitteldestillaten und Benzin nach der ASTM D 7545 und ASTM D 7525 - Standards 6,7 verwendet. Die Induktionsperiode durch die Vorrichtung gemessen wird als die Zeit, die notwendig definiert, um eine 10% Druckabfall (AP) in der Testzelle Kopfraum gemessen zu erreichen.
Diese Techniken wurden für den Standard - Charakterisierung von Oxidationsstabilität von Mitteldestillat - Kraftstoffen sowie zur Oxidationskinetik Studien 8, 9, 10,11 weitgehend verwendet.
Protokoll
HINWEIS: Bitte wenden Sie alle relevanten Sicherheitsdatenblätter (MSDS) vor dem Gebrauch. Der Bediener muss mit persönlicher Schutzausrüstung ausgestattet werden, einschließlich der Handschuhe, Kittel und Schutzbrille tragen. Vor dem Gebrauch müssen frische Reagenzien im Kühlschrank aufbewahrt werden. Oxidierte Brennstoffe sind reich an korrosiven sauren Spezies. Sie können nicht in Metallflaschen gelagert werden und muss im Kühlschrank in geeigneten Glasgefäßen, mit begrenzten Luftraum Luft gelagert werden, in einer vertikalen Position Kontakt zwischen dem Brennstoff und dem Kolben-Cap zu vermeiden. Der Kühlschrank wurde bei 6 ° C gehalten. Die Oxidation erzeugt flüchtige Oxidationsprodukte, die die Atemwege reizen kann. Daher müssen alle Oxidationsversuchen, die unter einer Abzugshaube getragen werden.
1. Advanced Oxidation Verfahren in Reaktor 1
HINWEIS: Reaktor 1 wurde verwendet , um die kontrollierte Oxidation von Methyloleat (MO), eine mono-ungesättigte Modellmolekül repräsentativ für kommerzielle FAME 3 auszuführen </ Sup>. Die Tests sollen bei der Überwachung MO Oxidation durch die folgenden Schritte.
- Bestimmen Sie die mittlere Induktionsperiode (IP)
- Bereiten Sie die Reaktionsgefäße und die Meßzellen nach dem Standard - Testverfahren 4.
- Entfernen Sie mögliche Staub oder Verunreinigungen aus den Reaktionsgefäßen, bevor Kraftstoff Einführung mit Druckluft.
- Füllen Sie die Reaktionsgefäße von Block A: 1 bis 4 mit 7 ml einer frischen Brennstoffprobe Oelsäuremethylester mit einer Pipette.
- Konfigurieren Sie den Test.
- Stellen Sie die Solltemperatur für Heizen von Block A bis 110 ° C (± 0,3 ° C).
- Stellen Sie die Luftströmungsrate werden durch die Probe auf 10 L / h geperlt.
- Stellen Sie die Abschaltkriterien entweder eine Leitfähigkeitsschwelle von 400 & mgr; S / cm oder eine IP von der Software bestimmt. Der Test wird beendet, wenn eines der beiden Kriterien erreicht ist.
- Geben Sie den Namen und Referenz von jeder der Proben von Block A indie Software.
- Starten Sie den Test, indem Sie die Schaltfläche "Start" drücken.
ANMERKUNG: Dies bedeutet gleichzeitig Luft durch die Probe sprudeln und Anheben des Heizblocks Temperatur (die Erwärmungszeit etwa 45 min für eine Solltemperatur von 120 ° C). Wenn das Abschaltkriterium erreicht ist, werden die Luftblasenbildung und die Blockheizung automatisch unterbrochen. - Extrahieren Sie die Reaktionsgefäße aus dem Heizblock.
- Manuell und gründlich die Inhalte des Reaktionsgefäßes geschüttelt, um die Brennstoffzusammensetzung zu homogenisieren. Übertragen Sie den Inhalt jedes Reaktionsgefäß in einen 10-ml-Glaskolben, und legen Sie die Glaskolben vertikal im Kühlschrank sofort nach der Extraktion.
- Bestimmung der Induktionsperiode (IP) aus dem Leitfähigkeitssignal der Methode der Tangenten Schnitt in Abbildung 2 veranschaulicht werden. Die Induktionsperiode von der Position der Schnittpunkt der extrapolierten Grundlinie angegeben ist (T1) und dasTangentenlinie von der Kurve Wende gezogen (T2) auf der x-Achse.
- Berechnen Sie die durchschnittliche IP (IP avg) die IP - Messungen verwenden , die Dispersion innerhalb von 10% der IP sind gemäß: IP avg = Σ IP gültig / n, wobei IP die IP - Messungen innerhalb von 10% der IP - Dispersion und n ihre Nummer gültig darstellt.
- Generieren Proben mit unterschiedlichen Oxidationsstufen
- Mit Block B, wiederholen Sie die Schritte 1.1.-1.5. Allerdings ändern Sie das Abschaltkriterium eine Endzeit gleich 4 Mal durch die Angabe der IP in Schritt 1.1.9 bestimmt durchschnittl.
- Auszug "von Hand" die erste Reaktionsgefäß aus dem Heizblock bei 0,5 der IP, das zweite Reaktionsgefäß bei der IP, das dritte Reaktionsgefäß bei 2 mal die IP und die vierte und letzte Reaktionsgefäß bei 4 mal UZ.
- Für jedes Reaktionsgefäß, manuell und gründlich die conten agitierents des Gefäßes um eine homogene Probe zu haben. Der gesamte Inhalt in 10 ml Glaskolben, beschriften jede Probe (0,5 IP, IP, 2 IP und 4 IP, jeweils) und legen Sie die Glaskolben vertikal im Kühlschrank sofort nach der Extraktion.
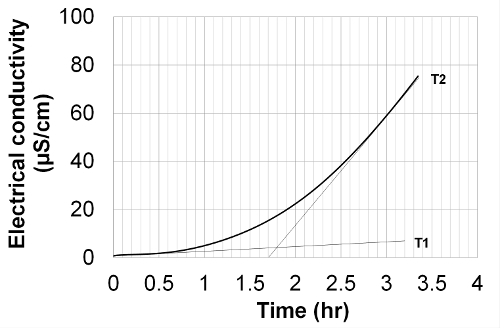
Abbildung 2. Induktionszeit - Bestimmungsverfahren durch Tangenten Kreuzung; Test auf Methyloleat bei 110 ° C. Die Induktionsperiode von der Position der Schnittpunkt der Extrapolation der Basislinie (T1) und der Tangentenlinie von der Kurve Flexion (T2) auf der x-Achse. gezeichnet gegeben Hier klicken anzuzeigen eine größere Version dieser Figur.
- Analysieren der erzeugten Proben
- Bestimmen Sie die TAN Oelsäuremethylester bei zunehmender OXID abgetastetation Stufen der μTAN Verfahren (abgeleitet von ASTM D664 9) verwendet wird .
- Spülen Sie alle Teile in Kontakt mit der Probe (Probengefäß, Elektrode und Magnetrührer) mit Reinstwasser von Isopropanol.
- Abwiegen 2 g der Probe und legen Sie sie in das Messgefäß.
- Verdünne die Probe in 10 g Isopropanol in das Meßgefäß.
- Nach und nach in Isopropanol eine Lösung von 0,1 mol / l KOH verdünnt, bis der Äquivalenzpunkt erreicht ist. Dies wird durch eine signifikante Potentialänderung angegeben (über 9 mV) gemessen, indem eine Glaselektrode.
- Berichten über die TAN der Probe in Milligramm KOH pro Gramm Kraftstoff (mg KOH / g).
- Analysieren Methyloleat bei zunehmenden Oxidationsstufen durch GC-MS abgetastet.
- Injizieren 1 & mgr; l der Probe in eine GC-MS, ausgestattet mit einer FFAP-Säule (60 m, 0,250 mm, 0,25 & mgr; m) mit einem Splitverhältnis von 1:75.
- Führen Sie das folgende Heizprogrammes derSäule: 40 ° C für 10 min, dann bei 5 ° C / min auf 100 ° C erwärmt, schließlich bei 1 ° C / min bis zu 250 ° C.
- Verwenden Sie die folgenden Parameter auf dem Massenspektrometer: Potential der Elektronen lonisierungsquelle: 70 eV - Massenbereich: m / z = 10 bis 400 - Full-Scan-Modus.
- Bericht des Gaschromatogramm Spektren und gehen Sie zur Identifizierung von signifikanten Peaks.
- Bestimmen Sie die TAN Oelsäuremethylester bei zunehmender OXID abgetastetation Stufen der μTAN Verfahren (abgeleitet von ASTM D664 9) verwendet wird .
2. Advanced Oxidation Verfahren in Reaktor 2
Hinweis: Reaktor 2 wurde verwendet, um aufeinanderfolgende Oxidationszyklen auf Biodiesel freien Dieselkraftstoff (B0) und Rapsmethylester (RME) durchführen. Die Tests bei der Überwachung Brennstoffoxidation durch das folgende Verfahren richtet.
- Führen Sie die erste Oxidationszyklus.
- Konfigurieren Sie den Test.
- Stellen Sie die Erwärmungstemperatur auf 150 ° C, um die Benutzerschnittstelle verwendet wird. Den Druck in der Zelle zu 7 bar die Benutzerschnittstelle verwendet wird. Stellen Sie die Abschaltung criterion: Druckverlust (& Dgr; P) von 10% des maximal erreichten Druck.
- Bereiten Sie die Testzelle. Entfernen Sie mögliche Staub oder Verunreinigungen mit Labor Wischer getränkt mit Aceton und ersetzen Sie den Dichtungsring.
- Füllen Sie die Zelle mit 5 ml der Kraftstoffprobe unter Verwendung einer Pipette. Schließen Sie die Testzelle mit einer Schraubkappe durch eine Schutzabdeckung verschlossen gefolgt.
- Starten Sie den Test durch Drücken der Taste "RUN" in der Benutzeroberfläche von Reaktor 2.
HINWEIS: Zunächst wird die Zelle mit Sauerstoff unter Druck, durch eine Zufuhrleitung eingespritzt wird, dann wird die Zelle, die Gase durch einen Absaugkanal zum Evakuieren entspannt. Dann unter Druck wieder mit Sauerstoff. Wenn der Kopfraumdruck 7 bar erreicht, beginnt der Test. Die Temperatur wird auf 150 ° C erhöht, und der Druck steigt zusammen mit der Temperatur, bis ein stabiler Maximalwert erreicht ist. - Notieren Sie sich den Computer, um die Druckänderung in Intervallen von 1 Sekunde bis zum shu mittoff Kriterium erreicht ist. Zu diesem Zeitpunkt stoppt die Messung und die Zelle Heizung automatisch.
- Warten für 15 Minuten, bis die Temperatur etwa 20 ° C reduziert wird.
- Drucklos Testzelle über die Benutzeroberfläche. Dieser Purge ermöglicht Atmosphärendruck in der Zelle zu erreichen. Öffnen Sie die Schutzabdeckung und die Schraubkappe.
- Konfigurieren Sie den Test.
- Führen Sie "x" aufeinanderfolgende Oxidationszyklen.
- Wiederholen Sie die Schritte 2.1.3 die gewünschten "x" mal zu 2.1.6.
- Am Ende der "x" Tests, übertragen die oxidierten Kraftstoff noch in der Zelle mit einer Pipette in ein 10 ml-Glaskolben, und legen Sie den Glaskolben vertikal im Kühlschrank verwenden.
- Reinigen Sie die Zelle mit Labor Scheibenwischer getränkt mit Aceton.
- Analysieren der erzeugten Proben
- Analysieren Sie die Proben unter Verwendung von FTIR-ATR.
- Reinigen Sie die ATR Diamant Zelllabor Papier mit Ethanol getränkt.
- confild die Software - Parameter: Stellen Sie 100 Scans das FTIR - Spektrum, fixieren Sie die Auflösung bei 4 cm -1 und stellen Sie den Spektralbereich von 600 bis 4000 cm -1 zu bauen.
- Extrahieren Sie die Brennstoffflasche aus dem Kühlschrank und agitieren seinen Inhalt sorgfältig durch, um die Kraftstoffzusammensetzung zu homogenisieren.
- Probe 10 & mgr; l von Kraftstoff aus dem Kraftstoffkolben mit einer Pipette und legen das Tröpfchen auf eine horizontale ATR Diamant Zelle bei Umgebungstemperatur verwenden, dann die Analyse zu starten.
- Analysieren Sie die Proben unter Verwendung von FTIR-ATR.
Ergebnisse
Studie Oelsäuremethylester Oxidation in Reaktor unter Verwendung von AOP 1
Die IP Methyloleat (MO) wurde bei 110 ° C dreimal gemessen, mit einem Fehler von weniger als 5% (absolute Abweichung 0,06 h). IP-Messungen nach dem Tangentenschnittverfahren zeigen eine durchschnittliche IP-Zeit von 1,8 Stunden. Das AOP wurde gemäß dem oben erwähnten Protokoll durchgeführt, um oxidierte Proben bei 0,5 IP, IP, IP 2 und IP 4 erreichen, respectively.
Abbildung 3 zeigt die Variation der Gesamtsäurezahl während des Oxidationsverfahrens. Die TAN-Messung ermöglicht die Bewertung des Gesamtoxidationszustand des Kraftstoffs. Die TAN von frischem MO niedriger ist als die Bestimmungsgrenze der TAN-Gerät und kann daher als unbedeutend betrachtet werden. Von 0 bis 0,5 IP bleibt die TAN sehr niedrig (etwa 0,1 mg KOH / g), und steigt dann 0,5-1 IP um einen Faktor größer ist als 8 mal. Bei 4 IP ist die TAN rund 52-mal höher als bei 0,5 IP einen exponentiellen Anstieg der TAN mit der Oxidationszeit anzeigt. Dieses Verhalten legt nahe, dass Säurespezies Bildung während der anfänglichen Oxidation Regime relativ langsam ist. Allerdings wird es von Bedeutung , bei mittleren und fortgeschrittenen Oxidations Regimen: dh von 0,5 bis IP und nach dem UZ.
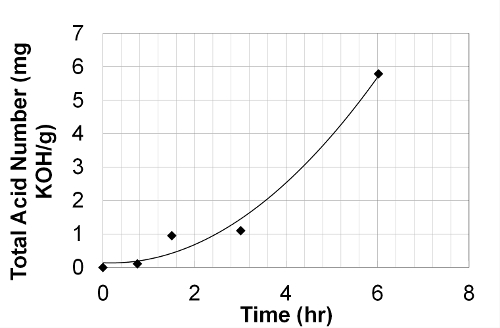
Abbildung 3. Variation der Gesamtsäurezahl (TAN) in verschiedenen Oxidationsstufen Oelsäuremethylester von 0 bis 4 IP IP. Die Gesamtsäurezahl von Methyloleat steigt mit der Oxidation Fortschritt. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Gesamt-Ionenströme (TIC), erworben während GC-MS - Kupplung, sind in 4 für die verschiedenen Oxidationsstufen der MO Probe dargestellt. TIC, die mit einem GC / FID Spur entspricht, stellt das Gesamtsignal aus dem Gaschromatographen kommen.
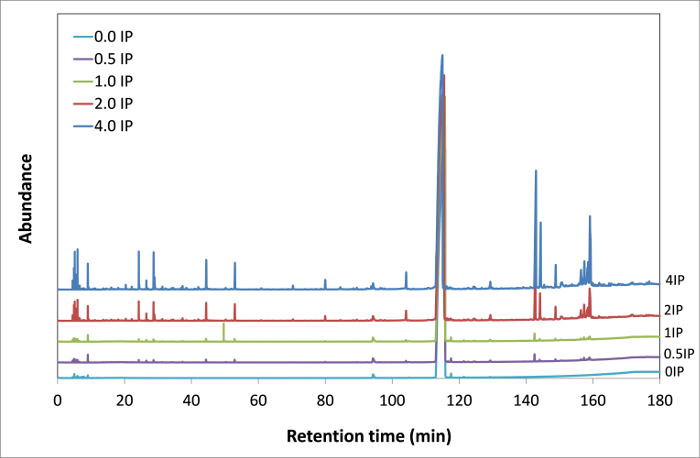
Abbildung 4. Gas - Chromatogramme von MO Proben bei verschiedenen Oxidationsstufen von 0 bis 4 IP - IP. Insgesamt Vergleich der Gaschromatogrammen auf einer breiten Palette von Retentionszeiten (0-180 min) die Bildung von mehreren neuen Spitzen im Zusammenhang mit den Oxidationsprodukten präsentiert . Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Im frischen MO (0 IP) gibt es bereits mehrere Spitzen, aber mit sehr niedrigen Intensitäten, höchstwahrscheinlich von Verunreinigungen. Da die Reinheit der Standard ist MO abo99% ve, wobei die Summe der Konzentrationen aller Verunreinigungen beträgt weniger als 1%. Die Peaks mit den Verunreinigungen verbunden sind, können identifiziert werden, was die Empfindlichkeit dieser analytischen Technik unterstreicht. Alle Chromatogramme sind auf der gleichen Skala normalisiert qualitativ auf die relativen Intensitäten der Peaks vergleichen. Es ist interessant, die Erhöhung der Intensitäten von mehreren Gipfeln von 0 IP (frische Probe) bis 4 IP (hochoxidierte Probe) zu bemerken. Außerdem einige Arten, die nicht in der ursprünglichen Chromatogramm vorhanden waren, bei mittleren bis hohen Oxidationsstufen mit allmählich zunehmender Intensitäten gebildet. Zur Vereinfachung der Lesbarkeit 7 zeigt nur den Bereich von 0 bis 30 Minuten. MO, eine Retentionszeit von 115 Minuten hat, erscheint nicht in diesem Zeitbereich. Die Kopplung mit der Massenspektrometrie (MS) ermöglicht es dem Benutzer, eine molekulare Identifizierung der Oxidationsprodukte durchzuführen. Die Identifizierung wurde auf der MO Probe bei 4-fachen IP oxidiert durchgeführt. In der Tat, diese letztere samp le stellt fast alle Oxidationsprodukte in früheren Stadien mit einer höheren Konzentration erzeugt.
Für jeden Peak auf dem Chromatogramm (Abbildung 5), die Identifizierung der zugeordneten Verbindung wurde durch Vergleich zwischen dem Versuchsmassenspektrum und dem theoretischen (NIST - Datenbank) hergestellt. Zum Beispiel war der Peak mit einer Retentionszeit von 26,5 Minuten methyl-6-heptenoat nach MS-Identifikation. Ergebnisse zeigen, daß Methyl-6-heptenoat, zunächst abwesend aus dem frischen Produkt wird während des Oxidationsverfahrens erzeugt wird. Qualitativ 0,5-4 fache des IP, die Intensität der zugehörigen Spitzen steigt um einen Faktor von etwa 10.
Ergebnisse auf die gesamte erhaltene Chromatogramm (0-190 Minuten) markieren die Bildung und dann die Erhöhung der Konzentration der Moleküle, die ursprünglich nicht vorhanden, da die Oxidationszeit zunimmt.
jove_content "fo: keep-together.within-page =" 1 "> Die Identifizierung aller Moleküle zeigt die Bildung von verschiedenen chemischen Einheiten während des Oxidationsprozesses zunächst durch die molekulare Spaltung mehrere kurzkettige Moleküle so ausgebildet sind , wie C 5. bis C 8 Alkene, C 6 bis C 8 -Alkanen, C 7 -C 8 Methylester mit Retentionszeiten rund 90-120min Durch die direkte Reaktion von molekularem Sauerstoff mit den Alkylresten oder Hydroperoxide, C 8 -C 9 -Aldehyde, C 8. - C 9 Methylestern , die andere oxygenierte funktionelle Gruppen (beispielsweise Alkohol oder Epoxiden) bei ähnlichen Retentionszeiten gebildet. Methylester und Aldehyden mit längeren Kettenlängen werden auch bei Retentionszeiten von mehr als 30 Minuten, wie 2-decenal und 2-undecenal gefunden.Einige der Produkte, die in der vorliegenden Arbeit mit GC-MS identifiziert wurden im Einklang mit wHut wurde in der Literatur bereits berichtet. Zum Beispiel Berdeaux et al. 12 erfolgt die Oxidation von MO out unter leicht verschiedenen experimentellen Bedingungen (180 ° C, 15 h Erhitzen, kein Sauerstoff). Eine Trennung wurde durchgeführt, um die nicht-polare Verbindungen zu entfernen und die polare Fraktion wurde in ein GC-MS-Gerät injiziert. Die Autoren fanden verschiedene Aldehyde und Methylester, also in Übereinstimmung mit unseren Ergebnissen. Weil die nicht-polare Fraktion nicht von diesen Autoren charakterisiert wurde, kein Vergleich möglich Alkane und Alkene betreffen. Die Konsistenz unserer Ergebnisse mit Literatur Ergebnisse unterstreicht das Potenzial des AOP für die Oxidationskinetiken von Kraftstoffen und Biokraftstoffen zu studieren.
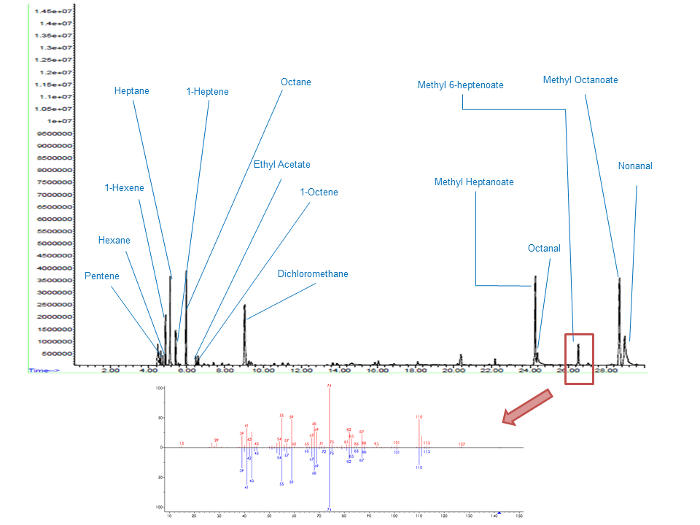
Abbildung 5. Gas - Chromatogramme von MO oxidiert bei 4 IP Molekulare Identifizierung der Produkte innerhalb eines Retentionszeitbereich von 0 - 30 Min . (Top Grafik) und einem Fokus auf Methyl-6-heptenoat Spitze (unteres Diagramm) das obere Massenspektrum entspricht den experimentellen Daten und der untere auf die theoretische Massenspektrum (NIST - Datenbank). Bitte klicken Sie hier , um eine größere Version davon zu sehen Zahl.
Studie der Oxidation von Biodiesel das AOP in Reaktor unter Verwendung von 2
Figur 6 zeigt Proben von B0, B0 und oxidierte folgenden 1, 4 und 6 Oxidationszyklen (B0-1) (B0-4) und (B0-6), respectively. Die Brennstofffarbänderungen während der Oxidation von transparent bis gelblich dann bräunlich. Diese Änderung ist auf die Bildung von polaren Verbindungen. Das Molekulargewicht dieser Produkte steigt mit der Oxidationsstufe. Oxidierte B0 Proben zeigen die Bildung eines dunklen viskosen Phase, die aus hochmolekularenGewicht polare Produkte.

Abbildung 6. B0 und oxidierten B0 Proben in Reaktor 2 nach 1, 4 und 6 Oxidationszyklen in Reaktor 2 Farbvariation von B0 während der Oxidation. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Figur 7 zeigt die Entwicklung der Zusammensetzung RME identifiziert mit FTIR während der Oxidation bei 1, 4 und 6 läuft in Reaktor 2 Drei Regionen untersucht werden (Abbildung 7). Peaks in der Region R 1 bei [800-1,400 cm -1] beobachtet deuten auf das Vorhandensein von CO und COC - Bindungen, die auf Alkohol, Epoxid und Oxiran - Funktionen zugeschrieben werden konnte. R 2 zeigt die Bildung von polaren Produkten wie Säuren, Aldehyde, ketEinsen und Ester. Die Spitzen identifiziert zwischen 1.650 und 1.760 cm -1 erweitern mit der Oxidationsstufe zusammen. Parallel dazu wurde ein deutlicher Rückgang der Doppelbindungen (C = CH) hier vertreten durch den Peak bei 3.010 cm -1 13 beobachtet wird: einer Umwandlungsrate von fast 30%, 90% und fast 100% beobachtet wurden nach 1, 4 und 6 läuft in Reaktor 2, respectively. Dieser Trend deutet auf die Bildung der Oxidationsprodukte beschrieben in R 1 und R 2 im Anschluss an die Umwandlung der Doppelbindungen in ungesättigten FAME.
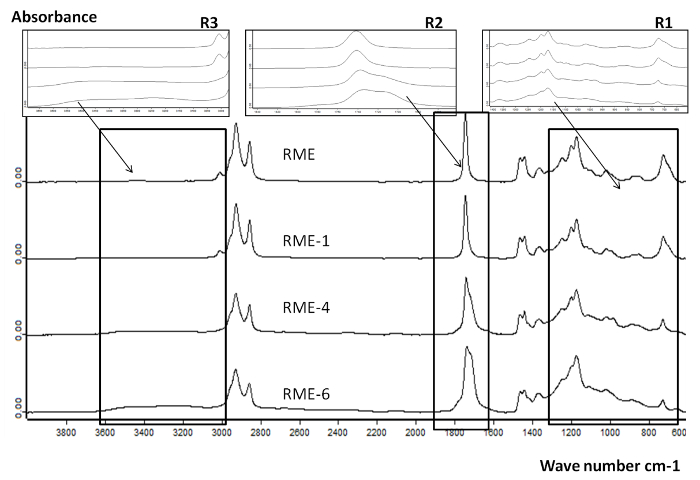
Abbildung 7. FTIR - Spektren für RME und oxidierten RME Proben in Reaktor 2 nach 1, 4 und 6 Oxidationszyklen. Insgesamt Vergleich der FTIR - Spektren von frischen und oxidierten RME auf einem breiten Wellenlängenbereich (600-3,800 cm -1) präsentiert die Variation des Absorptionssignal mit t assoziierter Oxidation. Diese Zahl hat sich mit freundlicher Genehmigung von 8 Copyright 2015 American Chemical Society. Nachgedruckt Bitte klicken hier , um eine größere Version dieser Figur.
8 stellt FTIR - Analyse von B0 und B0 oxidiert folgenden 1, 4 und 6 Oxidationszyklen. Drei Regionen sind gezeigt R 1 (600 - 1.300 cm -1), R 2 (1.600 - 1.800 cm -1) und R 3 (3.000 - 3.600 cm -1). Die Carbonyl - Bindung (C = O) wurde in der Region R 2 von B0-1, B0-4 und B0-6 detektiert. Der Bereich der Carbonyl - Bindung wurde für einen Vergleich der Oxidationsstufe 14,15 als Carbonyl - Peak bei 1.710 cm -1 nimmt mit der Oxidationsstufe verwendet wird . Dieser Peak ist auf die Bildung von polaren Produkte wie Aldehyde, Ketone, Säuren zurückzuführen. Die Peak-in die Region R 3 die Bildung von (OH) funktionelle Gruppen, die das Vorhandensein von Alkoholen und Säuren.
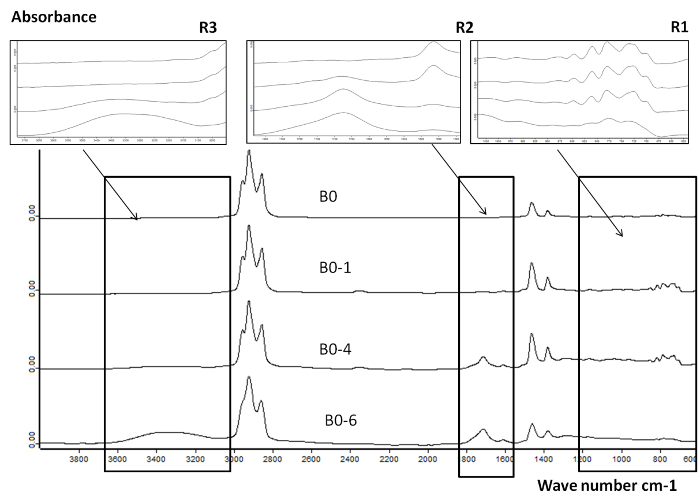
Abbildung 8. FTIR - Spektren für B0 und B0 oxidierten Proben in Reaktor 2 nach 1, 4 und 6 Oxidationszyklen Gesamt Vergleich der FTIR - Spektren von frischen und oxidierten B0 auf einem breiten Wellenlängenbereich. (600 - 3.800 cm -1) präsentiert die Variation des Absorptionssignals mit dem Oxidations verbunden. Diese Zahl hat sich mit freundlicher Genehmigung von 8 Copyright 2015 American Chemical Society. Nachgedruckt Bitte klicken hier , um eine größere Version dieser Figur.
Insgesamt wandte die AOP hier auf die Oxidation von gewerblich genutzten Diesel und biodiesel erlaubt die globale Oxidationsrate dieser Brennstoffe und die Bildung von mehreren polaren sauerstoffhaltigen Verbindungen in der gesamten Oxidationsverfahrens auf einem breiten Molekulargewichtsbereich zu überwachen. Gemäß den FTIR Ergebnisse auf B0 Brennstoff, eine geringe Menge an Carbonylverbindungen, insbesondere Ketonen und Aldehyden, werden nach dem ersten Oxidationszyklus (B0-1) gebildet ist. Nach 6 Oxidationszyklen (B0-6), zeigt die bräunlich und viskoser Probe eine schwere Oxidationsstufe. Die FTIR-Analyse liefert weitere Erkenntnisse über die wichtigsten funktionellen Gruppen einschließlich polare Oxidationsprodukte wie Alkohole, Säuren und Lactone. Eine höhere Oxidationsrate wurde auf RME im Vergleich zu B0 beobachtet. FTIR Ergebnisse auf RME zeigen die Umwandlung von ungesättigten Molekülen (Peak bei 3010 cm -1) und die Bildung von polaren Oxidationsprodukten. So was darauf hindeutet, dass ungesättigte Moleküle in RME den Oxidationsprozess sind die treibende Kraft und führt zu einer höheren Oxidationsrate im Vergleich mit B0.
Diskussion
Eine fortschrittliche Oxidations Protokoll (AOP) wurde in dieser Arbeit mit zwei Oxidationsreaktoren (Reaktor 1 und Reaktor 2) entwickelt. Dieses Protokoll wurde angewendet, um die Oxidation von kommerziellen Diesel und Biodiesel-Kraftstoffen sowie reine Reagenzien wie Methyloleat zu studieren. In diesem Abschnitt diskutieren wir einige Aspekte des Protokolls und seiner Anwendung.
Wenn Reaktor 1 und Reaktor 2 als Alterungsvorrichtungen verwendet wird, sollte die Homogenität der oxidierten Proben in Betracht gezogen werden, wie die Oxidation zur Bildung von unlöslichen Produkten führen kann, die auf den inneren Oberflächen der Vorrichtung kleben können. Diese können nicht vollständig mit einer Pipette aufgesammelt werden, nachdem die Kühlung der Vorrichtung. Auch nach der Probensammlung, zwei Phasen kann manchmal bei hohen Oxidationsstufen beobachtet werden. In solchen Fällen wird ein Teil des Überstandes gesammelt analysiert werden, aber nicht als repräsentativ für die gesamte oxidierte Probe betrachtet werden kann. Außerdem enthalten die gesammelten Proben nicht intermediate Spezies, die wichtig sind, um die Oxidationskinetiken beurteilen. Online-Analyse der Probe während der Oxidation kann helfen, dieses Problem anzugehen. Vorherige Arbeiten haben 18 Online - Analyse während der Kohlenwasserstoff - Oxidation unter Verwendung verschiedener Reaktoren, wie Rührkessel 16,17 oder Autoklaven umgesetzt. Diese Reaktoren ermöglichen die Überwachung der Oxidationsprodukte in sowohl der Flüssigkeit und den Gasphasen bei einer höheren Abtastfrequenz ist. Sie decken können breiteres Spektrum von Oxidationsbedingungen (zB Luftströmungsgeschwindigkeit, Temperatur, Geschwindigkeit Mischen). Jedoch erfordern sie spezifische und kostspielige Testausrüstung und sind zeitaufwendig. Zusätzlich kann, wie ihr Design und Testbedingungen unterschiedlich sind Standardtests Oxidationsstabilität, ist es schwierig, genau die Beziehung zwischen der Kraftstoff Reaktivität in den Standard- und alternative Tests herzustellen.
Typische Oxidationstests in Reaktor 1 oder Reaktor 2 produzieren weniger als 5 ml und 7 ml, JEWEILIGENely. Diese geringe Mengen sind nicht ausreichend, mehrere Analysen unter optimalen Bedingungen durchzuführen. Zum Beispiel erfordert herkömmliche Gesamtsäurezahl Analyse mindestens 20 Gramm der analysierten Probe (ASTM D664), die die Verwendung von μTAN in dieser Arbeit erläutert.
Die Berechnung IP (in Reaktor 1) wurde auf der Tangenten Schnittverfahren. Eine zweite mögliche Methode ist die Induktionsperiode unter Verwendung des sekundären Derivats 4 zu berechnen , wo die IP durch ein Maximum in der zweiten Ableitung angezeigt wird. Dieses Verfahren ist jedoch begrenzt, wenn das Leitfähigkeitssignal fluktuierenden ist, die häufig auftritt. Die Verwendung des Tangenten-Methode ermöglicht es dem Benutzer, diese Einschränkung zu überwinden. Jedoch ist die Tangentenverfahren benutzerabhängig, wie es für die Erstellung der Tangenten an den Benutzer angewiesen. In der vorliegenden Studie wurde die Bestimmung von demselben Betreiber für alle Proben durchgeführt. Replizieren Analysen wurden durchgeführt, um die Ergebnisse Richtigkeit zu überprüfen. according zu den experimentellen Ergebnissen hängt die Induktionsperiode Präzision (IP p) auf dem IP - Anschluss an die Gleichung IP p (h) = 0,15 IP-0,37, mit IP die Induktionsperiode, in Übereinstimmung mit der Genauigkeit von etwa 0,6 Stunden vorher gemeldet unter Standardbedingungen 5.
Die TAN ist ein grober Indikator für saure Spezies Bildung wird jedoch die Genauigkeit der μTAN Messung der Menge der Probe immer noch abhängig ist, insbesondere für Proben mit einer niedrigen Säurezahl. Außerdem hat die TAN keine molekulare Informationen. Nichtsdestotrotz ist es eine interessante Technik , da eine starke Beziehung zwischen dem Anstieg TAN und unlösliche Ablagerungen Bildung während der Oxidationsprozess wurde in der Literatur berichtet worden , 16,19,20. Daher wurde eine detailliertere Charakterisierung von oxidiertem MO Proben mit GC-MS durchgeführt.
die GC-MS-Technik anbelangt, so sollte das System überprüft werden,eine mögliche Kontamination durch ein Lösungsmittel (leer) Injektion, bevor die Proben zu analysieren. Da diese Technik sehr empfindlich ist, kann die Bildung von Spurenverbindungen überwacht werden. Auf diese Weise kann das Fehlen eines Parasiten peak überprüft werden.
Unabhängig davon, welche der Analysetechnik, die Probencharakterisierung sollte so schnell wie möglich durchgeführt werden, nach dem Oxidationsprozess. In der Tat sind die oxidierten Proben sehr instabil und eine lange Lagerzeit zu einer Änderung in der Probenzusammensetzung führen würde. Im Falle der Lagerung unvermeidbar, sollte die Aufmerksamkeit Flaschen Glas hermetisch zu verwenden , ausgewählt werden bezahlt und sie bei einer niedrigen Temperatur zu speichern (zB 6 ° C).
Zusammenfassend erlaubt das AOP dem Benutzer, den Oxidationsprozeß von mehreren Ein- und Mehrkomponentensysteme zu überwachen. Erstens durch die globale Reaktivität durch die Induktionsperiode zu charakterisieren, dann durch oxidierten Proben unter kontrollierten Bedingungen zu erzeugen. Mehrere Charakterisierung techniques wie GC-MS, FTIR, oder μTAN können mit den erzeugten Proben zu überwachen, die Veränderung ihrer Eigenschaften und chemischen Zusammensetzung verwendet werden. Die Ergebnisse bieten eine reichhaltige und ursprünglichen Informationen über die Oxidationskinetiken, den wichtigsten Abbauwege und den Oxidationsprodukten. Außerdem stellt AOP ein sehr nützliches Werkzeug, um den Einfluß der Oxidationsbedingungen wie Temperatur, Oxidationszeit und der Sauerstoffkonzentration zu untersuchen. Diese Arbeit stellt eine effiziente und vielversprechender Ansatz, der für die Untersuchung der Oxidationskinetiken für den Transport oder biologische Anwendungen von Nutzen sein kann.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The authors would like to thank the French National Association of Research and Technology (ANRT) for funding this research through the PhD grant awarded to Dr. Kenza Bacha.
Materialien
| Name | Company | Catalog Number | Comments |
| Rancimat | Metrohm | Rancimat 843 | Standard test apparatus for diesel and biodiesel oxidation stability |
| PetroOxy | Petrotest | 13-3000 | Standard test apparatus for diesel and biodiesel oxidation stability |
| FTIR spectrometer | Brucker | Brucker IFS66 | Apparatus for chemical composition analysis through chemical functions identification |
| Total acid number titrator | Metrohm | Titrino Plus 848 | Test apparatus for diesel and biodiesel oxidation stability |
| Gas Chromatograph | Agilent | 6890 Agilent GC/MS | Analatical chemistry technique used to separate the compounds present in a sample |
| Gas Chromatography column | Agilent | DB-FFAP column | Component of Gas Chromatogram that separates the molecules |
| Mass Spectrometer | Agilent | 5973 inert mass spectrometer | Analytical chemistry technique used to identify the compounds present in a sample |
| Methyl Oleate 99% | SIGMA ALDRICH | 311111 ALDRICH | Pure reagent |
| EMAG-free ultra-low sulfur diesel | Total ACS | CEC RF-06-03 | Commercial Diesel fuel |
| Rapeseed methyl Ester | ASG | Biodiesel 3826 00 10 | Commercial Biodiesel |
| Isopropanol >99.9% | VWR | 84881.290 | Solvent for Total Acid Number determination |
| KOH 0.1 M in isopropanol | VWR | 1.05544.1000 | Titration agent for Total Acid Number determination |
Referenzen
- Watkinson, A., Wilson, D. Chemical reaction fouling: A review. Exp. Therm Fluid Sci. 14 (4), 361-374 (1997).
- Denisov, E., Afanas'ev, I. . Oxidation and Antioxidants in Organic Chemistry and Biology. , (2005).
- European standard. . Automotive fuels - Fatty acid methyl ester (FAME) fuel and blends with diesel fuel - Determination of oxidation stability by accelerated oxidation method. , (2014).
- Ben Amara, A., Nicolle, A., Alves-Fortunato, M., Jeuland, N. Toward Predictive Modeling of Petroleum and Biobased Fuel Stability: Kinetics of Methyl Oleate/n-Dodecane Autoxidation. Energy Fuels. 27 (10), 6125-6133 (2013).
- Pullen, J., Saeed, K. An overview of biodiesel oxidation stability. Renew. Sustainable Energy Rev. 16 (8), 5924-5950 (2012).
- ASTM International. . Standard Test Method for Oxidation Stability of Middle Distillate Fuels - Rapid Small Scale Oxidation Test (RSSOT) - ASTM D 7545-14. , (2014).
- ASTM International. . ASTM Standard Test Method for Oxidation Stability of Spark Ignition Fuel - Rapid Small Scale Oxidation Test (RSSOT) - ASTM D 7524-14. , (2014).
- Bacha, K., Ben Amara, A., Vannier, A., Alves-Fortunato, M., Nardin, M. Oxidation Stability of Diesel/Biodiesel Fuels Measured by a PetroOxy Device and Characterization of Oxidation Products. Energy Fuels. 29 (7), 4345-4355 (2015).
- ASTM Standard. . Standard Test Method for Acid Number of Petroleum Products by Potentiometric Titration - ASTM D 664-11A. , (2011).
- Chatelain, K., Nicolle, A., Ben Amara, A., Catoire, L., Starck, L. A wide range experimental and kinetic modeling study of chain length impact on n-alkanes autoxidation. Energy & Fuels. , (2016).
- Ben Amara, A., Kaoubi, S., Starck, L. Toward an optimal formulation of alternative jet fuels: Enhanced oxidation and thermal stability by the addition of cyclic molecules. Fuel. 173, 98-105 (2016).
- Berdeaux, O., et al. A detailed identification study on high-temperature degradation products of oleic and linoleic acid methyl esters by GC-MS and GC-FTIR. Chem. Phys. Lipids. 165 (3), 338-347 (2012).
- Pillar, R., Ginic-Markovic, M., Clarke, S., Matisons, J. Effect of Alkyl Chain Unsaturation on Methyl Ester Thermo-Oxidative Decomposition and Residue Formation. J. Am. Oil Chem. Soc. 86 (4), 363-373 (2009).
- Singer, P., Ruhe, J. On the mechanism of deposit formation during thermal oxidation of mineral diesel and diesel/biodiesel blends under accelerated conditions. Fuel. 133, 245-252 (2014).
- Araujo, S. V., et al. FTIR assessment of the oxidation process of castor oil FAME submitted to PetroOXY and Rancimat methods. Fuel Process Technol. 92 (5), 1152-1155 (2011).
- Ben Amara, A., Lecointe, B., Jeuland, N., et al. Experimental study of the impact of diesel/biodiesel blends stability on the fuel injection system. SAE Int. J. Fuels Lubr. , (2014).
- Gernigon, S. . Hydrocarbon liquid fuel thermal stability, antioxidant influence and behavior (in French). , (2010).
- Lin, S. S., Hung-Shan, W. 34;Liquid-phase oxidation of cyclohexane using CoAPO-5 as the catalyst.". Appl. Catal., A. 105 (2), 289-308 (1993).
- Fortunato, M. A., Starck, L., Takahashi, T., Ohmae, K., IIda, Y. SAE Technical Paper 2015-01-1930. Oxidation Stability of Diesel/Biodiesel Blends: Impact of Fuels Physical-Chemical Properties over Ageing during Storage and Accelerated Oxidation. , (2015).
- Bouilly, J., Mohammadi, A. SAE Technical Paper 2012-01-0860. Biodiesel Stability and its Effects on Diesel Fuel Injection Equipment. , (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten