Method Article
Die Verwendung eines Low-Flow-Digital-Anästhesiesystem für Mäuse und Ratten
In diesem Artikel
Zusammenfassung
Here, we present a protocol to more safely and efficiently administer anesthetic gas to mice using a digital, low flow anesthesia system utilizing a syringe-driven direct injection vaporizer.
Zusammenfassung
A traditional vaporizer depends on flowing gas and atmospheric pressure for passive anesthetic vaporization. Newly developed direct injection vaporizers utilize a syringe pump to directly administer volatile anesthetics into a gas stream. Unlike a traditional vaporizer, it can be used at very low flow rates, making it ideal for use on mice and rats.
The equipment's capability to use low flow rates could result in a substantial cost savings due to the reduced need for anesthetic agents, compressed gas, and charcoal scavenging filters1. A lower flow rate means less waste of anesthetic gas and likely reduces the risk of anesthetic exposure to laboratory personnel. Thus, the high levels of precision and safety associated with direct injection vaporizers, along with a reduced need for anesthetic agents, compressed gas, and charcoal filters are beneficial for research requiring small animal anesthesia.
The goal of this protocol is to demonstrate the use of a syringe-driven direct injection vaporizer as part of a digital, low-flow anesthesia system. The direct injection vaporizer is capable of accurately delivering anesthesia at very low flow rates compared to a traditional vaporizer, making it a promising alternative for controlled gas anesthetic delivery to rodents.
Einleitung
Es gibt viele Präzision Verdampfern für veterinärmedizinische Zwecke zur Verfügung , die 2 zwischen Flussraten von 0,5 bis 10 l / min betrieben werden . Diese Flussraten sind nicht ideal für Nager, da der Bereich hoch ist im Vergleich zu ihren kleinen Atemminutenvolumen. Hohe Strömungsgeschwindigkeiten sind nicht in der veterinärmedizinischen Praxis aufgrund ihrer Förderung der Hypothermie und Trocknen des Respirationstraktes 3,4 empfohlen. viele gemeinsame Veterinär Verdampfer Hersteller Handbücher warnen, dass hohe Durchflussraten führen kann eine Erhöhung des Auftretens von Rückstauschwankungen Ferner. Es hat sich auch gezeigt , dass viele Standard - Verdampfern unter Flussraten von 500 ml / min ungenau werden, und diese Rate als Mindestdurchflussmenge im Veterinärbereich 5-7 angesehen wird.
Ein Tier kann auf einem T-Stück Schaltung oder modifizierte bain Schaltung mit einer Flussrate so günstig wie 1,5-2,2 mal das Minutenvolumen 8-10 des Tieres gehalten werden. Diese Strömungsraten gelten als sufficient Rückatmungs abgelaufener Gasen zu verhindern , und eine Erhöhung des Blutkohlendioxidkonzentrationen 8 verhindern. Mit dieser Flussrate Empfehlung, eine 30 g-Maus mit einer Fließgeschwindigkeit so günstig wie 52 ml / min, fast zehnmal kleiner als die angenommen 500 ml / min mindestens einem traditionellen Verdampfer aufrecht erhalten werden konnte.
Während einer traditionellen Verdampfer auf Gasstrom und Atmosphärendruck für passive Anästhetikum Verdampfung abhängt, misst eine direkte Injektion Verdampfer den gesamten Frischgasstrom und spritzt den Dampf direkt in den Gasstrom 2. Einige direkte Injektion Verdampfern verwenden eine Spritzenpumpe Anästhetikums in den Gasstrom zu verabreichen. Computerized Kontrollen erlauben diese Systeme automatisch die Spritzenpumpe Geschwindigkeit justieren das Volumen der flüssigen Mittel zu injizieren erforderlich, um die gewünschte Konzentration des Anästhetikums zu erreichen. Spritze angetrieben Verdampfern zur Verfügung stehen und für die klinische und pädiatrische Verwendung zugelassen und viele ähnliche Konfigurationen werden als angesehenästhetischen Konservierungsanlagen in der klinischen Praxis 16.11. Kurz nach ihrer Genehmigung Betäubungsmittel erhaltend Geräte mit Spritzenpumpe Verdampfern wurden 8,17,18 zur Verwendung in Tierstudien angepasst. Im Gegensatz zu einem herkömmlichen Verdampfer, ein Direkteinspritzsystem einer Spritzenpumpe verwendet wird durch eine Mindestdurchflussmenge, um die Genauigkeit zu erhalten beschränkt. Aus diesem Grund ist diese Technologie ideal für den Einsatz in rodent Anästhesie und andere Fälle, in denen geringe Strömungsgeschwindigkeiten notwendig sind. Die Vorteile und das Potenzial mit diesem Verdampfer Design damit verbundenen Kosteneinsparungen inspiriert die Entwicklung neuer Anästhesiesysteme speziell für Nager 1,19,20. Dieses neue System enthält auch einen eingebauten Luftpumpe, sodass der Benutzer Anästhesie zu verabreichen, ohne eine Druckgasquelle erforderlich ist. Als zusätzlicher Vorteil ist das System vorkalibriert zur Verwendung sowohl mit Isofluran und Sevofluran. Mit der Einführung dieser Verdampfertechnologie im Labortier Feld it ist jetzt möglich, kleine Labortiere bei Durchflussraten näher empfohlenen Werte für komprimiertes Gas ohne die Notwendigkeit zu betäuben.
Protokoll
Alle Untersuchungen wurden in Übereinstimmung mit den regulatorischen und institutionellen Richtlinien abgeschlossen. Die Tier Aspekte dieser Studie wurden von der Kent Scientific Corporation Tier Use Program ausgewertet, von der Purdue Animal Care und Use Committee (PACUC) genehmigt, und in Übereinstimmung mit dem Leitfaden für die Pflege und Verwendung von Labortieren 22 durchgeführt.
Hinweis: Das Low-Flow-Anästhesie digitale System in diesem Protokoll verwendet wird, mit einem integrierten Pulsoximeter ausgestattet.
1. Bis Stellen Sie den Low-Flow-Anästhesie-System mit integrierten Pulsoximeter
- Für Isofluran Lieferung
- Wählen Sie eine Trägergasquelle. Um die interne Luftpumpe verwenden, schrauben Inlet Anschluss auf der Rückseite, so dass die interne Pumpe Einlassraumluft.
- Verbinden Kohlebehälter Port zu erschöpfen.
- Schließen Sie Y-Adapter vor dem Low-Flow, digitale Anästhesiesystem. Verwenden Sie die farbcodierten Clips die weißen Zweige verbinden zu ter Bugnase und blau Zweige auf die Induktionskammer.
- Schließen weißen Clip Schellen und offenen blauen Clip klemmt Luftstrom in die Kammer zu leiten.
- Wählen Sie 2-ml-Spritze.
- Für Physiologische Überwachung, Verwendung des Pulse Oximeter Integrated
- Schließen Sie das Pulsoximeter paw Sensor-Anschluss auf der Rückseite des Low-Flow-Anästhesie-System, die mit "AUX".
2. Konfigurieren Sie die Einstellungen
- Für Anästhesie
- Schalten Sie das Anästhesiesystem, und rufen Sie das Einstellungsmenü. Drücken Sie Set Up für den Zugriff auf Hauptmenü> Anästhesie> Setup in rot.
- Wählen Sie das Narkosemittel. Drücken Sie Set Up Typ Anest in rot zu markieren. Verwenden Sie die Aufwärts- und Abwärtspfeile Isofluran auszuwählen.
- Stellen Sie die Spritzengröße. Drücken Sie Set Up Syr Größe zu markieren. Verwenden Sie die Auf- und Ab-Pfeile, um eine 2-ml-Spritze zu wählen.
- Stellen Sie die Leerposition. Drücken Sie Set Bis highlight leeren Satz in rot. Sicherung leer, voll gedrückten Glasspritze in die Spritzenhalteblock, indem die Spritze platziert, so dass die Spritze Clamp auf dem Metallring der Spritze sitzt. Drücken Sie die Auf- oder Ab-Pfeile, um den Schubblock zu bewegen, so dass der Pusher-Block mit der Spitze des Spritzenkolben Licht in Berührung kommt. Drücken Sie wählen leere Position zu setzen.
- Drücken Sie Set in rot entfernen zu markieren Up. Entfernen Sie die Spritze und füllen Sie die Spritze mit Isofluran die Flasche oben Adapter verwenden.
- Schließen Sie die Spritze mit dem Anästhesiesystem.
- Prime das Anästhetikum Förderschlauch. Drücken Sie Set Up Prime Rohr in rot zu markieren. Drücken Sie, bis die Betäubung bewegt sich durch die Spritze und in den schwarzen Anschluss an der Verdampferblock.
- Aktivieren Anästhesie. Drücken Sie Set in rot aktivieren zu markieren Up. Verwenden Sie die Auf- und Ab - Pfeile , um Ja auszuwählen. Drücken Sie Run / Zurück zum Hauptmenü zurückzukehren.
- Wählen Sie das einir Versorgung und Minutenvolumen. Drücken Sie Set Up Luftversorgung in rot zu markieren. Verwenden Sie die Aufwärts- und Abwärtspfeile Interne Pumpe zu wählen. Drücken Sie Set Up zu Minute Vol in rot markieren. Durchflussrate einstellen auf 250 ml / min.
- Für Physiologische Überwachung
- Stellen Sie die minimale erfassten Herzfrequenz-Maus (240). Drücken Sie auf Hauptmenü auf> MouseStat. Verwenden Sie nach oben und unten Pfeile Mindestherzfrequenz einzustellen.
3. Beginnen Sie Anästhesie-Versorgung
- Induzieren die Maus
- Drücken Sie Run / Back zweimal Run-Modus zu wechseln und den Luftstrom zu beginnen.
- Platzieren Sie die Maus in der Induktionskammer, den Deckel schließen fest. Stellen Sie die Narkosemittelkonzentration Knopf bis 3%.
- Überwachen Sie bis der Maus auf die gewünschte Ebene der Anästhesie erreicht, bestimmt durch den Verlust der Reflex aufrichtenden. Stellen Sie die Narkosemittelkonzentration nach Bedarf.
- Sobald das Tier verliert eine seiner aufrichtenden Reflexnd ausreichend betäubt ist, schalten Sie die Anesthesia Konzentration Wahl auf 0%. Die Autoren haben zuvor festgestellt , dass der Luftstrom so dass die Induktionskammer zu spülen 30-60 sec ausreicht, um die Kammer zu reinigen , ohne die Narkosetiefe 1 umgekehrt wird .
- Schnell öffnen Sie die weißen Klammern die Luft zum facemask zu lenken, und schließen Sie die blauen Klemmen der Induktionskammer führt.
- Öffnen Sie die Kammer vom Forscher, entfernen Sie die Maus, und sofort passen die Bugspitze.
- Zentrieren Sie das Tier auf einer Infrarot-Wärmekissen, auf Körpertemperatur bei 37 ° C über eine rektale Sonde auf einer Rückkopplungsschleife aufrechtzuerhalten.
- Wenn die Maus auf dem Nasenkonus stabil ist, auf 1,5%, die Konzentration von Isofluran einzustellen oder als für die Wartung benötigt, indem die Anästhetikum-Konzentration Drehen.
- Reduzieren Sie das Minutenvolumen für die Wartung. Die Mindestdurchflussrate, das Tier zu unterstützen, ist gleich 1,5 bis 2,2-fache des Minutenvolumens des Tieres (für eine 30 g-Maus,ein Minimum von 52 ml / min). Wenden Sie sich an die Anweisungen des Herstellers für einen empfohlenen Durchflussrate auf die Bugnase Stil Festlegung spezifischer und ggf. einstellen. Drücken Sie Einrichten des Hauptmenü zu gelangen, und drücken Sie dann, bis die Einstellung Minute Vol rot markiert ist. Verwenden Sie die Aufwärts- und Abwärtspfeile Zielfluss anzupassen. Drücken Sie Run / Zurück zum Hauptbildschirm zurückzukehren.
- Bestätigen Narkosetiefe durch einen Mangel an Rückzugsreflex während einer interdigitalen Prise bestimmt. Anwenden Augensalbe für die Augen Trockenheit während der Anästhesie zu verhindern.
4. Beginnen Sie Physiologische Überwachung
- Sensor wieder über Pad Hinterpfote. Positionieren Sie den Sensor so, dass das rote Licht unter der Pfote ist und beleuchtet die Pfote. Mit den Auf- und Ab-Pfeile auf dem Bildschirm, um die oxiwave anzuzeigen. Das Tier wird nun anästhesiert sicher einen geringen Strömungs, Spritze gesteuerte, digitale Verdampfer verwendet wird.
5. Nehmen Sie das Tier
- AusschaltenAnästhesie-Versorgung.
- Um die Lieferung von Narkose stoppen, drehen Konzentration Betäubungsmittel-Agent Regler auf Min (oder 0%) und entfernen Tier aus facemask.
- Überwachen Sie die Maus während der Narkose Erholung. Sobald die Maus vollständig ambulante geworden ist, schicken Sie es an den Käfig.
Ergebnisse
Tiere
3 erwachsenen C57 / BL6NTac weibliche Mäuse (Taconic, Alter 6-7 Wochen, Gewicht 15 +/- 1 g) wurden betäubt und mit 1,3-1,5% Isofluran während Herzfrequenz, Sauerstoffsättigung und Atemfrequenz überwacht wurden beibehalten. Alle Mäuse waren Murine Pathogen Frei wie durch Routine Anbieter Tests vor der Ankunft in der Anlage bestimmt. Die Tiere waren in Gruppen gehalten in microisolation Caging und Frei Zugang zu Standard-Nagetierfutter und Wasser-Flasche zur Verfügung gestellt.
Isofluran Usage
Das Low-Flow-Anästhesie System misst die Menge an Anästhetikum restlichen in der Spritze während des Gebrauchs. Das Volumen in der Spritze, wie sie in der Anästhesiesystem gemessen, wurde festgestellt, als das Tier auf den Nasenkonus übertragen wurde, und wieder am Ende des Wartungszeitraums. Das Endvolumen wwie aus dem Anfangsvolumen abgezogen , um die Menge des Anästhetikums während der Wartungsperiode (Abbildung 1) verbraucht wird, zu quantifizieren.
Physiologische Parameter
Herzfrequenz, SpO 2 und Atemfrequenz wurden während der Wartung über die Pulsoximetrie (- 4 Figuren 2) überwacht. Die Körpertemperatur wurde bei 37,5 ° C über eine Infrarot-Erwärmung pad gehalten. Jede Maus wurde erfolgreich bei niedrigen Strömungsraten von 100 ml / min von Raumluft unter einem Operationsebene Anästhesie gehalten für 60 min, wie durch einen Mangel an Entzugs reflex aus einer interdigitalen pinch bestimmt. Die Maus erwachte nicht oder zu interdigitalen kneift intermittierend während der Wartungsperiode angewendet reagieren. Das Tierherzfrequenz (Abbildung 2), Blut Sauerstoff (Abbildung 3) und Atemfrequenz (Abbildung 4) blieb relathungsweise stabil während der gesamten Studie. Auf Grund der Tier und Sensorpositionierung wurde die Atemfrequenz-Signal von Maus 1 und Maus 3 war intermittierend und die Messung unterbrochen. Wenn die Positionierung des Tieres angepasst wurde, verbessert das Signal und die gemessene Atemfrequenz zu ähnlichen Zeitpunkten zu anderen vergleichbar. Das Low-Flow - Anästhesie digitalen System verwendet , um einen Durchschnitt von 0,63 ml Isofluran während der 60 min der Wartungsperiode (Abbildung 1).
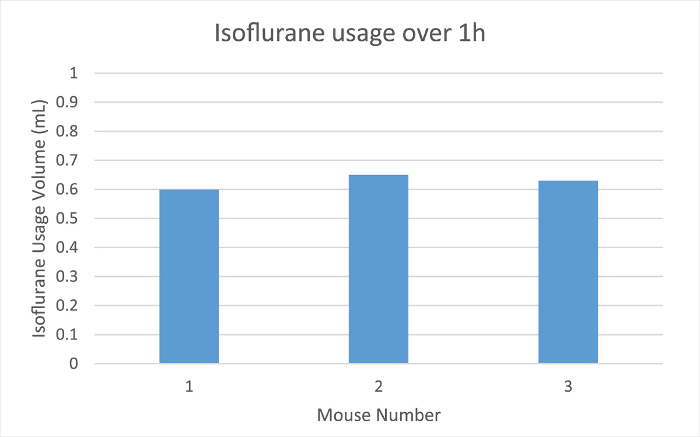
Abbildung 1:.. Isofluran Verwendung Die Menge von Isofluran in ml verwendet für drei verschiedene Mäuse über 1 h Anästhesie Wartung des digitalen Low-Flow - Anästhesie - System Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
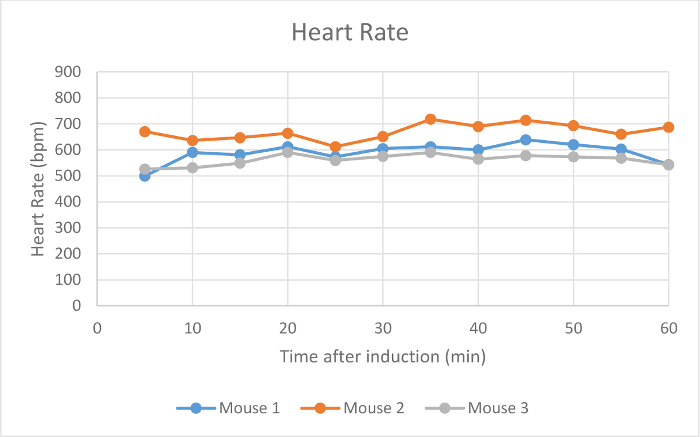
Abbildung 2:.. Herzfrequenz Die Herzfrequenz von drei Mäusen in Schlägen pro Minute (bpm) 5-60 Minuten nach der anfänglichen Narkoseeinleitung mit dem digitalen Low-Flow - Anästhesie - System Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
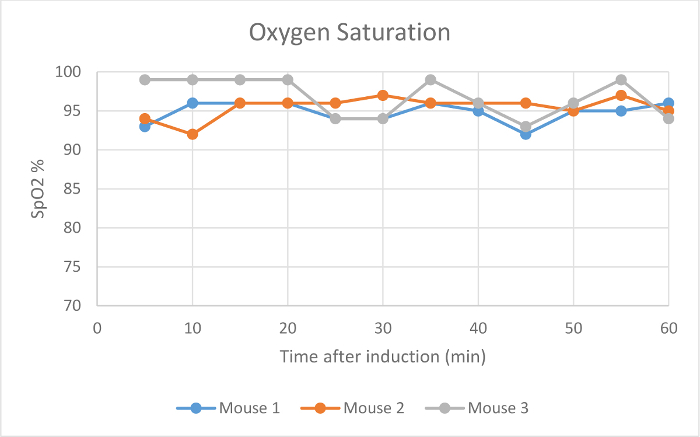
Abbildung 3:.. Sauerstoffsättigung des Blutsauerstoffsättigungswerte (%) von drei Mäusen 5-60 min nach dem anfänglichen Narkoseeinleitung mit dem digitalen Low-Flow - Anästhesie - System Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
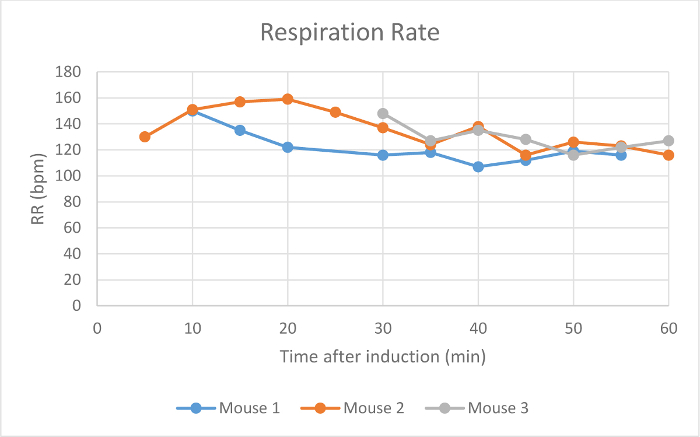
Abbildung 4:.. Respiration Rate Die Atmungsrate von drei Mäusen in Atemzügen pro Minute (bpm) 5-60 Minuten nach der anfänglichen Narkoseeinleitung mit dem digitalen Low-Flow - Anästhesie - System Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
Der digitale Low-Flow-Anästhesie-System ermöglicht es dem Benutzer effektiv Mäuse anästhesieren bei sehr niedrigen Strömungsgeschwindigkeiten ohne die Verwendung irgendeines komprimiertes Gas. Dies unterscheidet sich stark von der Standard passive Verdampfern, von denen die meisten von etwa 500 ml / min bei minimalen Strömungsgeschwindigkeiten eine Druckgasquelle erforderlich ist. Standard-Verdampfern verwenden wählt, die Präzision zwischen Abstufungen fehlt, und sie müssen jährlich die Genauigkeit zu erhalten gewartet werden. Eine Spritze getrieben Narkosesystem kann bei der eingestellten Strömungsgeschwindigkeit eine bestimmte Konzentration des Anästhetikums liefern die genaue notwendige Geschwindigkeit der Spritzenpumpe zu berechnen. Routine-Kalibrierungen sind nicht erforderlich, was zu zusätzlichen Kosten und Zeitersparnis.
Die empfohlene Mindestdurchflussmenge ein Tier auf einem Nicht-Rückatmungskreislauf aufrecht zu erhalten ist 1,5-2,2 mal das Minutenvolumen des Tieres. Die Strömungsgeschwindigkeit von 100 ml / min in dieser Studie verwendet Überschreiten dieser Mindest ausreichend Anästhetikum an die Tiere zu liefern. Die Strömungsgeschwindigkeit settings sind für dieses Anästhetikum Abgabetechnik kritisch, da die Strömungsrate direkt mit der Menge von Isofluran für einen bestimmten Zeitraum verwendet zusammenhängt. Bei niedrigen Strömungsgeschwindigkeiten verwendet wird , kann diese Technik stark die Menge des während des Gebrauchs erforderlich Isofluran zu reduzieren, während das Tier noch wirkungs 1,19-21 anästhesiert wird.
Neue Ausrüstungskosten zwischen traditionellen Verdampfern und Low-Flow-digital Verdampfern sind vergleichbar. Jedoch hat das digitale Low-Flow-Anästhesie System die Fähigkeit entweder Isofluran oder Sevofluran zu liefern. Dadurch entfällt die Notwendigkeit für bestimmte Isofluran und Sevofluran Präzision Verdampfern, die Verringerung der Erstausrüstung Kosten für Gruppen beide Anästhetika verwenden. Kürzlich veröffentlichte Vergleiche zwischen Verdampfer Technologien haben Kosteneinsparungen im Laufe der Zeit vorgeschlagen , wenn ein Low-Flow - Digital - Verdampfer 1,19,20 verwenden. Die Ergebnisse dieser Vergleiche verwendet werden könnten potentielle Kosteneinsparungen im Laufe eines Jahres zu approximieren. WieSuming ausgeführt typische Nutzungseinstellungen in 2 Stunden-Schritten, 5 Tage pro Woche für 52 Wochen ein traditionelles Verdampfer Isofluran wird 3,8 l von Isofluran oder zwölf 250-ml-Flaschen verbrauchen. Ein Low-Flow-digital Verdampfer bei der gleichen Frequenz verwendet würde nur 0,32 L, oder zwei 250 ml-Flaschen verbrauchen. Kohlebehälter Verbrauch wird ebenfalls reduziert. Unter der Annahme, dass jeder Kanister 50 g gespülten Abgas hält, wird eine traditionelle Verdampfer etwa 21 Kohlekanister im Laufe eines Jahres zu füllen. Im Vergleich dazu wird ein Low-Flow-Digital-Verdampfer 6 oder weniger benötigen. Ein traditionelles Verdampfer etwa 5 große Gasflaschen pro Jahr erfordern würde, die jeweils mit einer Kapazität von 9.500 L. Die interne Luftpumpe, bei einigen Modellen verfügbar digitaler Low-Flow-Verdampfern, entfällt die Notwendigkeit für komprimiertes Gas. Wenn komprimiertes Gas verwendet werden, so würde das System nur ein Zylinder pro Jahr 1 verwenden.
Die Technik kann je nach Bedarf modifiziert werden. Low-Flow digital vaporizers ermöglichen es dem Benutzer Narkosetiefe schnell und präzise einzustellen. Wenn der Narkosetiefe erhöht werden muss, oder verringert wird, kann der Benutzer die Anästhetikum-Konzentration in Schritten von 0,1% erhöhen die Wählscheibe auf der Oberseite des Systems verwendet wird. Die Strömungsgeschwindigkeit kann auch während des Verfahrens je nach Bedarf eingestellt werden. Dieses Protokoll verwendet eine 2-ml-Spritze, obwohl größere Spritzengrößen für längere Verfahren zur Verfügung stehen. Die interne Luftpumpe bietet dem Anwender die Möglichkeit, Tiere zu betäuben, ohne eine Druckgasquelle erforderlich ist. Verfahren für komprimiertes Gas oder zusätzlichen Sauerstoff erfordern, hat der Benutzer die Möglichkeit, eine Gasquelle an den Low-Flow-System zu verbinden, anstatt Umgebungsluft. Der Benutzer kann weiterhin die ausgewählte Luftquelle während des gesamten Verfahrens zu liefern oder zwischen der internen Pumpe und einer Druckgasquelle wie benötigt umschalten kann. Zum Beispiel kann der Benutzer das System so einstellen Raumluft über die interne Pumpe während der Induktion und Wartung zu liefern, sondern liefern zusätzliche Oxygen während der Genesung.
Zwar gibt es auch viele Vorteile sind ein Low-Flow-Digital-Verdampfer, dort mit Einschränkungen. Da ein Spülventil nicht enthalten ist, manuell in die Kammer mit sauberer Luft vor dem Öffnen Spülung ist der einzige Weg, um die Induktionskammer zu spülen. Dieses System ist nur bei niedrigen Strömungsgeschwindigkeiten zu betreiben und liefert keine Anästhesie über Flussraten von 800 ml / min, in denen traditionelle Vaporizer kann bis zu 10 l / min mit Flussraten verwendet werden. Dieses spezielle System eignet sich daher nur für kleine Tierarten. Darüber hinaus hält das System weniger Anästhetikum im Vergleich zu einem herkömmlichen Verdampfer. Es kann Situationen geben, in denen die Spritze während eines Verfahrens nachgefüllt werden muss. Um jedoch die leere Spritze zu ersetzen Verzögerungen beim Nachfüllen können in der Nähe von Vorfüllung eine zweite Spritze reduziert werden. Spritzengrößen von bis zu 10 ml sind verfügbar, um die Notwendigkeit zu reduzieren Spritzen Mitte Verfahren zum Nachfüllen. Schließlich, im Gegensatz zu einem herkömmlichen Verdampfer der Nieder flow digitalen Verdampfer erfordert Strom. Batterien sind für die Verwendung in Fällen verfügbar, wo elektrische Leistung nicht verfügbar ist oder für den Fall eines Stromausfalls.
Frühere Studien haben gezeigt , dass Low-Flow - Digitalsysteme verbrauchen weniger Isofluran, Trägergas und Kohle - Kanister im Vergleich zu einem herkömmlichen Anästhesiesystem 1,19,20. Die Reduktion der gespülten Narkosegas auch eine Verringerung der Abfallnarkosegas identifizieren konnte, obwohl die weitere Arbeit in diesen Bereichen erforderlich ist. Infrarot-Gasspektroskopie kann verwendet werden, um Abfall Isofluran Produktion überwachen und Dosimeter Abzeichen kann verwendet werden, Isofluran Exposition für das Laborpersonal in Zukunft Vergleiche zu quantifizieren.
Zusammengefasst wird diese Technik für Betäubungsmittel Lieferung an Gruppen, die in Nagetieren Anästhesie durch verbesserte Sicherheit, Wirksamkeit und Präzision gegenüber herkömmlichen Systemen von Vorteil sein.
Offenlegungen
Dieses Projekt wurde mit Ausrüstung und Finanzierung von Kent Scientific Corporation, der American Heart Association zu CJ Goergen (SDG18220010) und der Purdue University unterstützt. Die Autoren Krista Bigiarelli und Irina Toore sind Mitarbeiter von Kent Scientific Corporation, die Ausrüstung in diesem Artikel verwendet produziert. Open Access Veröffentlichung dieses Artikels wird von Kent Scientific Corporation gesponsert.
Danksagungen
The authors have no acknowledgements.
Materialien
| Name | Company | Catalog Number | Comments |
| Anesthetic Equipment | |||
| SomnoSuite Low-Flow Digital Anesthesia System | Kent Scientific Corporation | SOMNO | Includes anti-spill, anti-vapor bottle top adapter; Y adapter tubing; charcoal scavenging filter |
| MouseSTAT Pulse Oximeter & Heart Rate Monitor | Kent Scientific Corporation | SS-MSTAT-Module | Integrated into SomnoSuite |
| MouseSTAT Mouse Paw Sensor | Kent Scientific Corporation | MSTAT-MSE | |
| 2 ml Glass Syringe | Kent Scientific Corporation | SOMNO-2ML | |
| Low-Cost Induction Chamber, 0.5 L | Kent Scientific Corporation | SOMNO-0705 | |
| Low Profile Facemask, x-small | Kent Scientific Corporation | SOMNO-0304 | |
| Animal Warming | |||
| PhysioSuite Physiological Monitoring System with RightTemp Homeothermic Warming | Kent Scientific Corporation | PS-RT | Includes infrared warming pad, rectal probe, and pad temperature probe |
| Anesthetic Agents and Medications | |||
| Isoflurane (250 ml bottle) | Piramal Healthcare | ||
| Puralube Opthalmic Ointment | Perrigo |
Referenzen
- Damen, F. W., Adelsperger, A. R., Wilson, K. E., Goergen, C. J. Comparison of traditional and integrated digital anesthetic vaporizers. JAALAS. 54 (6), 756-762 (2015).
- Chakravarti, S., Basu, S. Modern Anaesthesia Vapourisers. Indian J Anaesth. 57 (5), 464-471 (2013).
- Carroll, G. . Small Animal Anesthesia and Analgesia. , (2008).
- Tranquilli, W. J., Thurmon, J. C., Grimm, K. A. . Lumb and Jones' veterinary anesthesia and analgesia. , 23-86 (2013).
- Ambrisko, T. D., Klide, A. M. Evaluation of isoflurane and Sevoflurane vaporizers over a wide range of oxygen flow rates. Am J Vet Res. 67 (6), 936-940 (2006).
- McKelvey, D. H. . Veterinary Anesthesia and Analgesia. , (2003).
- Thomas, J., Lerche, P. . Anesthesia and Analgesia for Veterinary Technicians. , 335 (2011).
- Flecknell, P. . Laboratory animal anaesthesia. , (2009).
- Mapleson, W. W. The elimination of rebreathing in various semiclosed anaesthetic systems. Brit J Anaesth. 26 (5), 323-332 (1954).
- Ward, C. S. Physical principles and maintenance. Anaesthetic equipment. , (1985).
- El-Attar, A. M. Guided isoflurane injection in a totally closed circuit. Anaesthesia. 46 (12), 1059-1063 (1991).
- Lockwood, G., Chakrabarti, M. K., Whitwam, J. G. A computer-controller closed anaesthetic breathing system. Anaesthesia. 48 (8), 690-693 (1993).
- Lowe, H. J., Cupic, M. Dose-regulated automated anesthesia (Abstract). Br. J. Clin. Pharmacol. 12 (2), 281-282 (1971).
- Soro, M., et al. The accuracy of the anesthetic conserving device (Anaconda) as an alternative to the classical vaporizer in anesthesia. Anes Analg. 111 (5), 1176-1179 (2010).
- Walker, T. J., Chackrabarti, M. K., Lockwood, G. G. Uptake of desflurane during anaesthesia. Anaesthesia. 51 (1), 33-36 (1996).
- Weingarten, M., Lowe, H. J. A new circuit injection technic for syringe-measured administration of methoxyflurane: a new dimension in anesthesia. Anes Analg. 52 (4), 634-642 (1973).
- Enlund, M., Wiklund, L., Lambert, H. A new device to reduce the consumption of a halogenated anaesthetic agent. Anaesthesia. 56 (5), 429-432 (2001).
- Kelly, J. M., Kong, K. L. Accuracy of ten isoflurane vaporisers in current clinical use. Anaesthesia. 66 (8), 682-688 (2011).
- Matsuda, Y., et al. NARCOBIT - A newly developed inhalational anesthesia system for mice. Exp Anim. 56 (2), 131-137 (2007).
- Matsuda, Y., et al. Comparison of newly developed inhalation anesthesia system and intraperitoneal anesthesia on the hemodynamic state in mice. Biol Pharm Bull. 30 (9), 1716-1720 (2007).
- Voightsverger, S., et al. Sevoflurane ameliorates gas exchange and attenuates lung damage in experimental lipopolysaccharide-induced lung injury. Anesthesiology. 111 (6), 1238-1248 (2009).
- Garber, J., et al. . Guide for the Care and Use of Laboratory Animals. , (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten