Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bestimmung der relativen Potenz von einer Anti-TNF monoklonaler Antikörper (mAb) durch neutralisieren TNF mit einer In Vitro bioanalytische Methode
In diesem Artikel
Zusammenfassung
Ein Protokoll für die Bestimmung der relativen Anti-apoptotische Aktivität eine Anti-TNF-MAB WEHI 164 Zellen eine Neutralisation Mechanismus mit wird hier vorgestellt. Dieses Protokoll eignet sich für die Neutralisation Stärke der verschiedenen Moleküle mit der gleichen biologischen Funktionen zu vergleichen.
Zusammenfassung
Dieses Protokoll zeigt die Messung des apoptotischen Aktivität Neutralisierung TNF in einem Fibroblast Zellen Mausmodell (WEHI 164) mit einem Anti-TNF-mAb. Darüber hinaus kann dieses Protokoll verwendet werden, andere Anti-TNF-Moleküle, wie zum Beispiel Fusionsproteine zu bewerten. Die zelluläre Modell hier beschäftigt ist empfindlich gegen TNF-vermittelten Apoptose, wenn ein zusätzlicher Stressfaktor in Zelle Kulturbedingungen (z. B. Serum Deprivation) induziert wird. Dieses Verfahren ist ein Beispiel für gewusst wie: Ausführen dieser analytische Assay, Hervorhebung der wichtigsten Vorgänge im Zusammenhang mit der Probenvorbereitung, Zelle Verdünnung Apoptose-Induktion und photometrische Messungen, die entscheidend für die erfolgreiche Ergebnisse zu gewährleisten. Dieses Protokoll zeigt die beste Leistung-Bedingungen zur Apoptose-Induktion und effiziente Signal aufzeichnen, was zu niedrigen Unsicherheit Werte.
Einleitung
Biologische Potenz ist die quantitative Messung der biologischen Aktivität basierend auf den definierten Produkt-Attribute, die die relevanten biologischen Eigenschaften verknüpft sind, während Menge (in Masse) eine physikalisch-chemische Maßnahme der Proteingehalt ist. Potenz-Tests, zusammen mit anderen analytischen Methoden sind im Rahmen der Produktkonformität, Stabilität und Vergleichbarkeit Studien durchgeführt. In diesem Sinne dienen die Potenz Messungen nachweisen, dass Produktchargen der kritischen Qualitätsattribute (CQAs) oder Akzeptanzkriterien in allen Phasen der klinischen Studien und nach Marktzulassung erfüllen.
Apoptose programmierter Zelltod, natürlich vorkommende, wenn Zellen infiziert sind, mit einem Virus oder wenn die Zellen durch einen ökologischen betonte, dass Kompromisse zellulären Lebensfähigkeit und Funktion1,2Faktor. Unter anderem zählt Apoptose-Hemmung oder biologische Neutralisation, die hauptsächlich bekannten therapeutischen Mechanismen der mAbs, insbesondere bei der Behandlung von chronischen Krankheiten, wie immun-vermittelte entzündliche Erkrankungen. Anti-TNF-Moleküle ausüben ihrer therapeutischen Eigenschaften durch die Blockierung der Interaktion von Tumor-Nekrose-Faktor Alpha (TNF) mit dem p55 und p75 Zelle Oberfläche Rezeptoren3, wodurch Signalwege, die schließlich zur zellulären Apoptose führen.
TNF kann Entzündungen in einigen chronischen Krankheiten4produzieren. TNF wird fälschlicherweise in das extrazelluläre Milieu durch Makrophagen, abgesondert die Wachposten des angeborenen Immunsystems und die Hauptakteure in dieser Art von Krankheit5sind. Als ein gemeinsamer Weg ist TNF Deregulierung der Pathogenese dieser Erkrankungen zugeordnet. Ohne Kontrolle und unter ständiger Induktion und Zelle Stress induziert TNF Tod und Gewebe Zelldegeneration, letztlich zu rheumatoider Arthritis, Morbus Crohn und andere pathologische Profile6.
TNF-Antagonisten, die das Zusammenspiel von TNF und seine Rezeptoren blockieren kamen verstärkt zum Einsatz als eine wirksame Therapie zur Verringerung der Symptomatik und behindern das Fortschreiten dieser Erkrankungen. Heutzutage sind Anti-TNF-Arzneimitteln verbreitet, die systemische Konzentration dieses Zytokin damit Verhinderung weiterer Degeneration der betroffenen Gewebe zu kontrollieren. In diesem Sinne ist es unerlässlich, bietet eine reproduzierbare und robuste Bioassay um zu beschreiben, die spezifische Fähigkeit eines Arzneimittels, seine biologische Wirkung zu erzielen.
In diesem Protokoll, kritischen Schritte bei der Entwicklung eines Neutralisation Assays identifiziert-für die erfolgreiche Messung der biologischen Potenz markiert sind, mit besonderem Schwerpunkt auf die Fähigkeiten, um die Bio-analytische Methode ausgeführt werden. Diese Bio-analytische Methode informiert nützliche Vergleichbarkeit zwischen verschiedenen Chargen oder Anti-TNF Arzneimittel im Vergleich zu einem klinisch getesteten Referenzstoff.
Protokoll
1. Vorbereitung der Medien und Lösungen
- bereiten das Kulturmedium: RPMI-1640 mit 10 % FBS, pH 7.4.
- Vorbereiten Assay Kulturmedium: RPMI-1640 ohne Phenol rot, aber mit 1 % FBS, pH 7.4.
- Zelle Waschlösung vorbereiten: DPBS Mg und Ca-freie Lösung mit 0,02 % EDTA, pH 7.4.
- Zelle Ablösung Lösung vorbereiten: 0,125 % Trypsin mit 1 mM EDTA.
- Auftauen einer 0,25 % igen Lösung von Trypsin-EDTA und Übertragung auf eine sterile 500-mL-Flasche 100 mL.
- Mix mit 100 mL Zelle Waschlösung und 15 mL Aliquots in 15 mL steriles Röhrchen zu verzichten. Shop unter-70 bis-80 ° C bis zur Verwendung.
- Filtern diese Lösungen durch einen 0,22-µm-Membran und bis zu 37 ° C für mindestens 30 min vor Gebrauch warm.
- Bereiten Apoptose-Induktion-Stammlösung TNF-Lösung bei 3,3 µg/mL.
- Auflösen 20 µg von TNF mit 500 µL Filter-sterilisierte Wasser in seiner primären Container und mischen bis zur vollständigen Auflösung.
- In einem 15 mL steriles Röhrchen zu übertragen und dieses Rohr 5,5 mL des DPBS Mg und Ca-freie Lösung hinzufügen. Mischen Sie sanft mit einem Vortex-Mixer.
- Aliquot der Lösung in 70 µL-Portionen. Verzichten jedes aliquoten in 0,5 mL Mikroröhrchen und bei-80 ° c
- Bereiten Apoptose Induktion Lösung: TNF-Lösung bei 40 ng/mL.
- Ein Aliquot der Apoptose Induktion Vorratslösung, Inkubation in einem Wasserbad bei 25 ° c für 10 min. Auftauen
- Apoptose-Induktion-Stammlösung auf 40 ng/mL zu verdünnen, indem 4,939 mL Assay Nährmedium in einem 15 mL steriles Röhrchen 61 µL 3,3 µg/mL TNF-Lösung hinzufügen.
- Mix von Vortex Mixer für 10 s; diese Lösung muss vor Gebrauch frisch zubereitet werden.
- Wärmen Sie die Lösung auf 37 ° C für mindestens 30 Minuten vor dem Gebrauch in th Eneutralization Assay.
- Bereiten die Substratlösung: Caspase 3/7 Glo Lösung 7 , 8.
- Die Caspase-Pufferlösung (Caspase 3/7 Glo Puffer) 12 h vor dem Gebrauch auftauen.
- Lassen die Caspase-Puffer-Lösung und das Substrat (Caspase 3/7 Glo Substrat) separat am 25 ± 5 ° C für 30 min vor dem vermischen sitzen.
- Transfer 10 mL der Pufferlösung Caspase zum Substrat Fläschchen und Mix durch Umkehrung.
- Halten bei 25 ± 5 ° C, lichtgeschützt bis zur Verwendung.
Hinweis: Die Lösung ist für 6 h bei Raumtemperatur stabil.
2. Zelle Culturing und Counting
- Zelle Auftauen und die ersten Subkultur.
- Entfernen Sie ein Fläschchen mit WEHI 164 Zellen 9 aus einer Tiefkühltruhe bei-80 ° c und übertragen Sie sie auf einem Eisbad.
- Oben und unten mit 1 mL vorgewärmten Kulturmedium pipette, bis die gefrorenen Zellen vollständig auftauen.
- 9 mL vorgewärmten Kulturmedium auf eine 15 mL steriles Röhrchen zu verzichten.
- Übertragen die Zellsuspension in der 15 mL steriles Röhrchen und mischen Sie fünfmal durch Umkehrung.
- Zentrifugieren der Zellsuspension bei 125 X g für 3 min. verwerfen den Überstand und die Zelle Pellet disaggregieren.
- 5 mL Kulturmedium hinzufügen das Rohr. Mischen, bis die Zellen völlig Nukleinsäuretablette sind.
- Für Zellzählung, 50 µL Zellsuspension auf einer 500 µL Reaktionscup und vermischen sich mit 50 µL 0,4 % Trypan Blau übertragen. Zählen der Zellen und passen Sie auf 0,5 x 10 6 Zellen/mL. Schritt 2.2, s.u..
- 75 mL Zelle Kultur Kolben 13 mL vorgewärmten Kulturmedium hinzufügen.
- Genügend Aussetzung Zellvolumen aus Schritt 2.1.6 0,5 x 10 6 Zellen/mL in der Zelle-Kultur-Kolben und Inkubation über Nacht bei 37 ° C und 5 % CO 2 zu verzichten.
- Zellzählung.
Hinweis: Siehe Referenz 10.- Mit der Lösung von Schritt 2.1.6, 0,05 mL auf eine Hemocytometer übertragen und bestimmen die Zelldichte unter dem Mikroskop verwenden Trypan blau Ausgrenzung.
- Die Gesamtzahl der lebensfähigen Zellen zu quantifizieren.
- Einstellen der Zellsuspensionen 0,5 x 10 6 Zellen/mL.
Formel 1
V Kulturmedium (mL) =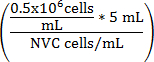
V Kulturmedium (mL) = (5 mL - V Zellsuspension)
V Kulturmedium (mL) = angepasste Lautstärke des WEHI 164 Zell-Aussetzung
NVC = Anzahl der lebensfähigen WEHI 164 Zellen/mL
V Kulturmedium (mL) = Assay Kulturmedium Volumen hinzugefügt, um die Zellsuspension zu 0,5 x 10 6 Zellen/mL
0,5 x 10 6 = Ziel Zelldichte
- Zell-Distanz und der zweiten und dritten Subkultur.
Hinweis: Ein Vakuumsystem kann verwendet werden, um die Lösungen aus den Kolben zu entfernen. Einweg- oder Glas sterile Pipetten können verwendet werden. Wenn die Pipette eine Baumwolle Verstopfung hat an der Spitze, sie muss vor dem Gebrauch entfernt werden.- Entfernen Sie das Kulturmedium aus der Zellkultur T-Kolben mit einer 1 mL sterilen Pipette und ein Vakuum.
- Zelle waschen verzichten 5 mL Lösung in die Kultur T-Kolben, vorsichtig mischen und die Lösung zu verwerfen. Wiederholen Sie diesen Schritt zweimal.
Hinweis: Die vollständige Entfernung des Kulturmediums ist entscheidend für effiziente Zelle Loslösung. - T-Kolben 15 mL der Zelle Ablösung Lösung hinzu und lassen Sie stehen für 3 min in einem Inkubator bei 37 ° C und 5 % CO 2.
- Stellen Sie sicher das Fehlen der angeschlossenen Zellen in die Innenwand der Flasche unter die Lupe genommen. Entfernen Sie die Zellen aus der Kultur T-Kolben mit einer sterilen 20 mL-Pipette und verzichten sie in ein steriles Röhrchen 50 mL.
- Zentrifugieren der Zellsuspension bei 125 X g für 3 min. verwerfen den Überstand und das Pellet mit einem anderen 5 mL Kulturmedium Aufschwemmen.
- Der Zellen zu zählen und fügen Sie genug Nährmedium zur Erreichung der gewünschten Zellkonzentration nach Gleichung 1.
- 72 cm 2 T Kolben dieser Suspension hinzu und Inkubation über Nacht bei 37 ° C und 5 % CO 2.
- Subkultur assay die Zellen mindestens zwei Mal vor der Verwendung in der Neutralisation. Wiederholen Sie die Schritte 2.3.1-2.3.8 für die nächsten zwei Tage.
- Assay Zellsuspension.
- Wählen Sie eine WEHI-164-Subkultur, die mindestens drei Pässe hat. Siehe Schritt 2.1.
- Trennen und die Zellen entsprechend Schritte 2.2 und 2.3 dieses Protokolls zählen.
- Verdünnen die Zellsuspension nach Gleichung 1 0,5 x 10 6 Zellen/mL.
- Verwenden diese Zellsuspension für die Neutralisation Assay. Mischen Sie alle Zellsuspensionen von Vortex Mixer vor dem Gebrauch.
3. Antikörper-Vorbereitung und Verdünnungen
- Quantifizierung der mAbs.
- Bestimmen Sie die Konzentration der Referenzstoff Kontrollprobe und analytische Probe durch UV-Absorption bei 280 nm mit ihren Massensterben Koeffizient (1,39) 11.
Hinweis: Original Konzentrationen könnten Drogen Produktetiketten entnommen werden. Allerdings muss dies durch UV-Absorption überprüft.
- Bestimmen Sie die Konzentration der Referenzstoff Kontrollprobe und analytische Probe durch UV-Absorption bei 280 nm mit ihren Massensterben Koeffizient (1,39) 11.
- mAb Verdünnungen.
- Verdünnt alle Proben unabhängig voneinander in dreifacher Ausfertigung, mit DPBS Mg und Ca-frei in 2 mL Mikroröhrchen bis 2 mg/mL Lösung. Bestätigen Sie diese Konzentration durch UV-Absorption in dreifacher Ausfertigung, mit DPBS Mg und Ca-freie Lösung als Rohling.
- Mischen die Lager Proteinlösungen für 5 s mit einem Vortex-Mixer.
- Verdünnen 100 µL jeder 2 mg/mL-mAb-Lösung mit 0,9 mL Kulturmedium Assay.
- Mix für 5 s von Vortex Mixer.
Hinweis: Diese Lösungen haben eine Konzentration von 200 µg/mL. Verdünnungen erfolgen für jedes dreifacher. - Zu verdünnen, 10 & #181; L jede 200 µg/mL-mAb-Lösung mit 0,99 mL Kulturmedium Assay. Mix für 5 s mit einem Vortex-Mixer. Diese Lösungen haben eine Konzentration von 2 µg/mL. Verdünnungsreihen für jedes dreifacher durchführen, vor der Verwendung in der Neutralisation Test.
- Anti-TNF mAb Verdünnungen in drei unabhängige Mikroplatten machen. Machen Sie ein Duplikat jedes unabhängige dreifacher Ausfertigung zu und verzichten sie in einer Mikrotestplatte zu, wie in Tabelle 1 angegeben. Bezug Stoff < tabelle Fo:keep-together.within-seite = "1" Fo:keep-mit-next.within-seite = "immer" Fo:text-ausrichten = "center" > Platte 1 Platte 2 Platte 3 Wells Probe Wells Probe Wells Probe B2:B11 Referenzstoff B2:B11 Kontrollprobe B2:B11 analytische Probe C2:C11 C2:C11 C2:C11 D2:D11 analytische Probe D2:D11 Referenzstoff D2:D11 Kontrollprobe E2:E11 E2:E11 E2:E11 F2:F11 Beispiel für ein Steuerelement F2:F11 Analyseprobe F2:F11 Referenzstoff G2:G11 G2:G11 G2:G11 Tabelle 1: Mikrotestplatte Probe Arrays. Ein vollständige Neutralisation Assay muss in drei Mikrotiterplatten in Koordinaten B2 G11 ausgeführt werden. Gelegentliche Abgabe von Verweis, analytische, und Kontrollproben erlauben Forschern, jede Bias in der Probe zu überprüfen.
- Perform mAb Verdünnungen von jeder Referenz probieren oder zu steuern, wie in Tabelle 2 dargestellt.
Hinweis: Die Anti-TNF-mAb-Konzentrationen in dieser Tabelle beschriebenen sind nicht die Endkonzentrationen in der Neutralisation Assay. < td > 250
T Möglichkeit 2: Anti-TNF mAb Verdünnungen. Serielle Verdünnungen von Anti-TNF mAbs sind in dieser Tabelle gezeigt. In dieser Tabelle beschriebenen Endkonzentrationen sind nicht die Konzentration in der Probe wo Anti-TNF mAbs wurden um den Faktor 3 (Kulturmedium, mAb Verdünnung + Zellen Aussetzung) verdünnt. Linien in Fettdruck stellen Verdünnungen aus Linien 3, 5, 7, 9 und 10; nicht fett gedruckten Linien stehen für Verdünnung von Linien 3, 4 und 6. Diese serielle Verdünnungen werden kurz vor Durchführung der Neutralisierung-Assay durchgeführt. Muss darauf geachtet werden, zu mischen, durch Pipettieren rauf und runter dreimal vor der Abgabe der Verdünnungen.Platte Spalte Volumen der Assay-Nährmedium (μL) Volumen Referenzstoff, analytische Probe oder Kontrolle Probe (uL) Konzentration in der Probe-Platte (ng/mL) 2 0 230 2000 3 150 150 von Linie 2 1000 4 75 75 von Zeile 3 500 5 100 50 von Zeile 3 333 6 75 75 von Linie 4 7 75 75 von Linie 5 166 8 75 75 von Linie 6 125 9 75 75 her m-Linie 7 83 10 75 75 von Linie 9 41 11 150 75 von Zeile 10 13 - Halten die Platten bei 25 ± 5 ° C bis zur Verwendung.
4. Neutralisation Assay mit WEHI 164 Zellen
- Mix durch alle Suspensionen (0,5 x 10 6 Zellen/mL) Zelle vor Abgabe bei jedem Schritt dieses Protokolls vortexen.
Hinweis: In diesem Abschnitt, jede Lösung auf 37 ° C für 30 min vor dem Gebrauch warm. - Übertragen 50 µL Zellsuspension zu jedem der 60 Brunnen von Mikrotiterplatten, Umzug von Spalte 2 bis 11 und Linie B bis G.
- Transfer 50 µL der mAb-Referenz, Probe und Kontrolle Verdünnungen in Mikrotiterplatten. Folgen Sie den Schritten, die in Abbildung 1 dargestellt.
- Fügen Sie 50 µL der Apoptose-Induktion-Lösung für jedes gut.
- Zellulärer Bedienung von 50 µL des WEHI 164 Zellen, verzichtet in drei Brunnen. Bringen jedes gut zu einem Endvolumen von 150 µL mit Assay Kulturmedium.
- Verwenden Sie ein Zytotoxizität Steuerelement aus einer Mischung von 50 µL WEHI 164 Zellen plus 50 µL der Apoptose-Induktion-Lösung. Bringen jedes gut zu einem Endvolumen von 150 µL mit Assay Kulturmedium.
- Für TNF-Steuerelement verwenden 50 µL der Apoptose-Induktion-Lösung und bringen es auf 150 µL mit dem Assay Kulturmedium.
- Für den Rohling verwenden 150 µL des Kulturmediums Assay allein.
- Füllen Sie die restlichen Brunnen mit 150 µL Kulturmedium Platte Verdunstung Auswirkungen zu vermeiden. Wiederholen Sie die Schritte
- 4.1.1-4.1.9 zweimal in zwei anderen Mikroplatten.
Hinweis: Die mAb Endkonzentrationen in die Mikrotestplatte sind: 0.666, 0.333, 0.167 0.111, 0.083, 0.056, 0.042, 0,028, 0,014 und 0,004 µg/mL. - Laden die Proben in Mikrotiterplatten, wie in Abbildung 1 gezeigt.
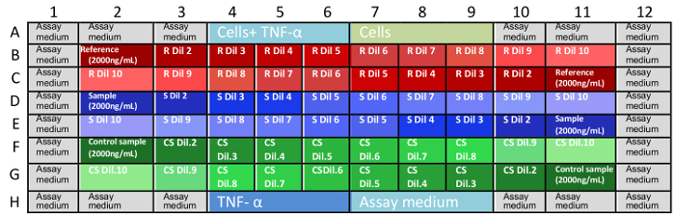
Abbildung 1: Disposition der Proben in den Assay Platten. B1 bis G11 sind auch Koordinaten in die Mikrotiterplatten und beschreiben die Positionen, wo die Probe Verdünnungen platziert werden. Fehlende Koordinaten sind Brunnen mit Kontrollen und Assay Kulturmedium (A1-A12 und H1-H12) gefüllt. Diese zufällige Verteilung von Proben (vorwärts- und Verdünnungen der Mikroplatten) hilft, um Verzerrungen in den Ergebnissen aufgrund der Verdunstung des Mediums oder anderen Variablen zu beseitigen. Es wird empfohlen, dass jeder Mikrotestplatte durch ein Analyst zu einem Zeitpunkt erfolgt. R:, S: Referenzprobe, CS: Kontrollprobe, Dil: Verdünnung. Bitte klicken Sie hier für eine größere Version dieser Figur. - Brüten die drei Platten bei 37 ° C und 5 % CO 2 für 16 ± 2 h.
- Lassen Sie die Caspase 3/7 Glo-Reagenz bei 25 ± 5 ° C für 30 min vor Gebrauch stehen.
- Dieses Reagenz in alle Vertiefungen, einschließlich der Proben und Kontrollen hinzufügen 100 µL.
- Schütteln Sie die Platten mit einer Mikrotestplatte Vortex Mixer für 3 min bei 25 ± 5 ° C sofort nach der Entnahme in die Vertiefungen.
- Inkubieren Sie die Platten für 2,5 ± 0,5 h bei 25 ± 5 ° C, vor Licht geschützt werden.
- Legen Sie das MikrofonRoplates in der Luminometer und füllen Sie den nächsten Abschnitt.
5. Analyse der Ergebnisse
- mit einer Software für die Erkennung von Lumineszenz Funktion Lumineszenz-Modus und dem Endpunkt.
- Wählen Sie einen 96-Well Clear-Boden-Platte und seine 80 interne Wells, ausgenommen Spalten 1 und 12.
- Wählen Sie eine Integrationszeit von 1.250 ms und 10 s für das Mischen der Mikrotestplatte vor Lesung.
- Wählen Sie die Brunnen wo Referenzstoff, analytische Substanz und Beispiel für ein Steuerelement platziert werden und identifizieren uns mit ihren entsprechenden Konzentrationen.
- Lesen Sie die Proben in Mikrotiterplatten mit der Luminometer gelegt.
- Verwenden eine vierte Parameter-Gleichung für die Analyse der Ergebnisse. Graph eine Dosis-Wirkungs-Kurve, wie in Abbildung 2 dargestellt.
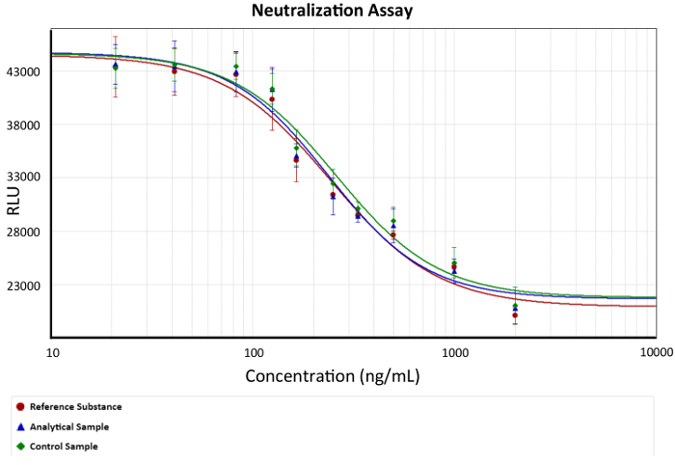
Abbildung 2: Dosis-Wirkungs-Kurve. Anti-TNF-mAb-Konzentration im Vergleich zu Lumineszenz (Zellviabilität) wird dargestellt. Eine vierte Parameter-Gleichung beschreibt den Anti-TNF-Schutz der mAbs diente als Vorbild. EC50 ist die Konzentration von mAb, das neutralisieren kann die Menge an TNF, die 50 % Zelltod in jedem Test, beispielhaft in der Grafik als die Veränderung der Neigung verursachen. Bars beschreiben die Standardabweichung der Lumineszenz für jede mAb-Konzentration. X steht für Anti-TNF Ab Konzentration und wird als eine logarithmische Funktion in ng/mL, während y steht für die Lumineszenz-Antwort in willkürlichen Lumineszenz-Einheiten. Bitte klicken Sie hier für eine größere Version dieser Figur.
Hinweis: In der vierten Parameter Gleichung, C ist die effektive Konzentration (EC50) 50. Dieser Wert wird verwendet werden, um den Referenzstoff Analyseprobe und Kontrollprobe durch die Effektor-Funktion vergleichen. - Für die Berechnung der relativen Potenzen, Referenzstoff zu 100 % zu beheben und die Potenzen der Probe zu berechnen und entsprechend zu kontrollieren.
Hinweis: Diese Werte sind in Abbildung 3 dargestellt.
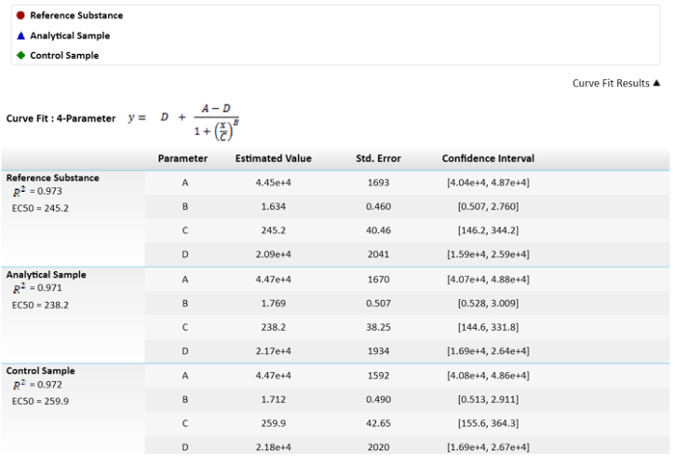
Abbildung 3: mathematische Gleichung zur Berechnung der EC50s und ihre Werte verwendet. EC50-Werte oder C-Parameter haben ihre Unsicherheit als Standardfehler dargestellt. Ein Vergleich der EC50s zwischen der Probe und Referenz Ergebnisse der relative Potenz wird auch dargestellt. Das Konfidenzintervall wird berechnet mit einem α = 0,05. Bitte klicken Sie hier für eine größere Version dieser Figur.
Ergebnisse
Dosis-Wirkungs-Diagramm (mit Steuerung)
Abbildung 1 stellt die Lumineszenz-Antwort gegen mAb Konzentration. Diese sigmoidale Funktion veranschaulicht Caspase 3 und 7 Release Assay Kulturmediums durch Lyse der Zelle. Zelltod wird durch Serum Hunger plus TNF signalisieren Induktion verbessert. Daher interagiert Anti-TNF-Molekül (mAb) mit Zytokin, Hemmung (durch sterische Behinderung) seine Wechselwirkung mit dem TNF-Zelle-Rezeptor. D...
Diskussion
Diese Charakterisierung hilft apriorische das biologische Verhalten eines Moleküls in der Entwicklung um zu bestimmen, bevor teure und zeitaufwendige klinische Studien durchgeführt werden. Es ist auch nützlich für die Freilassung von Charge zu Charge eines Produkts zugelassenes Medikament. Es ist erwähnenswert, dass diese Tests eignen sich zum bestimmen, ob ein Molekül eine ausreichende biologische Wirkung bezüglich sein Wirkungsmechanismus hat. Die Bio-analytische Methode präsentiert in diesem Tutorial ...
Offenlegungen
Die Autoren haben nichts preisgeben
Danksagungen
Diese Arbeit wurde unterstützt von der National Council of Science und Technology (CONACYT), Mexiko gewähren PEI CONACYT 2015 220333, ohne Teilnahme an das Design der Studie.
Materialien
| Name | Company | Catalog Number | Comments |
| WEHI 164 | ATCC | CRL-1751 | Fibrosarcoma cells from Mus musculus |
| RPMI-1640 Medium | ATCC | 30-2001 | Store medium at 2 °C to 8 °C |
| RPMI 1640 Medium, no phenol red | GIBCO | 11835-030 | Store medium at 2 °C to 8 °C |
| Trypsin-EDTA(0.25%),phenol red | GIBCO | 25200-056 | Store medium at -10 °C to -20 °C |
| DPBS, no calcium, no magnesium | GIBCO | 14190-136 | Store medium at 2 °C to 8 °C |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | Store at -20 °C to -70 °C |
| Fetal Bovine Serum (U.S), Super Low IgG | HyClone | SH3089803 | Store at -10 °C to -20 °C |
| Fetal Bovine Serum (U.S.), Characterized | HyClone | SH3007103 | Store at -10 °C to -20 °C |
| Caspase-Glo 3/7 Assay kit | Promega | G8093 | Store the Caspase-Glo. 3/7 Substrate and Caspase-Glo. 3/7 Buffer at –20 ºC protected fromLight |
| EDTA, Disodium Salt, Dihydrate, Crystal, A.C.S. Reagent | J.T.Baker | 8993-01 | -- |
| Sample mAb Adalimumab | Probiomed | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Reference and Control mAb Adalimumab | Abbvie | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Microplate Reader | Molecular Devices | 89429-536 | SpectraMax M3 Multi-Mode |
| Microplate reader Software | Molecular Devices | -- | SoftMax Pro 6.3 GxP |
| Incubator | Revco | 30482 | Revco RNW3000TABB Forced-Air CO2 |
| Laminar Flow Hood | The Baker Company | 200256 | Baker SG603A-HE | High Efficiency, Class II Type A2 |
Referenzen
- Elmore, S. Apoptosis: A Review of programmed cell death. Toxicol Patho. 35 (4), 495-516 (2007).
- Darwish, R. S. Regulatory mechanisms of apoptosis in regularly dividing cells. Cell Health Cytoskelet. 2 (1), 59-68 (2010).
- Tracey, D., et al. Tumor necrosis factor antagonist mechanism of action: A comprehensive review. Pharmacol Ther. 117 (2), 244-279 (2008).
- Körner, H., Sedgwick, J. Tumour necrosis factor and lymphotoxin: Molecular aspects and role in tissue-specific autoimmunity. Immunol Cell Biol. 74 (5), 465-472 (1996).
- Wong, M., et al. TNFa blockade in human diseases: Mechanisms and future directions. Clin Immunol. 126 (2), 121-136 (2008).
- Furst, D. E., Wallis, R., Broder, M., Beenhouwer, D. O. Tumor necrosis factor antagonists: different kinetics and/or mechanisms of action may explain differences in the risk for developing granulomatous infection. Semin Arthritis Rheum. 36 (3), 159-167 (2006).
- Karvinen, J., et al. Homogeneous time-resolved fluorescence quenching assay (LANCE) for caspase-3. J Biomol Screen. 7 (3), 223-231 (2002).
- Ren, Y. G., et al. Differential regulation of the TRAIL death receptors DR4 and DR5 by the signal recognition particle. Mol Biol Cell. 15 (11), 5064-5074 (2004).
- Sud, D., Bigbee, C., Flynn, J. L., Kirschner, D. E. Contribution of CD8+ T cells to control of Mycobacterium tuberculosis infection. J Immunol. 176 (7), 4296-4314 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Curr Protoc Immunol. Apendix 3, 3 (2001).
- Ramasubramanyan, N., et al. . Low acidic species compositions and methods for producing and using the same. 1, (2014).
- Masters, J. R., Stacey, G. N. Changing medium and passaging cell lines. Nat Protoc. 2 (9), 2276-2284 (2007).
- Eskandari, M. K., Nguyen, D. T., Kunkel, S. L., Remick, D. G. WEHI 164 subclone 13 assay for TNF: sensitivity, specificity, and reliability. Immunol Invest. 19 (1), 69-79 (1990).
- Hora, M. S., Rana, R. K., Smith, F. W. Lyophilized formulations of recombinant tumor necrosis factor. Pharm Res. 9 (1), 33-36 (1992).
- Ponnappan, S., Ponnappan, U. Aging and immune function: molecular mechanisms to interventions. Antiox Redox Signal. 14 (8), 1551-1585 (2011).
- Matsumaru, K., Ji, C., Kaplowitz, N. Mechanisms for sensitization to TNF-induced apoptosis by acute glutathione depletion in murine hepatocytes. Hepatology. 37 (6), 1425-1434 (2003).
- Camacho-Villegas, T., Mata-Gonzalez, T., Paniagua-Solis, J., Sanchez, E., Licea, A. Human TNF cytokine neutralization with a vNAR from Heterodontus francisci shark: a potential therapeutic use. mAbs. 5 (1), 80-85 (2013).
- Männel, D. N., Falk, W. Optimal induction of tumor necrosis factor production in human monocytes requires complete S-form lipopolysaccharide. Infect Immun. 57 (7), 1953-1958 (1989).
- Lis, K., Kuzawińska, O., Bałkowiec-Iskra, E. Tumor necrosis factor inhibitors-state of knowledge. Arch Med Sci. 10 (6), 1175-1185 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten