Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine schnelle Gleichgewichtsdialyse (RED) Methode zur Messung der Arzneimittelbindung an den Fall aus pulmonalen Tuberkuloseläsionen und Hohlräumen. Das Protokoll wird auch mit einer schaumigen Makrophagen-abgeleiteten Matrix verwendet, die ein wirksames Surrogat zum Fall ist.
Zusammenfassung
Die Tilgung der Tuberkulose-Krankheit erfordert Medikamentenregimen, die die Mehrfachschichten komplexer Lungenläsionen durchdringen können. Die Arzneimittelverteilung in den käsigen Adern von Hohlräumen und Läsionen ist besonders wichtig, weil sie Subpopulationen von drogenverträglichen Bakterien, die auch allgemein als persisten bezeichnet werden, beherbergen. Bestehende Methoden zur Messung der Arzneimittelpenetration bei Tuberkulose-Läsionen beinhalten kostspielige und zeitaufwändige in vivo- pharmakokinetische Studien, gekoppelt an bioanalytische oder bildgebende Verfahren. Die In-vitro- Messung der Arzneimittelbindung an Fallmakromoleküle wurde als Alternative zu solchen Techniken vorgeschlagen, da diese Bindung die passive Diffusion von Arzneimittelmolekülen durch den Fall beeinträchtigt. Die schnelle Gleichgewichtsdialyse ist ein schnelles und zuverlässiges System zur Durchführung von Plasmaprotein- und Gewebebindungsstudien. In diesem Protokoll haben wir eine schnelle Gleichgewichts-Dialyse (RED) -Gerät verwendet, um die Arzneimittelbindung an Homogenate von caseum zu untersuchen, das excis istAus den Läsionen und Hohlräumen von Tuberkulose-infizierten Kaninchen. Das Protokoll beschreibt auch, wie man eine Surrogatmatrix aus lipidbeladenen THP-1-Makrophagen erzeugt, um anstelle von caseum zu verwenden. Dieser Fall / Surrogat-Bindungstest ist ein wichtiges Instrument in der Tuberkulose-Wirkstoffforschung und kann angepasst werden, um die Arzneimittelverteilung bei Läsionen oder Abszessen, die durch andere Krankheiten verursacht werden, zu untersuchen.
Einleitung
Die Behandlung der pulmonalen Tuberkulose-Krankheit erfordert eine effektive Verteilung der Medikamente in verschiedene Arten von Läsionen. Nekrotische Läsionen und Hohlräume enthalten käsige Zentren, die Subpopulationen von drogenverträglichen oder "persistenten" Bakterien beherbergen. 1 , 2 Die Kavitationserkrankung ist mit minderwertigen Heilungsraten und schlechter Prognose verbunden. 3 , 4 Frühere Studien haben gezeigt, dass mit Hilfe von quantitativen und bildgebenden Techniken die Fähigkeit, in den Fall zu dringen, signifikant von einer Medikamentenklasse zur anderen variiert. 5 , 6 Diese Methoden erfordern jedoch die Verwendung von Tierinfektionsmodellen, die langsam und langwierig sind. Ein in vitro- Assay, der die Arzneimittelbindung an ex vivo caseum misst, wurde entworfen. Diese Bindung wurde gefunden, um umgekehrt mit der Arzneimittelpenetration in käsigen Granulomen zu korrelieren und ist daherAls prädiktives Werkzeug verwendet. 7
Gleichgewichtsdialyse gilt als der Goldstandardansatz für Plasmaprotein-Bindungsstudien. Die RED-Vorrichtung (Rapid Equilibrium Dialyse) bietet ein schnelles, einfach zu bedienendes und zuverlässiges System zur Durchführung solcher Assays. 8 Das Gerät besteht aus zwei Komponenten: Einweg-Einweg-Einsätze bestehend aus 2 Kammern, die durch einen vertikalen Zylinder mit halbdurchlässiger Membran getrennt sind; Und wiederverwendbare Basisplatten, die bis zu 48 Einsätze zu einem Zeitpunkt aufnehmen können. Die Dialysemembran hat einen 8 kDa-Molekulargewichts-Cutoff (MWCO), der sich ideal für Arzneimittel-Makromolekül-Bindungsstudien eignet. Das hohe Flächen-zu-Volumen-Verhältnis des Membranabteils ermöglicht eine schnelle Dialyse und Äquilibrierung. Sowohl die Einsätze als auch die Basisplatte wurden für eine minimale unspezifische Bindung validiert. Die Kombination der RED-Vorrichtung mit bioanalytischen Techniken liefert genaue Schätzungen der ungebundenen Fraktionen von Arzneimitteln in pLASMA. 8, 9
Obwohl ursprünglich Plasmaproteinbindung zu messen, das RED-Gerät wird in mehreren Gewebebindungsstudien verwendet worden, unter Verwendung von Homogenaten. 10, 11 in diesem Protokoll messen wir Medikament caseum Bindung, die nekrotische Ablagerungen von den nekrotischen Läsionen und der Hohlräume tuberculosis infizierten Kaninchen ausgeschnitten. Die azelluläre und nicht-vaskuläre Natur des käsigen Materials macht es leicht in eine homogene Suspension zu homogenisieren, die mit dem Assay kompatibel ist.
Da caseum ist mühsam herzustellen und schwer zu bekommen, wird das Protokoll auch für die Verwendung mit einer Surrogat-Matrix validiert, die von schaumigen Makrophagen hergestellt wird. THP-1 Monozyten abgeleiteten Makrophagen werden mit Ölsäure induziert, um mehrere Lipidkörper ansammeln, die sie geben ihre ‚schäumenden‘ Aussehen. Diese Lipid-beladenen Zellen werden geerntet undverarbeitet, um eine Matrix zu erzeugen, die wir als Ersatz verwenden, um caseum. Diese Studie hat gezeigt , dass die Drogen Bindung an diese Surrogat Matrix korreliert gut mit zu caseum Bindung, effektiv den in vivo nachahmt Prozess, die Arzneimittelpenetration in dem käsigen Kern von Granulomen und Hohlräumen verhindert.
Protokoll
Alle Tierversuche wurden in Übereinstimmung mit dem Leitfaden für die Pflege und Verwendung von Labortieren der National Institutes of Health mit Zustimmung des Institutional Animal Care und Use Committee des NIAID (NIH), Bethesda, MD durchgeführt. Alle Studien mit M. tuberculosis wurden in einem Labor mit Biosicherheitsstufe 3 (BSL-3) durchgeführt.
1. Kaninchen Infektionsmodell und Caseum Sammlung
- Infect Neuseeland weiße Kaninchen mit M. tuberculosis einen nasen nur Aerosol - Belichtungssystem unter Verwendung von wie oben beschrieben. 12, 13 erlauben die Infektion für 12-16 Wochen fortzuschreiten. Sedate die Kaninchen, die mit 35 mg / kg Ketamin und 5 mg / kg Xylazin intramuskulär, euthanize die Kaninchen mit 0,22 ml / kg Pentobarbital-Natrium und Phenytoin-Natrium intravenös und mit den necropsies fortzufahren.
- Mit einer Pinzette und Skalpell entfernen Lunge aus der Brust cavity. Von jedem Lungenlappen, seziert aus einzelnen Hohlräumen und großen nekrotischen Granulome mit einem Skalpell. Vorsichtig abkratzen caseum aus dem Hohlraum und Granulom Wänden. Wiegen, aufnehmen und speichern Proben in 2 ml Röhrchen mit Schraubverschluss bei -20 ° C bis zur Verwendung.
- Gamma-Bestrahlung der infektiösen caseum Proben bei 3 MegaRad auf Trockeneis sie uninfectious und sicher für den Einsatz in einem BSL-2 Labor zu machen.
2. In - vitro - Erzeugung von Caseum Surrogate von THP-1 - Zellen
- Wachsen THP-1 Monozyten in RPMI 1640-Medium (2 mM L-Glutamin und 10% fötales Rinderserum) in T175 Zellkulturflaschen (80 ml / Kolbe). Inkubieren der Kolben in einer 5% CO 2 -Atmosphäre bei 37 ° C für 3-4 Tage.
- Zentrifugieren der Kultur aus einer T175-Kolben in zwei 50 ml konischen Röhrchen bei 150 × g für 5 min. Überstand verwerfen und suspendiert das Pellet in 10 ml RPMI 1640 Medien.
- Pipette 5 & mgr; l dieser Kultur in ein 1,5 ml-Röhrchen mit 45 & mgr; l tRypan blau. Gründlich mischen durch Pipettieren. Übertragung 10 & mgr; l zu einem Hämozytometer und zählen die Anzahl der lebensfähigen THP-1-Monozyten (ungefärbten) ein Lichtmikroskop (Vergrßerung 10X) verwendet wird. Berechnen Sie die Anzahl der lebenden Zellen pro ml der Kultur. Verdünne mit RPMI - Medium auf die Enddichte von 1,25 x 10 6 Zellen / ml.
- Last 40 ml der Kultur auf einer großen Zellkulturplatte (50 x 10 6 Zellen / Platte). Werden 40 & mgr; l von 100 & mgr; M PMA (Phorbol-12-Azetat-myristate13 in Ethanol hergestellt) und lassen Zellen über Nacht in dem Inkubator haften.
HINWEIS: Endgültige Konzentration von PMA ist 100 nM. - Verdünnte reine Ölsäure (OA) (0,89 g / ml) in Ethanol zu einer Konzentration von 0,1 M (dh 31,7 uL OA in 968,3 & mgr; l Ethanol). Man verdünnt diese Lösung in frischem vorgewärmtem RPMI Medium auf eine Konzentration von 10 mM. Man verdünnt diesen OA Suspension auf 0,4 mM (endgültige Arbeitskonzentration) in RPMI-Medium vorgewärmt auf 37 ° C.
- Entfernen Sie die vorhandenen Medien und nichtAdhärierten Zellen aus den Zellkulturplatten und fügen sanft 40 ml 0,4 mM OA zu den THP-1-Makrophagen (THP-M) hinzu. Inkubieren bei 37 ° C im Inkubator über Nacht.
- Verwenden Sie ein Lichtmikroskop bei 40-facher Vergrößerung, um das Vorhandensein zahlreicher Lipidkörper-Einschlüsse in jedem THP-M visuell zu bestätigen. Entfernen Sie alle RPMI-Medium aus den Zellkulturplatten und waschen Sie die adhärenten Zellen zweimal mit phosphatgepufferter Kochsalzlösung (PBS) unter Verwendung einer 50 ml serologischen Pipette.
HINWEIS: Lipidkörper erscheinen als kleine, klare, sphärische Strukturen im Cytoplasma des THP-M. - Füge 40 ml 5 mM Ethylendiamintetraessigsäure (EDTA) in PBS zu jeder Platte hinzu. 15 min bei 37 ° C inkubieren.
- Lösen Sie die schaumigen Makrophagen (FM) durch wiederholtes Pipettieren über die Oberfläche der ganzen Platte mit einer 10-mL serologischen Pipette. Übertragen Sie die Zellsuspension auf ein 50-ml-Kegelrohr und drehen Sie sie bei 150 xg für 5 min.
- Das Zellpellet wird in 10 ml PBS (dritter PBS-Wäsche) a resuspendiertNd Übertragung auf eine vorgewogene 15-ml-konische Rohre. Spinne bei 150 xg für 5 min. Den Überstand sorgfältig mit einer serologischen Pipette abspülen und entsorgen.
- Betrachten Sie die FM-Pellets zu 3 Gefrier-Tau-Zyklen, um die Zellen zu lysieren und sie bei 75 ° C für 20-30 min zu inkubieren, um Proteine in der Matrix zu denaturieren. Die Pellets bei -20 ° C bis zum Gebrauch aufbewahren.
3. Rapid Equilibrierung Dialyse (RED) Assay
- 10 mM Stammlösungen aller Testverbindungen in Dimethylsulfoxid (DMSO) vorbereiten. Verdünnen Sie zu 500 μM Arbeitslösungen in DMSO vor jedem Assay.
- Wiegen Sie die Röhre mit dem Fallum Surrogat Pellet. Subtrahiere das Gewicht des leeren Rohres, um das Gewicht des Pellets allein abzuleiten. Füge 2-3 Metallperlen pro Röhrchen hinzu und unter Verwendung eines Gewebehomogenisators bei 1.200 Hüben / min für 1 min den Fallum oder die Surrogatmatrix in PBS (1: 9 w / v) zu stören, um 10x verdünnte Suspension jeder Matrix zu erreichen.
- Spike 6,5 μl der 500ΜM-Lösung der Testverbindung in 643,5 & mgr; l des Homogenats, um die Endkonzentration von 5 & mgr; M (& le; 1% DMSO) zu erreichen und zu verwirbeln.
- Legen Sie die ROT-Einsätze in die Grundplatte. Füge 200 μl der drogenspiked Matrix in die Spenderkammer (roter Ring) jedes RED-Inserts und 350 μl PBS in jede Empfängerkammer ein. Vorbereiten von 3 Einsätzen für jede Testverbindung (dreifache Proben). Siegelplatte mit einer Klebeplatte abdichten und bei 37 ° C auf dem Thermomixer bei 200 U / min (1 xg) für 4 h inkubieren.
- Nach der Inkubation mischen Sie den Inhalt der Spender- und Empfängerkammern vorsichtig 2-3 mal auf und ab. 20 μl Aliquote von Homogenat aus den Spenderkammern pipettieren und 20 μl sauberes PBS in ein 1,5 mL Röhrchen (1: 1) zugeben. In ähnlicher Weise pipettieren Sie 20 μl Aliquots von PBS-Proben aus den Empfängerkammern und fügen Sie 20 μl sauberes Homogenat (Matrix-Matching) hinzu. 8
HINWEIS: Matrix-Matching eliminiert die neFür 2 separate Kalibrierkurven (in Homogenat und PBS) für die quantitative Analyse. Der Inhalt der Spenderkammer kann im Laufe der Zeit sedimentieren. Den Inhalt vor dem Entfernen von Aliquoten vorsichtig mischen.
4. LC-MS Quantifizierung und Datenanalyse
- Fügen Sie 160 μl 1: 1 Methanol: Acetonitril mit 500 ng / ml Diclofenac oder 10 ng / ml Verapamil (interner Standard) zu jedem Röhrchen hinzu und verwirbeln Sie, um Proteine auszufällen. Zentrifugieren bei 10.000 xg für 5 min, um den Niederschlag zu sedimentieren und die Überstände in 96-Well-Tiefbrunnen-Platten zur Flüssigchromatographie-Massenspektrometrie (LCMS) zu überführen. 7
- Erstellen Sie Kalibrierkurven von 1-1.000 nM für jede Testverbindung, während Sie die gleiche Matrixzusammensetzung wie die obigen Proben halten. Quantifizieren Sie die Konzentration der Testverbindung in Proben aus den Spender- und Empfängerkammern nach einer LC-MS-Methode.
- Berechnen Sie den ungebundenen Bruch ( f u ) of die Droge in verdünnter Matrix unter Verwendung von Gleichung 1. Berechne des f u in unverdünnter Matrixgleichung unter Verwendung von 2 (D = Verdünnungsfaktor von 10). 14
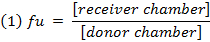
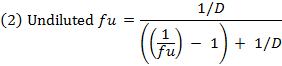
- Überprüfen Sie die Wiederherstellung (Massenbilanz) jeder Verbindung unter Verwendung von Gleichung 3 zu identifizieren Verbindungen mit Stabilität / Stoffwechsel / nicht-spezifische Bindungsprobleme.
HINWEIS: Wiederherstellung fällt typischerweise zwischen 70% und 130%. 15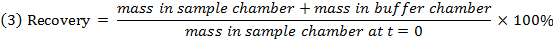
Ergebnisse
Mit diesem Protokoll haben wir Hunderte von Tuberkulose Medikament Entwicklung Verbindungen für ihre vorhergesagte Effizienz bei Eindringen Fallum getestet. Abbildung 1 zeigt die Grundkonzepte des ROTEN Assays. Die Dialysemembran der RED-Inserts ermöglicht es, dass ungebundene kleine Moleküle vom Spenderbrunnen zum Empfänger gut diffundieren und schließlich ein Gleichgewicht zwischen beiden Kompartimenten erreichen. Kleine Moleküle, die an Makromoleküle wie Protei...
Diskussion
Pulmonary nekrotische Läsionen und Hohlräumen bei Tuberkulose-infizierten Patienten enthalten Subpopulationen von Bakterien, die zur medikamentösen Behandlung recalcitrant sind. Die käsigen Kerne dieser Strukturen sind besonders verantwortlich, diese persisters in einer extrazellulären Umgebung für die Beherbergung. 16 günstige Verteilung von antibakteriellen Mitteln in diese entfernten Standorte wird angenommen , dass eine wichtige Determinante der Tuberkulose Wirksamkeit von Medikamenten...
Offenlegungen
Es gibt keine konkurrierenden finanziellen Interessen.
Danksagungen
Wir wünschen Johnson & Johnson, der TB Alliance, Astra Zeneca, Rib-X und Trius Therapeutics danken für die Bereitstellung von Bedaquilin, PA-824 (pretomanid), AZD5847, radezolid und Tedizolid sind. Brendan Prideaux, Matthew Zimmerman, Stephen Juzwin, Emma Rey-Jurado, Nancy Ruel, Leyan Li und Danielle Weiner unterstützte mit MALDI-Analyse, bioanalytische Verfahren, Herstellung der caseum Surrogat, chemische Synthese und Isolierung von Kaninchen-caseum. Diese Arbeit wurde mit Mitteln der Bill und Melinda Gates-Stiftung, Auszeichnung # OPP1044966 und OPP1024050 V. Dartois, NIH Geteilt Instrumentation Grant-S10OD018072 sowie eine gemeinsame Finanzierung von der Bill and Melinda Gates Foundation und Wellcome Trust für ein Kompetenzzentrum durchgeführt für Lead-Optimierung für Krankheiten der Dritten Welt zu P. Wyatt.
Materialien
| Name | Company | Catalog Number | Comments |
| New Zealand White Rabbits | Covance | - | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| THP-1 monocytic cell line | ATCC | ATCC TIB-202 | |
| 175 cm² TC-Treated Flask (T175) | Fisher Scientific | T-3400-175 | |
| RPMI 1640 media w/o glutamine | Fisher Scientific | MT-15-040-CV | |
| Hyclone Fetal Bovine Serum, Gamma irradiated | Fisher Scientific | SH3091003IR | |
| Hyclone L-glutamine, 200 mM | Fisher Scientific | SH3003401 | |
| Cellstar TC dish, 145 mm x 20 mm, vented | Fisher Scientific | T-2881-1 | |
| Phorbol 12-myristate 13-acetate (PMA) | Fisher Scientific | BP685-1 | |
| Ethylenediaminetetraacetic acid | Sigma | E6758 | |
| Oleic acid | Fisher Scientific | ICN15178101 | |
| Pierce RED Device Reusable Base Plate | Fisher Scientific | PI-89811 | |
| Pierce RED Device Inserts, 50/box | Fisher Scientific | PI-89809 | |
| Pierce RED insert removal tool | Fisher Scientific | 89812 | |
| Adhesive plate seal | Fisher Scientific | 08-408-240 | |
| PBS, pH 7.4, 10x 500 mL (Gibco) | Life Technologies | 10010-049 | |
| DMSO | Sigma | 472301 | |
| Acetonitrile | Sigma | 34998 | |
| Methanol | Sigma | 34860 | |
| Verapamil hydrochloride | Sigma | V4629 | |
| Diclofenac sodium salt | Sigma | 93484 | |
| Trypan Blue Solution, 0.4% | Fisher Scientific | 15-250-061 | |
| Ethanol, 200 proof | Fisher Scientific | 04-355-451 | |
| 2010 Geno/Grinder | SPEX SamplePrep | 2010 | |
| Bead Mill Homogenizer Accessory, Metal Bulk Beads | Fisher Scientific | 15-340-158 | |
| 484R Cobalt 60 Irradiator | JL Shepard | 7810-484-1 | |
| INCYTO C-Chip Disposable Hemacytometers | Fisher Scientific | 22-600-100 | |
| Upright Light Microscope | Leica | DM1000 | |
| Binary Liquid Chromatography system | Agilent | 1260 | Multi-compenent |
| Mass spectrometer | AB Sciex | 4000 |
Referenzen
- Sacchettini, J. C., Rubin, E. J., Freundlich, J. S. Drugs versus bugs: in pursuit of the persistent predator Mycobacterium tuberculosis. Nat Rev Microbiol. 6 (1), 41-52 (2008).
- Zhang, Y. Persistent and dormant tubercle bacilli and latent tuberculosis. Front Biosci. 1 (9), 1136-1156 (2004).
- Aber, V. R., Nunn, A. J. Short term chemotherapy of tuberculosis. Factors affecting relapse following short term chemotherapy. Bull Int Union Tuberc. 53 (4), 276-280 (1978).
- Chang, K. C., Leung, C. C., Yew, W. W., Ho, S. C., Tam, C. M. A nested case-control study on treatment-related risk factors for early relapse of tuberculosis. Am J Respir Crit Care Med. 170 (10), 1124-1130 (2004).
- Dartois, V. The path of anti-tuberculosis drugs: from blood to lesions to mycobacterial cells. Nature Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Sarathy, J. P., et al. Prediction of Drug Penetration in Tuberculosis Lesions. ACS Infect Dis. 2 (8), 552-563 (2016).
- Waters, N. J., Jones, R., Williams, G., Sohal, B. Validation of a rapid equilibrium dialysis approach for the measurement of plasma protein binding. J Pharm Sci. 97 (10), 4586-4595 (2008).
- Singh, J. K., Solanki, A., Maniyar, R. C., Banerjee, D., Shirsath, V. S. Rapid Equilibrium Dialysis (RED): an In-vitro High-Throughput Screening Technique for Plasma Protein Binding using Human and Rat Plasma. J Bioequiv Availab. 14, 1-4 (2012).
- Liu, X., et al. Unbound drug concentration in brain homogenate and cerebral spinal fluid at steady state as a surrogate for unbound concentration in brain interstitial fluid. Drug Metab Dispos. 37 (4), 787-793 (2009).
- Able, S. L., et al. Receptor localization, native tissue binding and ex vivo occupancy for centrally penetrant P2X7 antagonists in the rat. Br J Pharmacol. 162 (2), 405-414 (2011).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: a failed host immune response. Open Biol. 1 (4), 1-14 (2011).
- Via, L. E., et al. Tuberculous Granulomas are Hypoxic in Guinea pigs, Rabbits, and Non-Human Primates. Infect Immun. 76 (6), 2333-2340 (2008).
- Kalvass, J. C., Maurer, T. S. Influence of nonspecific brain and plasma binding on CNS exposure: implications for rational drug discovery. Biopharm Drug Dispos. 23 (8), 327-338 (2002).
- Di, L., Umland, J. P., Trapa, P. E., Maurer, T. S. Impact of recovery on fraction unbound using equilibrium dialysis. J Pharm Sci. 101 (3), 1327-1335 (2012).
- Lenaerts, A. J., et al. Location of persisting mycobacteria in a Guinea pig model of tuberculosis revealed by r207910. Antimicrob Agents Chemother. 51 (9), 3338-3345 (2007).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten