Method Article
Aufnahme von nasalen und bronchialen Flüssigkeiten: Precision Sampling der menschlichen Atemwege Schleimhaut und Labor Verarbeitung von Proben
In diesem Artikel
Zusammenfassung
Dieses Manuskript beschreibt die Verwendung von nasalen und bronchialen Absorption Techniken, speziell mit synthetischen absorptive Matrizen (SAM), um die Schleimhaut Flüssigkeit (MLF) der oberen und unteren Atemwege zu probieren. Diese Methoden bieten bessere Standardisierung und Verträglichkeit als bestehende Atemwege Sampling-Techniken.
Zusammenfassung
Die Methoden der nasalen Absorption (NA) und bronchiale Absorption (BA) verwenden synthetische absorptive Matrizen (SAM), um die Schleimhaut Flüssigkeit (MLF) der menschlichen Atemwege zu absorbieren. NA ist eine nicht-invasive Technik, die Flüssigkeit aus der unteren Nasenmuschel absorbiert und bewirkt, dass minimale Beschwerden. NA hat mit der Fähigkeit zur Probenahme der oberen Atemwege häufig wiederholen reproduzierbare Ergebnisse erbracht.
Im Vergleich dazu, alternative Methoden zur Probenahme der respiratorischen Schleimhaut, wie Nasen-Rachen-Aspiration (NPA) und herkömmlichen schrubben, sind weitere invasive und können größere Variabilität der Daten führen. Andere Methoden haben Einschränkungen, beispielsweise Biopsien und bronchiale Verfahren sind invasive, Auswurf enthält viele Tote Zellen sterben und erfordert Verflüssigung, Ausatmungsluft Kondensat (EBC) enthält Wasser und Speichel und Lavage Proben sind verdünnte und Variable.
BA kann durch den Arbeitskanal des Bronchoskop in Klinik durchgeführt werden. Die Probenahme ist gut verträglich und kann an mehreren Standorten in den Atemwegen durchgeführt werden. BA führt MLF Proben wird weniger verdünnt als alvéolaire Lavage (BAL) Proben.
Dieser Artikel beschreibt die Techniken der NA und BA sowie die Labor-Verarbeitung der daraus resultierenden Proben, die auf die gewünschte nachgelagerten Biomarker zu messenden zugeschnitten werden können. Diese Aufnahme-Techniken sind nützlich, Alternativen zu den herkömmlichen Sampling-Techniken verwendet in der klinischen Forschung der Atemwege.
Einleitung
Die meisten Erkrankungen der Atemwege verursachen eine entzündliche Reaktion, und es gibt ein dringender Bedarf an Stichproben aus der Atemwege Schleimhautoberfläche in allergischer Rhinitis, virale und Pilzinfektionen, Tuberkulose, Asthma, chronisch obstruktive Lungenerkrankung, pulmonale Fibrose und Lungenkrebs Krebs 1. Nasen-Rachen Absaugen (NPA), nasale Lavage und alvéolaire Lavage (BAL) sind gängige Techniken für die Probenahme der oberen und unteren Atemwege. Jedoch stellen diese Techniken erhebliche Probleme wie schlechte Verträglichkeit, Verdünnung von Entzündungsmediatoren und die Unfähigkeit, Probenahme2häufig wiederholen. Eine Alternative zur NPA Probenahme ist die Verwendung von Tupfer, entweder strömten Nylon, Baumwolle oder Viskose3,4, aber diese haben auch Einschränkungen, da sie Beschwerden und Schäden an der Nasenschleimhaut Epithel und in einigen Fällen irreversible Bindung von verursachen Entzündungsmediatoren5. Diese Techniken nicht in der Regel serienmäßig über eine Stunde wiederholt werden, und alternative Techniken möglicherweise wirksamer für die Erkennung von niedrigen Fülle Zytokine und Chemokine5,6. Darüber hinaus kann die Benutzer Variabilität verbunden mit diesen Techniken Inkonsistenzen in Daten, die in der Anforderung der größeren Patienten Kohorten erzeugen.
Alternativ wurden Absorption Techniken sowohl natürliche als auch synthetische Schwämme zur MLF von Schleimhaut-Oberflächen zu sammeln. Ophthalmologische Schwämme bestehend aus natürlicher Zellulose (z. B.Weck-Cel) wurden verwendet, um Probe Speichel, Hals-, und Vaginalsekret7. Darüber hinaus synthetische Schwämme aus Polyvinylalkohol (PVA) und hydroxylierten Polyvinylacetat (HPVA) wurden landwirtschaftlich8. Sieben verschiedene absorptive Materialien wurden für die Probenahme orale Flüssigkeit vor der Messung Antikörper9, während Polyurethan Mini-Schwämme verwendet wurden, um menschlichen Tränen10sammeln verglichen.
Filterpapier bestehend aus natürlicher Zellulose von der Baumwollpflanze ist allgemein verwendet worden, Nasensekret seit den bahnbrechenden Papier Alam und Kollegen in 199211,12,13,14aufnehmen, 15,16,17. Filterpapier Scheiben von Filter-Karten (z.B. Shandon) produziert worden und sind verwendet worden, um Histamin und Zytokine nach nasalen Allergen Herausforderungen gesteuert und mit natürlichen Allergen Exposition18,19 Messen ,20,21. Allerdings variieren verschiedene Chargen des Filterpapiers in sachlicher Proteinbindung und einige nicht, Cytokines freizugeben. Methoden mit einer synthetischen absorptive Matrix (SAM) wurden daher entwickelt2,22,23. SAMs sind jetzt in der Regel verwendet, um nasale MLF erhalten von Na Diese saugfähigen Materialien sind angenehm zu benutzen und erhalten MLF auch bei entzündeten Nasen in kurzen Abständen über einen längeren Zeitraum hinweg.
Nasale Absorption ist eine Form der Präzision Schleimhaut Probenahme mit einem SAM für die Probenahme der MLF in den oberen Atemwegen. NA-Geräte werden als CE-gekennzeichneten Medizinprodukten aus medizinischem Materialien mit Reinräumen hergestellt und sind frei von Staub und Allergenen. Der NA-Sampler besteht aus einem Griff und SAM in einem sterilen Cryotube. Die SAM besteht aus Polymeren, in der Regel Fasern, aber es gibt es auch als Schaum und diese sind zu weich und absorbierend, mit schnellen Feuchtigkeitstransport für die Probenahme werden ausgewählt. SAMs haben minimalen Proteinbindung erlauben die effiziente Elution von absorbiert Sekret. NA ist eine sehr sanfte, nicht-invasive Technik, die auf Spender aller Altersgruppen durchgeführt werden kann. Darüber hinaus ist serielle Probenahme, sogar alle paar Minuten möglich. NA gegen vorhandenen oberen Atemwegen Probenahme Techniken5 validiert wurde und sich wiederholende Probenahme ermöglichte Generation der kinetischen Daten nach Foulspiel der Atemwege mit Allergen23,24,25, bakteriellen Endotoxinen26 und viraler Art TLR-Agonisten (JI, A. Et Al., Manuskript in Vorbereitung). NA ist auch bei Säuglingen zu untersuchen, die Naturgeschichte der Atopie27,28,29 und viraler Bronchiolitis30verwendet wurde.
Bronchoskopische Microsampling (BMS) ist ein Verfahren zur Erhebung der MLF in der unteren Atemwege, die von Olympus31,32,33entwickelt wurde. Das BMS-System ist leider nur in Japan zugelassen. Olympus liefern zwei BMS-Systeme: eine mit einem faserigen hydroxylierte Polyester (FHPE) Sonde34,35,36,37, und eins mit einem Baumwoll Sonde33,38, 39 , 40 , 41 , 42 , 43. ein großes Hindernis war, dass die BMS-Sonde bei Patienten mit Asthma eingesetzt Schleimhaut Kontakt Blutungen, wobei die Hälfte aller Proben, die mit Blut kontaminiert verursacht. Die Autoren folgerten, dass es nicht möglich, die Probe mit diesem BMS-System von peripheren Atemwege Asthma Patienten43MLF war.
Als Alternative haben wir entwickelt, BA mit einem weichen SAM, die während der bronchoskopischen Untersuchung der unteren Atemwege, einschließlich nach experimenteller Infektion von asthmatischen Probanden mit Rhinovirus6ausgeführt werden können. Das BA-Gerät besteht aus: einer externen hohlen Katheter, Handstück, die zur Aktivierung die SAM extrudiert und eine zentrale Kunststoff Führungsdraht, der SAM an seinem Ende hat. Für NA BA-Kits sind aus medizinischem Material mit Reinräumen hergestellt und sind frei von Staub und Allergenen. Geräte sind CE gekennzeichnet und werden zur Verfügung gestellt Gamma bestrahlt. Der SAM-Streifen ist weich, absorbierend und hat schnellen Feuchtigkeitstransport für Musterkollektion. Es hat auch minimalen Proteinbindung erlauben die effiziente Elution von absorbiert Sekret. Das Gerät kann durch den Arbeitskanal ein Bronchoskop passen und verwendet werden kann, um schnell und präzise probieren MLF an bestimmten Standorten von Interesse innerhalb der Atemwege. Im Gegensatz zu BAL oder BMS ergibt BA nicht Kontakt zu Blutungen oder zusätzliche Patienten Beschwerden postoperativ.
Achten Sie darauf, dass die Verarbeitung von NA und BA Proben berücksichtigt werden sollten. Proben können direkt eingefroren und in Chargen verarbeitet oder kann sofort bearbeitet werden. Die Art der Verarbeitung kann in Richtung bestimmter downstream-Anwendungen, einschließlich Immunoassays für Zytokine, Chemokine und Immunglobuline oder Elutions virale, bakterielle, zugeschnitten und Wirtszelle verbundenen RNA. Wir präsentieren die klinische Erfassung und Labor Verarbeitungstechniken NA und BA als Leitfaden für die klinische Forscher zugeordnet.
Protokoll
Im folgenden Protokoll verwendeten Techniken wurden von der West London Forschungsethikkommission (Referenz-Nummer 15/lO/0444) genehmigt.
1. nasale Absorption (NA)
-
Vorbereitung vor der Probennahme NA
- Bei der Durchführung NA zuerst waschen Sie Hände und ziehen Sie der Handschuhe, vorzugsweise vor dem Patienten an.
- Inspizieren Sie die Nasenhöhle mit einer Stirnlampe zu, und haben Sie den Arzt ihrer nichtdominanten Daumen verwenden, um die Nase des Patienten um die Nasenhöhle zu visualisieren zurückziehen.
Hinweis: Eine nasale Spekulum ist nicht in der Regel erforderlich. - Visualisieren Sie die Nasenhöhle und minderwertig Nasenmuschel vor der Probenahme.
Hinweis: Die Nasenlöcher (Nasenlöcher) sind nicht rund im Querschnitt und gehen sie geradeaus nach hinten. In der Regel der unteren Nasenmuschel kann eine Wölbung oder Einbuchtung an der Seitenwand des Nasenlochs, als mit der Nasenscheidewand bilden die glatte, flache mediale Wand. Wir wollen Probe aus diesem minderwertigen Nasenmuschel, da das zugrunde liegende Epithel eine einfache Flimmerepithel der Atemwege44 ist.
-
NA-Probenahme
- Bei der Probenahme, passieren Sie die NA SAM sanft auf das Lumen des Nasenlochs, es flach an der unteren Nasenmuschel zu orientieren.
- Fragen des Spenders einen Zeigefinger verwenden, um die SAM auf der Nasenschleimhaut zu drücken. NA kann dazu führen, dass eine leichte kitzeln, mit Bewässerung möglich Auge, da die MLF aufgenommen wird.
Hinweis: Bei Erwachsenen führen wir in der Regel NA für 60 s. - Entfernen Sie nach Absorption der MLF das NA-Gerät aus dem Nasenloch und setzen Sie wieder in die ursprüngliche Röhre.
- Verarbeiten Sie die Proben im Labor sofort oder frieren Sie ein, wie später in diesem Protokoll aufgeführt.
Hinweis: NA ist in einer Vielzahl von nasalen Schleimhaut Herausforderung Modelle, und auch bei verschiedenen Atemwege Erkrankungen untersucht. Jedoch sollte die Validierung gegen andere respiratorische Probenahmeverfahren für jede Studie und Patient Bevölkerung durchgeführt werden.
2. bronchiale Absorption (BA)
-
Vorbereitung vor der BA Probenahme
Hinweis: BA erfolgt durch Fachpersonal in einer Bronchoskopie-Suite.- Überprüfen Sie vor der Platzierung der BA-Gerät nach unten den Katheter, dass SAM Extrudieren und zurück in den Katheter zurückziehen.
- Führen Sie vor Durchführung von BA an einem Patienten einen mock BA auf eine Bronchoskopie-Simulator.
-
BA-Probenahme
- Das Niveau der Bronchus Intermedius, nur die Einteilung in der rechten unteren und rechten mittleren Lappen proximalen übergeben Sie Bronchoskop die Luftröhre und die rechten Bronchus.
Hinweis: Wir probieren in der Regel aus der Bronchus Intermedius, obwohl andere Websites innerhalb der Atemwege entnommen werden können. Wenn der Katheter und SAM beobachtet, kann man den Bronchoskop Tipp nicht sehen. Wir beobachten die folgenden einfachen Schritte für BA, sobald das Bronchoskop die gewünschte Sampling-Seite erreicht hat. - Katheter nach unten: Einfügen des BA-Katheters durch den Betriebskanal das Bronchoskop bis die weiße Spitze nur sichtbar in den Atemwegen, bis maximal 1 cm distal zum Jahresende das Bronchoskop ist. Halten Sie die Bronchoskop und Katheter Spitze in der Mitte des lumens der Atemwege. Achten Sie darauf, um Kontakt zwischen der Katheterspitze und die Bronchialschleimhaut zur Verringerung des Risikos von Abrieb auf der Schleimhaut zu minimieren.
- SAM OUT: Drücken Sie den Griff des Geräts BA, dass SAM in das Lumen der Atemwege direkt mittleren oder unteren rechten Lappen extrudiert wird. Biegen Sie unter direkter Sicht die Spitze des Bronchoskop um sicherzustellen, dass die SAM unternimmt die MLF an der Atemwegswand Kontakt. Lassen Sie die SAM in den Atemwegen, flach an der Schleimhaut Wand für 30 s.
- SAM IN: Schauen Sie durch das Bronchoskop um sicherzustellen, dass die feuchte SAM-Sonde wieder über das Ende des Katheters gerade und nicht gebogen ist. Bei Bedarf kann die Katheter und Bronchoskop Spitze zurück zu SAM begradigen gebracht werden. Zurückziehen Sie unter direkter Sicht gerade SAM sanft zurück in den Katheter.
Hinweis: Wenn es Schwierigkeiten zurückziehen der SAM zurück in den Katheter, ziehen das ganze Gerät mit SAM wieder aus den Atemwegen extrudiert. - Katheter UP: Entziehen Sie den gesamte Katheter den Betriebskanal das Bronchoskop.
- Schneiden Sie SAM: SAM wird mit einer sterilen Schere abgeschnitten und ist dann in einem Cryotube auf Eis gelegt. Diese Proben können mit unterschiedlichen Methoden, wie Sie später in diesem Protokoll verarbeitet werden.
- Das Niveau der Bronchus Intermedius, nur die Einteilung in der rechten unteren und rechten mittleren Lappen proximalen übergeben Sie Bronchoskop die Luftröhre und die rechten Bronchus.
(3) die Verarbeitung von NA und BA Proben
Hinweis: Es gibt zahlreiche Möglichkeiten für Labor-Verarbeitung von Proben aus NA und BA. Diese Protokolle Bemühen um Proben für die spätere Verwendung zu speichern, und die MLF-Probe aus der SAM eluieren.
-
Optionen für die sofortige Behandlung von NA und BA Proben
- Option 1: Speichern der feuchten SAM auf Eis für ein paar Stunden vor der weiteren Verarbeitung.
- Option 2: Rohr sofort Tieffrieren NA SAMs in der Auflistung. In ähnlicher Weise BA SAMs in kryogenen Fläschchen nach Entfernung, mit einer Schere aus das Probenahmegerät einfrieren.
- Option 3: Legen Sie die freistehende SAM in Elution Buffer (300 µL) vor der Verarbeitung direkt oder tief gefrieren.
-
Optionen von Elution Buffer für NA und BA Proben
Hinweis: Die Wahl der Elution Puffer richtet sich auf das geschehen in der MLF-Probe analysiert werden und wir vier wichtigsten Alternativen vorschlagen:- Verwenden Sie eine vorgefertigte Testpuffer für Immunoassay-Verfahren geeignet. Dieser Puffer sollte eine kleine Menge des Reinigungsmittels (0,05 %) sowie Eiweiß, z. B. Rinderserumalbumin (BSA) bei 1 % enthalten.
- Alternativ verwenden Sie einen Puffer, enthält eine größere Menge von Waschmittel, damit die Zelle Lysis tritt.
Hinweis: Wir verwenden Puffer, Triton-X oder NP40 bei 1 % Konzentration enthalten. Zelle Lysis Puffer aktivieren intrazelluläre und extrazelluläre Zytokine werden von der SAM eluiert und führen in der Regel höhere Zytokine und Chemokine. Dieser Puffer sollte auch Eiweiß enthalten und sind mit BSA auf 1 % aus. - Für RNA-Messungen, wie quantitative PCR der viralen RNA oder Mess Host RNA RNA-Extraktionspuffer direkt hinzufügen der feuchten SAM.
Hinweis: Chaotropen RNA-Extraktion-Puffer enthalten Guanidinium, die Proteine denaturiert. Eine Alternative ist der eluierten MLF Flüssigkeit im Immunoassay oder Zelle Lysis Puffer enthaltenen RNA-Extraktionspuffer hinzu. - Organische Lösungsmitteln, wie Trifluoroacetic Säure, für die Extraktion von Lipiden und Metaboliten, Bewertung durch Massenspektrometrie verwenden.
Hinweis: Details dieser Reagenzien sind unter "Materialien" enthalten.
-
Elution Technik
- Einsetzen Sie für jede der oben genannten Elution Techniken die SAM in ein 2 mL Mikro-Zentrifugenröhrchen, zusammen mit dem gewünschten Extraktionspuffer.
- Vortex mischen die Probe für 30 s, SAM lose beigefügte Flüssigkeit und Biomolekülen zu waschen.
- Um vollständige Probenrückgewinnung sicherzustellen, führen Sie zentrifugale Elution indem feuchte SAM zu einem Spin Filter Mini-Spalte, die Einsätze in die gleichen 2 mL Mikro-Zentrifugenröhrchen zum Waschen verwendet.
Hinweis: Zwei Arten von Spin Filter Mini-Spalte können verwendet werden. Die erste enthält nur ein Kunststoff-Netz, das die SAM in der Position hält, so dass vollständige Elution von Flüssigkeiten. Alternativ, wenn mit infektiösem Material arbeiten, verwenden Sie Spin Filter mit einer Porengröße von 0,22 µm. Diese Filter werden Proben zu sterilisieren und eignen sich für Proben mit vermuteten mykobakteriellen Infektion. Diese Filter sollten jedoch vorab inkubierten mit Puffer, Bindung von Mediatoren des Filters durch unspezifische Wechselwirkungen zu minimieren. - Verwenden Sie sterilisierte Pinzette übertragen die feuchte SAM auf den Spin-Filter. Ändern Sie Zange zwischen Proben, um Kontaminationen zu vermeiden.
- Zentrifuge Proben für 20 min bei 16.000 x g in einer Mini-Zentrifuge auf 4 ° c abgekühlt
-
Zusammenfassung Beispiel Protokoll
- Im Labor, label 2 mL Mikro-Zentrifuge Rohre für Probenentnahme und fügen Sie die gewünschte Lautstärke der Elution Puffer (in der Regel 300 µL für NA; 100 µL für BA). Verschließen Sie Deckel und auf Eis.
- Nach Probenahme (sofort oder im Labor), die SAM aus dem Griff mit Pinzette entfernt und gelegt in den Puffer mit Sammelrohr (produziert im vorherigen Schritt). Stellen Sie sicher, die Kappe des Microcentrifuge Schlauch sicher geschlossen ist und die Proben auf Eis, an das Labor zur weiteren Verarbeitung zu übertragen.
- Entfernen Sie die Röhrchen mit SAM und Elution Puffer aus ihrem Transfer Container und Vortex-Mix für 30 s.
- Mit sterilen Pinzette, entfernen Sie SAM zu und in eine Spin-Spalte (mit oder ohne 0,22 µm-Cellulose-Acetat-Filter).
- Den Elution Puffer aus dem Sammelrohr zu sammeln und zu behalten.
- Setzen Sie die Spin-Säule mit SAM, in dem ursprünglichen Sammelrohr (oder eine neue Wenn sterile Filtern Proben) und Sammlung Puffer um spin-Spalte hinzufügen. Auf diese Weise wird der Spin-Spalte zurück in das Sammelröhrchen, dazu das Beispiel aus der SAM eluieren waschen Flüssigkeit durchlaufen.
- Zentrifugieren Sie die Proben mit Deckeln verschlossen (16.000 x g, 20 min, 4 ° C).
- Die Proben aus der Zentrifuge und einbauen möchten.
- Öffnen Sie den geschlossenen Deckel der Rohre und entfernen Sie die Spin-Spalte mit der SAM. SAM und Spin Spalte in einen geeigneten Abfallbehälter entsorgen.
- Sorgfältig Röhren Aliquoten, die das Eluat enthalten innerhalb des Schlauches in kryogenen gekennzeichnet. Das Gesamtvolumen der Eluat und das Volumen in jeder Aliquote aufzeichnen.
- Übertragen Sie die versiegelten Kryogen Röhrchen auf-80 ° C Gefrierschrank und speichern Sie aufrecht bis zu seiner Verwendung zu.
Ergebnisse
NA einfach in eine Reihe von Studien verwendet worden und nicht-invasiv messen Schleimhaut Entzündung. Nach Verabreichung des Allergens auf die Nase können Prostaglandin-D2 (PGD2) Stufen zu steigen und fallen innerhalb von Minuten (Abbildung 1), im Einklang mit Mastzelle Degranulation (Thwaites Et Al., Manuskript in Vorbereitung) beobachtet werden. Darüber hinaus können Vermittler von Typ-II-Entzündung, z. B. IL-5 (Abbildung 2, Nachdruck mit freundlicher Genehmigung von 24), in den Stunden nach nasalen Allergen Herausforderung23,24gemessen werden. Experimentelle Infektion von allergischen Asthmatikern und gesunden Kontrollpersonen NA diente ein Panel der Mediatoren einschließlich Interferon-Gamma (IFN-γ), Messen im Laufe von 7 Tagen (Abbildung 3, Nachdruck mit freundlicher Genehmigung von 6). Darüber hinaus demonstriert in natürliche respiratory syncytial Virus (RSV) Infektion von Säuglingen, NA RSV erhöhte Konzentrationen von inflammatorischen Zytokinen wie IFN-γ, im Vergleich zu nicht-RSV Säuglinge mit Bronchiolitis und gesunden Kontrollpersonen ( zugeordnet werden soll Abbildung 4, abgedruckt mit freundlicher Genehmigung von 30). Interessanterweise war diese Diskriminierung zwischen RSV und nicht-RSV-Bronchiolitis nicht signifikant in Zeit abgestimmt NPA Proben (Abbildung 4).
BA wurde auch während der experimentelle Infektion von allergischen Asthmatikern mit Rhinovirus verwendet. Am Tag 4 Rhinovirus Infektion, Ebenen von IFN-γ, CXCL11, wurden IL-10 und IL-5 erhöht vom Ausgangswert (Abb. 5; A, B, C und D, beziehungsweise). Darüber hinaus demonstriert diese Technik erhöhte IL-5 Niveaus in den unteren Atemwegen von allergischen Asthmatikern während Rhinovirus Infektion, im Vergleich zu gesunden Kontrollpersonen (Abbildung 5) (Abbildung 5 Nachdruck mit freundlicher Genehmigung von 6).
Diese repräsentative Ergebnisse von Proben mit Testpuffer mit 0,05 % Tween-20 und 1 % BSA eluiert generiert wurden (siehe Tabelle der Materialien).

Abbildung 1 : Schnelle Erzeugung und Clearance von Prostaglandin-D2 nach nasalen Allergen Foulspiel. Prostaglandin-D2 (PGD2) gemessen von nasalen Absorption Eluate in serieller Proben nach nasalen Allergen Herausforderung mit Timothy Gräserpollen (n = 5). Jede Zeile repräsentiert Daten von einem Individuum. Bitte klicken Sie hier für eine größere Version dieser Figur.
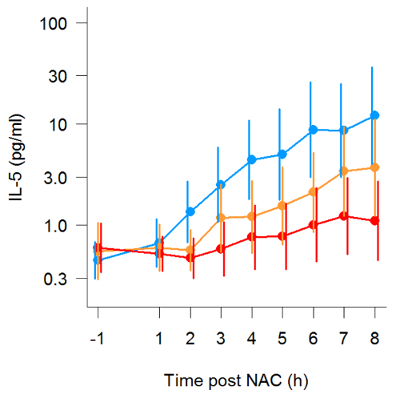
Abbildung 2 : Kinetische Messung von IL-5 nach nasalen Allergen Foulspiel. Produktion von IL-5 in seriellen nasale Absorption Proben nach nasalen Allergen Herausforderung. 3 wiederholen Sie Allergen Herausforderung Studien wurden durchgeführt, mit den Teilnehmern (n = 19), die Placebo erhielten (blau), niedrige Dosis (10 mg) oral Prednison (Orange) oder hohe Dosis (25 mg) oral Prednison (rot) eine Stunde vor dem Allergen-Verwaltung. Linien bezeichnen geometrischer Mittelwert und Fehlerbalken sind 95 %-Konfidenzintervall aller Teilnehmer. (Abbildung Nachdruck mit freundlicher Genehmigung von Leaker Et Al., Schleimhaut-Immunitätsforschung, 2017). Bitte klicken Sie hier für eine größere Version dieser Figur.
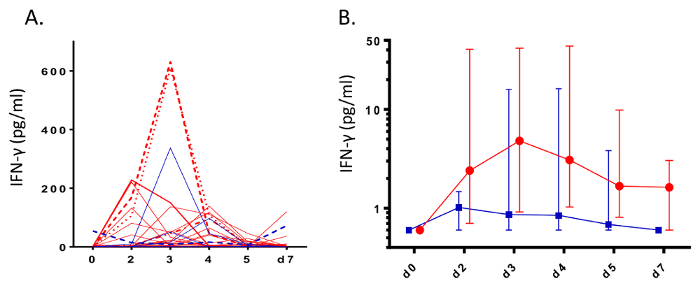
Abbildung 3 : Induktion von Interferon-γ während Rhinovirus Infektion. Während der Infektion Herausforderung von gesunden Erwachsenen (n = 11, blau) und allergischen Asthmatikern (n = 28, rot) mit Rhinovirus-16, nasale Absorption Probenahme wurde verwendet, um Niveaus der Interferon-γ (IFN-γ) zu messen. Daten werden als A) rohe Spaghetti Grundstücke von Privatpersonen und (B) mittlere Ebenen mit Fehlerbalken für interquartile Bereiche dargestellt. (Abbildung Nachdruck mit freundlicher Genehmigung von Hänsel Et al. 6). Bitte klicken Sie hier für eine größere Version dieser Figur.
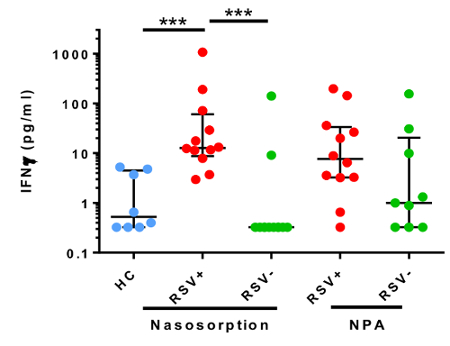
Abbildung 4 : Nasosorption diskriminiert erhöhten Interferon-γ mit RSV-Infektion von Säuglingen verbunden. Nasale Absorption und Nasen-Rachen-Aspiration (NPA) dienten, Interferon-γ Ebenen bei Säuglingen mit Bronchiolitis respiratory syncytial Virus (RSV) Infektion zu messen (rot, n = 12), ein nicht-RSV respiratorische Erreger (grün, n = 12), und gesund Kontrollen (blau, n = 9). Daten wurden analysiert mit einem Kruskall-Wallis-Test mit Dunns Korrektur für Mehrfachvergleiche (***p< 0,001). Linien bezeichnet Medians und Fehlerbalken sind interquartile reicht. (Abbildung mit freundlicher Genehmigung von Thwaites Et Al. geändert 30). Bitte klicken Sie hier für eine größere Version dieser Figur.
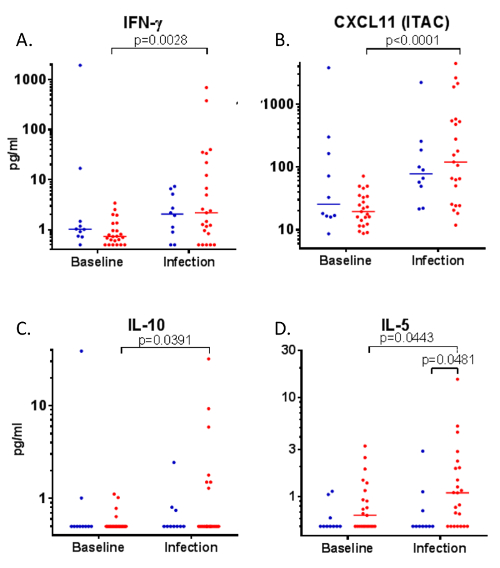
Abbildung 5 : Entzündungsmediatoren in Bronchien Absorption Proben während der Rhinovirus Infektion.
Nach Rhinovirus-16 Infektion von gesunden Kontrollpersonen (n = 10, blau) und allergische Asthma Freiwilligen (n = 23, rot), Bronchien Absorption wurde verwendet, um (A) IFN-γ, CXCL11 (B) und (C) IL-10 (D) IL-5 an der Basislinie und am 4. Tag der Infektion messen. Daten von Wilcoxon analysiert signiert Rang (übereinstimmenden Proben) und Mann-Whitney Test (unübertroffene Proben). Abbildung Nachdruck mit freundlicher Genehmigung von Hänsel Et al. 6 Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Ergebnisse von bestehenden Atemweg-Sampling-Techniken gelten als sehr variabel; Alternative Sampling-Techniken sind erforderlich, um die Forschung in diesem Feld5zu standardisieren. NA BA Probenahme der MLF in eine nicht-invasive Weise zu ermöglichen und haben spannende Potenzial um Immunantworten in gesunden und Kranken Atemwegen zu messen. Diese Techniken bieten zahlreiche Vorteile gegenüber bestehenden Techniken, einschließlich größere Verträglichkeit, Geschwindigkeit der Probenahme, die Fähigkeit, Probenahme, häufig wiederholen Inter Benutzer Variabilität zu senken, und verringerte Verdünnung immun Mediatoren5 . Die Dauer der Aufnahme und der Verarbeitungstechnik verwendet sollte optimiert für jede Studie und streng zwischen Probenahme Veranstaltungen erhalten. Darüber hinaus sollten bei BA, der Ort der Probenahme innerhalb der Atemwegs sorgfältig zwischen Individuen repliziert werden.
NA, und vor allem BA sind noch relativ neuartige Techniken für die klinische Forschung. Die Vorteile dieser Techniken haben jedoch ihre Verwendung in zahlreichen Studien, einschließlich sorgfältiger Validierung gegen alternative Techniken5geführt. Diese Geräte sind jetzt verfügbar, wie Geräte mit CE-Kennzeichnung für einen breiten Einsatz in der respiratorischen Forschung bereit. NA und BA in viel kleinere Probenvolumina als alternative Sampling-Techniken führen, führen höhere erhaltenen Konzentrationen mehr Sensibilität für niedrige Fülle immun Mediatoren.
Je nach gewünschten downstream-Anwendungen können NA und BA Proben direkt zur späteren Verarbeitung, Verbesserung der Studie Machbarkeit in einem klinischen Umfeld eingefroren werden. Das Protokoll zur Probe Handhabung kann auch an bestimmte downstream-Anwendungen angepasst werden. Die vorgeschlagenen Verarbeitungstechniken für die Sammlung von Protein, Lipid immun Mediatoren oder Nukleinsäuren verwendet werden, aber sollte für jede Studie optimiert werden. Insbesondere kann MLF mit verschiedenen Puffer eluiert werden. Erstens kann Immunoassay Puffer verwendet werden, um Schleimhaut Zytokine, Chemokine und Antikörper6,45zu messen. Puffer mit einem höheren Waschmittel können auch verwendet werden, um sicherzustellen, dass die Zelle Lysis Auftritt ermöglicht die Aufnahme von intrazelluläres Zytokine. Chaotropen RNA-Extraktion Puffer sollte verwendet werden, für die Bestimmung der Virusinfektion, virale laden, mRNA und das Mikrobiom zu hosten. Alternativ können organische Lösungsmittel für Lipidomics und Massenspektrometrie verwendet werden.
Zusammenfassend ist die direkte Absorption der MLF von Schleimhaut-Oberflächen eine spannende Technik mit möglichen Einsatz in Erkrankungen der Atemwege, Magen-Darm, urogenitalen und andere Schleimhaut. Diese vielversprechende Aufnahme-Techniken erfordern jedoch präzise Validierung der Probenahme und Verarbeitung Technik für individuelle Assays (Biomarker) in jeder Krankheit-Einstellung. Darüber hinaus werden diese neuartige Präzision Schleimhaut Probenahmetechniken Validierung gegen konventionelle Proben, wie z. B. aus Sputum, Blut und Atem erfordern. Mit diesen Techniken kann MLF verwendet werden, um Mikroben, Zytokine, Chemokine, Prostanoide und Antikörper zu messen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Finanzierung: Diese Arbeit wurde unterstützt durch die Finanzierung von kaiserlichen nationalen Instituts für Gesundheit Forschung (NIHR) Biomedical Research Centre (BRC), die NIHR Gesundheit Schutz Research Unit (HPRU) in Infektionen der Atemwege am Imperial College London in Partnerschaft mit Public Health England (PHE) und dem NIHR Imperial Patientensicherheit Translational Research Centre. Die geäußerten Meinungen sind diejenigen der Autoren und nicht unbedingt die der NHS, die NIHR, Department of Health oder Public Health England.
Materialien
| Name | Company | Catalog Number | Comments |
| Nasosorption (adult, 7mm width) | Hunt Developments | NSFL-FXI-11 | Different sizes are available for different patient groups/ages. |
| Bronchosorption | Hunt Developments | BSFL-FXI-11 | Minimum bronchoscope channel size 2mm; Max working length 815mm |
| Corning Costar Spin-X centrifuge tube filters (without membrane) | Sigma Aldrich | CLS9301-1000EA | |
| Corning Costar Spin-X centrifuge tube filters (0.22um membrane) | Sigma Aldrich | CLS8160-24EA | For sterilisation of samples with infection risk. |
| Assay (elution) buffer | Millipore | AB-33k | Not listed on the Millipore website but available through enquiry or general lab supply companies, such as Cedarlane. Contains 0.05% Tween-20 and 1% BSA. |
| NP-40 Cell lysis buffer | Life Technologies | FNN0021 | Add bovine serum albumin to 1% (w/v). Can recover higher absolute mediator levels. |
| Buffer RLT (RNA extraction) | Qiagen | 79216 | Allows recovery of RNA from nasosorption and bronchosorption samples. |
| Trifluoroacetic acid | Sigma Aldrich | 302031-100ML-M | For elution of samples to be used in HPLC applications |
| 2.0ml micro-centrifuge tubes | Costar | 3213 | 2ml tubes are required for the Spin-X tube filters, traditional 1.5ml tubes will not fit these. |
Referenzen
- Hansel, T. T., Johnston, S. L., Openshaw, P. J. Microbes and mucosal immune responses in asthma. Lancet. 381 (9869), 861-873 (2013).
- Lu, F. X., Esch, R. E. Novel nasal secretion collection method for the analysis of allergen specific antibodies and inflammatory biomarkers. J Immunol Methods. 356 (1-2), 6-17 (2010).
- Esposito, S., et al. Collection by trained pediatricians or parents of mid-turbinate nasal flocked swabs for the detection of influenza viruses in childhood. Virol J. 7 (1), 85(2010).
- Macfarlane, P., Denham, J., Assous, J., Hughes, C. RSV testing in bronchiolitis: which nasal sampling method is best? Arch Dis Child. 90 (6), 634-635 (2005).
- Jochems, S. P., et al. Novel Analysis of Immune Cells from Nasal Microbiopsy Demonstrates Reliable, Reproducible Data for Immune Populations, and Superior Cytokine Detection Compared to Nasal Wash. PLoS One. 12 (1), e0169805(2017).
- Hansel, T. T., et al. A Comprehensive Evaluation of Nasal and Bronchial Cytokines and Chemokines Following Experimental Rhinovirus Infection in Allergic Asthma Increased Interferons (IFN-gamma and IFN-lambda) and Type 2 Inflammation (IL-5 and IL-13). EBioMedicine. , (2017).
- Rohan, L. C., et al. Optimization of the weck-Cel collection method for quantitation of cytokines in mucosal secretions. Clin Diagn Lab Immunol. 7 (1), 45-48 (2000).
- Castle, P. E., et al. Comparison of ophthalmic sponges for measurements of immune markers from cervical secretions. Clin Diagn Lab Immunol. 11 (2), 399-405 (2004).
- Chang, C. K., Cohen, M. E., Bienek, D. R. Efficiency of oral fluid collection devices in extracting antibodies. Oral Microbiol Immunol. 24 (3), 231-235 (2009).
- Lopez-Cisternas, J., Castillo-Diaz, J., Traipe-Castro, L., Lopez-Solis, R. O. Use of polyurethane minisponges to collect human tear fluid. Cornea. 25 (3), 312-318 (2006).
- Alam, R., Sim, T. C., Hilsmeier, K., Grant, J. A. Development of a new technique for recovery of cytokines from inflammatory sites in situ. J Immunol Methods. 155 (1), 25-29 (1992).
- Sim, T. C., Grant, J. A., Hilsmeier, K. A., Fukuda, Y., Alam, R. Proinflammatory cytokines in nasal secretions of allergic subjects after antigen challenge. Am J Respir Crit Care Med. 149 (2 Pt 1), 339-344 (1994).
- Sim, T. C., Reece, L. M., Hilsmeier, K. A., Grant, J. A., Alam, R. Secretion of chemokines and other cytokines in allergen-induced nasal responses: inhibition by topical steroid treatment. Am J Respir Crit Care Med. 152 (3), 927-933 (1995).
- Weido, A. J., Reece, L. M., Alam, R., Cook, C. K., Sim, T. C. Intranasal fluticasone propionate inhibits recovery of chemokines and other cytokines in nasal secretions in allergen-induced rhinitis. Ann Allergy Asthma Immunol. 77 (5), 407-415 (1996).
- Linden, M., et al. Immediate effect of topical budesonide on allergen challenge-induced nasal mucosal fluid levels of granulocyte-macrophage colony-stimulating factor and interleukin-5. Am J Respir Crit Care Med. 162 (5), 1705-1708 (2000).
- Bensch, G. W., Nelson, H. S., Borish, L. C. Evaluation of cytokines in nasal secretions after nasal antigen challenge: lack of influence of antihistamines. Ann Allergy Asthma Immunol. 88 (5), 457-462 (2002).
- Riechelmann, H., Deutschle, T., Friemel, E., Gross, H. J., Bachem, M. Biological markers in nasal secretions. Eur Respir J. 21 (4), 600-605 (2003).
- Wagenmann, M., et al. Bilateral increases in histamine after unilateral nasal allergen challenge. Am J Respir Crit Care Med. 155 (2), 426-431 (1997).
- Wagenmann, M., Schumacher, L., Bachert, C. The time course of the bilateral release of cytokines and mediators after unilateral nasal allergen challenge. Allergy. 60 (9), 1132-1138 (2005).
- Baumann, R., et al. The release of IL-31 and IL-13 after nasal allergen challenge and their relation to nasal symptoms. Clin Transl Allergy. 2 (1), 13(2012).
- Baumann, R., et al. Nasal levels of soluble IL-33R ST2 and IL-16 in allergic rhinitis: inverse correlation trends with disease severity. Clin Exp Allergy. 43 (10), 1134-1143 (2013).
- Chawes, B. L., et al. A novel method for assessing unchallenged levels of mediators in nasal epithelial lining fluid. J Allergy Clin Immunol. 125 (6), 1387-1389 (2010).
- Scadding, G. W., et al. Optimisation of grass pollen nasal allergen challenge for assessment of clinical and immunological outcomes. J Immunol Methods. 384 (1-2), 25-32 (2012).
- Leaker, B. R., et al. The nasal mucosal late allergic reaction to grass pollen involves type 2 inflammation (IL-5 and IL-13), the inflammasome (IL-1beta), and complement. Mucosal Immunol. 10 (2), 408-420 (2017).
- Nicholson, G. C., et al. The effects of an anti-IL-13 mAb on cytokine levels and nasal symptoms following nasal allergen challenge. J Allergy Clin Immunol. 128 (4), 800-807 (2011).
- Dhariwal, J., et al. Nasal Lipopolysaccharide Challenge and Cytokine Measurement Reflects Innate Mucosal Immune Responsiveness. PLoS One. 10 (9), e0135363(2015).
- Folsgaard, N. V., et al. Neonatal cytokine profile in the airway mucosal lining fluid is skewed by maternal atopy. Am J Respir Crit Care Med. 185 (3), 275-280 (2012).
- Folsgaard, N. V., et al. Pathogenic bacteria colonizing the airways in asymptomatic neonates stimulates topical inflammatory mediator release. Am J Respir Crit Care Med. 187 (6), 589-595 (2013).
- Wolsk, H. M., et al. Siblings Promote a Type 1/Type 17-oriented immune response in the airways of asymptomatic neonates. Allergy. 71 (6), 820-828 (2016).
- Thwaites, R. S., et al. Nasosorption as a Minimally Invasive Sampling Procedure: Mucosal Viral Load and Inflammation in Primary RSV Bronchiolitis. J Infect Dis. 215 (8), 1240-1244 (2017).
- Ishizaka, A., et al. New bronchoscopic microsample probe to measure the biochemical constituents in epithelial lining fluid of patients with acute respiratory distress syndrome. Crit Care Med. 29 (4), 896-898 (2001).
- Ishizaka, A., et al. Elevation of KL-6, a lung epithelial cell marker, in plasma and epithelial lining fluid in acute respiratory distress syndrome. Am J Physiol Lung Cell Mol Physiol. 286 (6), L1088-L1094 (2004).
- Komaki, Y., et al. Cytokine-mediated xanthine oxidase upregulation in chronic obstructive pulmonary disease's airways. Pulm Pharmacol Ther. 18 (4), 297-302 (2005).
- Yamazaki, K., Ogura, S., Ishizaka, A., Oh-hara, T., Nishimura, M. Bronchoscopic microsampling method for measuring drug concentration in epithelial lining fluid. Am J Respir Crit Care Med. 168 (11), 1304-1307 (2003).
- Kikuchi, J., Yamazaki, K., Kikuchi, E., Ishizaka, A., Nishimura, M. Pharmacokinetics of telithromycin using bronchoscopic microsampling after single and multiple oral doses. Pulm Pharmacol Ther. 20 (5), 549-555 (2007).
- Kikuchi, E., et al. Comparison of the pharmacodynamics of biapenem in bronchial epithelial lining fluid in healthy volunteers given half-hour and three-hour intravenous infusions. Antimicrob Agents Chemother. 53 (7), 2799-2803 (2009).
- Kodama, T., et al. A technological advance comparing epithelial lining fluid from different regions of the lung in smokers. Respir Med. 103 (1), 35-40 (2009).
- Sasabayashi, M., Yamazaki, Y., Tsushima, K., Hatayama, O., Okabe, T. Usefulness of bronchoscopic microsampling to detect the pathogenic bacteria of respiratory infection. Chest. 131 (2), 474-479 (2007).
- Kipnis, E., et al. Proteomic analysis of undiluted lung epithelial lining fluid. Chest. 134 (2), 338-345 (2008).
- Kanazawa, H., Kodama, T., Asai, K., Matsumura, S., Hirata, K. Increased levels of N(epsilon)-(carboxymethyl)lysine in epithelial lining fluid from peripheral airways in patients with chronic obstructive pulmonary disease: a pilot study. Clin Sci (Lond). 119 (3), 143-149 (2010).
- Sugasawa, Y., et al. The effect of one-lung ventilation upon pulmonary inflammatory responses during lung resection. J Anesth. 25 (2), 170-177 (2011).
- Sugasawa, Y., et al. Effects of sevoflurane and propofol on pulmonary inflammatory responses during lung resection. J Anesth. 26 (1), 62-69 (2012).
- Cohen, J., et al. Ciclesonide improves measures of small airway involvement in asthma. Eur Respir J. 31 (6), 1213-1220 (2008).
- Fahy, J. V., Dickey, B. F. Airway mucus function and dysfunction. N Engl J Med. 363 (23), 2233-2247 (2010).
- de Silva, T. I., et al. Comparison of mucosal lining fluid sampling methods and influenza-specific IgA detection assays for use in human studies of influenza immunity. J Immunol Methods. , (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten