Method Article
Engineering-"Golden" Fluoreszenz durch Selektionsdruck Einbeziehung der nicht-kanonischen Aminosäuren und Protein-Analyse durch Massenspektrometrie und Fluoreszenz
In diesem Artikel
Zusammenfassung
Synthetischer Biologie ermöglicht das Engineering von Proteinen mit noch nie dagewesenen Eigenschaften mit Hilfe der co-translational Einfügen von nicht-kanonischen Aminosäuren. Hier präsentierten wir, wie eine Spektral rot verschoben-Variante des ein GLP-Typ Fluorophor mit neuartigen Fluoreszenz spektroskopischen Eigenschaften, genannt "Gold" fluoreszierende Protein (GdFP), über Selektionsdruck Aufnahme (SPI) in E. Coli hergestellt wird.
Zusammenfassung
Fluoreszierende Proteine sind grundlegende Werkzeuge für die Life Sciences, insbesondere für die Fluoreszenzmikroskopie lebender Zellen. Während Wildtyp und technische Varianten das grün fluoreszierende Protein aus Aequorea Victoria (AvGFP) sowie Homologe von anderen Arten bereits große Teile des optischen Spektrums abdecken, bleibt eine spektrale Lücke in der Nah-Infrarot-Region für welche AvGFP-basierte Fluorophore nicht verfügbar sind. Rot-verschoben fluoreszierenden Proteins (FP) Varianten würde erheblich erweitern das Toolkit für spektrale Entmischung von mehreren molekülsorten, aber die natürlich vorkommende rot-verschoben FPs aus Korallen oder Seeanemonen haben niedrigere Quantenausbeute der Fluoreszenz und minderwertige Foto-Stabilität im Vergleich zu den AvGFP Varianten. Weitere Manipulation und mögliche Erweiterung der Chromophor konjugierten System in Richtung der dunkelrote Spektralbereich wird auch durch das Repertoire der 20 kanonischen Aminosäuren vorgeschrieben durch den genetischen Code beschränkt. Um diese Einschränkungen zu überwinden, kann synthetischer Biologie weiter spektralen Rot-Verschiebung über Einfügen von nicht-kanonischen Aminosäuren in den Chromophor Dreiklang erreichen. Wir beschreiben die Anwendung von SPI auf Ingenieur AvGFP Varianten mit neuartigen spektralen Eigenschaften. Protein-Expression erfolgt in eine Tryptophan-auxotrophe E. Coli Belastung und durch die Ergänzung Wachstumsmedien mit geeigneten Indol Vorstufen. Innerhalb der Zellen sind diese Vorstufen in die entsprechenden Tryptophan-Entsprechungen konvertiert und in Proteine durch die ribosomale Maschinen in Reaktion auf UGG Codon aufgenommen. Der Ersatz von Trp-66 in der erweiterten "Cyan" Variante des AvGFP (ECFP) durch ein Elektron-Spenden 4-Aminotryptophan führt zu GdFP mit einer 108 nm Stokes-Verschiebung und eine stark rot-verschoben Emission maximale (574 nm), wobei thermodynamisch stabiler als sein Vorgänger ECFP. Rückstände-spezifische Einbindung der nicht-kanonische Aminosäure wird durch Massenspektrometrie analysiert. Die spektroskopischen Eigenschaften der GdFP zeichnen sich durch Zeitaufgelöste Fluoreszenz-Spektroskopie als eines der wertvollen Anwendungen von genetisch codierten Bildern pro Sekunde in den Life Sciences.
Einleitung
Seit der Entdeckung der das grün fluoreszierende Protein in der Qualle Aequorea Victoria (AvGFP) im Jahr 19621 und der erste heterologen Ausdruck in 19942 in anderen eukaryotischen Zellen sind fluoreszierende Proteine der GFP-Familie geworden. sehr wertvolle Werkzeuge und Ziele im Bereich Life Sciences. Umfangreichen genetischen und molekularbiologischen Technik enthalten, die Anpassung der artspezifischen Codon Usage, Beschleunigung der Faltung, verbesserte Reifung, erhöhte Helligkeit, Prävention von Oligomerisierung und Zuschnitt der spektralen und photochemischen Eigenschaften einschließlich der Fähigkeit, reversibel Photoswitch3,4,5,6. GFP verdankt seine Fluoreszenz aus seiner 4-(p- Hydroxybenzylidene) Imidazolidin-5-1 (HBDI) Chromophor. Letzteres ist nach der Ausbildung eine zusätzliche kovalente Bindung innerhalb der Peptidrückgrat unter dem Einfluss von molekularem Sauerstoff7ab aus der sogenannten Chromophor Dreiklang aus Aminosäuren (Ser-65/Tyr-66/Gly-67 in AvGFP) gebildet. Die Resonant stabilisierte konjugierte System interagiert dynamisch mit seiner molekularen Umgebung, so dass für die Absorption im sichtbaren Bereich und charakteristischen grünen Fluoreszenz dieser Proteine.
Innerhalb der Triade Chromophor ist die Anwesenheit von eine aromatische Aminosäure obligatorisch. Das standard Aminosäure-Repertoire umfasst jedoch nur vier aromatischen Rückstände (His, Phe, Trp und Tyr). Dies schränkt konventionelle Mutagenese Ansätze um wesentlich mehr rot-verschoben AvGFP Varianten bezogen auf die rot-verschoben natürliche FPs wie DsRed8 aus Discosoma Striata Coralimorphs oder Mkat/mNeptune9 aus zu erreichen die Seeanemone Entacmaea Quadricolor. Daher, dunkelrote und nahen infraroten Bereich des optischen Spektrums über 600 nm ist spärlich bedeckt von GFP-Varianten. Dies ist natürlich eine schwere Einschränkung für Fluoreszenz mikroskopisch kleine Ansätze, die spektrale Demultiplexen von mehreren Fluorophor Arten zur gleichen Zeit erfordern. Langwellige Marker sind beispielsweise auch notwendig, um des geringen Absorption Regimes von Hautgewebe zwischen 700-1.000 nm in den Einstellungen für Tiefe Gewebe imaging10verwenden.
Fluoreszierende Proteine aus AvGFP gliedern sich in mehrere Klassen anhand der spektroskopischen Eigenschaften und chemische Natur von deren Chromophore11. Mit der Triade Ser-65/Tyr-66/Gly-67, der Wildtyp Chromophor existiert als eine ausgewogenen Mischung zwischen neutralen und phenolische Form (λMax. = 395 nm, ε = 21.000 M-1cm-1) und der anionischen Phenolate Form (λMax. = 475 nm, ε = 7.100 M -1cm-1), und das Emissionsspektrum stellt einen einzigen Blick auf 508 nm. Die Hydroxylgruppe des Ser-65 ist von entscheidender Bedeutung, da es eine H-Bindung, Glu-222 in der Nähe der Chromophor spendet (Entfernung: 3.7 Å), fördert die Ionisation dieser carboxylat. Klasse ich zeichnet sich durch einen anionischen Phenolate Chromophor, wie EGFP (Phe-64-Leu/Ser-65-Thr; λMax. = 488 nm, ε = 35.600 M-1cm-1, λEm = 509 nm). Durch die Ser-65-Thr(Ala,Gly) Substitution der 395 nm Erregung Höhepunkt der neutralen Phenol-Form unterdrückt und der 470-475 nm Höhepunkt der anionischen Phenolate ist fünf bis sechs Mal verbessert und verlagerte sich auf 490 nm. Klasse II umfasst Proteine mit einer neutralen phenolischen Chromophor, wie Saphir-GFP. Hier die Thr-203-Ile Substitution fast vollständig unterdrückt die 475 nm Anregung, so dass nur die Spitze bei 399 nm. Da die anionischen Chromophor SOLVATISIERTE richtig sein kann, wird der neutrale Form begünstigt. Klasse III umfasst die "gelben" fluoreszierenden Varianten (EYFP; Ser-65-Gly/Val-68-Leu/ser-72-Ala/THR-203-Tyr; ΛMax. ε = 514 nm, ε = 84, 600 M-1cm-1, λEm = 527 nm) mit π-Stapeln Zusammenspiel von einem aromatischen Seitenkette und Phenolate, wie durch die Thr-203-His(Trp,Phe,Tyr) Substitutionen herbeigeführt, die führen bis zu 20 nm Rot-verschoben Emission Maxima (Thr-203-Tyr). Weitere Substitution (Gln-69-Lys) führt zu einem anderen 1-2 nm Rotverschiebung 529 nm, die rot-verschoben AvGFP Variante11bekannt. Der Austausch von Phenol für ein Indol (Tyr-66-Trp) schafft Klasse IV, wie in der Cyan-fluoreszierende ECFP (Ser-65-Thr/Tyr-66-Trp; λmax1 = 434 nm, ε = 24.800 M-1cm-1; λmax2 = 452 nm, ε = 23.600 M– 1cm-1 ; Λem1 = 477 nm, λem2 = 504 nm). Die Unterbringung von sperrigen Indol ist wahrscheinlich durch andere, kompensatorischen Mutationen aktiviert. Die ECFP Anregung und Emission Maxima fallen dazwischen diejenigen Proteine mit neutralen oder anionischen Chromophore. Klasse V Proteine beherbergen ein Imidazol anstelle das Phenol (Tyr-66-HSI), zB., blau-fluoreszierende Proteine wie EBFP. Klasse VI entsteht durch ein Phenol-Phenyl-Austausch Begünstigung der neutralen Chromophor Form ausschließlich, führt folglich zu den blau-verschoben Anregung und Emission Peak Positionen (360 nm und 442 nm, beziehungsweise).
Klassische Site-verwiesene Mutagenese eignet sich besonders für die Herstellung von neuartigen AvGFP Chromophor Varianten durch die Permutation der 65-67 Tripeptid und interagierenden Rückstände im Rahmen der 20 kanonischen Aminosäuren. Diese Möglichkeiten können weiter ausgebaut werden, wenn nicht-kanonischen Varianten von aromatischen Aminosäuren während ribosomale Protein Synthese12eingeführt werden. Im Prinzip gibt es zwei Möglichkeiten, dies zu erreichen. Die erste Strategie stützt sich auf die Substrat-Toleranz von Protein Übersetzung Maschinen, insbesondere von Aminoacyl-tRNA-synthetasen (AaRSs) in Richtung Verwandte Aminosäure-Analoga. Um dies zu erreichen, mit hohem Wirkungsgrad, auxotrophe Ausdruck E. Coli -Stämme sind, die nicht in der Lage, die entsprechende natürliche Aminosäure zu synthetisieren sind beschäftigt. Dies ermöglicht den Austausch des letzteren durch Zugabe von geeigneten nicht-kanonischen Aminosäuren (NcAAs) oder Vorstufen davon zu dem Kulturmedium. Diese Strategie, auch bekannt als selektive Druck Aufnahme (SPI)13,14, kann Rückstände-spezifischen Ersatz, die globale Integration der ncAA führen. Die zweite Strategie nutzt Stopcodon Suppressor tRNAs, welche mit der ncAA durch berechnet werden entwickelt AaRS Enzyme. Dies führt zu der überlesen in Frame-Stop-Codons und ortsspezifische ncAA Einbau ermöglicht. Diese Methode der Stopp-Codon Unterdrückung (SCS) führt zur Erweiterung des genetischen Codes15. Über Mutagenese wird ein Stopcodon in das Zielgen an der gewünschten Stelle platziert. Im Prinzip kann SPI auch zur rekombinanten Peptide und Proteine mit einer einzigartigen ncAA-Installation zu erstellen, da die seltenen kanonischen Aminosäuren wie Met oder Trp für Ersatz gewählt werden. Mit Trp, SPI Ansätze haben gezeigt, dass Arbeiten mit einer Vielzahl von analogen einschließlich 4 - F - 5 - F und 6 F Trp, 7-Aza-Trp, 4-OH und 5 OH Trp, sowie 4- und 5-NH2- Trp oder sogar β (Thienopyrrolyl) Alanin Derivate16 ,17,18,19,20. So konnte SPI sehr vorteilhaft für den Austausch von aromatischen Aminosäuren der GFP Chromophore durch nicht-kanonischen Varianten, die Möglichkeit um weitere Spektren und Stokes-Shift von diese FPs anzupassen sein. Wie für alle Protein Sequence Änderungen muss die Kompatibilität mit FP Falt- und Chromophor Reifung experimentell getestet werden.
In dieser Arbeit verwenden wir Klasse IV ECFP21, die anstelle der Wildtyp AvGFP Tyr, Trp Rückstände innerhalb der Triade Chromophor trägt. SPI verwenden, wird diese Trp-66 (und Trp-57, die nur andere Trp Rückstände in ECFP) durch 4-amino-TRP ersetzt Das Vorhandensein von Elektron-Spenden Aminogruppe des 4-amino-Trp innerhalb der Chromophor begünstigt die Resonanz Stabilisierung von einem angeregten Zustand weit rot-verschoben Protonentransfer (ESPT) mit einem 108 nm Stokes-Shift ausgestattet. Dieses "Goldene" fluoreszierende Protein (GdFP) ist die Variante mit der größten Rotverschiebung der maximale Fluoreszenz (574 nm) unter allen AvGFP gewonnenen Proteinen. Wir beschreiben die Methode der GdFP-Protein-Produktion von SPI und bieten die Protokolle für die obligatorische Analyse der daraus resultierenden veränderten Proteine durch Massenspektroskopie. Darüber hinaus zeigen wir, wie GdFP genutzt und Zeitaufgelöste Fluoreszenz-Spektroskopie Ansätze analysiert werden kann.
Protokoll
1. Umwandlung von Trp-auxotrophe E. coli
- Chemisch zu verwandeln oder Electrocompetent Zellen (50 µL) eines Trp auxotrophe E. Coli -Stamm, zB. ATTC 49980 (WP2, Mutant, abgeleitet von E. Coli -Stamm B/R22), mit 1 µL einer 1 ng/µL wässrige Lösung von dem pQE - 80 L His6-ECFP Plasmid mit Hitzeschock oder Elektroporation, beziehungsweise. Entnehmen Sie bitte dem Jupiter Science Education Database23,24 für Details.
Hinweis: Der Ausdruck Vektor kodiert pQE - 80 L His6-ECFP eine N-Terminal 6 x sein-tagged ECFP21 angetrieben durch eine bakterielle T5-Promoter mit Lac-Operator. Weiter trägt ein Selektionsmarker AmpR und ein colE1 Ursprung der Replikation (die pQE - 80 L-Vektor-Rückgrat-Sequenz finden Sie auf: https://www.qiagen.com/mx/resources/resourcedetail?id=c3b71572-4d82-4671-a79b-96357fe926d1&lang=en & autoSuggest = True). Das theoretische Molekulargewicht des His6-ECFG Wildtyp Proteins (nach Chromophor Reifung25) ist 28303.92 Da. Die übersetzten Zielsequenz Protein ist wie folgt (His-Tag unterstrichen, Vektor-abgeleitete Sequenzen in Fettdruck): MRGSHHHHHHGSMVSKGEELFTGVVPILVELDGDVNGHKFSVSGEGEGDATYGKLTLKFICTTGKLPVPWPTLVTTLTWGVQCFSRYPDHMK
QHDFFKSAMPEGYVQERTIFFKDDGNYKTRAEVKFEGDTLVNRIELKGIDFKEDGNILGHKLEYNYISHNVYITADKQKNGIKANFKIRHNIEDGS
VQLADHYQQNTPIGDGPVLLPDNHYLSTQSALSKDPNEKRDHMVLLEFVTAAGITLGMDELYK. - Platte transformierte Zellen auf LB-Agar-Platten (Tabelle 1) ergänzt mit 10 g/L Glukose, 100 µg/mL Ampicillin und über Nacht die Platten bei 37 ° C inkubieren.
(2) rekombinante Proteinexpression
-
Über Nacht Kultur von E. Coli ATCC 49980 pQE - 80 L His6-ECFP
- Bereiten Sie 5 mL LB-Medium (Tabelle 1; ergänzt mit 10 g/L Glukose, 100 µg/mL Ampicillin) in eine sterile 14 mL Polystyrol Kultur Rohr für aerobe Wachstum und impfen mit einer einzeln Kolonie von einer nährbodenplatte mit einer sterilen Pipette Tipp oder Impfung Schleife.
Hinweis: Es wird empfohlen, Kolonien von frisch transformierten Zellen verwenden. Die Platten mit Bakterienkolonien (ab Schritt 1.2.) können für mehrere Tage bei 4 ° C gelagert werden. - Über Nacht inkubieren Sie die Zellen bei 37 ° C in einem Orbitalschüttler bei 200-250 u/min.
- Bereiten Sie 5 mL LB-Medium (Tabelle 1; ergänzt mit 10 g/L Glukose, 100 µg/mL Ampicillin) in eine sterile 14 mL Polystyrol Kultur Rohr für aerobe Wachstum und impfen mit einer einzeln Kolonie von einer nährbodenplatte mit einer sterilen Pipette Tipp oder Impfung Schleife.
-
Ausdruck der Wildtyp ECFP
- 10 mL frisches LB-Medium zu impfen (Tabelle 1; ergänzt mit 10 g/L Glukose, 100 µg/mL Ampicillin) mit 100 µL der Übernacht-Kultur in einem 100 mL Erlenmeyerkolben. Inkubieren Sie den Kolben bei 37 ° C in einem Orbitalschüttler bei 200 u/min.
Hinweis: Optional, dieser Schritt kann durchgeführt werden in 10 mL NMM19 Medium (Tabelle 1) ergänzt mit 100 µg/L Ampicillin und 0,5 mM L-Tryptophan (Alternativ Indol kann verwendet werden). - Messung die optische Dichte bei 600 nm (OD600) alle 20 min. bevorzugt Messen Zelle Dichte durch die Bestimmung der Auslöschung bei 600 nm (OD600) in einem Spektralphotometer mit einer Küvette mit einer Weglänge von 1 cm. immer führen Sie eine Referenz Messung mit dem entsprechenden Kulturmedium. Verdünnen Sie die Proben und Mischung der Proben gut um einen Messwert von 0,1-0,8 zu erhalten, dann OD600 mit dem Verdünnungsfaktor zu berechnen. Einzelheiten hierzu finden Sie in vorherigen Veröffentlichung 26.
- Nehmen Sie bei Erreichen einer OD600 Wert von 0,5-0,8 (ca. 2-3 h nach der Inokulation), Probe "vor Induktion" für SDS-PAGE (Sodium Dodecyl Sulfat Polyacrylamid Gelelektrophorese, Schritt 4).
- Induzieren Sie Ziel Proteinexpression durch Anpassen der Flüssigkultur bis 0,5 mM IPTG (Isopropyl β-D-1-Thiogalactopyranoside, von 1 M-Stammlösung) und inkubieren Sie es bei 30 ° C in einem Orbitalschüttler bei 200 u/min für 4-8 h.
Hinweis: Cyan fluoreszierende Proteinen sind gemeinhin bei Temperaturen unter 37 ° C27dargestellt. - Probe für SDS-PAGE (Schritt 4) "nach dem Ausdruck" nehmen.
- Ernte der bakteriellen Zellen durch Zentrifugation für 10 min bei 5.000 x g und 4 ° C.
- Den Überstand durch Dekantieren zu verwerfen und die Zelle Pellets bei-20 ° C oder-80 ° C bis Ziel Proteinreinigung einfrieren.
- 10 mL frisches LB-Medium zu impfen (Tabelle 1; ergänzt mit 10 g/L Glukose, 100 µg/mL Ampicillin) mit 100 µL der Übernacht-Kultur in einem 100 mL Erlenmeyerkolben. Inkubieren Sie den Kolben bei 37 ° C in einem Orbitalschüttler bei 200 u/min.
-
SPI für die Herstellung von GdFP
- 10 mL des NMM19 Mediums (Tabelle 1) ergänzt mit 100 µg/mL Ampicillin, 15 µM Tryptophan und 10 µL der Nacht Kultur in einem 100 mL Erlenmeyerkolben impfen und die Kultur-Flasche über Nacht bei 30 ° C in einem Orbitalschüttler bei 200 u/min inkubieren.
Hinweis: Eine Vielzahl von chemisch definierten Medien für den Anbau von E. Coli und SPI ist verfügbar. Neben NMM hierin verwendeten MOPS mittlere28, Glukose-mineralische Salze mittlere29, Davis minimale mittlere30, M9 minimale mittlere31oder GMML32 eingesetzt werden. - Messen Sie am nächsten Tag OD600 alle 30 Minuten, bis der Wert nur um weniger als 0,05 über 30 min ändert. Der plateauwert sollte ungefähr 1.
Hinweis: Abweichungen von ± 0,3 Einheiten sind zulässig. Je nach Bakterienstamm und Medium verwendet kann die anfängliche Tryptophan-Konzentration (Schritt. 2.3.1) Anpassung erforderlich. - Nehmen Sie Probe "vor Induktion" für SDS-PAGE (Schritt 4).
- Ernte der bakteriellen Zellen durch Zentrifugation für 10 min bei 5.000 x g und 4 ° C. Den Überstand durch Dekantieren zu verwerfen.
- Die Zellen in NMM19 Medium mit 100 µg/mL Ampicillin 10 mL in einen 100-mL-Erlenmeyerkolben aufschwemmen und eine Endkonzentration von 1 mM mit 50 mM Stammlösung 4-amino-Indol hinzufügen. Die Inkubation für 30 min bei 30 ° C in einem Orbitalschüttler bei 200 u/min weiter.
Hinweis: Dieser Schritt ist wegen der geringen chemischen Stabilität von Ampicillin empfohlen und sorgt für die zelluläre Aufnahme von 4-amino-Indol. - Ziel-Protein-Expression durch Zugabe von IPTG, eine Endkonzentration von 0,5 mM mit 1 M Lager induzieren und die Probe über Nacht bei 30 ° C in einem Orbitalschüttler bei 200 u/min inkubieren.
Hinweis: Cyan fluoreszierende Proteinen sind gemeinhin bei Temperaturen unter 37 ° C27dargestellt. - Messen Sie am nächsten Tag OD600.
- Probe für SDS-PAGE (Schritt 4) "nach dem Ausdruck" nehmen.
- Ernte der bakteriellen Zellen durch Zentrifugation für 10 min bei 5.000 x g und 4 ° C und Überstand durch Dekantieren zu verwerfen.
- Für den Fall, dass ein solches Schiff nicht für Zentrifugation verwendet wurde, übertragen Sie die Zelle Pellet in ein 50 mL konische Polystyrol Röhrchen mit einem Spatel. Frieren Sie die Zelle Pellet bei-20 ° C oder-80 ° C bis Ziel Proteinreinigung.
- 10 mL des NMM19 Mediums (Tabelle 1) ergänzt mit 100 µg/mL Ampicillin, 15 µM Tryptophan und 10 µL der Nacht Kultur in einem 100 mL Erlenmeyerkolben impfen und die Kultur-Flasche über Nacht bei 30 ° C in einem Orbitalschüttler bei 200 u/min inkubieren.
3. Ziel Proteinreinigung über stillgestellte Metallionen Affinitätschromatographie (IMAC)
-
Bakterienzelle Lyse
- Die Zelle-Pellet für 10-20 min auf Eis Auftauen.
- Aufschwemmen der Zelle Pellet in einer 50 mL konische Polystyrol Tube mit 5 mL eiskaltes Bindung Puffer (Tabelle 1) auf dem Eis.
- Fügen Sie 20 µL 50 mg/mL Lysozym, 20 µL von 1 mg/mL DNase ich 20 µL von 1 mg/mL RNase A. das Röhrchen verschließen, durch invertieren 5 Mal vorsichtig mischen und halten Sie es für 30 min auf Eis.
Hinweis: Teilweise Zellaufschluss tritt wie von Lysozym katalysiert. - Lyse der Zellen durch Sonifikation mit einem Ultraschall Homogenisator Spitze mit drei Zyklen von 3 min in einem 15 mL Polystyrol Rohr gekühlt durch Matsch Eis mit 2 s von Puls 4 s Pause und 45 % Amplitude.
Hinweis: Alternativ Hochdruck Homogenisierung kann verwendet werden, zB., 20 Zyklen bei 14.000 Psi. Bei Bedarf verdünnen Sie mit Bindung Puffer um die Lautstärke minimal Instrument zu erreichen. Darüber hinaus können Protein Extraktion Reagenzien für Zellaufschluss verwendet werden. Siehe Materialtabelle für Beispiele. - Zentrifuge der Probe für 30 min bei 15.000-18.000 x g, 4 ° C.
- Übertragen Sie den überstand in ein frisches Tubus und notieren Sie sich das Flüssigkeitsvolumen.
- Filtern die Lösung durch einen 0,45 µm-Spritze-Filter mit einer 5 mL Luer Lock kunststoffspritze und ein Polyvinylidenfluorid (PVDF) Spritze Filter.
- Nehmen Sie "lysate" Probe für SDS-PAGE (Schritt 4).
- Aufschwemmen Sie Zelle Rückstand Pellet in DdH2O (gleiches Volumen als ehemalige lysate).
- Nehmen Sie Probe "Pellet" für SDS-PAGE (Schritt 4).
-
IMAC-Reinigung
- Verwenden Sie eine 1 mL abgepackt oder SB IMAC FPLC (schnelles Protein liquid Chromatography) Spalte gemäß Anweisungen des Herstellers. Verwenden Sie verbindliche Puffer (Tabelle 1) für Spalte Gleichgewichtherstellung ebenso wie bei der Waschschritt die folgt, nachdem die Zelle lysate auf die Spalte angewendet wurde.
- Sammeln Sie und bündeln Sie Eluat Brüche mit GdFP, die durch sichtbare helle goldene Farbe identifiziert werden können.
Hinweis: Optional das Zielprotein kann werden eluiert mit einem linearen Imidazol-Farbverlauf (0-250 mM) mit einem automatisierten System FPLC. - Bestimmen die Konzentration des Proteins mit dem Literaturwert für die vom Aussterben bedroht-Koeffizient bei 466 nm (Mundarten466 nm = 23.700 M-1 cm-1)33 mit Elution Buffer als Referenz. Informationen über die Vorgehensweise finden Sie in vorherigen Veröffentlichung26.
- Beispiel "Eluat" für SDS-PAGE, und 1 – 10 µg Protein pro Bahn bei Coomassie-Färbung.
Hinweis: SDS Probe Beträge variieren je nach der Färbung Methode und Farbstoff Empfindlichkeit. - Ein Aliquot der Eluat Fraktionen gegen Dialyse-Puffer oder MS Puffer mit einer Membran mit einem Molekulargewicht cutoff (MWCO) von 5.000-10.000 Dialyse. Bereiten Sie Dialysemembran gemäß Anweisungen des Herstellers. Dialyse eine 1 mL Probe dreimal gegen 100 mL Puffer für mindestens 2 h. Einzelheiten zu diesem Verfahren finden Sie in vorherigen Veröffentlichung34.
- Frieren Sie für die Lagerung Protein Probe in Dialyse-Puffer bei-80 ° C ein.
Hinweis: Aliquote sollte für mindestens 6 Monate stabil sein.
(4) SDS-PAGE-Probenvorbereitung von E. Coli ganze Zelle Extrakt
- Transfer eine Zellsuspension Äquivalent zu 1 mL OD600 = 1 Aufhängung (zB. 500 µL OD600= 2) zu einem 1,5 mL Microcentrifuge Schlauch.
- Ernte der Zellen durch Zentrifugation für 10 min bei 5000 X g, Raumtemperatur. Den Überstand durch pipettieren zu verwerfen.
- Fügen Sie 80 µL DdH2O und 20 µL 5 X SDS Ladepuffer Farbstoff (Tabelle 1) um die Zelle Pellet und Mischung von pipettieren.
- Denaturieren Sie die Zellen durch Erhitzen auf 95 ° C für 5 min in Wasser Baden oder Hitze-Block. Anschließend kühlen Sie die Proben auf Raumtemperatur.
- Verwenden Sie 10 µL für Coomassie gefärbt SDS-PAGE nach vorherigen Veröffentlichung35.
Hinweis: SDS Probe Beträge variieren je nach der Färbung Methode und Farbstoff Empfindlichkeit.
(5) intakt Masse Proteinanalytik durch Hochleistungs-Flüssigkeitschromatographie (HPLC) gekoppelt, Electrospray Ionisierung Flugzeit-Massenspektrometrie (LC-ESI-TOF-MS)
Hinweis: HPLC Farbverlauf, Einstellungen und Puffer variieren je nach der Trennsäule und Instrument verwendet. Siehe Materialtabelle für beispielhafte Ausstattung.
- Bestimmen die Konzentration des Proteins aus einer Stichprobe dialysiert gegen MS Puffer wie beschrieben (Schritt 3.2.3.) mit MS Puffer (siehe Materialtabelle) als Referenz.
- Verdünnen Sie die Protein-Probe zu einem Endvolumen von 80 µL MS Puffer über 0,1 mg/mL, mischen Sie, indem Sie vorsichtig pipettieren, übertragen Sie die Lösung in ein MS Autosampler Fläschchen mit Glaseinsatz und schließen Sie es mit einer Kappe. Streichen das Fläschchen, um Luftblasen zu entfernen.
- Füllen Sie eine zweite Autosampler Fläschchen ohne Glaseinsatz (Puffer leer) mit 1 mL der MS Puffer.
- Lassen Sie das Gerät zum Aufwärmen. Durchführen Sie Kalibrierung. Stellen Sie sicher, dass ausreichende Mengen an Lösungsmitteln flüssige Chromatographie-Klasse verfügbar sind (> 100 mL).
- Programmieren eine linearen 20 min HPLC Steigung von 5 % auf 80 % Puffer eine (0,1 % Ameisensäure in DdH2O), kombiniert mit Puffer B (0,1 % Ameisensäure in Acetonitril).
- Eine Strömung von 0,3 mL/min HPLC ab und warten Sie, bis die Spalte Druck stabil ist.
- Legen Sie eine Autosampler Injektionsvolumen von 5 µL für die LC-ESI-TOF-MS-Methode, erstellen einen Arbeitsvorrat für eine leere laufen von einem Beispiel ausführen gefolgt und Zuweisen des entsprechenden Autosamplers Fläschchen Positionen. Führen Sie den Arbeitsvorrat.
- Öffnen Sie nach Abschluss der Arbeitsvorrat die generierten Beispieldatendatei. Wählen Sie einen Bereich in der gesamten Ion aktuelle (TIC) Plot für Dekonvolution und deconvolute der MS-Spektrum mit der maximalen Entropie Dekonvolution Algorithmus.
Hinweis: Abhängig von den experimentellen Bedingungen, können weitere Arten von nicht ausgereiften FP auftreten oder Puffer Ion Addukte.
(6) Fluoreszenz-Lebensdauer-Messungen und Verfall-assoziierten Spektren (ZVE) von GdFP
Hinweis: Für die Instrumentierung der Zeitaufgelösten Fluoreszenz-Spektroskopie finden Sie Tabelle der Materialien für beispielhafte Ausstattung. Absorption und Fluoreszenzanregung sowie Emissionsspektren von fluoreszierenden Proteinen kann auch mit Labor-Fluoreszenz und UV/Vis-Spektralphotometer aufgezeichnet werden.
-
Wellenlänge-resolved Lebensdauer Fluoreszenzmessung von GdFP
- Bereiten Sie 2 mL einer 1 µM-Lösung von GdFP durch Verdünnung in PBS-Puffer (Tabelle 1) bei pH 7. Füllen Sie die Lösung in eine 1 cm-Quarz-Küvetten.
- Installieren Sie Ps-gepulste 470 nm Laser Probe Erregung und 488 nm lang-Pass Emission Filter zu, und passen Sie 600 L/mm Gitter von der Zeit und Wellenlänge korreliert Einzelphotonen zählen36 (TWCSPC)-Detektor für den Erwerb des Regimes Wellenlänge 500-700 nm.
- Fluoreszenz-Emission bei einer Pulsrate von etwa 200 x 103 Photonen/s zu erwerben, bis etwa 103 zählt in den Erwerb maximal die Fluoreszenz-Verfall-Kurven mit single Photon counting Software angesammelt sind.
-
Messung der instrumentalen Antwort Funktion37 (IRF)
- Ersetzen Sie die Probe-Küvette mit einer 1 cm-Quarz-Küvette gefüllt mit 1 g/L kolloidale Kieselsäure (~ 220 m2/g) in PBS-Puffer bei pH 7.
Hinweis: Die Kieselsäure-Suspension wird mit 400 g/L wässrige Suspension zubereitet. - Entfernen Sie 488 nm lang-Pass Emission Filter und Einfügen grau Filter die Zählrate am TWCSPC Detektor auf unter 100 x 103 Grafen/s einstellen.
- Stellen Sie ein Gitter für den Erwerb von 470 nm Photonen im Kanal 8 der 16-Kanal-TWCSPC-Detektor.
- Erwerben Sie die IRF, bis etwa 10 x 103 zählt in der maximalen Emission kumuliert werden.
- Convert Fluoreszenz Verfall Kurven und IRF, ASCII-Dateien mit globalen passend38 Programm.
- Verhalten Global nach einem Modell einer Summe von drei exponentiellen Komponenten mit Lebenszeiten als verknüpfte Parameter passen.
- Grundstück-Zerfall zugeordnet Spektren (ZVE) als Amplitude Verteilungen der einzelnen Verfall Komponenten in Abhängigkeit von der Wellenlänge Datenanalyse-Software.
- Ersetzen Sie die Probe-Küvette mit einer 1 cm-Quarz-Küvette gefüllt mit 1 g/L kolloidale Kieselsäure (~ 220 m2/g) in PBS-Puffer bei pH 7.
Ergebnisse
Mit der Technik der selektiven Druck Aufnahme, kann Trp-66 in der Chromophor Dreiklang aus ECFP (und Trp-57, die nur andere Trp Rückstände in ECFP) durch 4-amino-Trp ersetzt werden dadurch erzeugt rot-verschoben GdFP mit unterschiedlichen spektralen Eigenschaften. Massenspektrometrie muss verwendet werden, um die gewünschten stöchiometrischen Integration der nicht-kanonischen Aminosäuren in das Protein in Abbildung 1dargestellten Ergebnisse unter Beweis zu stellen. Danach stellen wir Daten von Mikroskopie, UV-Vis Absorption Spektroskopie sowie stationäre und Zeitaufgelöste und Wellenlänge Fluoreszenz-Spektroskopie zur Charakterisierung der Eigenschaften der GdFP-Fluorophor mit Fokus auf die pH-Abhängigkeit der der Spektren.
Um den Austausch von zwei Trp Rückstände in ECFP von 4-amino-Trp zu bestätigen, wird die massenspektrometrische Analyse durchgeführt. Abbildung 1 zeigt eine repräsentative deconvoluted ESI-MS-Spektrum von GdFP. Während Wildtyp ECFP eine berechnete Protein Masse von 28,283.9 Da nach der Chromophor Reifung hat, ist die entsprechende Masse von GdFP 28,313.9 Da. Das deconvoluted ESI-MS-Spektrum der GdFP weist eine Masse Hauptgipfel am 28,314.1 ± 0,1 Da, die Abweichung vom theoretischen Wert von weniger als 10 ppm. Wird innerhalb der typischen Genauigkeitsbereich für diese Art von Analyse25, dies bestätigt die Einbeziehung der ncAA über SPI (Versuchswert für Wildtyp ECFP: 28,283.7 Da).
Abbildung 2 zeigt die konfokale Fluoreszenzmikroskopie imaging (CFIM) Bilder von Bakterienzellen EGFP, EYFP, ECFP und GdFP auf Wiederfreisetzung des Bakteriums in PBS-Puffer zum Ausdruck zu bringen. Alle Bilder wurden auf einem Mikroskop, ausgestattet mit einer UV Ziel und Laser Erregung bei über die gleiche Energie für jede Probe erworben.
Abbildung 3A zeigt eine Überlagerung von CFIM Bildern von E. Coli -Bakterien, die mit dem Ausdruck verschiedener FPs, einschließlich GdFP, immer mit sehr ähnlichen Anregungsenergie (Wellenlängen wie in Abbildung 2) überwacht. Abbildung 3 b zeigt die Chromophor Strukturen der FP Varianten gezeigt. In Bezug auf die Helligkeit des GdFP im Vergleich zu ECFP (Fluoreszenz-Quanten-Ausbeute-φ = 0,4), EGFP (φ = 0,6) und EYFP (φ = 0,6) Es ist wichtig zu beachten, dass für GdFP, ein breiteres Spektrum der Erwerb von Fluoreszenzlicht (30 nm) wurde verwendet, im Gegensatz zu 20 nm verwendet für andere Spe CIES, um die Intensität der Bilder, um ähnliche Werte einzustellen. Ein etwas niedriger Koeffizient, der vom Aussterben bedroht und eine reduzierte Quantenausbeute infolge einzigartige photophysikalischen Eigenschaften ist die Helligkeit des GdFP niedriger im Vergleich zu den anderen FPs angezeigt.
Das Absorptionsspektrum des ECFP (Abbildung 3) hat zwei charakteristische Maxima bei 434 nm und 452 nm. Im Gegensatz dazu zeichnet sich durch eine breite rot-verschoben Absorptionsbande mit dem Maximum an 466 GdFP nm. Die Absorption von EGFP ist ein weiterer rot-verschoben auf 488 nm. Jedoch wegen der viel größeren Stokes-Verschiebung des GdFP (108 nm) im Vergleich zu ECFP (41 nm) und EGFP (20 nm), das Emissionsspektrum des GdFP ist die am meisten rot-verschoben aller drei GFP Derivate hier untersuchten (Abbildung 3D). Während die Fluoreszenzemission von ECFP zwei charakteristische Maxima auf 475 zeigt nm und 505 nm, EGFP hat einen breiten wichtigsten Emission Band erreichte einen Spitzenwert von 508 nm (λMax.) mit einer leichten Schulter bei 540 nm. Die Fluoreszenz des GdFP erscheint am ca. 565 nm (λmax.) (Abbildung 3D). Seine Emissionsspektrum enthält einen kleinen Beitrag von Wildtyp ECFP ist auch sichtbar, wie eine kleine Schulter auf 475 nm. Dieser Bruchteil ECFP wird vor der Induktion während des SPI-Verfahrens, wie beschrieben33synthetisiert.
Abbildung 3E zeigt die pH-Wert-abhängige Änderungen in das Absorptionsspektrum des GdFP. Zur Abwechslung pH-Wert von 8 bis 5 die maximale Emission verschiebt sich leicht auf die rot und eine leichte Erweiterung der Absorptionsbande beobachtet. Die Verringerung der Absorption Amplitude ist jedoch nur etwa 10 % zwischen pH 8 und pH 5, darauf hinweist, dass der Grundzustand Eigenschaften der GdFP-Chromophor sehr schwach durch den pH-Wert verändert.
Die Zeitaufgelöste Fluoreszenzemission überwacht durch einzelnes Photon zählen ist in Abbildung 4dargestellt. Der Verfall Kurven überwacht in der spektralen Kanälen zentriert bei 550 nm und 600 nm (Abbildung 4A) zeigen eine etwas schneller Verfall der Fluoreszenz bei 600 nm im Vergleich zu den Verfall bei 550 nm. Die Ergebnisse einer globalen Passung der Fluoreszenz zerfallen Kurven mit zwei exponentielle Komponenten führt zu zwei Spektral unterscheidbar Fluoreszenz-Verfall-Komponenten mit Zeitkonstanten von 1.0 ns und 3,3 ns (Abbildung 4 und D).
Die Fluoreszenz-Emission des GdFP hängt stark von pH-Wert, wie es typisch für viele fluoreszierende Protein-Varianten der GFP-Familie ist. Abbildung 4 b vergleicht die Fluoreszenzemission von GdFP zwischen pH 5 und pH 8, was eindeutig einen Rückgang der Fluoreszenzintensität bei niedriger pH-Wert, zeigt während die spektralen Eigenschaften konstant bleiben.
Der Verfall-assoziierten Spektren (ZVE)39 des GdFP (Abb. 4 und D) zeichnen sich durch zwei unterschiedliche Emission Bands. Der Beitrag des langsamen 3.3 ns Komponente ist stärker ausgeprägt in den kurzen Wellenlängenbereich um 550 nm (60 %) mit geringen Beitrag der schnellere Komponente (40 %). Bei 600 nm, beide Komponenten verfügen über die gleiche Amplitude. Auf eine Verschiebung von pH 7 (Abbildung 4) auf pH 6 (Abbildung 4), die spektralen Eigenschaften der der DAS kaum ändern und die Zeitkonstanten aus der globalen Montage-Routine sind auch die gleichen (die Genauigkeit der die DAS Zeitkonstanten ist etwa ± 0.15 ns). Der Unterschied in der absoluten Amplituden der beiden Komponenten DAS ist klar, macht allerdings die voll für die reduzierte Fluoreszenz Emission Amplitude auf den gleichen pH-Verschiebung in Abbildung 4 b.

Abbildung 1: Repräsentative deconvoluted ESI-MS-Spektrum von GdFP. Das ESI-MS-Spektrum der GdFP (Goldfarbe, vergrößerten Grundstück gezeigt als Einschub) zeigt einen Hauptgipfel am 28314.1 Da (berechneter Wert 28313.9 Da). Das Spektrum für Wildtyp ECFP ist schwarz dargestellt. Bitte klicken Sie hier für eine größere Version dieser Figur.
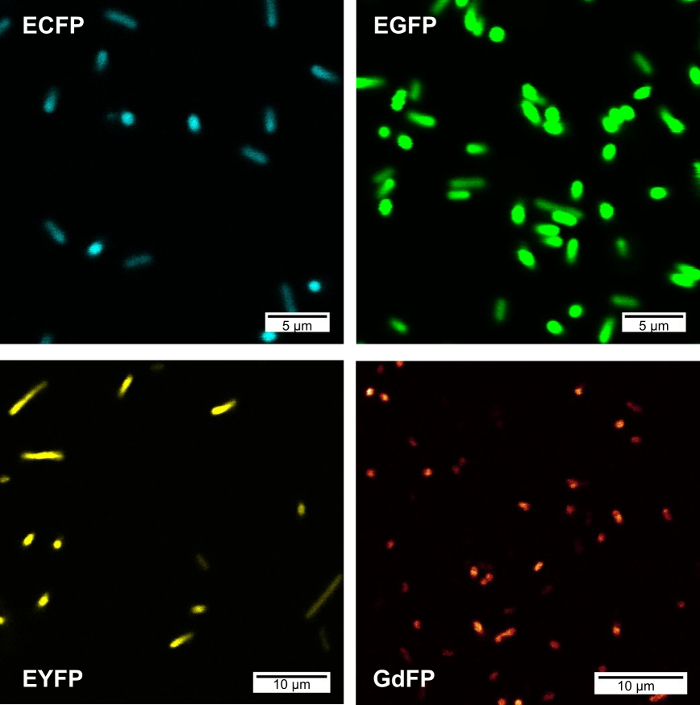
Abbildung 2: konfokale Fluoreszenz-Mikroskopie-Bilder aus Bakterienpopulationen zum Ausdruck bringen verschiedene FPs. Die folgenden Wellenlänge-Einstellungen wurden für die Bildaufnahme verwendet: ECFP (λex = 457 nm, Erkennung: 461-480 nm), EGFP (λex = 488 nm, Erkennung: 495-515 nm), GDFP (λex = 476 nm, Erkennung: 560-590 nm), EYFP (λex = 514 nm, Erkennung: 520-530 nm). Bitte klicken Sie hier für eine größere Version dieser Figur.
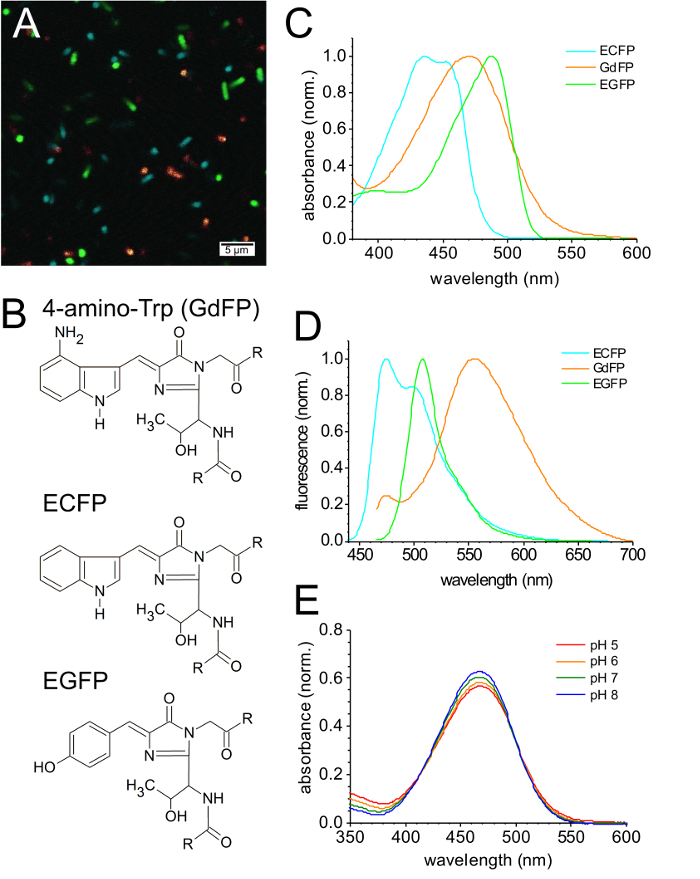
Bild 3: spektrale Eigenschaften des GdFP. (A) CFIM Bild aus einer Mischung von Bakterienzellen EGFP, ECFP und GdFP nach der Wiederfreisetzung des Bakteriums in PBS-Puffer zum Ausdruck bringt. (B) Chromophor Strukturen der GdFP (mit 4-amino-Trp anstelle von Rückständen 66), die elterliche ECFP (mit Trp an Position 66) und EFGP (mit Tyr an Position 66). (C) Vergleich der normalisierten Absorptionsspektren von GdFP, ECFP und EGFP, während in (D), das normalisierte Fluoreszenz Emissionsspektrum von ECFP (Erregung bei 430 nm) ist im Vergleich zu den Fluoreszenz-Emissionsspektren EGFP und GdFP (beide aufgeregt bei 450 nm). (E) pH-Abhängigkeit der Absorptionsspektren (normalisiert Absorption bei 280 nm). Bitte klicken Sie hier für eine größere Version dieser Figur.
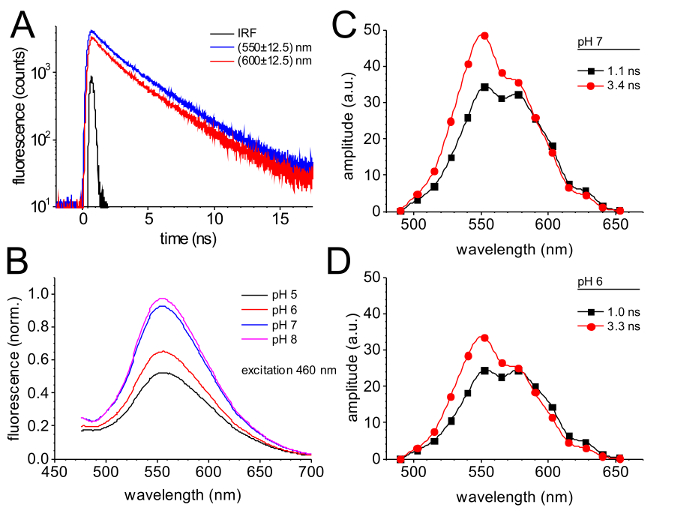
Abbildung 4: Zeitaufgelöste Fluoreszenz des GdFP. (A) Fluoreszenz Verfall der GdFP durch überwacht und Wellenlänge-Zeitaufgelösten Einzelphotonen zählen in der spektralen Kanälen zentriert bei 550 nm und 600 nm (± 12,5 nm) nach Anregung mit 470 nm Laserpulsen. Die instrumentale Response-Funktion (IRF) informiert über die zeitliche Auflösung des verwendeten Setup. (B) Variante des das Emissionsspektrum des GdFP abhängig vom pH-Wert (Erregung bei 460 nm). (C, D) Verfall-assoziierten Spektren (ZVE) von GdFP bei pH 7 (C) und pH 6 (D) ermittelt, nachdem Dekonvolution und Wellenlänge-Zeitaufgelöste Fluoreszenz zerfällt und globale Einbau von zerfällt in allen Kanälen durch eine globale Gruppe von zwei Exponentialfunktionen mit verknüpfte Zeitkonstanten. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5: Strukturen der Intramolekulare Ladungstransfer ECFP (schwarz) und GdFP (Gold) Chromophore. Die Zunahme der Größe der Chromophor-Systems durch gute Elektron Spender einer amino-Gruppe im Rahmen der ncAA ermöglicht die Bildung von mehr mesomeric Strukturen zur Stabilisierung der Resonanz von den angeregten Zustand zu erreichen. Die Anschlussstellen zum Schafott FP werden als Halbkreise angezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Stammlösung | Konzentration, Lösungsmittel | Hinweis | |
| 20 % D-Glucose | 200 g/L D-Glucose in DdH2O | Sterilisieren Sie durch Filtration durch einen 0,45 µm Pore Größe Spritze filter | |
| Indol | 50 mM in isopropanol | ||
| 4-amino-Indol | 50 mM in 20 % Ethanol (20 mL Ethanol in einem Endvolumen von 100 mL gefüllt mit DdH2O) | ||
| IPTG | 1 M in DdH2O | ||
| L-tryptophan | 15 mM in DdH2O mit 1 M HCl gelöst (Hinzufügen von HCl tropfenweise unter Rühren bis Pulver Dissoved ist) | ||
| Lysozym | 50 mg/mL in DdH2O | ||
| DNase ich | 1 mg/mL in DdH2O | ||
| RNase A | 1 mg/mL in DdH2O | ||
| Amp100 | 100 mg/mL Ampicillin in DdH2O | ||
| Natrium-Dodecylsulfate (SDS) | 200 g/L in DdH2O | ||
| Ammoniumsulfat ((NH4)2SO4) | 1 M in DdH2O | Sterilisieren durch Autoklavieren | |
| Kalium Dihydrogen Phosphat (KH2PO4) | 1 M in DdH2O | Sterilisieren durch Autoklavieren | |
| di-Kalium-Wasserstoff-Phosphat (K2HPO4) | 1 M in DdH2O | Sterilisieren durch Autoklavieren | |
| Magnesium-Sulfat (MgSO4) | 1 M in DdH2O | Sterilisieren durch Autoklavieren | |
| D-glucose | 1 M in DdH2O | Sterilisieren Sie durch Filtration durch einen 0,45 µm Pore Größe Spritze filter | |
| Natriumchlorid (NaCl) | Im DdH2O 5 M | Sterilisieren durch Autoklavieren | |
| Kalzium-Chlorid (CaCl2) | 1 g/L | Sterilisieren Sie durch Filtration durch einen 0,45 µm Pore Größe Spritze filter | |
| Eisen(II) chlorid (FeCl2) | 1 g/L | Sterilisieren Sie durch Filtration durch einen 0,45 µm Pore Größe Spritze filter | |
| Thiamin | 10 g/L | Sterilisieren Sie durch Filtration durch einen 0,45 µm Pore Größe Spritze filter | |
| Biotin | 10 g/L | Sterilisieren Sie durch Filtration durch einen 0,45 µm Pore Größe Spritze filter | |
| Spurenelemente mix | Kupfersulfat CuSO4, Zink-Chlorid (ZnCl2), Mangan-Chlorid (MnCl2), Ammonium Molybdat ((NH4)2MoO4); je 1 mg/L in DdH2O | Sterilisieren Sie durch Filtration durch einen 0,45 µm Pore Größe Spritze filter | |
| 19 Aminosäuren Mischung | 1) lösen sich 0,5 g L-Phenylalanin und 0,5 g L-Tyrosin in 100 ml DdH2O mit tropfenweise Zugabe von 1 M HCl unter Rühren bis Pulver aufgelöst hat. | ||
| (2) wiegen, 0,5 g aller restlichen L-Aminosäuren (mit Ausnahme von L-Tryptophan). Mischen Sie mit 22 mL fo 1 M KH2PO4 und 48 mL 1 M K2HPO4. Ca. 800 mL DdH2O hinzufügen. Rühren Sie, bis die Lösung klar wird. | |||
| (3) Add die gelösten L-Phenylalanin und L-Tyrosin aus Schritt 1.) und stellen Sie die Lautstärke auf 1 L mit DdH2O. | |||
| (4) entkeimen der Aminosäure-Gemisch durch Vakuumfiltration mit einer Flasche Top Filteranlage. | |||
| Puffer und Medien | Zusammensetzung/Vorbereitung | ||
| SDS Ladepuffer Farbstoff, konzentrierte sich 5 x | 0,25 M Tris pH 6.8, 50 % V/V Glycerin, 0,25 % w/V Bromphenol blau, 0,5 M Didhiothreitol (DVB-t; Alternativ 5 % β-Mercaptoethanol), 10 % w/V Natrium-Dodecylsulfate (SDS) | ||
| Bindung-Puffer | 50 mM Natrium Dihydrogenphosphate (NaH2PO4), 500 mM NaCl, 10 mM Imidazol, pH 8 | ||
| Elution buffer | 50 mM Natrium Dihydrogenphosphate (NaH2PO4), 500 mM NaCl, 250 mM Imidazol, pH 8 | ||
| Dialyse-Puffer | 50 mM Natrium Dihydrogenphosphate (NaH2PO4), 150 mM NaCl, Glycerin 100 mL/L, pH 8 | ||
| MS-Puffer | 10 mM Tris-HCl, pH 8 | ||
| neue minimal 19 L-Aminosäuren mit Ausnahme von L-Tryptophan (NMM19)-haltigem medium | Mischen Sie alle Stammlösungen der folgenden Endkonzentrationen erhalten: 7,5 mM (NH4)2SO4, 1,7 mM NaCl, 22 mM KH2PO4, 50 mM K2HPO4, 1 mM MgSO4, 20 mM D-Glucose, 50 mg/L 19 Aminosäuren mischen, 1 µg/L CaCl2, 1 µg/L FeCl2, 10 µg/L Thiamin, Biotin 10 mg/L, 0,01 mg/L Spurenelemente mix | ||
| LB-medium | Zusammensetzung: 10 g/L Tryptone, 5 g/L Hefeextrakt, 10 g/L NaCl, pH 7,0 in DdH2O | ||
| Zubereitung: | |||
| (1) wiegen, 50 g Tryptone, 25 g Hefe-Extrakt, 5 g NaCl in eine 1 L Flasche. | |||
| (2) Add ddH2O bis ~ 800 mL und Auflösen Komponenten unter Rühren. | |||
| 3) pH-Wert Messen und ggf. durch tropfenweise Zugabe von 1 M HCl oder 1 M NaOH auf pH 7 einstellen. Fügen Sie ddH2O bis zu 1 L. | |||
| (4) entkeimen durch Autoklavieren Volumenverlust danach suchen und hinzufügen sterile DdH2O, bei Bedarf zu kompensieren. Bei 4 ° C bis zur Verwendung aufbewahren. | |||
| LB-Agar-Platten | Zusammensetzung: 10 g/L Tryptone, 5 g/L Hefeextrakt, 10 g/L NaCl, 15 g/L Agar-agar, pH 7.0 in DdH2O | ||
| Zubereitung: | |||
| (1) wiegen, 50 g Tryptone, 25 g Hefe-Extrakt, 5 g NaCl, 7,5 g Agar-agar in eine 1 L Flasche. | |||
| (2) Add DdH2O bis zu 500 mL und Auflösen Komponenten unter Rühren. | |||
| 3) pH-Wert Messen und ggf. durch tropfenweise Zugabe von 1 M HCl oder 1 M NaOH auf pH 7 einstellen. Fügen Sie ddH2O bis zu 1 L. | |||
| (4) entkeimen durch Autoklavieren Volumenverlust danach suchen und fügen Sie sterile DdH2O zu kompensieren, wenn nötig. (Hinweis: LB-Agar kann bis zur Verwendung für die Zubereitung von LB-Agar-Platten bei 4 ° C gelagert werden. Schmelzen Sie vorsichtig erstarrtem Agar mit Hilfe einer Mikrowelle) | |||
| 5.) Wenn die Lösung ist noch Warm (30-40 ° C), eine Endkonzentration von 100 µg/mL Ampicillin hinzufügen | |||
| (6) Gießen Sie etwa 15 mL der Flüssigkeit aus Schritt 5.) in eine sterile 10 cm Petrischale unter sterilen Bedingungen. Wenn der Agar erstarrt ist, können Platten für 1 Woche bei 4 ° C bis zum Gebrauch gespeichert werden. | |||
| Phosphat-gepufferte Kochsalzlösung (PBS) | Zusammensetzung: 137 mM NaCl, 2,7 mM KCl, 10 mM Na2HPO4, 1,8 mM KH2PO4, 1 mM CaCl2, 0,5 mM MgCl2, pH 7. Sterilisieren Sie durch Autoklavieren oder Filtration. | ||
Tabelle 1: Lager-Lösung und Puffer.
Diskussion
Um sehr hohe Wirkungsgrade der ncAA-Aufnahme zu erreichen, beruht die auxotrophien-basierte SPI-Methode auf der Verwendung von metabolisch veränderter Wirtszellen, die nicht in der Lage, die entsprechenden natürlichen Vorbild der ncAA zu synthetisieren. Für E. Colisind solche Belastungen verfügbar. Auch die gleichzeitige Einbindung der mehrere NcAAs in das gleiche Protein ist machbar mit multiauxotrophic Stämme. Der Rückstand-Modus der Ersatz und die chemischen Repertoire auf ähnliche chemische Analoga eingeschränkt kann als Nachteile gesehen werden. Dennoch kann eine große Anzahl von Protein-Varianten produziert werden, wie die natürliche bakterielle Übersetzung Apparat zahlreiche Aminosäure-Analoga verträgt. Beispielsweise könnte Proteine mit in-Vitro -Übersetzung, entfallen etwa 73 % aller Codons des genetischen Codes für Geschlechtsangleichende40zur Verfügung stehen mehr als 50 NcAAs integriert werden. Darüber hinaus kann auch SPI ermöglichen effizientes multisite Kennzeichnung des Ziel-Protein-41. Im Prinzip die SPI-Methode beschränkt sich nicht auf E. Coli, aber kann in einem beliebigen anderen Host und für jede der 20 kanonischen Aminosäuren, arbeiten, sofern auxotrophe Stämme und definierten Anbau-Medien zur Verfügung stehen. Zum Beispiel sind zwei Methionin-Analoga, Azidohomoalanine (Aha) und Homopropargylglycine (Hpg), kommerziell zur Verfügung und wird für die Kennzeichnung der Proteine und Proteome in verschiedenen Organismen. Darüber hinaus kann Aha intrazellulär hergestellt und anschließend in Protein42integriert. Diese ncAA eignet sich besonders für Bioorthogonal Konjugationen wie Click-Chemie von Tirrel und Kollegen entwickelt: zum Beispiel in Pflanzen Gewebe von Arabidopsis Thaliana, Bombyx Mori Larven43, Drosophila Zellen44sowie Larven Zebrafisch45 und Säugerzellen einschließlich Neuronen46, können Proteine mit Aha47,48gekennzeichnet werden. In ähnlicher Weise wurden Trp Analoga antimikrobielle Peptide in Trp auxotrophe Lactococcus Lactis Stämme49erfolgreich integriert. SPI ist auch nützlich für den Bereich der Xenobiologie50,51, die Alternativen zu den grundlegenden chemischen Zusammensetzung des Lebens erforscht. Zum Beispiel, basierend auf früheren Arbeiten auf E. Coli52 und B. Subtilis53, eine E. Coli -Stamm vor kurzem eine evolutionäre Strategie unter Selektionsdruck, Thienopyrrole anstatt zu verwenden entwickelte sich durch Indol, wodurch Proteom-weite Substitution von Tryptophan durch Thienopyrrole-Alanin in den genetischen Code54. In der Regel stellt die kanonische Aminosäure Trp, die durch ein einziges Triplett (UGG) kodiert ist, ein viel versprechendes Ziel für Protein-Engineering durch den Facettenreichtum der Indol-Chemie, das zahlreiche chemische Varianten bietet. Vor kurzem, und als Alternative zu SPI-basierten Einbindung, berichtet ein Roman SCS-Plattform fähig, Trp Analoga ortspezifisch in bakteriellen und eukaryotic Wirte zu integrieren wurde55. Dies erweitert weiter die Toolbox in Vivo ncAA-basierte Protein-Engineering, einschließlich der Änderung der spektralen Eigenschaften.
Neben dem Einsatz von auxotrophe Ausdruck Gastgeber erfordert SPI-Protokoll strenge Fermentationsbedingungen, sowohl in Bezug auf Ziel Ausdruck Timing und die Zusammensetzung des Mediums um ncAA Einbindung hocheffizienter und Proteinausbeute Ziel zu erreichen 56. Anbau erfolgt mittels chemisch definierte minimalen Medien, die im wesentlichen neben wichtigen Salze die Quellen für Stickstoff (Ammoniumsalz) und Kohlenstoff (D-Glucose), Vitamine und Spurenelemente enthalten. Obwohl in Ermangelung weiterer Auxotrophies, die übrigen Aminosäuren nicht unbedingt erforderlich (20 -n, wenn n Aminosäuren müssen ersetzt werden) werden häufig hinzugefügt, um das Bakterienwachstum57zu fördern. Während einer anfänglichen Wachstumsphase vor Induktion der Proteinexpression Ziel hinzukommen die n kanonischen Aminosäuren ausgetauscht werden Konzentrationen zu begrenzen. Zellwachstum wird fortgesetzt, bis die gezielte essentiellen Aminosäuren als experimentell gekennzeichnet durch eine stationäre OD600aufgebraucht sind. Anschließend wird das Kulturmedium durch frisches Medium ersetzt, die die erschöpften Aminosäure fehlt und der ncAA in reichlich Konzentrationen enthält. Für die ribosomale Aufnahme von Tryptophan-Analoga wie gezeigt in diesem Protokoll wird ein Indol analog eingespeist, die wird intrazellulär in den entsprechenden Tryptophan-Derivat von Tryptophan Synthase58konvertiert. Als nächstes wird Ziel-Protein-Expression induziert. Zu diesem Zeitpunkt sind die Zellen kurz vor dem Ende des logarithmischen Wachstums, wie eine Balance zwischen total Zellzahl und Fitness. Da das Vorhandensein und die Einbeziehung von den kanonischen Aminosäuren zu Wildtyp Protein-Produktion führen würde, ist es wichtig, sicherzustellen, dass die essentielle Aminosäure vor Induktion vollständig aufgebraucht ist. Ebenso ist es zwingend erforderlich, um die Effizienz der ncAA Einbindung in das Zielprotein, häufig durch Massenspektrometrie untersuchen. Im Falle einer erheblichen Präsenz die kanonische Aminosäure, Anbau Bedingungen müssen angepasst werden, z.B.durch Veränderung der Konzentration der wesentlichen Amino acid(s) für die erste Wachstumsphase oder die Dauer des letzteren. Im Falle einer niedrigen AaRS Aktivität gegenüber der ncAA kann die Überexpression des körpereigenen Enzyms oder Co Ausdruck einer anderen AaRS, das mehr in Richtung der ncAA aktiv ist, durchgeführte59.
Die kanonische Aminosäure Trp mit drei bemerkenswerte Eigenschaften ausgestattet ist: (i) seinen natürlichen Reichtum an Proteinen ist gering; (Ii) die biophysikalischen und chemischen Eigenschaften sind einzigartig (zB., es ist in der Regel die dominierende Herkunft der intrinsische Fluoreszenz von Proteinen und Peptiden), und (Iii) Es trägt zu einer Vielzahl von biochemischen Interaktionen und Funktionen, einschließlich Π-Stapeln, H-Bindung und kation-π-Wechselwirkungen. Alle diese Funktionen sind auf Trp → 4-amino-Trp Substitution im GdFP. Darüber hinaus Zweifel radikal verändert, das Design der Extraklasse "Gold" AvGFPs ist ein bemerkenswertes Beispiel für engineering maßgeschneiderte Autofluorescent Proteine. Mit unterschiedlichen spektralen Eigenschaften kann FPs auf bestimmte spektrale Fenster über Mutagenese und ncAA Aufnahme abgestimmt werden. Im Falle eines GdFP wird dies durch einen einfachen chemischen Austausch H → NH2 im Rahmen der in den ECFP Chromophor Dreiklang enthalten Indol-Ring erreicht. Abbildung 5 zeigt die Auswirkungen der ncAA Gründung innerhalb der Chromophor. Die Einführung der Elektron-Spenden-Gruppe aus 4-amino-Indol (intrazellulär umgerechnet auf 4-amino-Trp) ermöglicht eine Vielzahl von mesomeric Strukturen, die einen stabilisierten angeregten Zustand erklären kann. Diese unterschiedlichen Eigenschaften des ausgedehnten konjugierten Systems spektroskopisch, seine erweiterten Stokes-Shift und Rot-verschoben Fluoreszenzemission zurückzuführen. So berichtete zuvor, verbesserte Intramolekulare Ladungstransfer innerhalb der GdFP-Chromophor ist von Natur aus empfindlich auf pH-Wert (Abbildung 4 b) und begleitet von einer größeren Änderung Dipolmoment zwischen S0 Boden und S1 aufgeregt Zustand im Vergleich zu ECFP33. Als alternative Elektron Spenden Gruppen könnte Tryptophan Analoga ein Indol Lagerring mit Hydroxygruppen ersetzt verwendet werden, wie in einer Vergleichsstudie mit dem Modell Protein Barstar41berichtet.
Die Absorption und Fluoreszenz Spektren der GdFP sind im Vergleich zu ECFP und EGFP erweitert (Abbildung 3 und D). Homogene Verbreiterung der Absorption und Fluoreszenz-Bands ist in der Regel durch Schwingungs-Modi in der Chromophor und darüber hinaus durch Kopplung der Chromophor, weitere Schwingungs Modi vorhanden in der Protein-60verursacht. Die Ankopplung an die lokalen Protein Umwelt stützt sich auf Gebühren, die auf den Chromophor lokalisiert. Da die strukturelle Inhomogenität des Proteins führt zu lokalen Variationen des vibronic Spektrums, solche Kopplung zwischen den vibronic Spektren der Chromophor und dem Rest des Proteins von kostenlos Betriebsverlagerungen und mesomeric Staaten wie im unterstützt werden Abbildung 5. Diese Kopplung unterstützt auch die große Stokes-Verschiebung und unbedingt reduziert die Quantenausbeute der Fluoreszenz. Im Vergleich zu anderen rot-verschoben FPs GdFP sogar verbesserte proteinstabilität und eine geringe Tendenz zur Aggregation33,61,62ausgestellt. Es unterscheidet sich in der Farbe von anderen FP-Varianten nicht nur, sondern stellt auch eine deutlich höhere Thermostabilität und verbesserte kooperative Faltung33. Die Fluoreszenzintensität ist zu mindestens 90 % erhalten beim Erhitzen auf 60 ° C, während ECFP Fluoreszenz auf etwa 30 % reduziert ist. In Proteinen tragen aromatischen Aminosäuren oft zu Netzwerke interagierender Seitenketten, die häufig eine stabilisierende Wirkung auf die Tertiärstruktur des Proteins haben. AvGFP birgt solch eine Seite Chain-Netzwerk, bestehend aus den Chromophor selbst, als auch als Phe-165, His-148 und Tyr-145. Diese Seitenketten sind nicht nur ziemlich starr in die GdFP Struktur33, aber wichtiger ist, sie bilden hydrophobe Kontakte mit den Chromophor. Die prominentesten Novum in GdFP identifiziert ist, dass die aminiertem-Chromophor mehr proximalen Phe-165. Diese Interaktion ist eine Funktion, die nicht in anderen bekannten AvGFPs beobachtet. Da die zwei Rückstände 3.2-4.5 Å voneinander entfernt sind, können amino-aromatischen Wechselwirkungen auch vorhanden sein. Zusammen mit der Aminierung-induzierte Resonanz Stabilisierung des der Chromophor stabilisieren diese am ehesten diese hydrophobe Netzwerk von Aminosäuren in einer kooperativen Weise. Ein effektiver Intramolekulare Ladungstransfer könnte durch diese Interaktionen in den angeregten Zustand im Vergleich zu den Grundzustand der Chromophor unterstützt werden, und es entfallen zumindest teilweise auf die 108 nm Stokes Shift33,62 .
In rationale Gestaltung der Fluorophor Eigenschaften ist eine Zunahme der Größe des delokalisierte π-Systems voraussichtlich in einer rot-verschoben Erregung Wellenlänge zur Folge. Diese Faustregel wird durch eine Reihe von Aminosäuren in Position 66 führt zu neutralen Chromophore befolgt: Phe (λMax. = 355 nm) < seine (λMa X= 386 nm) < Tyr (λMax. = 395 nm) < Trp (λMax. = 436 nm)63. Durch verschiedene Strategien erreicht diese Erweiterung der Chromophor konjugierten Systems von π-Bindungen in der Natur. Für DsRed aus Discosoma Striataverlängert er sich um die Integration von eine weitere Aminosäure, damit Verlagerung der λMax. bis 573 nm64. Der Chromophor des asFP595 (λMax. = 595 nm) von Anemonia Sulcata wurde um eine imino-Gruppe, Erweiterung der π-System-65erweitert. Da das Chromophor von GdFP und anderen AvFPs der gleichen Größe ist, muss ein anderes Prinzip einer Emissionswellenlänge im Bereich der erweiterten DsRed und asFP595 Chromophore nach sich ziehen. Die Tiefe Stokes-Verschiebung von 108 nm ist zurückzuführen auf die klare Struktur des GdFP-Chromophor, das enthüllt ein neues photophysikalischen Prinzip bei der Gestaltung der Autofluorescent Proteine. Vorläufige Berechnungen (wie berichtet in 62) haben gezeigt, dass das Dipolmoment des aufgeregt Zustand Chromophor des GdFP wesentlich größer als im Grundzustand, im Gegensatz zu den jeweiligen Werten des ECFP. Während das Dipolmoment des GdFP von ~ 3 D (Debye) im S0 Zustand auf ~ 15 S1 steigt, die Veränderung für die ECFP-Chromophor war eher moderat (von ~ 4 D bis ~ 6 D). So entsteht die einzigartige goldene Fluoreszenz des GdFP durch erhebliche Intramolekulare Ladungstransfer innerhalb der Chromophor, was die Vielfalt der möglichen mesomeric Strukturen (siehe Abbildung 5) erhöht, die Resonanz Stabilisierung ermöglichen. Dies verringert die Energie aus der Emission erfolgt. Als Folge der tief greifenden Wandel in der Dipolmoment auf Anregung ist die Intramolekulare Ladungstrennung der Hauptgrund für die Änderungen in das elektrostatische Potential der Chromophor Umwelt. Die umliegenden Protein-Matrix passt sich wiederum auf die Veränderungen in der Ladungsverteilung nach Chromophor Anregung. Die anschließende strukturelle Relaxation senkt das Energieniveau des aufgeregt Chromophor, die Verschiebungen der Fluoreszenz-Spektrum auf dem roten wegen seines Transfer kostenlos. Für der gleiche Grund, als Folge der große Stokes-Verschiebung und erhöhte Raten von STRAHLUNGSLOSE Prozesse, die Quantenausbeute der Fluoreszenz des GdFP reduziert im Vergleich zu ECFP33.
Die hohe Quantenausbeute und kleine Stokes-Verschiebung des ECFP und EGFP sind in der Regel eine starre Protein-Umgebung der Chromophor, wodurch die Anzahl der Freiheitsgrade reduziert zugeschrieben und damit interne Konvertierung zugunsten die Strahlungs Lockerung der angeregten Zustand 66. Infolgedessen könnte die molekulare Design mehr starr eingebettete Chromophore mit reduzierten Ankopplung an die verbleibenden Proteinmatrix dienen als Leitfaden weiter rot-verschoben GFP Derivate mit hoher Fluoreszenz Quantenausbeute produzieren. Für weitere technische Ansätze zur Rot-verschoben Autofluorescent Proteine zu produzieren, ist Erweiterung des Systems der π-Elektronen und eine starre Chromophor Struktur mit schwacher Kopplung an die Protein-Umwelt daher höchst wünschenswert. Solche Änderungen könnte auch direkt in der GFP-basierte Chromophore oder durch Platzierung des gewünschten NcAAs in der Nähe der Chromophor eingeführt werden.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessenkonflikte.
Danksagungen
Diese Arbeit wurde unterstützt von der Deutschen Forschungsgemeinschaft (Exzellenzcluster "Unifying Konzepte in Katalyse) T.F und N.B. und durch das Bundesministerium für Bildung und Wissenschaft (BMBF-Programm"HSP 2020", TU-WIMIplus Projekt SynTUBio), F.-j.s.
Materialien
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 4-aminoindole | Sigma-Aldrich | 525022 | |
| acetonitrile | VWR | HiPerSolv CHROMANORM ULTRA for LC-MS, 83642 | LC-MS grade required |
| agar-agar | Carl Roth | 5210 | |
| ammonium molybdate ((NH4)2MoO4) | Sigma-Aldrich | 277908 | |
| ammonium sulfate ((NH4)2SO4) | Sigma-Aldrich | A4418 | |
| ampicillin sodium salt | Carl Roth | K029 | |
| biotin | Sigma-Aldrich | B4501 | |
| bromophenol blue | Sigma-Aldrich | B0126 | |
| calcium chloride (CaCl2) | Sigma-Aldrich | C5670 | |
| colloidal silica | Sigma-Aldrich | Ludox HS-40, 420816 | |
| Coomassie Brillant Blue R 250 | Carl Roth | 3862 | |
| copper sulfate (CuSO4) | Carl Roth | CP86.1 | |
| D-glucose | Carl Roth | 6780 | |
| di-sodium hydrogen phosphate (Na2HPO4) | Carl Roth | X987 | |
| di-potassium hydrogen phosphate (K2HPO4) | Carl Roth | P749.1 | |
| 1,4-dithiothreitol (DTT) | Carl Roth | 6908 | |
| DNase I | Sigma-Aldrich | D5025 | |
| ethanol | Carl Roth | 9065.1 | |
| formic acid | VWR | HiPerSolv CHROMANORM for LC-MS, 84865 | LC-MS grade required |
| glycerol | Carl Roth | 3783 | |
| imidazole | Carl Roth | X998 | |
| indole | Sigma-Aldrich | I3408 | |
| iron(II) chloride (FeCl2) | Sigma-Aldrich | 380024 | |
| isopropanol | Carl Roth | AE73.1 | |
| isopropyl β-D-1-thiogalactopyranoside (IPTG) | Sigma-Aldrich | I6758 | |
| lysozyme | Sigma-Aldrich | L6876 | |
| magnesium chloride (MgCl2) | Carl Roth | KK36.1 | |
| magnesium sulfate (MgSO4) | Carl Roth | 8283.2 | |
| manganese chloride (MnCl2) | Sigma-Aldrich | 63535 | |
| β-mercaptoethanol | Carl Roth | 4227.3 | |
| potassium chloride (KCl) | Carl Roth | 6781.3 | |
| potassium dihydrogen phosphate (KH2PO4) | Sigma-Aldrich | P5655 | |
| RNase A | Carl Roth | 7156 | |
| sodium chloride (NaCl) | Carl Roth | P029 | |
| sodium dihydrogen phosphate (NaH2PO4) | Carl Roth | T879 | |
| sodium dodecyl sulphate (NaC12H25SO4) | Carl Roth | 0183 | |
| thiamine | Sigma-Aldrich | T4625 | |
| Tris(hydroxymethyl)-aminomethane (Tris) | Carl Roth | 5429 | |
| Tris hydrochloride (Tris-HCl) | Sigma-Aldrich | 857645 | |
| tryptone | Carl Roth | 8952 | |
| yeast extract | Carl Roth | 2363 | |
| zinc chloride (ZnCl2) | Sigma-Aldrich | 229997 | |
| Name | Company | Catalog Number | Comments |
| amino acids | |||
| L-alanine | Sigma-Aldrich | A7627 | |
| L-arginine | Sigma-Aldrich | A5006 | |
| L-asparagine | Sigma-Aldrich | A8381 | |
| L-aspartic acid | Sigma-Aldrich | A0884 | |
| L-cysteine | Sigma-Aldrich | C7352 | |
| L-glutamic acid | Sigma-Aldrich | G2128 | |
| L-glutamine | Sigma-Aldrich | G3126 | |
| L-glycine | Sigma-Aldrich | G7126 | |
| L-histidine | Sigma-Aldrich | H8000 | |
| L-isoleucine | Sigma-Aldrich | I2752 | |
| L-leucine | Sigma-Aldrich | L8000 | |
| L-lysine | Sigma-Aldrich | L5501 | |
| L-methionine | Sigma-Aldrich | M9625 | |
| L-proline | Sigma-Aldrich | P0380 | |
| L-phenylalanine | Sigma-Aldrich | P2126 | |
| L-serine | Sigma-Aldrich | S4500 | |
| L-threonine | Sigma-Aldrich | T8625 | |
| L-tryptophan | Sigma-Aldrich | T0254 | |
| L-tyrosine | Sigma-Aldrich | T3754 | |
| L-valine | Sigma-Aldrich | V0500 | |
| Name | Company | Catalog Number | Comments |
| Lab materials | |||
| 0.45 µm syringe filter with PVDF membrane | Carl Roth | CCY1.1 | |
| 1.5 mL microcentrifuge tubes | Eppendorf | 30120086 | |
| conical polystyrene (Falcon) tubes, 50 mL | Fisher Scientific | 14-432-22 | |
| Luer-Lock syringe 5 mL | Carl Roth | EP96.1 | |
| dialysis membrane, Molecular Weight Cut-Off (MWCO) 5,000 | Spectrum Medical Industries | Spectra/Por MWCO 5000 dialysis membrane, 133198 | |
| Immobilized Metal ion Affinity Chromatography (IMAC) column 1 mL, Ni-NTA | Macherey Nagel | Protino series, 745410.5 | |
| petri dishes (polystyrene, sterile) | Carl Roth | TA19 | |
| pQE-80L plasmid vector | Qiagen | no longer available | replaced by N-terminus pQE Vector set Cat No./ID: 32915 |
| protein extraction reagent BugBuster | EMB Millipore | 70921-4 | |
| round-bottom polystyrene tubes, 14 mL | Fisher Scientific | Corning Falcon, 14-959-1B | |
| Trp-auxotrophic E. coli strain | ATCC | ATCC 49980 | Bridges BA et al., Chem Biol Interact., 1972, 5(2):77-84; see main text for alternatives |
| Name | Company | Catalog Number | Comments |
| Mass Spectrometry equipment | |||
| mass spectrometer for LC-ESI-TOF-MS | Agilent | Agilent 6530 Accurate-Mass QTOF | coupled with Infinity LC system |
| mass spectrometry data analysis software | Agilent | MassHunter Qualitative Analysis software v. B.06.00 | |
| High-Performance Liquid Chromatography (HPLC) column for LC-ESI-TOF-MS | Sigma-Aldrich | Supelco Discovery BIO Wide Pore C5 HPLC column, 3 µm particle size, 10 cm x 2.1 mm | |
| HPLC autosampler vials 1.5 mL | Sigma-Aldrich | Supelco 854165 | with conical 0.1 mL glass inserts, screw caps and septa |
| Name | Company | Catalog Number | Comments |
| General equipment | |||
| benchtop centrifuge for 1.5 mL Eppendorf tubes | Eppendorf | 5427 R | |
| cooling centrifuge for 50 mL Falcon tubes | Eppendorf | 5810 R | |
| high pressure microfluidizer for bacterial cell disruption | Microfluidics | LM series with “Z” type chamber | |
| peristaltic pump for LC | GE Healthcare | P-1 | |
| Fast Protein Liquid Chromatography (FPLC) system | GE Healthcare | ÄKTA pure 25 L | |
| orbital shaker for bacterial cultivation | Infors HT | Minitron | |
| UV/Vis spectrophotometer | Biochrom | ULTROSPEC 2100 | |
| ultrasonic homogenizer for bacterial cell disruption | Omnilab | Bandelin SONOPULS HD 3200, 5650182 | with MS72 sonifier tip |
| Name | Company | Catalog Number | Comments |
| Fluorescence spectroscopy equipment | |||
| ps-pulsed laser 470 nm | Picoquant GmbH | PDL-470 | |
| time- and wavelength-correlated single photon counting (TWSPC) acquisition software | Picoquant GmbH | SymPhoTime 64 | |
| time- and wavelength-correlated single photon counting (TWSPC) detector | Picoquant GmbH | PML-16C | 16 spectral channels, to be selected by grating settings |
| single photon counting software | Picoquant GmbH | SPCM 9.75 | |
| global fitting software | Picoquant GmbH | SPC2Glo(R) | |
| fluorescence decay data analysis software | Picoquant GmbH | FluoFit program | |
| data analysis software | OriginLab Inc. | Origin 9.2 | |
| neutral density filter set | Schott | NG1 to NG11 | (400 - 650 nm, transmission 50 %, 20%, 10 %, 5 %) |
| 488 nm long-pass emission filter | AHF Analysentechnik | AHF-488 | |
| quartz cuvette | Thorlabs GmbH | CV10Q1400 | 1 cm pathlength |
Referenzen
- Shimomura, O., Johnson, F. H., Saiga, Y. Extraction, Purification and Properties of Aequorin, a Bioluminescent Protein from the Luminous Hydromedusan, Aequorea. J Cell Compar Physl. 59 (3), 223-239 (1962).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263 (5148), 802-805 (1994).
- Andresen, M., et al. Structure and mechanism of the reversible photoswitch of a fluorescent protein. P Natl Acad Sci USA. 102 (37), 13070-13074 (2005).
- Andresen, M., et al. Structural basis for reversible photoswitching in Dronpa. P Natl Acad Sci USA. 104 (32), 13005-13009 (2007).
- Brakemann, T., et al. A reversibly photoswitchable GFP-like protein with fluorescence excitation decoupled from switching. Nat Biotechnol. 29 (10), 942-947 (2011).
- Kremers, G. -. J., Gilbert, S. G., Cranfill, P. J., Davidson, M. W., Piston, D. W. Fluorescent proteins at a glance. J Cell Sci. 124 (Pt 2), 157-160 (2011).
- Shimomura, O. Structure of the chromophore of aequorea 0. shimomura green fluorescent protein. FEBS Lett. 104 (2), 220-222 (1979).
- Shaner, N. C., Campbell, R. E., Steinbach, P. A., Giepmans, B. N. G., Palmer, A. E., Tsien, R. Y. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Shcherbo, D., et al. Bright far-red fluorescent protein for whole-body imaging. Nat Methods. 4 (9), 741-746 (2007).
- Shcherbakova, D. M., Subach, O. M., Verkhusha, V. V. Red fluorescent proteins: advanced imaging applications and future design. Angew Chem Int Edit. 51 (43), 10724-10738 (2012).
- Stepanenko, O. V., Verkhusha, V. V., Kuznetsova, I. M., Uversky, V. N., Turoverov, K. K. Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes. Curr Protein Pept Sc. 9 (4), 338-369 (2008).
- Wang, L., Xie, J., Deniz, A. A., Schultz, P. G. Unnatural amino acid mutagenesis of green fluorescent protein. J Org Chem. 68 (1), 174-176 (2003).
- Budisa, N., Steipe, B., Demange, P., Eckerskorn, C., Kellermann, J., Huber, R. High-level biosynthetic substitution of methionine in proteins by its analogs 2-aminohexanoic acid, selenomethionine, telluromethionine and ethionine in Escherichia coli. Eur J Biochem. 230 (2), 788-796 (1995).
- Sharma, N., Furter, R., Kast, P., Tirrell, D. A. Efficient introduction of aryl bromide functionality into proteins in vivo. FEBS Lett. 467 (1), 37-40 (2000).
- Liu, C. C., Schultz, P. G. Adding new chemistries to the genetic code. Annu Rev Biochem. 79, 413-444 (2010).
- Twine, S. M., Murphy, L., Phillips, R. S., Callis, P., Cash, M. T., Szabo, A. G. The Photophysical Properties of 6-Azaindole. J Phys Chem B. 107 (2), 637-645 (2003).
- Lepthien, S., Hoesl, M. G., Merkel, L., Budisa, N. Azatryptophans endow proteins with intrinsic blue fluorescence. P Natl Acad Sci USA. 105 (42), 16095-16100 (2008).
- Budisa, N., et al. Probing the role of tryptophans in Aequorea victoria green fluorescent proteins with an expanded genetic code. Biol Chem. 385 (2), 191-202 (2004).
- Ross, J. B., et al. Spectral enhancement of proteins: biological incorporation and fluorescence characterization of 5-hydroxytryptophan in bacteriophage lambda cI repressor. P Natl Acad Sci USA. 89 (24), 12023-12027 (1992).
- Soumillion, P., Jespers, L., Vervoort, J., Fastrez, J. Biosynthetic incorporation of 7-azatryptophan into the phage lambda lysozyme: Estimation of tryptophan accessibility, effect on enzymatic activity and protein stability. Protein Eng Des Sel. 8 (5), 451-456 (1995).
- Heim, R., Tsien, R. Y. Engineering green fluorescent protein for improved brightness, longer wavelengths and fluorescence resonance energy transfer. Curr Biol. 6 (2), 178-182 (1996).
- Bridges, B. A., Mottershead, R. P., Rothwell, M. A., Green, M. H. L. Repair-deficient bacterial strains suitable for mutagenicity screening: tests with the fungicide captain. Chem Biol Interact. 5 (2), 77-84 (1972).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: The Heat Shock Method. J Vis Exp. , (2017).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: Electroporation. J Vis Exp. , (2017).
- Grigorenko, B. L., Krylov, A. I., Nemukhin, A. V. Molecular modeling clarifies the mechanism of chromophore maturation in the green fluorescent protein. J Am Chem Soc. , (2017).
- JoVE Science Education Database. General Laboratory Techniques. Introduction to the Spectrophotometer. J Vis Exp. , (2017).
- Goedhart, J., et al. Structure-guided evolution of cyan fluorescent proteins towards a quantum yield of 93%. Nat Commun. 3, 751 (2012).
- Neidhardt, F. C., Bloch, P. L., Smith, D. F. Culture medium for enterobacteria. J Bacteriol. 119 (3), 736-747 (1974).
- Hörnsten, E. G. On culturing Escherichia coli on a mineral salts medium during anaerobic conditions. Bioprocess Eng. 12 (3), 157-162 (1995).
- Davis, B. D. The Isolation of Biochemically Deficient Mutants of Bacteria by Means of Penicillin. P Natl Acad Sci USA. 35 (1), 1-10 (1949).
- Sambrook, J., Russell, D. W. . Molecular Cloning: A Laboratory Manual. , (2001).
- Wang, Y. -. S., et al. The de novo engineering of pyrrolysyl-tRNA synthetase for genetic incorporation of L-phenylalanine and its derivatives. Mol Biosyst. 7 (3), 714-717 (2011).
- Bae, J. H., et al. Expansion of the genetic code enables design of a novel "gold" class of green fluorescent proteins. J Mol Biol. 328 (5), 1071-1081 (2003).
- JoVE Science Education Database. Dialysis: Diffusion Based Separation. J Vis Exp. , (2017).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Separating Protein with SDS-PAGE. J Vis Exp. , (2017).
- Petrásek, Z., et al. Excitation energy transfer from phycobiliprotein to chlorophyll d in intact cells of Acaryochloris marina studied by time- and wavelength-resolved fluorescence spectroscopy. Photoch Photobio Sci. 4 (12), 1016-1022 (2005).
- Kolber, Z. S., Barkley, M. D. Comparison of approaches to the instrumental response function in fluorescence decay measurements. Anal Biochem. 152 (1), 6-21 (1986).
- Pelet, S., Previte, M. J. R., Laiho, L. H., So, P. T. C. A fast global fitting algorithm for fluorescence lifetime imaging microscopy based on image segmentation. Biophys J. 87 (4), 2807-2817 (2004).
- Loefroth, J. E. Time-resolved emission spectra, decay-associated spectra, and species-associated spectra. J Phys Chem. 90 (6), 1160-1168 (1986).
- Hartman, M. C. T., Josephson, K., Lin, C. -. W., Szostak, J. W. An expanded set of amino acid analogs for the ribosomal translation of unnatural peptides. PLoS One. 2 (10), e972 (2007).
- Budisa, N., et al. Global replacement of tryptophan with aminotryptophans generates non-invasive protein-based optical pH sensors. Angew Chem Int Edit. 41 (21), 4066-4069 (2002).
- Ma, Y., Biava, H., Contestabile, R., Budisa, N., di Salvo, M. L. Coupling bioorthogonal chemistries with artificial metabolism: intracellular biosynthesis of azidohomoalanine and its incorporation into recombinant proteins. Molecules. 19 (1), 1004-1022 (2014).
- Teramoto, H., Kojima, K. Incorporation of Methionine Analogues Into Bombyx mori Silk Fibroin for Click Modifications. Macromol Biosci. 15 (5), 719-727 (2015).
- Deal, R. B., Henikoff, J. G., Henikoff, S. Genome-wide kinetics of nucleosome turnover determined by metabolic labeling of histones. Science. 328 (5982), 1161-1164 (2010).
- Hinz, F. I., Dieterich, D. C., Tirrell, D. A., Schuman, E. M. Non-canonical amino acid labeling in vivo to visualize and affinity purify newly synthesized proteins in larval zebrafish. ACS Chem Neurosci. 3 (1), 40-49 (2012).
- Dieterich, D. C., et al. In situ visualization and dynamics of newly synthesized proteins in rat hippocampal neurons. Nat Neurosci. 13 (7), 897-905 (2010).
- Dieterich, D. C., Link, A. J., Graumann, J., Tirrell, D. A., Schuman, E. M. Selective identification of newly synthesized proteins in mammalian cells using bioorthogonal noncanonical amino acid tagging (BONCAT). P Natl Acad Sci USA. 103 (25), 9482-9487 (2006).
- Glenn, W. S., et al. Bioorthogonal Noncanonical Amino Acid Tagging (BONCAT) Enables Time-Resolved Analysis of Protein Synthesis in Native Plant Tissue. Plant Physiol. 173 (3), 1543-1553 (2017).
- Zhou, L., et al. Incorporation of tryptophan analogues into the lantibiotic nisin. Amino Acids. 48 (5), 1309-1318 (2016).
- Acevedo-Rocha, C. G., Budisa, N. Xenomicrobiology: a roadmap for genetic code engineering. Microb Biotechnol. 9 (5), 666-676 (2016).
- Agostini, F., Völler, J. -. S., Koksch, B., Acevedo-Rocha, C. G., Kubyshkin, V., Budisa, N. Biocatalysis with Unnatural Amino Acids: Enzymology Meets Xenobiology. Angew Chem Int Edit. 56 (33), 9680-9703 (2017).
- Bacher, J. M., Ellington, A. D. Selection and characterization of Escherichia coli variants capable of growth on an otherwise toxic tryptophan analogue. J Bacteriol. 183 (18), 5414-5425 (2001).
- Wong, J. T. Membership mutation of the genetic code: loss of fitness by tryptophan. Pc Natl Acad Sci USA. 80 (20), 6303-6306 (1983).
- Hoesl, M. G., et al. Chemical Evolution of a Bacterial Proteome. Angew Chem Int Edit. 54 (34), 10030-10034 (2015).
- Italia, J. S., et al. An orthogonalized platform for genetic code expansion in both bacteria and eukaryotes. Nat Chem Biol. 13 (4), 446-450 (2017).
- Völler, J. -. S., Thi To, T. M., Biava, H., Koksch, B., Budisa, N. Global substitution of hemeproteins with noncanonical amino acids in Escherichia coli with intact cofactor maturation machinery. Enzyme Microb Tech. 106, 55-59 (2017).
- Budisa, N., Steipe, B., Demange, P., Eckerskorn, C., Kellermann, J., Huber, R. High-level biosynthetic substitution of methionine in proteins by its analogs 2-aminohexanoic acid, selenomethionine, telluromethionine and ethionine in Escherichia coli. Eur J Biochem. 230 (2), 788-796 (1995).
- Völler, J. -. S., Budisa, N. Coupling genetic code expansion and metabolic engineering for synthetic cells. Curr Opin Biotech. 48, 1-7 (2017).
- Johnson, J. A., Lu, Y. Y., Van Deventer, J. A., Tirrell, D. A. Residue-specific incorporation of non-canonical amino acids into proteins: recent developments and applications. Curr Opin Chem Biol. 14 (6), 774-780 (2010).
- Somsen, O. J., van Grondelle, R., van Amerongen, H. Spectral broadening of interacting pigments: polarized absorption by photosynthetic proteins. Biophys J. 71 (4), 1934-1951 (1996).
- Kurschus, F. C., Pal, P. P., Bäumler, P., Jenne, D. E., Wiltschi, B., Budisa, N. Gold fluorescent annexin A5 as a novel apoptosis detection tool. Cytom Part A. 75 (7), 626-633 (2009).
- Lepthien, S., Wiltschi, B., Bolic, B., Budisa, N. In vivo engineering of proteins with nitrogen-containing tryptophan analogs. Appl Microbiol Biot. 73 (4), 740-754 (2006).
- Wachter, R. M., Elsliger, M. -. A., Kallio, K., Hanson, G. T., Remington, S. J. Structural basis of spectral shifts in the yellow-emission variants of green fluorescent protein. Structure. 6 (10), 1267-1277 (1998).
- Verkhusha, V. V., Lukyanov, K. A. The molecular properties and applications of Anthozoa fluorescent proteins and chromoproteins. Nat Biotechnol. 22 (3), 289-296 (2004).
- Martynov, V. I., Savitsky, A. P., Martynova, N. Y., Savitsky, P. A., Lukyanov, K. A., Lukyanov, S. A. Alternative cyclization in GFP-like proteins family. The formation and structure of the chromophore of a purple chromoprotein from Anemonia sulcata. J Biol Chem. 276 (24), 21012-21016 (2001).
- Piatkevich, K. D., Malashkevich, V. N., Morozova, K. S., Nemkovich, N. A., Almo, S. C., Verkhusha, V. V. Extended Stokes shift in fluorescent proteins: chromophore-protein interactions in a near-infrared TagRFP675 variant. Sci Rep. 3 (1), 1847 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten