Method Article
Ein Saug Blister-Protokoll, menschliche T-Zelle Recall Antworten In Vivo zu studieren
In diesem Artikel
Zusammenfassung
Hier bieten wir eine Demonstration des Modells Saug Blister kutanen erinnern. Das Modell ermöglicht einen einfachen Zugang zu menschlichen in-Vivo adaptive Immunantworten, zum Beispiel im Rahmen der Entwicklung von Impfstoffen zu studieren.
Zusammenfassung
Kutane Antigen-Rückruf Modelle erlauben für Studien des menschlichen Gedächtnisses Antworten in Vivo. In Verbindung mit Haut Saug Blister (SB) Induktion bietet dieses Modell Zugänglichkeit zu selten Populationen von antigenspezifischen T-Zellen Vertreter des zellgedächtnisses Reaktion sowie das Zytokin Mikroumgebung in Situ.
Dieser Bericht beschreibt das praktische Verfahren der kutanen Rückruf, ein SB-Induktion und eine Ernte von antigenspezifischen T-Zellen. Um die Methode zu veranschaulichen, dient der Tuberkulin-Hauttest Antigenen Rückruf bei Personen, die vor dieser Studie wurde eine Bacillus Calmette-Guérin-Impfung gegen eine Infektion mit Mycobacterium Tuberculosis. Zu guter Letzt vorgesehen sind, Beispiele für Multiplex und Flow durchflusszytometrischen Analyse der SB Exemplare illustrieren hohe Bruchteile von antigenspezifischen polyfunktionalen CD4 + T-Zellen zur Verfügung durch dieses Sampling-Methode im Vergleich zu Zellen aus dem Blut isoliert.
Die hier beschriebene Methode ist sicher und minimal-invasive, bietet eine einzigartige Gelegenheit, sowohl angeborene und adaptive Immunantworten in Vivozu studieren und kann vorteilhaft sein, einer breiten Gemeinschaft von Forschern, die mit zellvermittelte Immunität und Mensch Speicher-Antworten im Zusammenhang mit der Entwicklung von Impfstoffen.
Einleitung
Ein Haut-SB ist eine künstlich herbeigeführte Blister, die für die Ernte von Zellen und Flüssigkeit direkt von der Haut ermöglicht. Die Technik der Erhöhung der SBs durch Vakuum ist eine bekannte Tool auf dem Gebiet der Dermatologie verwendet für die Untersuchung der Haut Immunologie in Gesundheit und Krankheit1,2,3,4,5, 6 , 7 , 8. dieser Bericht zeigt, wie die SB-Technik in Kombination mit kutanen Antigenen Rückruf (SB-kutanen Rückruf-Methode) direkte Einblicke in adaptive Immunantworten in Vivoliefern kann.
Das Prinzip hinter der SB-Induktion ist einfach: ein leichtes Vakuum auf einen kleinen Bereich der Haut angewendet wird. Der Unterdruck wird schließlich die Epidermis von der Dermis, erstellen eine lokale Blase gefüllt mit Flüssigkeit und Zellen1,2,9trennen zwingen. Die Blister-Flüssigkeit durch eine Feinnadelpunktion geerntet werden kann und die Inhalte können für weitere Studie in Vitroverwendet werden.
In den letzten Jahren gab es ein zunehmendes Interesse in der SB-Methode für die Untersuchung von in Vivo Immunantworten als Krankheiten, die auf die Haut10,11beschränkt. Die Studie der adaptiven Immunität beim Menschen ist durch die Tatsache begrenzt, dass die Zellen und Zytokine von Interesse aus dem peripheren Blut abgetastet werden, weil eine invasive Probenahme von Lymphknoten oder Magen-Darm-Schleimhaut möglicherweise nicht akzeptabel und unethisch. Ein Beispiel ist das Studium der langlebigen menschlichen Gedächtnisses T-Zell-Reaktionen nach Impfung12. In solchen Studien kann die Probenahme von entsprechenden T-Zellen eine große Herausforderung, weil die Population der betreffenden Zellen, die Immunität zu vermitteln im lymphatischen Gewebe befindet sich, und nur eine sehr begrenzte Anzahl von spezifischen T-Zellen im peripheren Blut zirkulieren.
Die SB-Technik bietet eine einzigartige Gelegenheit zum Studium der Memory T-Zellen und andere spezifische Zellpopulationen. Im Anschluss an die kutane Impfung von Antigen T-Zellen spezifisch für das Antigen werden auf die Haut von ihrer lymphatischen Hideaways rekrutiert und probieren Sie einfach aus dem SB. Die Methodik und Forschung Anwendungen dieses kutanen Rückruf-Modells wurden von Akbar Et Al. beschrieben. in 20132. Eine häufig verwendete Antigen für Haut Rückruf ist der im Handel erhältlichen gereinigtes Protein-Derivat (PPD) von Mykobakterien verwendet, um ein Tuberkulin-Hauttest (TST)13durchzuführen wo PPD in der dermalen Schicht der Haut injiziert. Bei Personen mit einer bestehenden immunologisches Gedächtnis zu PPD [z.B., Personen mit Mycobacterium Tuberculosis (Mtb) Infektion oder eine vorherige Impfung Bacillus Calmette-Guérin (BCG)], die Antigen-Ablagerung führt zu einer erinnern Sie Reaktion bei der Migration auf die Haut und eine in Vivo klonalen Expansion der PPD-spezifische CD4 + T-Zellen2,11,14,15. Folglich sammeln hohe Bruchteile von PPD-spezifische polyfunktionalen CD4 + T-Zellen in der Haut bereit für die SB-Probenahme. T-Zellen, die mit dieser Methode gesammelt haben sich als robust erwiesen und sind ausreichend reichlich, geprägt durch eine Reihe von Immunoassays und eine langfristige in-vitro- Kultur15. So das kutane Rückruf-Modell und die SB-Induktion erweisen eine wertvolle Methode, um in Vivo T-Zell-Antworten von ex-Vivo -Analysen zu studieren, und mehr wissen dieses Ansatzes kann Forscher mit Interessen in der zellulären Immunologie profitieren und Impfstoffentwicklung.
Dieser Bericht enthält die ersten schrittweise Anleitung zum Menschenhaut Saug Bläschen im PPD injiziert Haut zu induzieren. Das Kutane Antigen-Rückruf-Modell wird mit der TST bei BCG-geimpften Probanden demonstriert. Schließlich ist die relevanten ex-Vivo -Analyse der Zellen und Zytokine durch SB isoliert beispielhaft. Phänotypische und funktionelle Eigenschaften von PPD-spezifischen T-Zellen durch die SB-Methode abgerufen werden gründlich an anderer Stelle beschrieben,2,10,11,16,17, 18 , 19. Ziel dieses Berichts ist es, die praktische und immunologische Aspekte der Methodik, die Anwendung dieser Technik von anderen Forschergruppen erleichtern zu diskutieren.
Protokoll
Alle Methoden beschrieben, einschließlich der Verwendung von menschlichen Probanden wurden von der dänischen Ausschuss für Gesundheit Forschungsethik (H-15002988) und der dänischen Datenschutzbehörde (jr.nr. 2015-57-0102) genehmigt. PPD-Datei muss ein zertifiziertes Produkt für den menschlichen Gebrauch zugelassen und in der richtigen Dosierung des Herstellers verabreicht werden. Abweichungen in der Dosierung oder Verabreichung erfordern zusätzliche ethische Zulassungen und freiwillige Einwilligung geben müssen.
(1) Tuberkulin-Hauttest
- Der/die freiwillige mündliche und schriftliche Einwilligung einzuholen. Vor der Injektion stellen Sie sicher, dass der/die freiwillige versteht und akzeptiert das Verfahren einschließlich möglichen nachteiligen Auswirkungen.
Hinweis: Einschlusskriterien spezifisch für dieses Protokoll sind Alter > 18 Jahre und eine dokumentierte BCG-Impfung. Einschlusskriterien können je nach Fragestellung (d.h., eine zusätzliche Aufnahme Kriterium konnte nachweislich positive TST). - Verwenden Sie eine fertige Lösung der PPD-Datei für den menschlichen Gebrauch [20 Tuberkulin Einheiten (TU) /mL]. Desinfizieren Sie die Gummikappe ein Fläschchen mit einem Alkoholtupfer.
- Vorbereitung der Injektionsstelle
- Suchen Sie die Injektionsstelle auf der Bauchseite des freiwilligen Unterarm.
- Legen Sie den Arm Palm-Up auf eine glatte Oberfläche und wählen Sie einen Bereich im oberen Drittel des Unterarms, ca. 5-10 cm aus dem Ellenbogengelenk. Bleiben frei von Narben, Venen oder geschädigter Haut.
- Desinfizieren Sie den Bereich mit einem alkoholischen Tupfer.
- Bereiten Sie die PPD-Lösung
- Verwenden Sie eine 1 mL sterile Spritze mit einem 27-30G/short (z.B. 12 mm) Nadel fixiert.
- Vorsichtig mischen und 0,1 mL der PPD-Lösung anstreben. Stellen Sie sicher, dass es keine sichtbaren Luftblasen gibt.
- Intradermale Injektion PPD
Hinweis: Dieser Schritt beschreibt, wie eine einzelne PPD-Ablagerung durchführen, aber mehrere Ablagerungen der PPD-Datei in den gleichen Arm ist möglich. Dies kann jedoch bestimmten ethische Genehmigung verlangen.- Spannen Sie die Haut und zeigen Sie die Nadel in einem Winkel von 5-15° auf der Haut mit der Fase nach oben.
- Stecken Sie die Spitze der Nadel in der dermalen Schicht der Haut und stellen Sie sicher, dass die Spitze fast durch die Epidermis sichtbar ist.
- Injizieren Sie langsam 0,1 mL PPD-Lösung.
Hinweis: Wenn richtig verabreicht, wird eine blasse Papel von 6-10 mm sofort angezeigt. Die Papel verschwindet nach ca. 10 Minuten. - Wenn Sie zwei oder mehr Ablagerungen, streben Sie eine maximale Trennung (5-10 cm) von der Injektionsstellen ohne dabei ein gutes Stück aus dem Ellenbogen und Handgelenk.
Hinweis: Dadurch wird verhindert, dass einen potenziellen Zusammenfluss der Hauttest Antwort und die ununterbrochene Positionierung aus zwei Kammern, Saug.
2. Bewertung der Hautreaktion - Tag 3
- Beachten Sie nach 48-72 h die Größe der Hautreaktion. Die Verhärtung (Schwellung) zu messen und nicht das Erythem (Rötung) der Reaktion.
- Ertasten die harte Schwellung mit Fingern und dann markieren Sie die Kanten der Verhärtung mit einem Kugelschreiber. Verwenden Sie ein Lineal, Messen Sie den Durchmesser der Verhärtung und notieren sich das Ergebnis in mm.
Hinweis: Eine Lesung der Verhärtung Größe kann die Wahl der Blende Durchmesser für die Ansaugkammer führen.
(3) Saug-Blister Induktion - Tag 7
- Montieren Sie die Saugvorrichtung Einheit.
Hinweis: Absaugung Geräteeinheiten sind Vakuumpumpen mit beigefügten Kammern für Saug Blister Induktion. Das Gerät verwendet in dieser Demo wird individuell angefertigt, aber Absaugvorrichtung Einheiten sind auch im Handel erhältlich. Die Pumpe muss im Bereich von-20 bis-40 kPa einstellbar sein und bieten einen stabilen und zuverlässigen Unterdruck. Regionale sollte ethische Zustimmung vor der Durchführung von Experimenten mit dieser Methode.- Zuerst bereiten Sie den Schöpfraum durch Montage der Bodenplatte Öffnung und der fensterplatte mit der Kammer und der Verbindungsschlauch. Befestigen Sie den Kammer-Anschluss Schlauch dicht an der Vakuumpumpe.
Hinweis: Die Kammern sollte auch eine Bodenplatte mit einem Loch für die Blister-Induktion, die für den Kontakt mit der menschlichen Haut geeignet sein sollte, und einer Deckplatte mit einem Fenster, so dass für die visuelle Kontrolle der Blase.
- Zuerst bereiten Sie den Schöpfraum durch Montage der Bodenplatte Öffnung und der fensterplatte mit der Kammer und der Verbindungsschlauch. Befestigen Sie den Kammer-Anschluss Schlauch dicht an der Vakuumpumpe.
- Bestimmen Sie die optimale Blende Durchmesser der Messblende im Verhältnis zur Größe der Hautreaktion; Je größer die Blende, desto größer die Blase.
- Desinfizieren Sie die Haut der/des freiwilligen und der Messblende mit Alkoholtupfer.
- Die Haut der Schöpfraum zuordnen.
- Stellen Sie sicher, dass der freiwillige Arm bequem aufliegt.
- Stellen Sie sicher, dass das Loch in die Bodenplatte der Schöpfraum Überreaktion der PPD-Datei befindet, so dass die Mitte von der Reaktion der Haut sichtbar ist.
- Die Kammer locker mit Gurten sichern: Wenn Unterdruck angewendet wird, wird die Kammer auf der Haut haften und zu behaupten.
- Schalten Sie die Absaugvorrichtung und stellen Sie den Druck auf-20 kPa.
- Erhöhen Sie nach 30 min den Unterdruck bis-25 kPa.
- Nach 60 min weiter erhöhen Sie den Unterdruck bis-30 kPa.
- Halten Sie den Druck auf-30 kPa, bis eine Blase voll ausgebildet wird. Sicherstellen Sie, dass der Unterdruck in diesem Protokoll zur Verfügung gestellt für eine angepasste Instrument spezifisch sind. Es möglicherweise notwendig, den Druck etwas anpassen, wenn das Protokoll in anderen Situationen anwenden.
Hinweis: Die Induktionsphase Blister reicht von 60 bis 180 min (1-3 h) mit den tatsächlichen Blasenbildung auftreten innerhalb der letzten 30 min., mörderisches oft mit einem juckenden Gefühl verbunden ist. Die Bläschen können als einzelne oder mehrere verschmelzenden Bläschen auftreten. Wenn Blister Ruptur oder Blutung auftritt, wird empfohlen, die Blister-Induktion zu beenden, indem Sie langsam den Druck freigeben. - Nachdem die Blase voll ausgebildet ist, lassen Sie den Druck, und entfernen Sie vorsichtig die Ansaugkammer aus der Haut ohne Ruptur der Blase.
- Gelten Sie eine weiche Wundauflage auf der Haut-Umgebung und legen Sie eine harte Kappe (z.B.aus einem Plastikschlauch 50 mL) über die Blase.
- Sichern Sie die Kappe mit allergikerfreundlichen chirurgische Band, gefolgt von einer weiche elastische Bandage.
- Weisen Sie der Freiwilligen, übermäßige körperliche Belastung für die nächsten 12-24 h im Kommandobereich/Blister zu vermeiden.
4. Ernte der Blister Fluid - Tag 8
- Aufdem 8 Tag sanft die schützenden Verband entfernen und die Blister mit Haut Desinfektion Spray zu desinfizieren.
- Verwenden Sie eine sterile Spritze 2 mL mit einer Nadel 23G Blister-Inhalt zu ernten. Stechen Sie die Nadel in die Spitze/Lateral Seite des Daches Blister und abzusaugen Sie langsam die Flüssigkeit. Berühren Sie den Boden der Kavität, aber achten Sie darauf, die Flüssigkeit zu ernten.
- Bewerben Sie eine Dressing auf dem eingestürzten Blister.
- Übertragen Sie die Blister-Flüssigkeit auf ein steriles Röhrchen. Beachten Sie die Lautstärke.
- Drehen Sie die Blister-Flüssigkeit nach unten bei 600 X g mit einer Tischplatte Zentrifuge für 4 min.
- Den überstand auf eine andere Röhre übertragen und Aufschwemmen der Zelle Pellet in 500 µL Zelle Medium.
Hinweis: Die Zellen sind nun bereit für das zählen und weitere Analyse. Überstände können bis zur Verwendung bei-20 bis-80 ° C aufbewahrt werden.
5. Analysen des Saugens Blister Zellen und Flüssigkeiten
Hinweis: Die Anweisungen für die Analyse von Zellen und Flüssigkeit erhalten Haut saugen Blasen nicht in den Anwendungsbereich dieses Protokolls ist. Um repräsentative Ergebnisse für diesen Bericht zu liefern, wurden jedoch intrazellulären Fleck Flow Cytometry und Multiplex-Analysen durchgeführt. Die Methodik wird nachfolgend kurz beschrieben.
- Durchflusszytometrie
- Suspensionen von 1 x 105 frische Zellen isoliert saugen Blasen aus 1 BCG geimpft freiwilligen mit 10 µg/mL PPD zu stimulieren und inkubieren Sie die Zellen bei 37 ° C und 5 % CO2. Gehören Sie unstimulierte Zellen für eine parallele Bebrütung.
- 1 x 106 PBMCs 1 BCG geimpft freiwilligen mit 10 µg/mL PPD gewonnenen Suspensionen zu stimulieren und inkubieren Sie die Mischung bei 37 ° C und 5 % CO2. Gehören Sie unstimulierte Zellen für eine parallele Bebrütung.
- Nach 2 h alle Zellen mit Brefaldin A und Monensin zu behandeln und ihnen 6 h bei 37° c inkubieren
- Färben Sie die Zellen mit einer Gruppe von Live/Dead-Fleck-BV510, Anti-CD4-AF780, Anti-CD3-BV421, Anti-CD8-PerCP-Cy5.5, Anti-CCR7-PE, Anti-CD45RA-BV786, Anti-IFN-γ-AF700, Anti-TNF-α-PE-Cy7 und Anti-IL-2-FITC.
- Gehören Sie FMO-Steuerelemente im Bereich PBMC.
- Durchführen einer durchflusszytometrischen Analysis mit einem Durchflusszytometer und analysieren Sie die Ergebnisse mit der entsprechenden Software.
- Tor auf die Zytokin-produzierenden CD3 + CD4 + CD8-Teilmengen mit Hilfe der folgenden gating Strategie: Unterhemden - > tragfähige CD3 + - > CD4 + CD8 - - > IFN-γ +, TNF-α + oder Il-2 +.
- Tor auf Effektor-Speicher-Zell-Populationen mit Hilfe der folgenden gating Strategie: Unterhemden - > tragfähige CD3 + - > CD4 + CD8 - - > CCR7 - CD45RA-.
- Berechnen Sie einzelne Cytokine Profile mit booleschen gating.
- Cytokine Freigabe Demonstrationen
- Nach einer Demonstration von einem Cytokine release in Vivo, verwenden eine Multiplex-Analyse um zu quantifizieren, die Ebenen von Il-2, IFN-γ, TNF-α, IL-10 und IL-13 in aufgetauten Saug Blister Flüssigkeit aus 4 Freiwillige gewonnen.
- Für eine Demonstration eines Zytokin-Release von Zellen entnommen Absaugung Blister Ex Vivo, Verwendung frisch Saug Blister Zellen und PBMCs von 1 BCG geimpft freiwilligen erhalten.
- Die PBMC infizieren und Saug-Blister Zellen mit 100 koloniebildenden Einheiten (KBE) von Mtb -H37Rv und inkubieren sie für 4 Tage.
- Verwenden Sie eine Multiplex-Analyse um zu quantifizieren, die Ebenen von Il-2, IFN-γ, TNF-α, IL-10 und IL-13 in allen Kultur-Überstände.
- Passen Sie die Messungen über den Assay Berechnungsbereich bis an die Grenze der oberen Berechnung.
Ergebnisse
Acht Erwachsene Probanden (Durchschnittsalter: 30 Jahre reichen: 26-43 Jahre) mit einer dokumentierten frühere BCG-Impfung (mediane Zeit von BCG-Impfung: 5,5 Jahre reichen: 1-30 Jahre) waren im Preis inbegriffen. Die Teilnehmer waren mikrodialysemembranen mit 2 TU PPD, gefolgt von einer TST-Bewertung am 3. Tag herausgefordert. SBs wurden am 7. Tag induzierte am 8. Tag geerntet und alle Bläschen waren mit Saug Blister Kammern mit 10 mm Bohrung Durchmesser angehoben. Sieben Personen erhielten 2 separate PPD Impfungen gleichzeitig in den gleichen Arm, gefolgt von 2 parallelen SB Induktionen (siehe den Hinweis auf mehrere PPD Ablagerungen unter Schritt 1.4 im Protokoll). Peripheren Blut wurde am 7. Tag für Plasma und einem PBMCs Isolation durch Dichte-Gradienten-Zentrifugierung gezogen. Plasma und Flüssigkeit Überstände von SBs wurden bei-20 ° c gelagert. SB-Frischzellen (SBCs) wurden gezählt mit nigrosin Fleck und Mikroskopie.
Die klinische TST Reaktionen und SBC Ertrag sind in Abbildung 1dargestellt. Die mittlere Größe der TST Verhärtungen war 10,25 mm (Bereich: 0 - 20 mm) und die mittlere Zellzahl pro Blister war 50.000 (Reichweite: 15.000-210.000 Zellen, Anzahl der Bläschen: 15). Zwei der freiwilligen hatte kein klinisches Ansprechen in entweder 2 TSTs und einer entsprechenden niedrigen Ergebniszelle Ausbeute von 15.000 Zellen/Blister. Die Zellausbeute war verbunden mit der mittlere klinische Antwort der TST (Spearmans R = 0.643, p = 0.094).
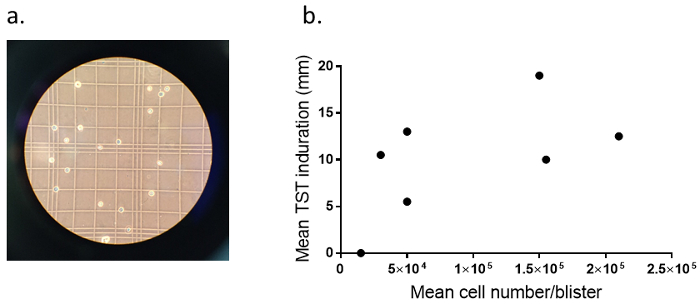
Abbildung 1 : Absaugung Blister Zellausbeute. (ein) zeigt dieses Panel einem Vertreter Mikroskopie nigrosin-gefärbten Zellen isoliert von SBs 7 Tage Post-TST angehoben. (b) dieses Panel zeigt Beziehungen zwischen den mittleren TST Verhärtung (mm) und die mittlere Zellausbeute (n/blister) bei 8 BCG-geimpften Probanden (Anzahl der Bläschen = 15). Die Punkte stehen für mittlere Einzelmessungen. Bitte beachten Sie, dass 2 Punkte überlappen, da beide 2 Freiwillige eine TST-Verhärtung von 0 mm und einer Zelle Ausbeute von 15.000 hatte. Bitte klicken Sie hier für eine größere Version dieser Figur.
Um die Strömung durchflusszytometrischen SB Charakterisierung zu demonstrieren, SBCs stammen aus freiwilliger 43-j hrige, die BCG geimpft 30 Jahre früher gewesen und hatte keine bekannten Exposition zu Mtb. die SBCs wurden isoliert nach der Induktion von einem einzigen Blister ( Verhärtung: 1,4 mm/100.000 SBCs). Abbildung 2 zeigt repräsentative Grundstücke der intrazellulären Zytokin Färbung der die SBCs versus PBMCs.
In dieser freiwilligen der Bruchteil der CD3 + CD4 + CD8-SBCs stieg von 67 % in unstimulierte Zellen auf > 90 % bei einer PPD in Vitro Restimulation, während der Anteil der CD3 + CD4 + CD8-PBMCs konstant geblieben (~ 51 %, Abbildung 2). Mehr als 92 % der in-vitro- PPD-, als auch die unstimulierte CD3 + CD4 + CD8-SBCs, waren die Effektor-Speicher-Typ (CCR7 - CD45RA-, Daten nicht gezeigt). Die allgemeine Brüche bestimmter CD3 + CD4 + CD8-Zellen induziert durch PPD-Stimulation lagen in der SBCs im Vergleich zu der PBMCs (33,1 Vs. 0,2 %, unstimulierte Proben abgezogen). In der PBMCs wurden die Fraktionen von polyfunktionalen PPD-spezifische CD3 + CD4 + CD8-Zellen alle < 0,05 %.

Abbildung 2 : Repräsentative Flow Cytometry Grundstücke SBCs im Vergleich zu PBMCs. Paneele ein und b zeigen repräsentative Dichte unstimulierte Grundstücke CD8 + und CD4 + Populationen in (einem) Vs. PPD-stimulierten PBMCs und (c) SBCs. Platten b und d langsam Grundstücke der intrazellulären Zytokin Färbung in PPD-stimulierten CD3 + CD4 + CD8-Zellen (b) PBMCs und (d) SBCs. Bitte klicken Sie hier für eine größere Version dieser Figur.
Wie erwartet, waren CD3 + CD4 + CD8-SBCs aktivierten in Vivo, illustriert durch einen hohen Anteil der Zellen Beflecken für hochreguliert Zytokine (12 %), mit der vorherrschenden Zytokine, TNF-α und IFN-γ. Doch nach PPD-Stimulation, die Cytokine sezernierenden Zellen verschoben in Richtung ein Triple - oder Doppel-positiven TNF-α, IFN-γ + IL-2 + (17 %) und IFN-γ + TNF-α + (15 %) Profil (Abb. 3 b, PBMC Profile vom selben Spender gehören zum Vergleich in Abbildung 3a). Die Zytokin-expressionsprofile für PPD-stimulierten Effektor Speicher CD4 + T-Zelle Teilmengen (CD3 + CD4 + CD8-CCR7 - CD45RA-) waren vergleichbar mit der CD3 + CD4 + CD8-Bevölkerung in den Abbildungen 2 und 3 (Daten nicht gezeigt) vorgestellt.
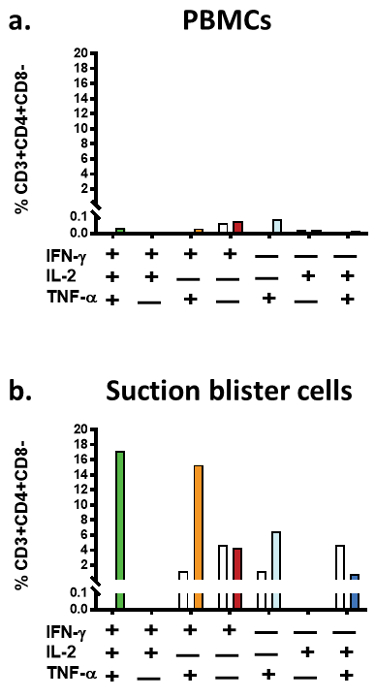
Abbildung 3: Cytokine Profile für CD4 + PPD angeregt und unstimulierte SBCs versus PBMCs. Diese Tafeln zeigen individuelle Profile für die Herstellung von Zytokin (ein) CD3 + CD4 + CD8-PBMCs Zellen und (b) CD3 + CD4 + CD8-SBCs. Die Balken repräsentieren Bruchteile von Antigen-spezifischen Cytokine Profile in unstimulierte Zellen (weiße Balken) und auf eine in-vitro- Stimulation mit PPD (farbige Balken).
Zur Erkundung die SB-Flüssigkeit als eine Quelle von Informationen auf der Zytokin-Mikroumgebung an der Stelle der Haut testen, wurden die Zytokin-Ebenen in Flüssigkeit geerntet von SBs induzierten 7 Tage Post-TST (Abbildung 4a) gemessen. Die mittlere Höhe der IFN-γ, TNF-α und Il-2 wurden 339 Pg/mL, 19 Pg/mL und 1 Pg/mL, bzw. (n = 6). Die Plasmaspiegel waren im Allgemeinen sehr gering. Zellen, die isoliert von SBs produziert hohe Pro-inflammatorischen Zytokinen ex Vivo (Abbildung 4 b). Titrationen SBCs von 1 Freiwillige waren für 4 Tage im Beisein von virulenten M. Tuberculosis kultiviert ± autologe PBMCs. Die IFN-γ lagen > in Kulturen mit SBCs, unabhängig vom Vorhandensein von PBMCs 30-fache höher.
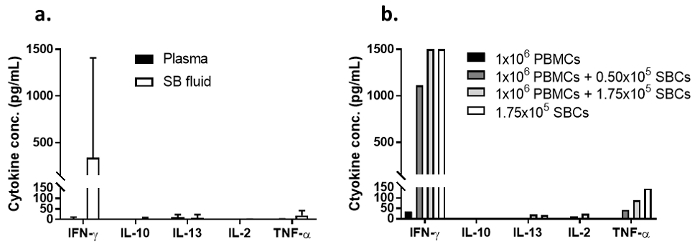
Abbildung 4 : Zytokin Ebenen in SB Flüssigkeit, Plasma, und MTB -Kultur Überstände infiziert. (ein) zeigt dieses Panel Zytokin Ebenen in SB Fluid Überstände und Plasma von 6 BCG-geimpften Probanden. Die Balken repräsentieren die mediane Zytokin Ebenen; die Fehlerbalken darstellen den Bereich. (b) zeigt dieses Panel Zytokin Ebenen in Überstände aus 4 parallelen 600 µl ex Vivo 4-tägigen Kulturen von 1 x 106 PBMCs (schwarze Balken), 1,75 x 10,5 SBCs (weiße Balken) und 1 x 106 PBMCs gespickt mit 0,5 oder 1,75 x 10 5 SBCs (graue Balken) mit Mtbinfiziert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Dieses Manuskript beschreibt eine praktische Verfahren für die Untersuchung des menschlichen Immunsystems Gedächtnis Antworten in Vivo, mit kutanen Antigen Recall und Zelle Ernte durch Induktion von Absaugen Blister. TST wurde als Beispiel intradermale Antigen Ablagerung und BCG-Impfstoff Rückruf verwendet. Schließlich war ein Beispiel für SB Probe Charakterisierung von Strömungsanalyse durchflusszytometrischen und Multiplex Zytokin vorausgesetzt zeigen, dass etwa ein Drittel der SB-Zellen wurden polyfunktionalen antigenspezifischen T-Zellen von den Effektor Erinnerung Phänotyp.
Die entscheidenden Schritte dieses Protokolls gehören die intrakutane Injektionstechnik, Saug Blister-Induktion und der Blister-Punktion. Erstens erfordert eine korrekte intradermale Abscheidung geschultes Personal. Eine falsche Aussage kann zu suboptimalen Ergebnissen führen. PPD ist in der Regel einen bekannten und sicheren kutanen Antigen, sondern seine Zusammensetzung variieren zwischen Herstellern, Begrenzung der Vergleichbarkeit13,20. Dieser Bericht enthält Anweisungen für ein einzelnes intradermale Ablagerung von 2 TU und wahlweise zwei parallele Ablagerungen (2 x 2 TU), die zusätzliche ethische Genehmigung bedürfen. Jedoch haben andere Studien 10 TU verwendet, die die Wahrscheinlichkeit einer starken Haut Reaktion10,21. Während der SB Induktion Schritt werden kleinen schrittweisen Anstieg der Unterdruck das Risiko von Blutungen und Blister Bruch. Die Chancen einer Kontamination mit roten Blutkörperchen oder Leukozyten aus dem Blut sind in der Regel gering2. Die aseptische Punktion Technik verhindert Verkeimung und Vermeidung des Kontakts zwischen der Punktionsnadel und dermalen Blister Boden reduziert Verunreinigungen von Schutt oder resident Hautzellen. Jedoch bevorzugen einige Forscher SB Flüssigkeit zu ernten, durch einen sanften Druck auf punktiert Blister10. Es möglicherweise notwendig, die Septen innerhalb der Blase zu durchbohren. Die SB-Technik selbst ist minimal invasiv; reduzierte SBs heilen ohne Narbenbildung und Infektionen sind sehr selten. 2 jedoch ein gewisses Maß an Hypo-Pigmentierung auftreten und SB Induktion sollte wohl bei Menschen mit einer Geschichte von Kolloid Narbenbildung vermieden werden.
Technische Einschränkungen umfassen niedrige Ergebniszelle Erträge und daher nur begrenzte Möglichkeiten für langfristige Lagerung. Beziehungen zwischen der äußerst Ertrag, klinische TST Reaktionen, Blister Größe und Erythrozyten Kontamination wurde gründlich an anderer Stelle beschrieben,2,10. Die BCG-Rückruf-Experimente hier vorgestellten (Abbildung 1) war die mediane Gesamtausbeute von jeder Blister 50.000, impliziert eine kleine Versuchsanordnung mit diesen Zellen, vor allem, wenn SBCs studierte allein15. Spezifische T-Zell-Population in einer SB-Probe übersteigt jedoch vor allem, was in PBMC-Proben in beide relative und absolute Zellzahlen gefunden wird. Im Beispiel in Abbildung 2dargestellt wurden die Anzahl der Dreifach-positiven PPD-spezifischen T-Zellen in einer Stichprobe von 100.000 SB Zellen mehr als 2 x größer als die Zahl gefunden in 1 x 106 PBMCs vom selben Spender (Daten nicht gezeigt). Eine visuelle Bewertung der TST-Reaktion ist die häufigste klinische Methode für die Bewertung von M. Tuberculosis Speicher. Beachten ist die zugrunde liegende adaptive immunologische Reaktion nicht zur gleichen Zeit wie die klinische Haut Reaktion2,21empor. Nicht alle BCG geimpft oder Mtb-exponierten Individuen entwickeln starke TST Reaktionen und Strategien für die Klassifizierung und eine Handhabung von Proben aus TST non-Responder, sowie eine bereits vorhandene mykobakteriellen Sensibilisierung in der Studienpopulation vor der Einleitung einer Rückruf-Studie mit dieser Methode berücksichtigt werden müssen. Auch in SB-Probenahme und visuelle Bewertung, gibt es ein Potenzial für eine theoretische Bias bei Personen mit reduzierten Haut Reaktionen aufgrund von globalen oder hautverwandt Immunität beeinträchtigt, wie z. B. HIV-Infektion und bestimmte Altersgruppen2gesehen, 13,18,20. Darüber hinaus ist eine immunologische Steigerung der TST Reaktion mit umfassender Tests bekannt20,22. Die SB-Zelle-Phänotypen allerdings bleiben eher konstant, wenn TSTs wiederholte10sind. Diese Beobachtung unterstützt die Rolle von SB-Rückruf bei Längsschnittstudien der zellulären Immunantwort.
T-Zell-Immunologen ermöglicht eine SB-Rückruf für die Ernte von hohen Bruchteile von Antigen-spezifischen Zellen. Das Timing der SB für eine Stichprobe aus einer PPD-Ablagerung ist jedoch entscheidend, da die zelluläre Zusammensetzung und das Zytokin Mikroumgebung im Laufe der Zeit ändern. In diesem Protokoll Bläschen waren induzierte Post-7-Tage-Challenge und die isolierten Zellen waren in erster Linie Effektor Speicher CD4 + T-Zellen einschließlich hohe Bruchteile von Zellen mit einem Co-Ausdruck von IFN-γ, TNF-α und Il-2. Diese Beobachtungen stehen im Einklang mit früheren Studien, die beschreiben, wie T-Zell-Aktivierung, Proliferation und Differenzierung erfolgt im PPD-vorbereitete Haut2,15,21. Kinetische SB Studien bei PPD sensibilisiert Menschen deuten darauf hin, dass die sehr frühe Haut Reaktion unspezifische; aber bereits innerhalb der ersten Tage nach der PPD-Challenge, die Antwort wird dominiert von CD4 + T-Zellen (beide zentralen Speicher und Effektor Speicher Phänotypen sind beschrieben worden), und nach 3 Tagen, die Antwort ist geprägt durch hohe Bruchteile von PPD-spezifischen Cytokine Produktion von CD4 + T-Zellen2,8,10,15,21. Diese adaptive Zytokin-Antwort bleibt für mehr als 2 Wochen2,8,10,23nachweisbar. 7. Tag Post-TST scheint der optimale Zeitpunkt für die Sammlung der Cytokine Produktion Memory CD4 + T-Zellen2sein. Jedoch können andere Zeitpunkte natürlich je nach Antigen und Antwort von Interesse relevant sein. Der Hinweis in einer Studie berichtet die Anpassungsreaktion PPD ein wenig früher mit einem Rückgang der Pro-inflammatorische Zytokin-Sekretion bereits bei 5 Tage Post-TST10einen Höchstwert.
SB-Flüssigkeit enthält hohe Konzentrationen von Pro-inflammatorischen Zytokinen und anderen Proteinen, die repräsentativ für die Haut Mikroumgebung15,24gezeigt. Kinetik-Studien haben gezeigt, dass TNF-α und IFN-γ Ebenen in SB Fluid Höhepunkt nach 3 Tagen beim IL-2 Ebenen Gipfel nach 7 Tage2,10, wahrscheinlich spiegelt die Dominanz der adaptive Reaktionen zu diesem späteren Zeitpunkt. Da SB Zellen aktiviert in Vivowurden, weisen sie eine hohe spontane Zytokin-Version sowie ein Potenzial für eine bestimmte Version auf Restimulation (Abbildung 3 und 4).
Dieser Bericht konzentriert sich auf CD4 + T-Zell-Immunität. Wie in Abbildung 2gezeigt hat es waren in der Tat die Mehrzahl der isolierten T-Zellen CD4 +, zwar gab es fast keine CD8 + T-Zellen in den sog blister Flüssigkeit. Dies steht im Einklang mit anderen SB PPD-Rückruf Studien berichten von geringen Anteilen und einer minderwertigen wandernden Kapazität von CD8 + T-Zellen im Vergleich zu CD4 + T Zellen2,8,10,23. Eine weitere Charakterisierung der CD8 + Beitrag wäre vorzuziehen; Dies ist jedoch den Rahmen dieses Berichts sprengen.
T-Zellen sind essentiell für die immun Kontrolle der Mtbbetrachtet; Allerdings ist es schwierig, eine zuverlässige Korrelat des Schutzes spiegelt sich in der adaptiven Immunantwort vom Blut25,26zu identifizieren gewesen. Dieses Hindernis behindert stark die Entwicklung neuer TB Impfstoffe, da gibt es derzeit keine Alternative zu großen und sehr teuren Wirksamkeit Studien27. TB-Impfstoff-Entwickler bestimmen Impfstoff Immunogenität durch die Beurteilung kleiner und vorübergehender Veränderungen in der Impfstoff-spezifische T-Zell-Populationen in der Blut-28,-29. Es ist jedoch fraglich, ob die kleine Bruchteil der zirkulierenden Antigen-spezifische T-Zellen im Blut gefunden relevant ist (d. h.in der Lage, die Migration auf die Website einer Infektion und repräsentativ für die T-Zelle-reiche Mikroumgebung Steuerung Mtb) 27 , 30 , 31 .
Basierend auf früheren Studien und die enthaltenen Daten, stellt das SB-kutanen Rückruf-Modell ein ungenutztes Potenzial für die Untersuchung der Impfstoff-spezifische T-Zellen. Nicht nur ermöglicht das Modell einen Rückruf von einem Impfstoff Antwort generiert vor Jahrzehnten, sondern ermöglicht auch die Bewertung der wahre Erinnerung Potenzial in einem Gewebe-spezifischen Kontext15,18,19,21. Roman, spezifische Hauttests, die Antigene auch umfasste der Kandidat Untereinheit TB Impfstoffe enthalten, schlagen neue Möglichkeiten für die Impfstoff-Bewertung mit diesem Modell28,32. Darüber hinaus transkriptomischen Analysen legen nahe, dass eine Zelle – Immunantwort erzeugt in PPD-herausgefordert Haut, die Antwort gefunden in der Mtb ähnelt-infizierten Lunge18.
Während Haut stanzbiopsien auch für eine Zelle Ernte aus der Haut ermöglichen und Raumdaten, verglichen mit SB-Sampling, die Methode ist mehr invasiv und erfordert eine enzymatische oder mechanische Verarbeitung, einzellige Suspensionen33vorzubereiten. Messung der Zytokine und Zelle Marker ist vergleichbar zwischen den beiden Methoden2,10.
Die Saug Blister-Methode hat bereits in vielen Bereichen der medizinischen Forschung neben Dermatologie, entweder allein oder in Kombination mit einer systemischen oder lokalen Haut Herausforderung angewendet. Beispiele hierfür sind Studien zur Sepsis, Epstein - Barr-Virus-verbundene Lymphoproliferative Krankheit, Diabetische Neuropathie, Glukokortikoid Aufnahme Effekte und Studien am Menschen Testen von therapeutischen Antikörpern oder Modelle für T-Zelle-gezielte Therapien10 ,34,35,36,37,38.
Aus therapeutischer Sicht die SB-kutanen Rückruf-Methode bietet einzigartige Vorteile den zentrale T-Zell-Speicher mögliche studieren und -aus beiden biologischen und technischen Standpunkt aus betrachtet-die Haut scheint eine entsprechende Probenahme Fach2, 15,18,19,21. Insbesondere kann im Vergleich zu traditionellen, passive Probenahme des zirkulierenden PBMCs, die SB-kutanen Rückruf-Methode für das Studium der T-Zellen, die nachweislich die Fähigkeit zum Migrieren von den Lymphknoten als Reaktion auf ihre relevanten Antigen, und füllen Sie die lokale Erweiterung und Differenzierung in einem gewebespezifischen in Vivo Kontext15,18,19,21.
Abschließend zeigte das Modell hier für Forscher auf dem Gebiet der menschlichen adaptiven Immunität und T-Zell-targeting Agenten (d. h.in der ansteckenden Krankheit Vaccinology oder Krebs) relevant sein können. Die TST-Modell in diesem Protokoll angewendet ist natürlich von besonderer Bedeutung auf dem Gebiet der TB Impfstoffentwicklung. Das Grundkonzept dieses Modells ist jedoch in anderen Bereichen der Forschung sehr zutreffend.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir würden gerne Mads Radmer Jensen für seine praktische und akademische Beratung bedanken; Lau Lindqvist und Kaare Svejstrup für die Bereitstellung von Fachwissen; Helene Bæk Juel, Jonathan Filskov, Signe T. Schmidt und Solveig W. Harpøth für ihre technische Unterstützung; Das Personal an der Gentofte TB-Ambulanz für ihre Ausbildung in der PPD-Verwaltung; und allen Helfern für die Teilnahme an der Studie. Dieses Projekt wird gefördert durch die Europäische Kommission H2020-Programm [Grant-Nummer TBVAC2020 643381], und wir möchten Konsortialpartner für fruchtbaren Diskussionen danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Gloves for laboratory use | Imtex, Denmark | 1013 | |
| Desinfection spray | Apotek, Denmark | 82% alcohol, with glycerin, for human skin | |
| Alcohol swaps | Mediq, Denmark | 1131892 | |
| PPD RT 23 "SSI" (2 T.U./0.1ml) | AJ Vaccines | ||
| Myjector syringe with fixed needle | Terumo | A236 | 1 ml/29G/12mm |
| Ruler | not relevant | for skin reaction evaluation | |
| Ballpoint pen | not relevant | for skin reaction evaluation | |
| Portable Lung Suction Unit | Laerdal Medical, Denmark | 78000011 | NOTE. Modified for ranges below -40kPa and supplied with pressure gauge (ref. 1031107) by the Technical Dept. , Hvidovre Hospital |
| Negative Pressure Chamber Assembly, unheated with connecting tubing | Electronic Diversities, Finksburg, MD, USA | ||
| Orifice Plate, 47mm, 10mm Hole | Electronic Diversities, Finksburg, MD, USA | ||
| Negative Pressure Instrument Seal Kit | Electronic Diversities, Finksburg, MD, USA | ||
| Negative pressure Chamber Strap | Electronic Diversities, Finksburg, MD, USA | 12 inches | |
| Micropore Surgical tape | 3M | 1533-1 | 2.5cm x 9.1m |
| Cap from 15ml plastic tube | Sarstedt, Germany | 62,547,254 | |
| Tubigrip bandage | Mölnlycke Health Care, Sweden | 1443 | |
| Cosmopor steril adhesive dressing | Hartmann | 9008337 | 7.2 x 5 cm |
| 2ml Syringe Concentric Luer Slip | Becton Dickinson | 300185 | |
| Microlance 23G/30mm needle | Becton Dickinson | 300700 | |
| Safe-Lock microcentrifuge tubes (autoclaved) | Eppendorf | 0030120086 | Autoclaved |
| Minispin plus centrifuge | Eppendorf | 5453000011 | |
| Gibco AIM V Medium | Life Technologies | 12055-091 |
Referenzen
- Kiistala, U. Suction blister device for separation of viable epidermis from dermis. Journal of Investigative Dermatology. 50 (2), 129-137 (1968).
- Akbar, A. N., et al. Investigation of the cutaneous response to recall antigen in humans in vivo. Clinical & Experimental Immunology. 173 (2), 163-172 (2013).
- Hatje, L. K., Richter, C., Blume-Peytavi, U., Kottner, J. Blistering time as a parameter for the strength of dermoepidermal adhesion: a systematic review and meta-analysis. British Journal of Dermatology. 172 (2), 323-330 (2015).
- Smith, T. J., Wilson, M. A., Young, A. J., Montain, S. J. A suction blister model reliably assesses skin barrier restoration and immune response. Journal of Immunological Methods. 417, 124-130 (2015).
- Maranda, E. L., et al. Surgical management of leukoderma after burn: A review. Burns: Journal of the International Society of Burn Injuries. 44 (2), 256-262 (2017).
- Wilhelm, K. P., Wilhelm, D., Bielfeldt, S. Models of wound healing: an emphasis on clinical studiea. Skin Research and Technology: Official Journal of the International Society for Bioengineering and the Skin (ISBS) and the International Society for Digital Imaging of Skin (ISDIS) and the International Society for Skin Imaging (ISSI). 23 (1), 3-12 (2017).
- Maini, A. A., et al. A Comparison of Human Neutrophils Acquired from Four Experimental Models of Inflammation. PLoS ONE. 11 (10), (2016).
- Kenney, R. T., Rangdaeng, S., Scollard, D. M. Skin blister immunocytology. A new method to quantify cellular kinetics in vivo. Journal of Immunological Methods. 97 (1), 101-110 (1987).
- Carvalho, J. C. O., Palero, J. A., Jurna, M. Real-time imaging of suction blistering in human skin using optical coherence tomography. Biomedical Optics Express. 6 (12), 4790-4795 (2015).
- Belson, A., et al. Characterisation of the clinical and activated T cell response to repeat delayed-type hypersensitivity skin challenges in human subjects, with KLH and PPD, as a potential model to test T cell-targeted therapies. Inflammation Research: Official Journal of the European Histamine Research Society ... [et al.]. 65 (5), 389-404 (2016).
- Vukmanovic-Stejic, M., Reed, J. R., Lacy, K. E., Rustin, M. H. A., Akbar, A. N. Mantoux Test as a model for a secondary immune response in humans. Immunology Letters. 107 (2), 93-101 (2006).
- Thakur, A., Pedersen, L. E., Jungersen, G. Immune markers and correlates of protection for vaccine induced immune responses. Vaccine. 30 (33), 4907-4920 (2012).
- CDC. . TB | Fact Sheets - Tuberculin Skin Testing for TB. , (2018).
- Vukmanovic-Stejic, M., et al. Varicella Zoster-Specific CD4+Foxp3+ T Cells Accumulate after Cutaneous Antigen Challenge in Humans. The Journal of Immunology. 190 (3), 977-986 (2013).
- Reed, J. R., et al. Telomere erosion in memory T cells induced by telomerase inhibition at the site of antigenic challenge in vivo. The Journal of Experimental Medicine. 199 (10), 1433-1443 (2004).
- Tatovic, D., Young, P., Kochba, E., Levin, Y., Wong, F. S., Dayan, C. M. Fine-Needle Aspiration Biopsy of the Lymph Node: A Novel Tool for the Monitoring of Immune Responses after Skin Antigen Delivery. The Journal of Immunology. 195 (1), 386-392 (2015).
- Bond, E., et al. Plasmacytoid dendritic cells infiltrate the skin in positive tuberculin skin test indurations. Journal of Investigative Dermatology. 132 (1), 114-123 (2012).
- Bell, L. C. K., et al. In Vivo Molecular Dissection of the Effects of HIV-1 in Active Tuberculosis. PLoS Pathogens. 12 (3), e1005469 (2016).
- Tomlinson, G. S., et al. Transcriptional profiling of innate and adaptive human immune responses to mycobacteria in the tuberculin skin test. European Journal of Immunology. 41 (11), 3253-3260 (2011).
- Nayak, S., Acharjya, B. Mantoux test and its interpretation. Indian Dermatology Online Journal. 3 (1), 2-6 (2012).
- Vukmanovic-Stejic, M., Reed, J. R., Lacy, K. E., Rustin, M. H. A., Akbar, A. N. Mantoux Test as a model for a secondary immune response in humans. Immunology Letters. 107 (2), 93-101 (2006).
- Menzies, D. Interpretation of Repeated Tuberculin Tests. American Journal of Respiratory and Critical Care Medicine. 159 (1), 15-21 (1999).
- Pitzalis, C., et al. Selective migration of the human helper-inducer memory T cell subset: confirmation by in vivo cellular kinetic studies. European Journal of Immunology. 21 (2), 369-376 (1991).
- Kool, J., et al. Suction blister fluid as potential body fluid for biomarker proteins. Proteomics. 7 (20), 3638-3650 (2007).
- Flynn, J. L., Chan, J. Immunology of tuberculosis. Annual Review of Immunology. 19, 93-129 (2001).
- Kagina, B. M. N., et al. Specific T cell frequency and cytokine expression profile do not correlate with protection against tuberculosis after bacillus Calmette-Guérin vaccination of newborns. American Journal of Respiratory and Critical Care Medicine. 182 (8), 1073-1079 (2010).
- García-Basteiro, A. L., Ruhwald, M., Lange, C. Design of tuberculosis vaccine trials under financial constraints. Expert Review of Vaccines. 15 (7), 799-801 (2016).
- Luabeya, A. K. K., et al. First-in-human trial of the post-exposure tuberculosis vaccine H56:IC31 in Mycobacterium tuberculosis infected and non-infected healthy adults. Vaccine. 33 (33), 4130-4140 (2015).
- Tameris, M., et al. The candidate TB vaccine, MVA85A, induces highly durable Th1 responses. PloS One. 9 (2), e87340 (2014).
- Woodworth, J. S., et al. Subunit vaccine H56/CAF01 induces a population of circulating CD4 T cells that traffic into the Mycobacterium tuberculosis-infected lung. Mucosal Immunology. 10 (2), 555-564 (2016).
- Gideon, H. P., et al. Variability in tuberculosis granuloma T cell responses exists, but a balance of pro- and anti-inflammatory cytokines is associated with sterilization. PLoS Pathogens. 11 (1), e1004603 (2015).
- Ruhwald, M., et al. Safety and efficacy of the C-Tb skin test to diagnose Mycobacterium tuberculosis infection, compared with an interferon γ release assay and the tuberculin skin test: a phase 3, double-blind, randomised, controlled trial. The Lancet Respiratory Medicine. 5 (4), 259-268 (2017).
- He, X., de Oliveira, V. L., Keijsers, R., Joosten, I., Koenen, H. J. P. N. Lymphocyte Isolation from Human Skin for Phenotypic Analysis and Ex Vivo Cell Culture. Journal of Visualized Experiments. (110), e52564 (2016).
- Koskela, M., et al. Blister fluid and serum cytokine levels in severe sepsis in humans reflect skin dysfunction. Acta Anaesthesiologica Scandinavica. 61 (1), 53-61 (2017).
- Wada, T., et al. Characterization of skin blister fluids from children with Epstein-Barr virus-associated lymphoproliferative disease. The Journal of Dermatology. 45 (4), 444-449 (2018).
- Andersson, C., Rajala, T., Särkkä, A. Hierarchical models for epidermal nerve fiber data. Statistics in Medicine. 37 (3), 357-374 (2018).
- Ramshanker, N., et al. Effects of Prednisolone on Serum and Tissue Fluid IGF-I Receptor Activation and Post-Receptor Signaling in Humans. The Journal of Clinical Endocrinology & Metabolism. 102 (11), 4031-4040 (2017).
- Bouma, G., et al. CCL20 neutralization by a monoclonal antibody in healthy subjects selectively inhibits recruitment of CCR6+ cells in an experimental suction blister. British Journal of Clinical Pharmacology. 83 (9), 1976-1990 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten