Method Article
Charakterisierung der menschliche Monocyte Teilmengen von Vollblut Flow Cytometry Analysis
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll für die Charakterisierung von Monocyte Teilmengen von Vollblut Durchflusszytometrie. Dazu gehören wie Tor die Teilmengen und bewerten ihren Ausdruck der oberflächenmarker skizziert und geben ein Beispiel für die Beurteilung des Ausdrucks (entzündlich) M1 und M2-Marker (entzündungshemmend).
Zusammenfassung
Monozyten sind wichtige Mitwirkende in verschiedenen entzündlichen Erkrankungen und Veränderungen an diesen Zellen, einschließlich ihrer Teilmenge Proportionen und Funktionen, können pathologische Bedeutung haben. Eine ideale Methode für die Prüfung von Änderungen an Monozyten ist Vollblut-Durchflusszytometrie, da die minimale Handhabung von Proben von dieser Methode Serums Zellaktivierung beschränkt. Jedoch sind viele verschiedene Ansätze unternommen, um die Monocyte Teilmengen führt zum inkonsistenten Identifikation der Teilmengen zwischen Studien Tor. Hier zeigen wir eine Methode mit Vollblut Durchflusszytometrie zu identifizieren und zu charakterisieren, menschliche Monocyte Teilmengen (klassische, zwischen- und nicht-klassischen). Wir skizzieren zur Vorbereitung der Blutproben für Durchflusszytometrie, Tor der Teilmengen (stellen Sie sicher, kontaminierende Zellen entfernt wurden) und Monocyte Teilmenge Ausdruck der oberflächenmarker zu bestimmen – in diesem Beispiel M1 und M2-Marker. Dieses Protokoll ist erweiterbar auf andere Studien, die eine Standardmethode gating erfordern für die Beurteilung der Monocyte Teilmenge Proportionen und Monocyte Teilmenge Ausdruck von anderen funktionellen Markern.
Einleitung
Monozyten sind eine Art von weißen Blutkörperchen, die eine wichtige Rolle bei der Förderung und Entzündung zu lösen. Es gibt drei wichtigsten Teilmengen von Monozyten anerkannte, klassische (~ 85 %), Fortgeschrittene (~ 5 %) und nichtklassischen (~ 10 %) Monozyten, die sich durch ihr Niveau der Cluster der Differenzierung (CD) 14 und CD16 Ausdruck1auszeichnen. Die Proportionen der Monocyte Teilmengen können abweichen, mit dem Vorhandensein von Krankheiten, wie z. B. ein erhöhter Anteil von Zwischenprodukten in verschiedene entzündliche Staaten2,3 einschließlich Herz-und Kreislauferkrankungen, wo das Niveau der Zwischenprodukte ist im Zusammenhang mit klinischen Ereignisse4,5. Darüber hinaus können Erkrankungen, Monozyten auch funktionelle Veränderungen, mit vielen Veränderungen nachweisbar durch einen Unterschied in der Oberfläche Marker Ausdruck6,7unterziehen. Ein solches Beispiel ist Monocyte M1-neigen, eine Zunahme der Marker, die mit M1 Makrophagen, die bei Herz-Kreislauf-Krankheiten, Diabetes, Adipositas und metabolisches Syndrom7,8,9 beobachtet wurde , 10.
Trotz der Popularität der Durchflusszytometrie Monocyte Teilmenge Proportion und Funktion zu beurteilen gibt es eine beträchtliche Variabilität in der Probenvorbereitung und Teilmenge gating zwischen Studien, die es schwierig macht, die Ergebnisse zwischen solchen Studien vergleichen. Wichtig ist, gibt es keinen Konsens in der Abgrenzung der Monocyte Teilmengen, doch ein standardisiertes Vorgehen unbedingt die klinische Bedeutung der Änderungen in Teilmenge Proportionen in verschiedene Krankheiten gegeben. Teil der Schwierigkeit in Anspritzung ergibt sich daraus, die Monozyten zu unterscheiden von der Klassik über die Mittelstufe der nichtklassischen Teilmenge11 und als solches Monozyten existieren unterschiedliche Populationen12, eher als ein kontinuierliches Spektrum . Interessanterweise zeigte Zawada Et Al. , dass verwenden entweder einen rechteckigen oder trapezförmigen Anspritzung der Mittelstufe Teilmenge, sowohl eine höhere mittlere Teilmenge geführt, die ein Herz-Kreislauf-Endpunkt13vorhergesagt. Dies macht deutlich, dass, zumindest für die Berechnung der Proportionen, die zentrale Frage eine konsequente gating Strategie zwischen verschiedenen Proben (Studien), anwendet anstatt zu versuchen, die endgültig zwischen Untergruppen unterscheiden. Während definitive Anspritzung wichtiger sein kann bei der Beurteilung der Funktion, die Veränderung der Marker Ausdruck zwischen Teilmengen ist inkrementelle12,14, und somit wieder, Konsistenz der gating ist vielleicht wichtiger. Als solche ist ein Ziel gating-Methode, die die Monocyte Teilmengen zwischen verschiedenen Proben reproduzierbar Verteilungen erforderlich. Die hier vorgestellte Methode soll Tor Monocyte Teilmengen mit einer klaren Erklärung und Rechtfertigung für die gating-Technik beschäftigt und bewerten die Teilmengen für Surface Marker Ausdruck, wodurch es eine Methode, die Forscher haben erlaubt Vertrauen in die Nutzung dieser Technik bei verschiedene Proben der Beurteilung.
Protokoll
Diese Studie wurde von der WSLHD menschlichen Forschung Ethikkommission (HREC) (Genehmigung AU rot HREC/15/WMEAD/289) genehmigt.
(1) Probenvorbereitung für Vollblut-Durchflusszytometrie
Hinweis: Als menschliches Blut infektiös ist, sollte die Probe-Set-up in ein Biohazard-Haube durchgeführt werden.
- Sammeln Sie die Blutproben von den Teilnehmern in 3 mL Ethylen Diamin Tetra Acetic Acid (EDTA) Röhren.
- Bestimmen Sie die Anzahl der weißen Blutkörperchen (WBC) mit einem Hämatologie-Analysegerät oder Hemocytometer.
- Verdünnen mit Phosphat gepufferte Kochsalzlösung (PBS) (pH ~ 7.4), die Konzentration auf ~ 5 x 10 einzustellen6 WBC/mL.
- Bereiten Sie genügenden master-Mix für die Anzahl der Rohre (z. B. für 14 Röhren, bereiten 16 x master-Mix) durch die Kombination von 16 x Volumen von 50 µL Blut, 0,75 µL anti-CD14-V450, 0,5 µL anti-CD16-APC und 0,625 µL anti-HLA-DR-PerCP. Wirbel und Pipette 51.9 µL Mischung in jedem Röhrchen (Tabelle 1).
Hinweis: Antikörper sollten titriert werden, um festzustellen, optimale Färbung Konzentrationen für die fluoreszierende Antikörper verwendet. - Surface Marker (M1 und M2 oder Isotype Control, Phycoerythrin (PE) gekennzeichnet) hinzufügen Antikörper (Beispiel siehe Tabelle 2) und PE gekennzeichnet Marker für T-Zellen (CD3), B-Zellen (CD19), neutrophile (CD66b) und natürlichen Killer (NK) Zellen (CD56) (Tabelle 3). Wirbel und inkubieren Sie für 30 min, 4 ° C im Dunkeln.
Hinweis: Marker für Lymphozyten, Neutrophilen Granulozyten und NK-Zellen sind nur für die Validierung der gating-Methode enthalten. - 250 µL des kombinierten Erythrozyten Lyse/WBC festlegunglösung, Wirbel sanft sofort hinzufügen und 10 Minuten im Dunkeln bei 4 ° c inkubieren
- Fügen Sie 250 µL PBS und Spin Zellen nach unten, bei 260 X g für 10 min bei Raumtemperatur.
- Entfernen Sie überstand, auszusetzen Sie Zellen in 300 µL 1 % Formaldehyd wieder.
Hinweis: Formaldehyd ist giftig. Nitril-Handschuhe verwenden und verwenden in Abzug. - Lagerung bei 4 ° C, vor Licht geschützt, bis die Analyse durchgeführt wird.
Hinweis: Flow-Analyse wird empfohlen, innerhalb von 48 h der Probenvorbereitung durchgeführt werden.
2. die Durchflusszytometrie
- Überprüfen Sie Flow Cytometer Log um Mitarbeiter der Einrichtung zu gewährleisten haben durchgeführt Qualitätskontrollen.
Hinweis: Zur Gewährleistung der Konsistenz zwischen Analysen, Instrument der Qualitätskontrolle und der Aufrechterhaltung konsistent sind Ziel-Fluoreszenz-Intensitäten mit Perlen Kontrolle empfohlen. - Um das Flow Cytometry Experiment einzurichten, klicken Sie auf "neues Experiment dann"neue Probe"und"neue Röhre"Rohre hinzufügen. Wählen Sie bivariate Grundstücke durch Klicken auf das Symbol aus und verwenden Sie die Dropdown-Menüs die Achse Parameter auswählen. Aufnahme von einem CD16/CD14 Grundstück und ein Grundstück einen Detektor neben Zeit anzeigen zu überwachen, die Übernahme zu gewährleisten.
- Rohr und klicken Sie auf "Importieren". Überprüfen Sie die Geräteeinstellungen Spannung um sicherzustellen, dass die detektorsignale nicht von Waage sind.
- Zellen in der Monocyte-Tor der CD14/CD16 Handlung fallen zu beobachten. Aufnahme-Schwelle auf 5.000 Veranstaltungen für das klassische Monocyte Tor festgelegt und klicken Sie auf "Record".
- Daten für die restlichen Rohre weiter. Nachdem Daten für alle Rohre aufgenommen wurde, exportieren Sie Bewegungsdaten als .fcs Dateien zur Analyse.
Hinweis: Um Genauigkeit zu gewährleisten, sollten einzelne Farbsteuerungen Entschädigung erfasst werden. Eine Entschädigung-Matrix kann berechnet und auf die Daten vor der Analyse für spektrale Spill über15,16Konto angewendet werden.
3. Monocyte Anspritzung
- Öffnen Sie Dateien in der Analysesoftware. Klicken Sie doppelt Rohr Namen und wählen Sie Parameter aus den Dropdown-Menüs zu visualisieren die Zellen auf einem forward Scatter FSC (A) / Höhe FSC(H) Streudiagramm zu übermitteln. Erstellen Sie ein Wams-Ausschluss-Gate durch einen Klick auf das Werkzeugsymbol Polygon Tor und umschließt die Zellen wie in (Bild 1A).
- Wählen Sie die geschlossenen Zellen (durch einen Doppelklick auf die gated Region) und in das neue Display anpassen Feld Dropdown-Menüparameter die Zellen auf einem FSC (A) Anzeige / Side Scatter SSC(A) plot. Klicken Sie auf die rechteckige Tor-Symbol und wählen Sie großzügig die Monocyte Bevölkerung basierend auf den vorderen und seitlichen Scatter-Eigenschaften, die Mehrheit der Lymphozyten, NK-Zellen und Granulozyten (Abbildung 1 b) auszuschließen.
- Wählen Sie die geschlossenen Zellen und auf einem Grundstück von CD14/CD16, Auswahl der Parameter mithilfe der Drop-Down-Menüs anzuzeigen. Klicken Sie auf das Polygon Tor Monozyten anhand ihrer charakteristischen "┐" Form (Abbildung 1) wählen.
- Wählen Sie die geschlossenen Zellen und zeigen Sie die Monozyten auf einem Grundstück von CD16/HLA-DR mithilfe der Drop-Down-Menüs Parameter auswählen. Klicken Sie auf das Polygon-Tor der HLA-DR-positiven Zellen auswählen und schließen alle übrigen NK Zellen und Neutrophilen17 (Abbildung 1).
- Wählen Sie die geschlossenen Zellen und zeigen Sie die HLA-DR-positiven Zellen auf einem CD14/HLA-DR-Grundstück mit Dropdown-Menüs Parameter auswählen. Klicken Sie auf das Polygon-Tor und ein Tor um die HLA-DR High/CD14 niedrigen Zellen auszuschließen (B-Zellen express hohe Konzentrationen von HLA-DR aber nicht CD14) zu zeichnen (Abbildung 1E).
Hinweis: B-Zell-Kontamination auftreten und sollten daher untersucht werden. Wenn die nicht-klassischen Bevölkerung in Figur 1 nicht aus den Zellen auf der linken Seite unterscheidet, dürfte Kontamination. 3.5 Schritt kann übersprungen werden, wenn B-Zellen mit nichtklassischen Monozyten nicht überlappen. - Wählen Sie die geschlossenen Zellen und verwenden Sie Dropdown-Menüs, um sie auf einem Grundstück von CD16/CD14 anzuzeigen. Wählen Sie aus Plotoptionen "Zebra-Plot" Monocyte Teilmenge Tore gezogen werden, um festzustellen, Teilmenge Proportionen (Abb. 1F) ermöglichen.
Hinweis: wenn Zebra Handlung auf die Analyse-Software, Pseudo-Farbe (glatt) nicht verfügbar ist oder konturdiagramm geeignet. - Klicken Sie auf die rechteckige Tor-Symbol und wählen Sie die klassische Monozyten durch zeichnen ein annähernd rechteckigen Tor um die CD14 hoch/CD16 niedrig, klassische Monocyte Bevölkerung. Unter "Anzeigen" wählen Sie "Show mediane" der Median Fluoreszenzintensität für klassische Monozyten angezeigt. Stellen Sie die Luftklappe ein, so dass die Bevölkerung eine gleichmäßige Verteilung von der Median auf der linken und rechten umfasst alle Zellen auf der linken Seite.
- Wählen Sie die mittlere Bevölkerung durch das Zeichnen einer rechteckigen Tor, das die Zellen rechts neben dem klassischen Tor umfasst. Passen Sie die Unterseite des Tores, die nichtklassischen Zellen ausschließen, indem Sie das Tor mit der Unterseite der konzentrischen Kreise, die vollständig innerhalb der klassischen Monocyte-Tor, das sicherstellt, dass der mittlere Teil einen CD14 Ausdruck vergleichbar hat Ausrichten der Einklang mit der aktuellen Nomenklatur klassischer Bevölkerung Haupt.
- Tor der nichtklassischen Teilmenge indem man einen rechteckigen Kasten nach unten von der unteren Kante der Mittelstufe Teilmenge, die Zellen an der Unterseite der Bevölkerung (Abb. 1F) auswählen.
- Unter "Anzeigen" wählen Sie "Show Tor Frequenzen" den Anteil der einzelnen Monocyte-Untergruppen bestimmen.
4. Überprüfung der Gating-Methode
- Um festzustellen, ob potenziell kontaminierende Zelltypen effektiv gated-Out sind, zuerst identifizieren unterschiedliche Zellpopulationen mit Antikörpern gegen T-Zellen (CD3), B-Zellen (CD19), neutrophile (CD66b) und NK-Zellen (CD56) (Abbildung 2).
Hinweis: Hier T Zellen und Neutrophilen sitzen nicht in der Nähe der "┐" Form von Monozyten und werden in Abbildung 1aus angespritzt. - Bestätigen Sie, dass NK-Zellen, in Schritt 3.4 (Abbildung 1 entfernt werden) und B-Zellen im Schritt 3.5 (Abbildung 1E) entfernt sind, wie in Abbildung 3dargestellt. Wenn NK-Zellen oder B-Zellen nicht eingezäunt-Out sind, stellen Sie die Tore.
(5) phänotypische Monocyte Marker Ausdruck
- Jede Teilmenge Monocyte Zellen auswählen. Ändern Sie Drop-Down-Parameter, um ein Histogramm für jeden Monocyte Teilmenge (Abb. 1F) anzeigen von einzelnen Marker und seine passende Isotype (Abbildung 4) zu erstellen.
- Berechnen Sie den Grad des Ausdrucks der einzelnen Marker (Median oder geometrisches Mittel) im Vergleich zu den jeweiligen Isotype-Kontrolle.
Ergebnisse
Die Monocyte gating Strategie und Flow-zytometrie Analyse hier verwendet (Abbildung 1) erfolgreich gated Monocyte Teilmengen und offenbart ihre relativen Proportionen. Die Proportionen (für dieses Beispiel) wurden als 88,1 % Dichtertreffen, 4,33 % Zwischenprodukte und 7,49 % nicht-Dichtertreffen berechnet. Diese Teilmenge Tore waren nicht kontaminiert mit B-Zellen, T-Zellen, neutrophile oder NK-Zellen, die mit Marker CD19, CD3-CD56 und CD66b, bzw. bestätigt wurde. Durch die Beurteilung der relativen Position von anderen Populationen, ist es klar, dass die T-Zellen und Neutrophilen auch außerhalb der Monocyte "┐" Form auf einem Grundstück von CD16/CD14 (Abbildung 2A und 2D) fallen. Jedoch überlappt die NK-Zellen und B-Zell-Populationen mit der nicht-klassischen Monocyte Bevölkerung (Abb. 2 b und 2 C). Die Schritte der gating-Strategie (Abbildung 1 und 1E) bestätigten die NK-Zellen (Abbildung 3A) und B-Zellen (Abb. 3 b) ausschließen. Obwohl die B-Zell-Population einen kleinen Teil der nicht-klassischen Monozyten einschloss, war die Menge vernachlässigbar.
Dass die Teilmengen, die Grad, sie verschiedene oberflächenmarker, M1 drückten, gated (CD64, CD86 und CD120b) und M2 (CD163, CD11b und CD93) bewertet wurde. Die Marker zeigte positiven Ausdruck im Vergleich zu ihren entsprechenden Isotype-Kontrollen, wie durch die Verschiebung der Histogramme (Abbildung 4) zu sehen. Der Median der Marker war größer als die der Isotype Steuerelemente.
Anwendung dieser gating Strategie auf eine Blutprobe, die Aufteilung in vier Röhren, gebeizt und separat, bringt vergleichbare Ergebnisse zwischen Rohren (Tabelle 4) analysiert.
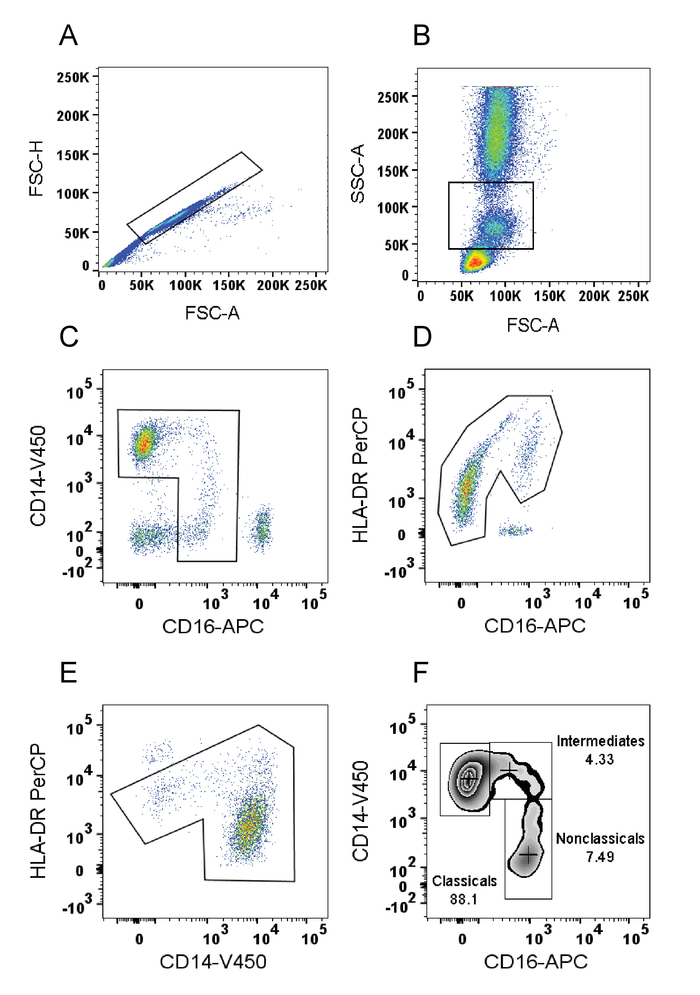
Abbildung 1: Repräsentative Monocyte Anspritzung Strategie im menschlichen Blut. (A) FSC(A) vs. FSC(H) Plot: Gating die Zellen, die eine gleiche Fläche und Höhe haben, so entfernen Klumpen (höhere FSC(A) im Vergleich zu FSC(H)) und Schutt (sehr niedrige FSC) K = 1000. (B) FSC(A) vs. SSC(A) Plot: Breite Auswahl an Monozyten anhand ihrer SSC/FSC-Eigenschaften. (C) CD16 vs. CD14 Plot: Gating um Monozyten Wählen basierend auf ihren charakteristischen "┐" Form. (D) CD16 vs. HLA-DR Plot: Gating auswählen HLA-DR-positiven Zellen und NK-Zellen zu entfernen. (E) CD14 vs. HLA-DR: Gating, B-Zellen (HLA-DR CD14-hoch/niedrig) von den Monozyten auszuschließen. (F) Monozyten verwürfelt auf CD16 vs. CD14 Grundstück an der Monocyte Teilmengen Tor ausgewählt. Bei A-F entspricht Zelldichte mit blau und grün anzeigt, geringe Dichte, rot und Orange zeigt hohen Dichte und Orange Mittelklasse Dichte anzeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.
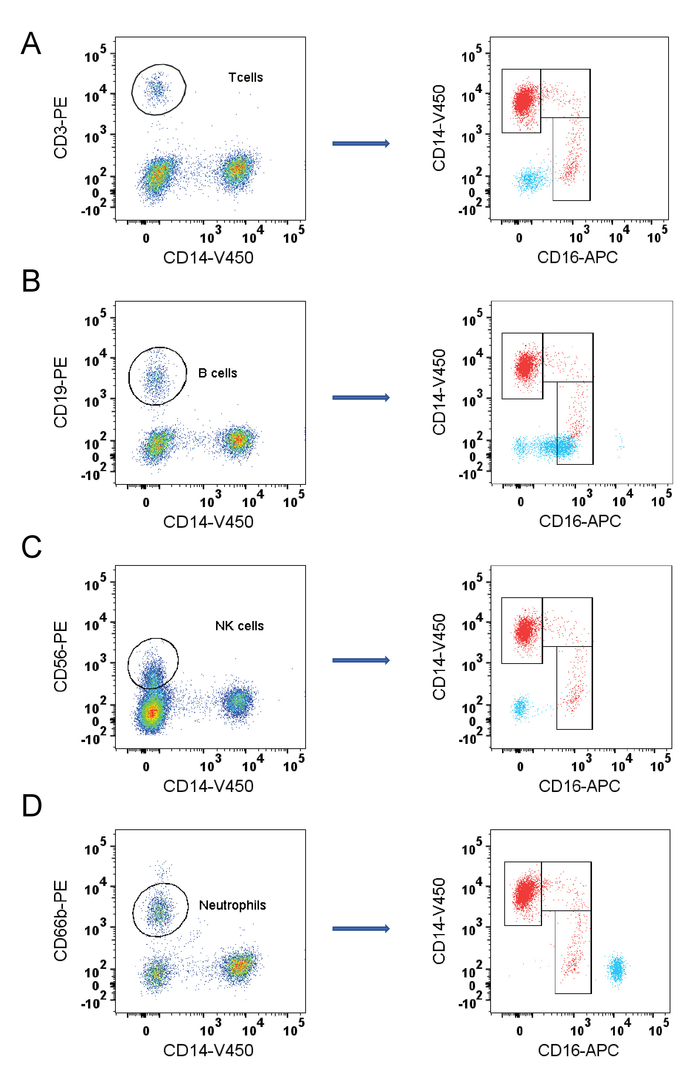
Abbildung 2: Überprüfung der Strategie durch Identifizierung von potenziell kontaminierende Zellen gating. Potenziell kontaminierende Zellen sind durch Markierungen gekennzeichnet (A) T-Zellen (CD3), (B) B-Zellen (CD19), (C) NK-Zellen (CD56) und (D) Neutrophilen (CD66b). Die linken Seitenteile zeigen Identifizierung jeder Bevölkerung nach Anspritzung gemäß Abbildung 1A und 1 b, mit hoher Zelldichte aus Farbe (rot) zu niedrig (blau). Der rechten Seite Tafeln zeigen jede Zellpopulation (blau) überlagert auf dem endgültigen Monocyte CD16/CD14 Grundstück, Nähe dieser Populationen, Monozyten (rot) zu offenbaren. Bitte klicken Sie hier für eine größere Version dieser Figur.
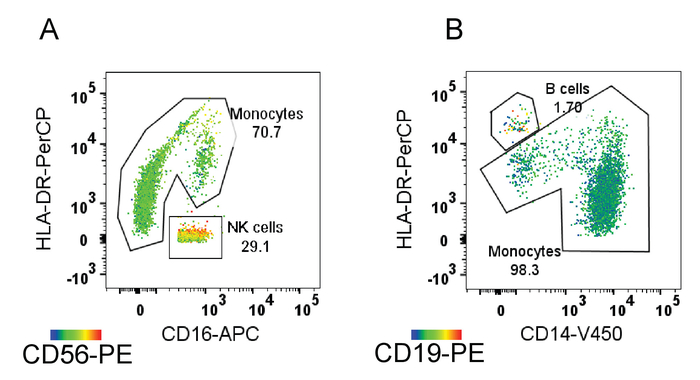
Abbildung 3: Bestätigung, dass gating Schritte kontaminierende Zellen entfernen. Hitze Karten, auf denen des Grades des Ausdrucks von hoch (rot) zu niedrig (blau) von CD56 (A) und (B) CD19. Gating Schritte erfolgreich Zellen mit hohen CD56 auszuschließen (NK-Zellen) und hohe CD19 (B-Zellen). Bitte klicken Sie hier für eine größere Version dieser Figur.
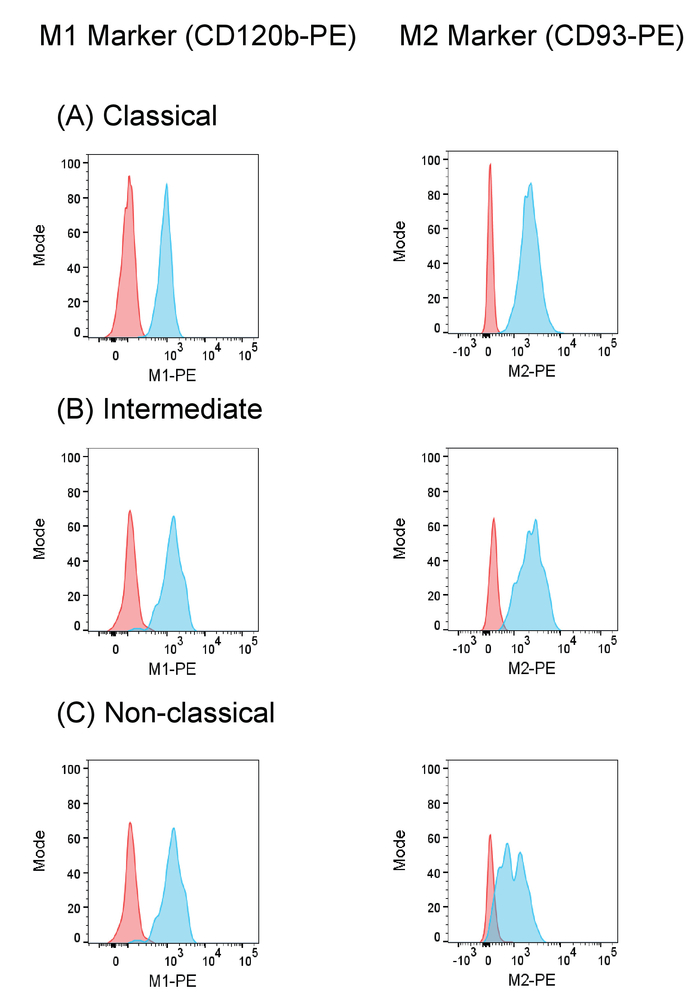
Abbildung 4: Monocyte Ausdruck der M1 (CD120b) und M2 (CD93) Markierungen. Die Histogramme der Monocyte M1 und M2 Marker Ausdruck (blau) zeigt deutliche Verschiebung von der Isotype (rot) für (A) Dichtertreffen, Zwischenprodukte (B) und (C) nicht-Dichtertreffen geglättet. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Antikörper | Volumen (50 µL Blut) | Volumen (16 X) 800 µL Blut |
| CD14 - V450 | 0,75 ΜL | 12 ΜL |
| CD16 - APC | 0,5 ΜL | 8 ΜL |
| HLA-DR-PerCP | 0,625 ΜL | 10 ΜL |
Tabelle 1: Antikörper für die gesamte Durchblutung und master-Mix.
| Rohr | PE-Antikörper | Code | Isotype Match | Lager Konzentration | Arbeiten Volumen |
| 1 | IgG1 | BD (555749) | NA | 1,0 µg/20 µL | 0,625 ΜL |
| 2 | CD163 | BD (556018) | BD IgG1 | 0,125 µg/20 µL | 5 ΜL |
| 3 | CD64 | BD (558592) | BD IgG1 | 0,06 µg/20µL | 10 ΜL |
| 4 | IgG1 | BD (555749) | NA | 1,0 µg/20 µL | 1,25 ΜL |
| 5 | CD86 | BD (555658) | BD IgG1 | 1,0 µg/20 µL | 1,25 ΜL |
| 6 | CD11b | BD (561001) | BD IgG1 | 1,0 µg/20 µL | 1,25 ΜL |
| 7 | IgG2a | F & E (IC003P) | NA | 25 µg/mL | 5 ΜL |
| 8 | CD120b (TNFRII) | F & E (FAB226P) | R & D IgG2a | 25 µg/mL | 5 ΜL |
| 9 | IgG1 | BL (400112) | NA | 0,2 mg/mL | 2.5 ΜL |
| 10 | CD93 | BL (336108) | BL IgG1 | 50 µg/mL | 1,25 ΜL |
Tabelle 2: M1/M2-PE Fluorochrom beschriftet monoklonale Antikörper für die gesamte Durchblutung.
| Rohr | Antikörper | Arbeiten Volumen |
| 11 | CD3 | 5 ΜL |
| 12 | CD19 | 5 ΜL |
| 13 | CD66b | 1,25 ΜL |
| 14 | CD56 | 5 ΜL |
Tabelle 3: PE Fluorochrom beschriftet monoklonale Antikörper für Lymphozyten (T-Zellen, B-Zellen), Neutrophilen Granulozyten und NK-Zellen.
| Rohr | % Klassik | % Intermediate | % Non-classical |
| 1 | 84,3 | 5.11 | 10.1 |
| 2 | 84,2 | 5.05 | 10.5 |
| 3 | 84,3 | 5.03 | 10.7 |
| 4 | 81,6 | 5.03 | 12.1 |
Tabelle 4: Monocyte Teilmenge Proportionen aus einer Blutprobe gebeizt und separat analysiert.
Diskussion
Vollblut-Durchflusszytometrie ist ein idealer Ansatz, Monozyten zu studieren, wie die Zellen unter Bedingungen in der Nähe ihrer physiologischen Mikroumgebung bietet einen Einblick in ihre Rollen Infektionen und entzündlichen Erkrankungen untersucht werden. Darüber hinaus die Verwendung von frischen (d. h. unbearbeitet) Blutproben minimiert die Änderungen oder die Zelle Transformationen, die durch Lagerung oder Handhabung18,19, wie die bekanntermaßen auftreten, mit Einfrieren aufgetaut Monozyten entstehen können 20. schnelle Probenvorbereitung wird empfohlen, da einige Marker hochreguliert sind, wenn die Proben bei Raumtemperatur vor der Verarbeitung19gehalten werden. Die optimalen Konzentrationen von M1 und M2 Markierungen wurden durch Titration bestimmt, und dies sollte für jede neue Antikörper, unspezifischen Bindung zu begrenzen, gleichzeitig sicherstellen, dass der Grad der Verschiebung durch Antigen-Ausdruck wird und durch Mangel an Antikörpern nicht eingeschränkt. Die Entfernung der roten Blutkörperchen und Fixierung der weißen Blutkörperchen mit Lyse-Lösung ist ein wichtiger Schritt in diesem Protokoll als Flow Cytometry21,22das Vorhandensein von roten Blutkörperchen stören kann. Beachten Sie, dass zwar einige Lyse-Lösungen kompatibel mit Nein-Wash beflecken, klarer Populationen sind deutlich in unseren Händen, wenn ein Waschschritt verwendet wird.
Richtige Setup das Durchflusszytometer ist auch wichtig, beim Ausdruck der Monocyte Marker zu vergleichen. Wir empfehlen, dass Forscher konsistent Ziel Fluoreszenz-Intensität von Kontrolle Perlen und Qualitätskontrollen auf dem Instrument führen verwendet werden, führen Sie konsistente Ergebnisse über verschiedene Proben an verschiedenen Tagen zu liefern. Darüber hinaus sind Isotype Steuerelemente zur Unterstützung bei der Interpretation der unspezifischen Hintergrundsignal generiert durch unspezifische Antikörperbindung verwendet. Monozyten haben ein hohes Maß von Fc-Rezeptoren11 und sind daher anfällig für unspezifische Bindung. Der Hinweis das Niveau der unspezifischen Bindung unterscheidet sich für die verschiedenen Untergruppen, und somit die Verwendung eines Isotype-Steuerelements wird wichtig, wenn den Grad der Marker Ausdruck zwischen Teilmengen zu vergleichen.
Ein weiteres wichtiges Kriterium zu berücksichtigen ist die gating Schritte eingesetzt. Einige Studien deuten darauf hin, dass es entscheidend zeichne eine enge Tor um die Monocyte Bevölkerung in FSC(A)/SSC(A) Plotten get rid of die meisten der nicht-monozytären CD16 positive Zellen23,24,25, aber dies kann zum Verlust von einigen Monozyten als nicht-Monocyte Zellen mit Monozyten auf FSC/SSC überschneiden können Grundstücke26. Um andere Blutzellen auszuschließen, die die Monozyten verunreinigen können, ist die Aufnahme einer dritten Monocyte Markierung neben CD14 und CD16, vielmehr wesentlich26,27. Aus diesem Grund HLA-DR wird häufig verwendet, und ist ideal, da es nicht durch NK Zellen oder Neutrophilen17,28zum Ausdruck kommt. Obwohl Lymphozyten (B-Zellen und T-Zellen) HLA-DR Ausdrücken können, unterscheiden sie sich von Monozyten in Bezug auf CD14 Ausdruck. HLA-DR ist eine ideale dritte Markierung, CD86 empfahl auch5,27,29 , aber nicht hier verwendet wurde ist auch ein M1-Marker und somit der Grad des Ausdrucks für Monocyte Teilmengen bewertet wurde.
Validierung der gating-Strategie verwendet ist von entscheidender Bedeutung. Obwohl NK-Zellen mit nicht-Dichtertreffen überlappen, wenn sie nicht28 eingezäunt sindbekannt sind, merken wir, dass B-Zellen auch überschneiden können, mit der nicht-Klassik (Abbildung 2 b); ob dies der Fall in anderen Studien ist möglicherweise abhängig von Fluorochrom Wahl, Gerätekonfiguration, Detektorempfindlichkeit oder sogar den Krankheitszustand geprüft wird. Hier die überlappenden B Zellen zeigten hohe Expression von HLA-DR und wurden nicht durch Auswahl der HLA-DR-positiven Zellen in Abbildung 1, gated. Vielmehr, um B-Zellen zu entfernen verwendet wir ein zusätzliches Grundstück von CD14 / HLA-DR, wo die B-Zellen trennen sich von nicht-Dichtertreffen aufgrund ihrer höheren HLA-DR und niedrige CD14 Ausdruck.
Es gibt auch viele verschiedene Möglichkeiten, in denen die Tore für die Monozyten selbst in der Literatur gezogen wurden; Dazu gehören Quadranten (die Teilmengen werden durch Quadrant Marker getrennt) und rechteckigen oder trapezförmigen Boxen13 (mit Einzelboxen für jede Teilmenge gezogen), die darüber hinaus unterscheiden sich in ihrer Platzierung abgrenzen, wo eine Teilmenge endet und eine andere beginnt. Wahrscheinlich diese Unterschiede reflektieren die Tatsache, dass Monozyten als ein Kontinuum von Zellen, Differenzierung von Klassik zu nichtklassischen, nicht als klar getrennte Populationen existieren. Jedoch da Variationen in Techniken zur Identifizierung von Teilmengen sich auf Unterschiede in den berechneten Monocyte Teilmenge Proportionen führen können, ist es wichtig, dass die gating Methode einigermaßen Objektiv, sondern als subjektiv, weil dadurch machen Sie die Methode, robuster und reproduzierbar. Einige Studien verwenden ein Isotype-Steuerelement für CD16 um die Grenze zwischen der klassischen und Zwischenprodukte Teilmengen30zu bestimmen. Auf der anderen Seite wurde um die Trennung von Zwischenprodukten und nicht Dichtertreffen definieren, vorgeschlagen, dass der Hell-Dunkelgrenze kann vertikal oder schräg, mit der Wahl bis zu den Ermittlern, der Maßgabe, dass es reproduzierbar sein sollte, aber ein rechteckiges Tor wurde empfohlen, um Vergleiche zwischen den Studien13,30,31zu erleichtern. Hier wurde erhöhte Objektivität durch zeichnen die Daten auf einem Grundstück von Zebra und Anwendung objektiver visual Rules gewonnen, weil Zebra Grundstücke eine zusätzliche Visualisierung Cue bieten durch Mischen Farbverlauf in jeweils gleicher Wahrscheinlichkeit bin über eine traditionelle konturdiagramm. Der Rechte Rand der klassischen Teilmenge wurde gezogen, so dass die Bevölkerung gleichmäßig um den Median der Bevölkerung verteilt wurde. Die Trennung zwischen dem Vermittler und nicht Dichtertreffen wurden auch dadurch, dass die Basis der Zwischenprodukte an der Unterseite der konzentrischen Kreise innerhalb der klassischen Bevölkerung ausgerichtet standardisiert (d. h. die mittlere Bevölkerung deutlich hohes Maß an CD14, wie pro die einheitliche Nomenklatur1drückt).
Während einige Studien vorgeschlagen haben die Verwendung von zusätzlichen Markierungen, wie C-C Chemokin-Rezeptor Typ 2 (CCR2) oder 6-Sulfo-LacNAc (SLAN) für den Erhalt der erfolgreiche Enumeration von Monozyten und offenbaren ihre klinische Bedeutung32,33 , in unseren Händen die Ebene des Ausdrucks von vielen Monocyte funktionellen Markern variiert stark zwischen den einzelnen14. Diese Variation kann die Nützlichkeit dieser Marker Teilmengen basierend auf ihren Ausdruck definieren beschränken. Automatisierte rechnergestützte Ansätze wurden auch verwendet, um zu visualisieren und cluster-Monocyte Teilmengen einschließlich visuelle interaktive stochastische Nachbar einbetten (ViSNE), t-verteilten stochastische Nachbar einbetten (tSNE) oder Spanning-Tree-Progression Analyse der Dichte normalisiert Ereignisse (Pik)34,35, die visuelle Darstellung der Zellen basierend auf dem Satz der verwendeten mehrere Marker zur Verfügung stellen können. Während dies zur Erhöhung der Genauigkeit der gating-Strategie in Monocyte Teilmenge Klassifizierung gezeigt wurde, ist es anerkannt, dass ein Nachteil die Anzahl der Antikörper (und entsprechenden Fluorophor Kanäle ist) erforderlich. Seine Nützlichkeit richtet sich nach den Fragen; die zusätzliche Komplexität kann nicht garantiert werden, z. B. in Aufzählung Studien.
Monozyten gated mit unserer Technik zeigen Proportionen im Einklang mit der Literatur und der Ausdruck der oberflächenmarker von drei Teilmengen leicht ermittelt werden. Insgesamt bietet die Technik und Methodik hier erklärt eine standardisierte und unkomplizierte Methode der Monocyte Teilmenge Proportionen auflisten und Bewertung von Surface Marker Ausdruck, die verlängert werden kann, sollen andere Marker sowie, damit Validieren ihre funktionalen Rollen in verschiedenen anderen Bedingungen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Durchflusszytometrie erklang in den Flow Cytometry Core Facility, die vom Westmead Institute for Medical Research, Westmead Research Hub, Cancer Institute New-South.Wales und National Health and Medical Research Council unterstützt wird. Diese Studie wurde unterstützt durch klinische Chemie Forschung und Bildungsfonds.
Materialien
| Name | Company | Catalog Number | Comments |
| BD vacutainer blood collection set | Becton Dickinson | 367286 | |
| BD vacuitainer K2E 5.5 mg plus blood collection tubes -3.0 ml | Becton Dickinson | 7128959 | |
| Phospahate Buffered Saline (PBS) | Lonza | 17-516F | |
| 5ml polystyrene round bottom FACS tube (12 x 75 mm style) | Invitro technologies | 352054 | |
| V450 Mouse Anti-Human CD14 Antibody [MφP9] | BD Biosciences | 560349 | |
| APC Mouse monoclonal Anti-CD16 Antibody [3G8] | Abcam Australia | ab140477 | |
| Per CP Anti-Human HLA-DR Antibody [L243] | BioLegend | 307628 | |
| PE Mouse IgG1 κ Isotype Control [MOPC-21] | BD Biosciences | 555749 | Lot # 4283901 |
| PE Mouse Anti-Human CD163 Antibody [GHI/61] | BD Biosciences | 556018 | Lot # 2335626 |
| PE Mouse Anti-Human CD64 Antibody [10.1] | BD Biosciences | 558592 | Lot # 36768 |
| PE Mouse Anti-Human CD86 Antibody [2331 (FUN-1)] | BD Biosciences | 555658 | Lot # 3109766 |
| PE Mouse Anti-Human CD11b/Mac-1 Antibody [ ICRF44] | BD Biosciences | 561001 | Lot # 3228959 |
| PE Mouse IgG2A Isotype control [20102] | R&D Systems | IC003P | Lot # 1212031 |
| PE Human TNF RII/TNFRSF1B Antibody [22235] | R&D Systems | FAB226P | Lot # 612051 |
| PE Mouse IgG1, κ Isotype Control [MOPC-21] | BioLegend | 400112 | Lot # B220359 |
| PE Anti-human CD93 Antibody [VIMD2] | BioLegend | 336107 | Lot # B143544 |
| PE Mouse Anti-Human CD3 Antibody [SK7] | BD Biosciences | 347347 | Lot # 3010929 |
| PE Mouse Anti-Human CD19 Antibody [HIB19] | BD Biosciences | 561741 | Lot # 2307721 |
| PE Mouse Anti-Human CD56 Antibody [B159] | BD Biosciences | 561903 | Lot # 3011796 |
| PE Anti-human CD66b Antibody [G10F5] | BioLegend | 305105 | Lot # B154037 |
| OptiLyse C | Beckman Coulter | A11895 | |
| Formaldehyde solution 37% | Sigma | F1635 | |
| BD FACSCanto II Flow Cytometer | BD Biosciences | ||
| Automatic haematology analyser, XT-1800i | Sysmex | ||
| Centrifuge GS-6R | Beckman | ||
| Flowjo software v10.0.7 | Tree Star Inc |
Referenzen
- Ziegler-Heitbrock, L., et al. Nomenclature of monocytes and dendritic cells in blood. Blood. 116 (16), e74-e80 (2010).
- Rossol, M., Kraus, S., Pierer, M., Baerwald, C., Wagner, U. The CD14(bright) CD16+ monocyte subset is expanded in rheumatoid arthritis and promotes expansion of the Th17 cell population. Arthritis & Rheumatism. 64 (3), 671-677 (2012).
- Wildgruber, M., et al. The "Intermediate" CD14++CD16+ monocyte subset increases in severe peripheral artery disease in humans. Scientific Reports. 6, 39483 (2016).
- Heine, G. H., et al. Monocyte subpopulations and cardiovascular risk in chronic kidney disease. Nature Review Nephrology. 8 (6), 362-369 (2012).
- Rogacev, K. S., et al. CD14++CD16+ monocytes independently predict cardiovascular events: a cohort study of 951 patients referred for elective coronary angiography. Journal of the American College of Cardiology. 60 (16), 1512-1520 (2012).
- Bories, G., et al. Impaired alternative macrophage differentiation of peripheral blood mononuclear cells from obese subjects. Diabetes and Vascular Disease Research. 9 (3), 189-195 (2012).
- Fadini, G. P., et al. An unbalanced monocyte polarisation in peripheral blood and bone marrow of patients with type 2 diabetes has an impact on microangiopathy. Diabetologia. 56 (8), 1856-1866 (2013).
- Satoh, N., et al. Unbalanced M1/M2 phenotype of peripheral blood monocytes in obese diabetic patients: effect of pioglitazone. Diabetes Care. 33 (1), 7 (2010).
- Chen, X., Devaraj, S. Monocytes from metabolic syndrome subjects exhibit a proinflammatory M1 phenotype. Metabolic Syndrome and Related Disorders. 12 (7), 362-366 (2014).
- Williams, H., et al. Human classical monocytes display unbalanced M1/M2 phenotype with increased atherosclerotic risk and presence of disease. International Angiology. 36 (2), 145-155 (2017).
- Wong, K. L., et al. Gene expression profiling reveals the defining features of the classical, intermediate, and nonclassical human monocyte subsets. Blood. 118 (5), e16-e31 (2011).
- Hijdra, D., Vorselaars, A. D., Grutters, J. C., Claessen, A. M., Rijkers, G. T. Phenotypic characterization of human intermediate monocytes. Frontiers in Immunology. 4, 339 (2013).
- Zawada, A. M., et al. Comparison of two different strategies for human monocyte subsets gating within the large-scale prospective CARE FOR HOMe Study. Cytometry Part A. 87 (8), 750-758 (2015).
- Patel, V. K., Williams, H., Li, S. C. H., Fletcher, J. P., Medbury, H. J. Monocyte inflammatory profile is specific for individuals and associated with altered blood lipid levels. Atherosclerosis. 263, 15-23 (2017).
- Bayer, J., Grunwald, D., Lambert, C., Mayol, J. F., Maynadie, M. Thematic workshop on fluorescence compensation settings in multicolor flow cytometry. Cytometry Part B: Clinical Cytometry. 72 (1), 8-13 (2007).
- Szaloki, G., Goda, K. Compensation in multicolor flow cytometry. Cytometry Part A. 87 (11), 982-985 (2015).
- Abeles, R. D., et al. CD14, CD16 and HLA-DR reliably identifies human monocytes and their subsets in the context of pathologically reduced HLA-DR expression by CD14(hi) /CD16(neg) monocytes: Expansion of CD14(hi) /CD16(pos) and contraction of CD14(lo) /CD16(pos) monocytes in acute liver failure. Cytometry Part A. 81 (10), 823-834 (2012).
- Mukherjee, R., et al. Non-Classical monocytes display inflammatory features: Validation in Sepsis and Systemic Lupus Erythematous. Scientific Reports. 5, 13886 (2015).
- Lundahl, J., Halldén, G., Hallgren, M., Sköld, C. M., Hed, J. Altered expression of CD11b/CD18 and CD62L on human monocytes after cell preparation procedures. Journal of Immunological Methods. 180 (1), 93-100 (1995).
- Appleby, L. J., et al. Sources of heterogeneity in human monocyte subsets. Immunology Letters. 152 (1), 32-41 (2013).
- Dagur, P. K., McCoy, J. P., Robinson, J. P., et al. Collection, Storage, and Preparation of Human Blood Cells. Current protocols in cytometry. 73, (2015).
- Einwallner, E., et al. Lysis matters: Red cell lysis with FACS Lyse affects the flow cytometric enumeration of circulating leukemic blasts. Journal of Immunological Methods. 390 (1), 127-132 (2013).
- Tsujioka, H., et al. Impact of Heterogeneity of Human Peripheral Blood Monocyte Subsets on Myocardial Salvage in Patients With Primary Acute Myocardial Infarction. Journal of the American College of Cardiology. 54 (2), 130-138 (2009).
- Autissier, P., Soulas, C., Burdo, T. H., Williams, K. C. Immunophenotyping of lymphocyte, monocyte and dendritic cell subsets in normal rhesus macaques by 12-color flow cytometry: Clarification on DC heterogeneity. Journal of Immunological Methods. 360 (1), 119-128 (2010).
- Hristov, M., Schmitz, S., Nauwelaers, F., Weber, C. A flow cytometric protocol for enumeration of endothelial progenitor cells and monocyte subsets in human blood. Journal of Immunological Methods. 381 (1-2), 9-13 (2012).
- Zawada, A. M., et al. Monocyte heterogeneity in human cardiovascular disease. Immunobiology. 217 (12), 1273-1284 (2012).
- Zawada, A. M., et al. SuperSAGE evidence for CD14++CD16+ monocytes as a third monocyte subset. Blood. 118 (12), e50-e61 (2011).
- Heimbeck, I., et al. Standardized single-platform assay for human monocyte subpopulations: Lower CD14+CD16++ monocytes in females. Cytometry Part A. 77 (9), 823-830 (2010).
- Rogacev, K. S., et al. Monocyte heterogeneity in obesity and subclinical atherosclerosis. European Heart Journal. 31 (3), 369-376 (2010).
- Ziegler-Heitbrock, L., Hofer, T. P. J. Toward a Refined Definition of Monocyte Subsets. Frontiers in Immunology. 4, 23 (2013).
- Weber, C., et al. Role and analysis of monocyte subsets in cardiovascular disease. Joint consensus document of the European Society of Cardiology (ESC) Working Groups "Atherosclerosis & Vascular Biology" and "Thrombosis". Thromb Haemost. 116 (4), 626-637 (2016).
- Shantsila, E., et al. Immunophenotypic characterization of human monocyte subsets: possible implications for cardiovascular disease pathophysiology. Journal of Thrombosis and Haemostasis. 9 (5), 1056-1066 (2011).
- Hofer, T. P., et al. slan-defined subsets of CD16-positive monocytes: impact of granulomatous inflammation and M-CSF receptor mutation. Blood. 126 (24), 2601-2610 (2015).
- Qiu, P., et al. Extracting a cellular hierarchy from high-dimensional cytometry data with SPADE. Nature Biotechnology. 29, 886 (2011).
- Thomas, G. D., et al. Human Blood Monocyte Subsets: A New Gating Strategy Defined Using Cell Surface Markers Identified by Mass Cytometry. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (8), 1548-1558 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten