Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein platebasierter Cytotoxicity Assay zur Bewertung der Rate Placental Natural Killer Cell Cytolytic Funktion
In diesem Artikel
Zusammenfassung
Hier stellen wir eine detaillierte Methodik zur Verfügung, um die zytotoxische Funktion natürlicher Killerzellen von den Plazenta durch einen farbimetrischen Plattentat zu isolieren und zu bewerten. Das reduzierte Mutterperfusionsdruckrattenmodell der Plazenta-Ischämie wurde ausgewählt, um die antikörpervermittelte Isolierung und Beurteilung der zytotoxischen Funktion natürlicher Killerzellen zu demonstrieren.
Zusammenfassung
Es ist allgemein bekannt, dass dezidale Naturkiller (NK) eine entscheidende Rolle bei der Entstehung und Aufrechterhaltung der normalen Schwangerschaft spielen. Neuere Studien haben gezeigt, dass sich bei Frauen, die an negativen Schwangerschaftskomplikationen wie wiederkehrenden Fehlgeburten und Präeklampsie leiden, eine veränderte Population von zirkulierenden und dezidalen NK-Zellen verändert. Studien unserer Gruppe haben gezeigt, dass Bluthochdruck in der Schwangerschaft mit einer erhöhten Population von aktivierten NK-Zellen in der Plazenta auf der Grundlage der Expression von Oberflächenaktivierungsmarkern verbunden ist. Dieses Manuskript liefert ein detailliertes Protokoll, um die zytotoxische Funktion von NK-Zellen zu beurteilen, die von Placentas in einem präeklampsia-ähnlichen Tiermodell der chirurgisch induzierten Plazentämie isoliert sind. Die folgenden Schritte werden detailliert beschrieben: Generierung von Einzelzellenaufhängung, NK-Zell-Isolierung, Ex-vivo-Stimulation, Effektor: Zielzellenkultur und der Zytotoxizitäts-Test.
Einleitung
Die Präeklampsie ist eine hypertensive Störung der Schwangerschaft, die durch fetale Wachstumseinschränkung, End-Organschäden und chronische Immunaktivierung gekennzeichnet ist. Die chronische Immunaktivierung bei Frauen mit Präeklampsie führt zu vermehrten zirkulierenden und plazentalen entzündlichen Zytokinen, einem Ungleichgewicht in CD4+ T-Zellen-Populationen und einer erhöhten Population vonaktivierten Naturkillerzellen (NK) 1. Studien, die kürzlich in unserem Labor veröffentlicht wurden, zeigen eine Rolle für NK-Zellen bei der Entstehung einiger der Pathophysiologie, die mit Präeklampsie im Rattenmodell "Reduced UUPP" (RUPP) der Präeklampsie in Verbindung gebracht wird. Mit Hilfe der Strömungszytometrie wurde eine erhöhte Population von aktivierten NK-Zellen im Kreislauf und Placentas von RUPP-Ratten im Vergleich zu normalen schwangeren (NP) Ratten beobachtet.
Um die Strömungszytometrie-Beobachtungen zu bestätigen, wurden funktionelle Studien durchgeführt, um die zytotoxische Aktivität von NK-Zellen zu beurteilen, die von den Plazenta von NP und RUPP-Ratten isoliert wurden. Es gibt mehrere Methoden zur Beurteilung der zytotoxischen Funktion von zytotoxischen CD8+ T-Zellen und NK-Zellen. Der Goldstandard für die funktionelle zytotoxische Analyse ist der Chrom-Release-Test3. Weitere entwickelte Protokolle,die verwendet werden, sind die Fließzytometrie 4, die Bildcytometrie 5, die Kalkein-Version6und zuletzt die Biolumineszenz7. Dieses Video wird ein detailliertes Protokoll über die Verwendung des gut etablierten Laktat-Dehydrierungs-Tests (LDH) zur Messung der zytotoxischen Funktion von NK-Zellen mit einem kommerziell erhältlichen LDH-Zytotoxizitäts-Assay-Kit liefern.
Protokoll
Alle Protokolle wurden vom Institutional Animal Care and Use Committee der University of Mississippi Medical Center genehmigt. Die Pflege und der Umgang mit den Tieren entsprachen den Nationalen Gesundheitsrichtlinien für die ethische Tierbehandlung.
1. Lymphozyte Cell Isolation von Placentas
- Entfernen Sie eine Plazenta aus der Ratte Gebärmutter (Gestation Tag 19) und legen Sie in 10 mL eiskalte PBS8.
- Legen Sie eine Plazenta auf einen 100 μm-Filter und sitzen Sie in einer Petrischale mit 13,5 ml RPMI und 1,5 ml FBS (Gesamtvolumen beträgt 15 mL). Verwenden Sie die flache Seite eines Spritzenplums, um die Plazenta durch den Filter in die Petrischale zu schieben.
- Bereiten Sie drei 15 ml Kegelröhren für jedes Gewebe vor. Fügen Sie jedem Rohr 3 ml Dichte-Gradientenmedium (siehe Materialtafel) hinzu, dann überlagern Sie sorgfältig 5 ml homogenisierte Plazenta in jedes Rohr.
- Zentrifuge für 25 min bei 300 x g bei Raumtemperatur (RT) ohne Bremse. Sammeln Sie die dünne weiße Puffschicht mit einer Transferpipette.
NOTE: Nach der Zentrifugation sind 3 Schichten sichtbar, oben die rote RPMI, die weiße Puffschicht in der Mitte und die klare Dichte der mittleren Schicht unten. Verwenden Sie eine Transferpipette, um die weiße Puffschicht aus dem Rohr zu ziehen. Kombinieren Sie Puffenschicht aus allen Rohren der gleichen Plazenta in 1 Schlauch. - Fügen Sie 10 ml RPMI zu kombinierten Puff-Ebenen hinzu. Zentrifuge für 10 min, 300 x g,bei 4 ° C und Abwerfen supernatant.
2. Isolierung von natürlichen Killerzellen
- Resuspend Zellpellet in 50 μL eiskalter PBS
- Fügen Sie dem Herstellerprotokoll einen biotinbeschriebenen CD3-Antikörper hinzu und mischen Sie sich gut mit einer Pipette. Das Rohr in einen Röhrendreher legen und 20 min bei 4 ° C inkubieren.
- 1 ml RPMI, Zentrifuge für 10 min bei 400 x g und 4 ° C, und abwerfen supernatant.
- Resuspend Pellets in 1 ml RPMI und kombinieren Sie mit 150 μL Magnetperlen in einem 1,5 ml Mikrozentrifugenrohr. Das Mikrozentrifugenrohr in einen Röhrenrohrator legen und bei 4 ° C 30 Minuten inkubieren.
NOTE: Ziehen Sie zu diesem Zeitpunkt den Release-Puffer aus und lassen Sie RT im Biosicherheitsschrank erreichen. - Legen Sie die Rohre 1 min in den Magneten. Sammeln Sie supernatant und speichern Sie CD3-Zellpopulation in einem 15 ml Rohr auf Eis.
NOTE: Das ist die CD3- Population der Zellen. - Das Rohr aus dem Magneten nehmen und 1 ml RPMI hinzufügen. Mit einer Pipette 5-mal Zellen und Perlen vermischen.
- Wiederholen Sie Schritt 2,5.
- Zentrifuge die CD3- Zellpopulation 10 min bei 400 x g und 4 ° C und werfen Supernatant ab. Wiederbelebung des Zellpellets in 50 μL eiskalter PBS
- Fügen Sie CD161a einen Antikörper mit biotinbezeichneter CD161a zu CD3- Zellen nach dem Herstellerprotokoll hinzu und mischen Sie gut. Schlauch in einen Röhrendreher geben und 20 min bei 4 ° C inkubieren.
- 1 ml RPMI, Zentrifuge für 10 min bei 400 x g und 4 ° C, und abwerfen supernatant. Resuspend Pellets in 1 ml RPMI und kombinieren Sie mit 150 μL Magnetperlen in einem 1,5 ml Mikrozentrifugenrohr.
- Mikrozentrifugenrohr in einen Röhrenrohrator geben und bei 4 ° C 30 Minuten inkubieren.
- Legen Sie die Rohre 1 min in einen Magneten. Sammeln Sie supernatant und werfen Sie CD3-/CD161a- Zellen ab.
- Entfernen Sie die Röhre vom Magneten und fügen Sie 1 ml RPMI hinzu. Mit einer Pipette 5-mal Zellen und Perlen vermischen.
- Wiederholen Sie Schritt 2.12.
- Entfernen Sie Mikrozentrifugenröhren aus dem Magneten und fügen Sie 1 ml RT Release-Puffer hinzu. Schlauchtrohr auf Röhrendreher legen und beim Inkubieren für 15 Minuten bei RT drehen.
- Rohren 1 min in Magnet legen. Übernatant in einem neuen 15 ml konischen Rohr auf Eis sammeln.
NOTE: Das ist die Population der NK-Zellen. - Entfernen Sie die Röhre vom Magneten und fügen Sie 1 ml RT RPMI hinzu. Zellen und Perlen 5-mal mit Pipette vermischen.
- Wiederholen Sie den Schritt 2.16, indem Sie Supernatant in der gleichen Röhre. Gut mischen und eine 20 μL-Probe nehmen, um Zellen zu zählen
NOTE: Halten Sie die Röhre auf Eis. - Zentrifuge CD3-/CD161a+ Zellen für 10 min, 400 x g bei 4 ° C, dann supernatant entfernen. Die Zellen in RPMI (10% FBS, 1% Pen/Strep, 2 ng/mL IL-2) und Saatgut mit einer Konzentration von 3 x 10 5 Cells/in einer 6-Well-Platte in 2,5 mL NK-Zell-Aktivierungsmedien wiederverwenden. Inkubaten Sie Zellen für 48 h bei 37 ° C, 5% CO2 in einem befeuchteten Inkubator.
3. Zytotoxizität Assay: Rückruf von NK-Zellen oder YAC1 aus Kultur oder Passing Cells
NOTE: Alle Schritte müssen unter der Haube durchgeführt werden. Alle Zellrohre müssen immer auf Eis gehalten werden.
- Verwenden Sie einen gläserologischen Pipet, um YAC1-Zellen und Medien aus der Flasche zu sammeln, in einem 50-ML-Rohr auf Eis zu legen und gut zu mischen. Nehmen Sie 20 μL, um Zellen zu zählen.
- Die YAC1-Zellen 10 min bei 300 x g und 4 ° C ausspinnen. Zählen Sie Zellen, während diese sich drehen.
- In einer 6-Well-Platte der NK-Zelle wird Trypsin/EDTA zu jedem Brunnen angebracht. Tippen Sie auf die Platte und legen Sie in Inkubator.
- Nachdem die Zellen mit trypsin/EDTA für ~ 5 min bei 37 ° C inkubiert haben, kratzen Sie die Plate/Flasche mit einem sterilen Plattenschrott. Fügen Sie jedem Brunnen 1 mL NK Cell Media hinzu.
- Zellen und Medien mit serologischem Pipet sammeln und in einem 15 mL Zentrifugenrohr sammeln. Nehmen Sie 20 μL, um Zellen zu zählen.
- Die NK-Zellen 10 min, 400 x g bei 4 ° C ausdrehen. Zählen Sie die Zellprobe aus Schritt 3.5 während dieser Zentrifugation.
NOTE: Schauen Sie sich die Kulturplatten unter einem Mikroskop an, bevor Sie sie ablegen, um sicherzustellen, dass keine Zellen mehr an den Boden der Brunnen befestigt sind. Da das Experiment NK-Zellen und YAC1-Zellen verwendet, sollten Sie jede einzelne einzeln zählen. - Zählen Sie Zellen und übertragen Sie sich in den Konzentrationen, die in Optimierungsversuchen ermittelt werden, um die entsprechende Anzahl von Ziel-und Effektionsverhältnissen zu testen. Dies wird durch eine erneute Aussetzung des Pellets in den entsprechenden Medien erreicht, um die folgenden Zellkonzentrationen zu erreichen: YAC1 bei 4 x 105 cells/mL und NK-Zellen bei 2 x 107 cells/mL.
4. Cytotoxicity Assay: Assay-Protokoll
- Verwenden Sie eine runde Unterseite, Kultur behandelt 96-Well-Platte, um die Platte, wie in Tabelle 1vorgeschlagen. Diese Tabelle zeigt die experimentellen Bedienelemente und 3 Sätze von NK-Experimentierkolonnen. Diese kann auf insgesamt 10 NK-Versuchssäulen in einer 96-Well-Platte erweitert werden.
- Zentrifugen Sie die Assay-Platte mit 250 x g für 4 min, um sicher zu sein, dass die Effektivität und die Zielzellen in Kontakt sind. Inkubieren Sie die 96-Brunnenplatte für 5 Stunden in einem befeuchteten Kammerinkubator bei 37 ° C, 5% CO2 , um einen umfassenden Kontakt zwischen Ziel-und Effektorzellen und Zielzell-Lyse durch Effektorzellen zu erreichen.
NOTE: Das Protokoll kann hier pausiert werden. - 45 Minuten vor der Ernte von Supernatanten, 10 μL von 10x Lysis Lösung zu den Target-Cell Maximum LDH Release Brunnen (Wells 1E, 1F, 1G und 1H) hinzufügen und die Platte wieder in die befeuchte Kammer legen.
- Nach Abschluss der Inkubationszeit wird die Platte mit 250 x g für 4 min zentrifuge. Mit einem Multichannel-Pipettor 50 μL-Aliquots aus allen Brunnen auf eine frische 96-well-Flachboden-Assay-Platte übertragen.
NOTE: Berühren Sie den Boden der Brunnen nicht, damit die Zellen nicht in die frische Assay-Platte übertragen werden. Verwenden Sie nicht eine kultivierte, behandelte Platte als frische Teller. -
Machen Sie Assay Reagent.
- Nachdem der Assay-Buffer die Raumtemperatur erreicht hat, fügen Sie 12 ml Assay-Buffer zu einer Substrat-Mabm-Flasche hinzu. Umkreinnend und sanft schütteln, bis sich vollständig aufgelöst. 1 Flasche reicht für zwei 96-Brunnenplatten.
NOTE: Assay-Buffer sollte beim Auftauen vor Licht geschützt werden. Mischen Sie sofort vor der Verwendung.
- Nachdem der Assay-Buffer die Raumtemperatur erreicht hat, fügen Sie 12 ml Assay-Buffer zu einer Substrat-Mabm-Flasche hinzu. Umkreinnend und sanft schütteln, bis sich vollständig aufgelöst. 1 Flasche reicht für zwei 96-Brunnenplatten.
- Fügen Sie 50 μL Assay Reagent zu allen Brunnen in der Assay-Platte aus Schritt 4.6 hinzu. Die Platte mit Folie bedecken, um sie vor Licht zu schützen und bei Raumtemperatur 30 Minuten inkubieren.
NOTE: Neu hergestellte Assay-Reagent sollte in einem Gefrierschrank gelagert werden. Reagent ist gut für etwa 8 Wochen. - Fügen Sie jedem Brunnen 50 μL Stop-Lösung hinzu. Lesen Sie die Platte innerhalb von 1 Stunde nach dem Hinzufügen von Stop-Lösung und notieren Sie die Absorbierung auf 490 nm. Die repräsentativen Daten werden in Tabelle 2angezeigt.
5. Berechnung der Ergebnisse
- Berechnen Sie den durchschnittlichen Absorbtionswert aus den Kulturmittelbodenturbrunnen und ziehen Sie von allen Absorbtionswerten für experimentelle, zielgerichtete Remente-LDH-Relegeburten und Effektzellen-Spontaneous LDH-Release-Brunnen ab.
- Berechnen Sie die durchschnittlichen Absorbtionswerte für die Volumenkorrektur-Kontrollbrunnen und ziehen Sie sich von den Absorbtionswerten ab, die für die Target Cell Maximum LDH Release Control Brunnen erworben wurden.
- Verwenden Sie die korrigierten Werte aus den Schritten 5.1 und 5.2 in der folgenden Formel, um die Prozent-Zytotoxizität für jeden Effektor zu berechnen: Gut anvisieren.
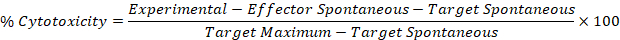
Ergebnisse
Die von NP-und RUPP-Ratten gewonnenen transzentalen NK-Zellen wurden für 5 Stunden mit Zielzellen in ihren jeweiligen Medien im Verhältnis 50 (NK: Ziel) inkubiert. Absorbance wurde mit 490 nm aufgezeichnet und die Rohdaten werden in Tabelle 2angezeigt. Die durchschnittliche Absorption des Kulturmittel-Rückgrundes und der Volumenkorrektur der Kontrollbrunnen wurde berechnet. Diese Durchschnittswerte wurden von den entsprechenden Brunnen abgezogen, die im Herstellerprotokoll angegeben sind und sind in <...
Diskussion
Es gibt eine Reihe wichtiger Schlüsselangaben, die für optimale Ergebnisse zu berücksichtigen sind. Die Sterilität der verwendeten Zellen ist sehr wichtig. Nach der Sammlung der Plazenta ist es wichtig, dass die Vorbereitung und Isolierung der NK-Zellen unter sterilen Bedingungen in einem Biosicherheitsschrank durchgeführt wird. Da alle Zellen LDH bei Zellschäden freisetzen, sollte man außerdem darauf achten, dass die NK-Zellen nach der Isolation und während des Ko-Kulturprozesses eine hohe Lebensfähigkeit der N...
Offenlegungen
Keine finanziellen oder sonstigen Interessenkonflikte werden von den Autoren erklärt.
Danksagungen
Diese Arbeit wurde unterstützt vom National Heart Lung and Blood Institute der National Institutes of Health im Rahmen des Stipendiums R00HL130456, dem National Institute of General Medical Sciences der National Institutes of Health unter dem Preis P20GM104357, und von der Mississippi INBRE, finanziert durch einen Institutional Development Award (IDeA) von den National Institutes of General Medical Sciences der National Institutes of Health unter der Fördernummer P20GM103476. Der Inhalt liegt allein in der Verantwortung der Autoren und vertritt nicht notwendigerweise die offiziellen Ansichten der Nationalen Gesundheitsinstitute.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 mL Eppendorf tube | Fisher | 5408129 | |
| 100 µL Filter | Fisher | 22363549 | Nylon Mesh |
| 15 mL conical tube | Fisher | 0553859A | |
| 3 mL syringe | Fisher | 14823436 | |
| 50 mL conical tube | Fisher | 7203510 | |
| 6-well cell culture plate | Corning | 720083 | |
| 96-well Tissue Culture Plate | CELLTREAT | 229190 | Sterile, Round Bottom |
| AOPI | Nexcelom | CS201065ML | |
| Cell scraper | Fisher | 8100241 | |
| Cellometer Disposable Counting Chambers | Nexcelom | CHT4-SD100 | |
| Cellometer Vision Image Cytometer | Nexcelom | N/A | |
| Cytotox 96 Non-Radioactive Cytotoxicity Assay Kit | Promega | G1780 | |
| Dynabeads Flowcomp Flexi Kit | Invitrogen | 11061D | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| EDTA | Sigma Aldrich | EDS-100G | |
| FBS | Atlanta Biologicals | S11150H | |
| Flow Cytometry Tube | Corning | 352008 | |
| Lymphoprep | Fisher | NC0460539 | Density gradient medium; 4 x 250 mL |
| PBS | Fisher | SH3025801 | 10 x 500 mL |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Petri dishes | Fisher | 9720500 | Without Pad |
| Purified Mouse anti-Rat CD161a | BD Biosciences | 555006 | |
| Purified Mouse anti-Rat CD3 | BD Biosciences | 554829 | |
| Recombinant Rat IL-2 | R&D Systems | 502-RL | |
| RPMI | Gibco | 11875135 | 1640 Medium |
| T25 flask | Corning | 430639 | |
| Trypsin | ThermoFisher | 15090046 | |
| YAC-1 cell | ATCC | TIB-160 |
Referenzen
- Cornelius, D. C., Cottrell, J., Amaral, L. M., LaMarca, B. Inflammatory Mediators: A causal link to hypertension during pregnancy- Studies in Preeclampsia. British Journal of Pharmacology. , (2018).
- Elfarra, J., et al. Natural killer cells mediate pathophysiology in response to reduced uterine perfusion pressure. Clinical Science. 131 (23), 2753-2762 (2017).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14 (2), 181-196 (1968).
- Kim, G. G., Donnenberg, V. S., Donnenberg, A. D., Gooding, W., Whiteside, T. L. A novel multiparametric flow cytometry-based cytotoxicity assay simultaneously immunophenotypes effector cells: comparisons to a 4 h 51Cr-release assay. Journal of Immunological Methods. 325 (1-2), 51-66 (2007).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), 0141074 (2015).
- Neri, S., Mariani, E., Meneghetti, A., Cattini, L., Facchini, A. Calcein-acetyoxymethyl cytotoxicity assay: standardization of a method allowing additional analyses on recovered effector cells and supernatants. Clinical and Diagnostic Laboratory Immunology. 8 (6), 1131-1135 (2001).
- Karimi, M. A., et al. Measuring cytotoxicity by bioluminescence imaging outperforms the standard chromium-51 release assay. PLoS One. 9 (2), 89357 (2014).
- Caporossi, C., Nogueira, P. L., Marques, J. C., Assis, R. M., Aguilar-Nascimento, J. E. Validation of the gastroschisis experimental model and the influence of the mother's diet enriched with glutamine in the fetal morphology. Acta Cirúrgica Brasileira. 29 (3), 158-165 (2014).
- Lv, L. H., et al. Functional distinction of rat liver natural killer cells from spleen natural killer cells under normal and acidic conditions in vitro. Hepatobiliary and Pancreatic Diseases International. 11 (3), 285-293 (2012).
- Flieger, D., et al. A novel non-radioactive cellular cytotoxicity test based on the differential assessment of living and killed target and effector cells. Journal of Immunological Methods. 180 (1), 1-13 (1995).
- Jang, Y. Y., et al. An improved flow cytometry-based natural killer cytotoxicity assay involving calcein AM staining of effector cells. Annals of Clinical Laboratory Science. 42 (1), 42-49 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten