Method Article
Technischer Aspekt der automatisierten Synthese und Echtzeit-Kinetik-Evaluierung von [11C]SNAP-7941
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll zur vollautomatischen Radiobeschriftung von [11C]SNAP-7941 und zur Analyse der Echtzeitkinetik dieses PET-Tracers auf P-gp-extierende und nicht-extierende Zellen dar.
Zusammenfassung
Die Positronenemissionstomographie (PET) ist eine wesentliche molekulare Bildgebungstechnik, die Einblicke in Wege und die Verwendung gezielter Radioligande für In-vivo-Untersuchungen bietet. Innerhalb dieses Protokolls wird eine robuste und zuverlässige ferngesteuerte Radiosynthese von [11C]SNAP-7941, einem Antagonisten des Melanin-konzentrierenden Hormonrezeptors 1, beschrieben. Die Radiosynthese beginnt mit cyclotron produziertem[11C]CO2, das anschließend durch einen Gasphasenübergang zu [11C]CH3OTf weiter umgesetzt wird. Dann wird dieses reaktive Zwischenprodukt in die Vorläuferlösung eingeführt und bildet den jeweiligen Radiotracer. Die chemische sowie die radiochemische Reinheit werden mittels RP-HPLC bestimmt, die routinemäßig im radiopharmazeutischen Qualitätskontrollprozess eingesetzt werden. Zusätzlich wird die Molaktivität berechnet, da sie eine Notwendigkeit für die folgenden kinetinen Echtzeituntersuchungen ist. Darüber hinaus wird [11C]SNAP-7941 auf MDCKII-WT- und MDCKII-hMDR1-Zellen angewendet, um die Auswirkungen der P-Glykoprotein-Expression (P-gp) auf die Zellakkumulation zu bewerten. Aus diesem Grund wird die P-gp-extierende Zelllinie (MDCKII-hMDR1) entweder ohne oder mit Blockierung vor Experimenten mittels des P-gp-Substrats ()-verapamil verwendet und die Ergebnisse werden mit denen verglichen, die für die Wildtypzellen beobachtet wurden. Der gesamte experimentelle Ansatz zeigt, wie wichtig ein präzises Zeitmanagement ist, das für jede präklinische und klinische Studie mit PET-Tracern, die mit kurzlebigen Nukliden wie Kohlenstoff-11 (Halbwertszeit: 20 min) radioaktiv gekennzeichnet sind, unerlässlich ist.
Einleitung
[11C] SNAP-7941 wurde als erster Positronen-Emissionstomographie (PET)-Tracer entwickelt, der auf den Melanin-konzentrierenden Hormonrezeptor 1 (MCHR1) abzielt - ein Rezeptor, der hauptsächlich an der zentralen Regulierung von Appetit und Nahrungsaufnahme beteiligt ist1. Die Carbon-11-Kennzeichnung von SNAP-7941, einem gut charakterisierten MCHR1-Antagonisten, ergab den authentischen PET-Tracer2,3,4,5. Die vollautomatische Radiosynthese ist jedoch eine große Herausforderung in Bezug auf die Zeitliche Wirksamkeit und Reproduzierbarkeit mit dem kurzlebigen Radionuklid Carbon-11, das eine Halbwertszeit von 20 min6bietet. Die Gesamtsynthesezeit sollte auf ein Minimum beschränkt werden, und als Faustregel sollte 2-3 Halbwertszeiten (d.h. etwa 40-60 min für Kohlenstoff-11)7nicht überschreiten. Insbesondere müssen Syntheseverfahren für Radiotracer, die auf Rezeptorsysteme mit geringer Expressionsdichte abzielen, umfassend optimiert werden, um ausreichende Erträge und damit eine hohe Molaktivität zu erhalten8. Die synthetische Strategie folgt oft der Radionuklidproduktion innerhalb eines Zyklotrons und der Freisetzung von [11C]CO2 an den Synthesizer. Dort wird [11C]CO2 zunächst auf [11C]CH4 reduziert und anschließend mit Jod auf die Ausbeute reagiert [ 11C]CH3I über die Gasphasenmethode9,10. Weitere Behandlung mit Silbertriflate ergibt [11C]CH3OTf direkt online. Anschließend wird dieses reaktive Kohlenstoff-11-markierte Zwischenprodukt in eine Lösung eingeführt, die das Vorläufermolekül enthält. Eine automatisierte Radiosynthese beinhaltet zusätzlich einen Reinigungsprozess mit semipräparativem RP-HPLC inklusive nachträglicher Formulierung des Produktes, das für präklinische und klinische Studien geeignet ist.
Unabhängig von der Halbwertszeit des Radionuklids und dem Zeitaufwand der Radiosynthese ist die Pharmakokinetik eines Radiopharmazeutikums der kritischste Teil, der während der PET-Tracer-Entwicklung bewertet werden muss. In Bezug auf Neuroimaging ist der Hirneintrag des PET-Tracers die wichtigste Voraussetzung. Die Blut-Hirn-Schranke (BBB), eine "Sicherheitsgrenze" des Gehirns, drückt jedoch Efflux-Transporter hoch aus, die kleine Moleküle (z. B. PET-Tracer) entladen und deren Anwendbarkeit effizient behindern können.
Ein großer Nachteil bei der präklinischen Auswertung sind unerwartete Wechselwirkungen zu diesen Efflux-Transportern, die in In-vitro-Experimenten oft nicht erkannt werden und zum Versagen des PET-Tracers in vivo führen, wie bei [11C]SNAP-7941 beobachtet. Die PET-Bildgebung bei Ratten zeigte eine geringe Hirnansammlung, die nach Verabreichung des P-gp-Inhibitors Tariquidar11dramatisch zunahm. Diese Daten legten nahe, dass [11C]SNAP-7941 ein Substrat dieses Efflux-Transportersystems ist, das Dieligandbindung an zentrale MCHR1 behindert. Leider fehlt es immer noch an geeigneten In-vitro-Modellen, die die Vorhersage der BBB-Penetration in einem frühen Stadium der Tracer-Entwicklung ermöglichen.
Hier beschreiben wir die automatisierte Synthese von [11C]SNAP-7941 mit einem Synthesizer für Kohlenstoff-11-Methylierungen. Der Schwerpunkt dieser Arbeit liegt darin, einen Überblick darüber zu geben, wie ein konsekutierter experimenteller Ansatz organisiert werden kann, einschließlich der automatisierten Synthese, Qualitätskontrolle sowie der aufeinanderfolgenden In-vitro-Evaluierung mit dem sehr kurzlebigen Nuklid kohlenstoff-11.
Zunächst werden die wichtigsten Schritte für eine erfolgreiche Radiosynthese mit minimalem Zeitaufwand und maximalem Ertrag beschrieben. Dann wird ein zuverlässiges Qualitätskontrollverfahren eingerichtet, das den Radiotracer für potenzielle klinische Studien zur Verfügung stellt und die Kriterien des Europäischen Arzneibuchs12erfüllt. Die Quantifizierung der Molkonzentration und die Berechnung der jeweiligen Molaktivität ist eine wesentliche Voraussetzung für die aufeinanderfolgenden kinetischen Messungen.
Schließlich wird eine neue und einfache In-vitro-Methode zur Bewertung der Wechselwirkungen von [11C]SNAP-7941 zum Efflux-Transporter P-gp (hMDR1) vorgestellt. Das vorgeschlagene kinetische Modell verwendet ein einfach zu handhabendes Gerät, das eine sofortige Dateninterpretation ermöglicht und minimalen Zellkulturaufwand erfordert13.
Protokoll
VORSICHT: Im folgenden Protokoll sind mehrere Schritte beteiligt, die Handhabung und Manipulation von Radioaktivität erfordern. Es ist wichtig, dass jeder Schritt in Übereinstimmung mit der Strahlenschutzabteilung des Instituts und dem jeweiligen nationalen Gesetzgeber ist. Für die beteiligten Betreiber nach dem ALARA-Prinzip ("As Low As Reasonably Achievable") ist es zwingend erforderlich, die Exposition gegenüber ionisierender Strahlung zu minimieren.
1. Zeitmanagement und Planung des Experiments
HINWEIS: Die kurze Halbwertszeit von Carbon-11 erfordert ein genaues Zeitmanagement, um den Verlust von Radioaktivität zu minimieren (Abbildung 1). Es ist wichtig, dass jeder Beteiligte seinen Verantwortungsbereich und den Zeitpunkt der jeweiligen Aktion kennt. Für die Einrichtung eines kinetischen Echtzeitexperiments von [11C]SNAP-7941 sind rund vier Personen für einen reibungslosen Ablauf erforderlich.
- Organisieren Sie einen Hersteller für [11C]SNAP-7941.
- Informieren Sie den Qualitätskontroll-Betreiber, der die Spezifikationsbewertung, Berechnung der Massenkonzentration und der Molaktivität der Synthesestartzeit durchführt.
- Halten Sie den kinetischen Echtzeitexperimentierer bereit für die Verdünnungsberechnung und die Durchführung des Experiments.
- Weisen Sie den Läufer an, die Radioaktivität zum jeweiligen Zeitpunkt an den jeweiligen Ort zu übertragen.
2. Automatisierte Synthese von [11C]SNAP-7941 für den präklinischen Einsatz
- Vorbereitung des Synthesizers (Abbildung 2).
- Schalten Sie den Synthesizer ein, benötigte technische Gase (Helium und Wasserstoff) und die Synthesizer-Steuerungssoftware Tracerlab. Wählen Sie den jeweiligen Synthesesequenzfang aus.
- Waschen Sie V1-V3 einmal mit Wasser und zweimal mit Aceton über den Reaktor und HPLC-Ventil entweder auf Last oder injizieren Position in die Schlaufenabfallflasche.
- Trocknen Sie alle zugehörigen Leitungen in den und aus dem Reaktor über das Einspritzventil mit einem kontinuierlichen Heliumstrom, der über V18 aktiviert wird.
- Erhitzen Sie die [11C]CH3I Falle sowie die [11C]CH3OTf-Falle unter einem Heliumstrom von 100 mL'min-1 bis 200 °C über V24, V25, V29, V15, V9, V17 und V32/V33 mit freistehendem Reaktor.
- Überprüfen Sie den gleichen Weg auf Leckagen (mit angeschlossenem Reaktor) mit einem Heliumstrom von 100 ml -min-1. Die Dichtheit ist gewährleistet, wenn der Durchfluss unter 4 ml-min-1fällt.
- Schalten Sie die HPLC-Pumpe (5-10 mL-min-1) ein und waschen Sie die HPLC-Leitungen und das Einspritzventil mit Acetonitril/Wasser (50/50, v/v) sowie die HPLC-Leitungen mit dem HPLC-Lösungsmittel über V14 in die Glühbirne.
- Leeren Sie die Glühbirne über V11 und V12 in die Abfallflasche mit einem Heliumstrom über V19. Waschen Sie die entsprechenden Leitungen mit Wasser aus V6 über V11 und V12 mit einem Heliumstrom über V18.
- Waschen Sie V5 mit Ethanol und V4 mit Wasser über V11 und V12 in die Produktsammelflasche (PCV) mit einem Heliumstrom über V18, und leeren Sie dann die PCV über V13 in die Abfallflasche mit einem Heliumstrom über V20.
- HPLC-Pumpe ausschalten, zur Synthese auf das Lösungsmittel schalten (wässriges Ammoniumacetat (2,5 g L-1)/Essigsäure 97,5/2,5 v/v; pH 3.5)/Acetonitril 75/25 v/v), die halbpräparative HPLC-Säule anbringen und die Säule ausdemivieren (Durchfluss von 5 ml -min-1).
- Füllen Sie die Reagenzien für die Synthese und Reinigung: 1,5 ml Wasser (V2), 4,5 ml mit 0,9% NaCl (V4), 0,5 ml 96% Ethanol (V5), 10 ml Wasser (V6) und 90 ml Wasser (Glühbirne).
- Befestigen Sie eine neue Schleifenabfall-Durchstechflasche; eine Produktdurchstechflasche (gekennzeichnet und mit einer Belüftungsnadel ausgestattet) zu V13 und dem flüssigen Stickstoff.
- Voraussetzung ist eine SPE-Kartusche (Festphasenextraktion) mit 10 ml 96% Ethanol und 20 ml Wasser und befestigen Sie sie zwischen V11 und V12.
- Starten Sie die Vorlaufsequenz 20 min vor Beginn der Synthese, bestehend aus dem Erhitzen der [11C]CO2 Falle auf 400 °C und Spülen der Falle mit einem Heliumstrom von 50 mL'min-1über V27 (2 min). Dann die [11C]CO 2-Falle 3 min mit Wasserstoffgas (120 mL-min-1)vorspülen und schließlich auf unter 40 °C abkühlen.
- 1 mg Vorläufer in 400 l Acetonitril auflösen (für die DNA-Synthese, < 10 H2O), die Lösung auf die Reaktion übertragen und 5,5 l TBAH (264 mg-mL-1 in Methanol) hinzufügen. Befestigen Sie den Reaktor an seiner jeweiligen Position.
- Schließen Sie die heiße Zelle und schalten Sie den Druck der heißen Zelle ein.
- Bestätigen Sie den Beginn des Kühlprozesses der CH 4-Falle mit flüssigem Stickstoff bis -75 °C.
- Lassen Sie die Radioaktivität los, wenn die Temperatur erreicht ist.
- Zyklotronproduktion von [11C]CO2
ANMERKUNG: Die Schritte 2.2.1-2.2.4 werden gleichzeitig zur Herstellung des Radiosynthesemoduls durchgeführt (siehe auch Abbildung 1).- Schalten Sie den Magneten des Zyklotrons ein.
- Wählen Sie das Ziel 11C-CO2 und starten Sie den Strahl 65 A.
- Bestätigen Sie den Beginn der Bestrahlung, indem Sie die Taste Bestrahlung starten
- Stoppen Sie den Strahl und bestätigen Sie die Freisetzung von Radioaktivität in den Synthesizer durch Drücken der Taste Lieferung, nachdem die gewünschte Menge an Radioaktivität erreicht ist (ca. 120 GBq nach 30 min).
- Durchführung der vollautomatischen Radiosynthese
- Bestätigen Sie, dass das System bereit ist, die Radioaktivität zu empfangen, und starten Sie den automatisierten Prozess
- Überwachung des folgenden automatisierten Prozesses.
- Prüfen Sie, ob das [11C]CO2 automatisch über V26 (ca. 4 min) vom Cyclotron in die Syntheseeinheit übertragen wird und ob das [11C]CO2 auf dem mit Nickel als Katalysator imprägnierten Molekularsieb gefangen ist ([ 11 C]CO 2-Falle) bei Raumtemperatur.
- Verfolgen Sie, ob die [11C]CO 2-Falle automatisch zuerst mit Helium (50 mL-min-1) und dann mit Wasserstoffgas (120 mL-min-1) gespült wird. Beachten Sie dann, dass V27 und V25 geschlossen sind und das eingeschlossene [11C]CO2 einschließlich des Wasserstoffgases auf 400 °C erhitzt wird und dass die formierte [11C]CH4 weiter zum vorgekühlten [11C]CH 4 transportiert wird. Falle und dort gefangen.
- Überwachen Sie, dass V10 geschlossen, V9 geöffnet (in Richtung Jodsäule) und [11C]CH4 wieder durch Erhitzen der[11C]CH4 Falle langsam auf 80 °C freigesetzt und mit einem Heliumstrom über V10 (Auspuffausgang). Und weitere prüfen, ob [11C]CH4 in [11C]CH3I innerhalb der Zirkulationseinheit umgewandelt wird, die ca. 3 min und die formierte [11C]CH3kontinuierlich auf der [11C] CH3I Falle.
- Stellen Sie sicher, dass das Auspuffventil V16 geöffnet ist und die [11C]CH3 IFalle mit einem Heliumstrom (20 mL/min-1) über V24 auf 90 °C erhitzt wird. Hierdurch werden mögliche Nebenprodukte entfernt und dann V16 geschlossen.
- Bestätigen Sie, dass die [11C]CH3 Ibereit ist, in den Reaktor freigesetzt zu werden.
- Überwachen Sie folgenden automatisierten Prozess: Prüfen Sie, ob die Falle [11C]CH3I auf 190 °C erhitzt wird und die gebildete [11C]CH3I über die [11C]CH3OTf-Falle (V32 und V33, noch bei 200 ° C), V7 und V8 unter einem kontinuierlichen Heliumstrom (10-25 mL-min-1, V24). Dabei müssen V21 und V23 (Auspuffausgang) geöffnet sein.
- Bestätigen Sie, dass die Radioaktivität im Reaktor eingetroffen ist, sobald die Radioaktivität im Reaktor nicht mehr ansteigt.
- Überwachung des folgenden automatisierten Prozesses und ggf. Vorbereitung auf manuelle Eingriffe
- Prüfen Sie, ob V23, V21 und V8 automatisch geschlossen sind und das Reaktionsgemisch auf 75 °C erhitzt wird. Nach 3 min beobachten, ob der Reaktor mit flüssigem Stickstoff gekühlt wird, bis die Temperatur unter 35 °C liegt. Stellen Sie anschließend sicher, dass das Reaktionsgemisch mit 1,5 ml Wasser über V2 abgeschreckt wird. Dabei müssen V21 und V23 (Auspuffausgang) geöffnet sein.
- Verfolgen Sie, wenn V21 und V23 geschlossen sind und das Reaktionsgemisch durch Durchqueren eines Flüssigkeitsdetektors in die HPLC-Schleife (5 ml) auf das HPLC-Einspritzventil übertragen wird. Verfolgen Sie, ob das Reaktionsgemisch automatisch in die HPLC-Säule injiziert wird.
- Beobachten Sie das Chromatogramm und schneiden Sie die Produktspitze manuell über den Button Peak start. Drücken Sie Peak-Ende, wenn das Produkt-Peak-Signal nach einer Retentionszeit von etwa 8-10 min unter ca. 400 cpfällt (Durchfluss: 5 ml-min -1, Abbildung 3).
- Schalten Sie einen zusätzlichen Heliumstrom ein, um die Beleerung der Glühbirne zu beschleunigen.
- Überwachen Sie, ob die Glühbirne entleert wird, und beobachten Sie die Abfallflasche: Prüfen Sie, ob die Glühbirne über V11, die SPE-Patrone und V12 mit einem Heliumstrom über V19 und einer zusätzlichen Heliumleitung in den Abfall entleert wird und ob das Produkt auf der SPE-Patrone verbleibt.
- Bestätigen Sie, dass die Glühbirne vollständig leer ist.
- Überwachung des automatisierten Prozesses der SPE-Reinigung und Produktübertragung
- Prüfen Sie, ob die SPE-Patrone mit 10 ml Wasser über V6, V11 und V12 in den Abfall gewaschen wird und ob Ethanol das Produkt über V5, V11 und V12 in die PCV einlükt. Beachten Sie schließlich, ob 0,9% NaCl über V4, V11 und V12 in die PCV aufgenommen wird, um das Produkt zu verdünnen.
- Stellen Sie sicher, dass die Produktlösung über V13 und einen sterilen Filter in die Endproduktdurchstechflasche mit einem Heliumstrom über V20 übertragen wird.
- Bestätigen Sie, dass das Produkt vollständig übertragen wurde.
3. Qualitätskontrolle (QC)
HINWEIS: Die Qualitätskontrolle von Radiopharmazeutika umfasst die Messung der folgenden Parameter:
- Radiochemische Reinheit und Molaktivität (RP-HPLC)
- Restlösungsmittel (Gaschromatographie, GC)
- Osmolalität (Dampfdruckosmometer)
- pH-Wert (pH-Meter)
- • Spektrum-/Radionuklidreinheit (Spektrometer)
- Halbwertszeit/Radionuklidreinheit (Dosiskalibrator)
Alle physikalisch-chemischen Parameter werden vor der Freisetzung des Produkts bestimmt und die Werte müssen im definierten Qualitätsparameterbereich liegen.
- Vorbereitung der Qualitätskontrollgeräte
- Beginnen Sie die Vorbereitung 30 min vor dem Ende der Synthese.
- Bereiten Sie eine konische Durchstechflasche in einem bleiabgeschirmten Behälter und eine abgeschirmte 1 ml Spritze mit einer befestigten Nadel vor.
- Bereiten Sie eine Referenzstandardlösung von SNAP-7941 (10 g'mL-1) in Wasser für HPLC vor.
- Schalten Sie den pH-Wert, den Gaschromatographen und die verwendeten Gase, das Osmometer und alle Komponenten des HPLC ein.
- Schalten Sie die HPLC-Steuerungssoftware ein und wählen Sie die dedizierte Spalte und das entsprechende Verfahren für [11C]SNAP-7941 (mobile Phase: (Wasser/Essigsäure 97,5/ 2,5 v/v; 2,5 g.L-1 Ammoniumacetat; pH 3,5)/Acetonitril 70/30 v/v; Durchfluss: 1 mL-min -1) und schreiben Sie eine Beispielliste mit zwei Messungen (Standard und Produkt). Starten Sie die Methode zur Konditionierung der Spalte.
- Injizieren Sie 20 l der Referenzlösung SNAP-7941 mit einer Hamilton-Spritze nach 10 min Konditionierung und starten Sie den Analyselauf.
- Waschen Sie die Hamilton-Spritze zweimal mit Acetonitril und Wasser nach der Injektion.
- Starten Sie die GC-Steuerungssoftware, und schreiben Sie die Beispielliste.
- Durchführung von Qualitätskontrolle
- Messen Sie die absolute radioaktive Ausbeute des Produkts nach dem Ende der Synthese und übertragen Sie 100 l des Produkts in eine Reaktionsflasche mit der vorbereiteten bleiabgeschirmten Spritze zur Qualitätskontrolle.
HINWEIS: Alle daten aus der Qualitätskontrolle müssen in Übereinstimmung mit den nationalen Vorschriften dokumentiert werden. - Analytische hPLC: Messen Sie die radiochemische Reinheit und chemische Reinheit und informieren Sie die für die Zellkulturexperimente Verantwortliche sofort über die Ergebnisse.
- Zeichnen Sie 40 l der QC-Probe und injizieren Sie in den HPLC. Starten Sie den Lauf, indem Sie den Arm des Einspritzventils von Load to Inject bewegen (Abbildung 3).
HINWEIS: Während des Laufs (8 min) können andere Messungen des Protokolls durchgeführt werden, um so viel Zerfall wie möglich zu vermeiden. - Öffnen Sie das Chromatogramm und integrieren Sie alle Spitzen im Radioaktivitätskanal. Vergleichen Sie die Retentionszeit des Produkts (5,0-7,0 min) mit der Retentionszeit des Referenzstandards. Vergleichen Sie die Fläche unter der Kurve in Prozent aller integrierten Spitzen. Die Produktspitze muss mehr als 95 % (radiochemische Reinheit) der gesamten integrierten Bereiche (Radiokanal) betragen.
- Integrieren Sie das Signal in den UV-Kanal, um die chemische Reinheit zu bestimmen. Die Hauptunreinheit ist in der Regel die Vorläufer-SNAP-Säure bei 2,8-3,5 min. Die Konzentration von [natC]SNAP-7941 wird aus der Kalibrierkurve nach der Integration berechnet. Berechnen Sie die Konzentration von SNAP-7941 in .mol-mL-1 und bestimmen Sie die Molaktivität mittels der folgenden Gleichung:
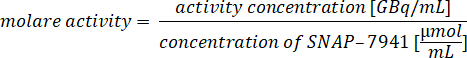
- Zeichnen Sie 40 l der QC-Probe und injizieren Sie in den HPLC. Starten Sie den Lauf, indem Sie den Arm des Einspritzventils von Load to Inject bewegen (Abbildung 3).
- Für die Gaschromatographie 20 l der Qualitätskontrollprobe in eine spezielle Glasdurchstechflasche übertragen. Legen Sie es in den Autosampler und starten Sie die Messung. Nachdem die Messung abgeschlossen ist, öffnen Sie das Chromatogramm und notieren Sie sich die Anzahl der automatisch integrierten Spitzen. Die Probe sollte nicht mehr als 410 ppm Acetonitril und 10% Ethanol enthalten.
- Osmolalität: Legen Sie eine Papierprobenscheibe auf die spezielle Mulde und tragen Sie 10 l der Probe auf. Drücken Sie die Schließtaste, um die Osmolalität zu messen. Nach 3 min zeigt das Gerät die Osmolalität an, die in einem Bereich von 190-500 mosm-kg-1liegen muss.
- pH: Die Elektrode mit Wasser waschen. Messen Sie den pH-Wert, indem Sie die Elektrode in die Probe legen. Der pH-Wert muss in einem Bereich von 5,0-8,5 liegen. Waschen Sie die Elektrode nach der Messung erneut und legen Sie die Elektrode in die Referenz-pH-Lösung.
- -Spektrum: Setzen Sie die QC-Probe in das Spektrometer, öffnen Sie die Steuerungssoftware und starten Sie die Messung. Stoppen Sie die Messung und notieren Sie die gemessene Energie, die 511 keV sein muss (Bereich 420-520 keV). Öffnen Sie das Dateimenü und schützen Sie die Datei mit der entsprechenden Chargennummer. Erinnern Sie sich an das gespeicherte Spektrum in der dedizierten Software und drucken Sie das Spektrum.
- Halbwertszeit: Messen Sie die Aktivität der QC-Probe zweimal mit dem Dosiskalibrator. Notieren Sie sich die jeweiligen Zeiten und berechnen Sie die Halbwertszeit des Exponentials.
- Messen Sie die absolute radioaktive Ausbeute des Produkts nach dem Ende der Synthese und übertragen Sie 100 l des Produkts in eine Reaktionsflasche mit der vorbereiteten bleiabgeschirmten Spritze zur Qualitätskontrolle.
- entlassen
- Nachdem alle Parameter getestet wurden und die Ergebnisse den Richtlinien der österreichischen Behörden entsprechen, geben Sie den Radiotracer frei. Der Betreiber muss die Richtigkeit der Daten unterschreiben.
4. Bewertung der Wechselwirkungen zum P-gp-Transporter
- Zellkultur
- Starten Sie den laminaren Luftstrom (LAF) der Werkbank und reinigen Sie die Bank mindestens 15 min, bevor Sie mit der Arbeit beginnen.
- Mischen Sie das Zellkulturmedium unter sterilen Bedingungen im LAF mit 10% FCS (50 ml) und 0,5% Antibiotika (2,5 ml) mit einer sterilen volumetrischen Pipette mit einer automatisierten Pipettierhilfe.
- MDCKII-hMDR1 und MDCKII-WT-Zellen auftauen und in einem T75- oder T175-Zellkulturkolben 10-14 Tage vor Experimenten unter aseptischen Bedingungen (LAF) kultivieren.
- Ändern Sie das Medium am nächsten Tag, um alle nicht haftenden und apoptotischen Zellen zu entfernen.
- Ersetzen Sie alle drei Tage das Medium durch ein frisches Medium (12 ml für den T75 bzw. 23 ml für den T175-Zellkulturkolben).
- Teilen Sie die Zellen nach dem Zeitplan der Experimente auf frische Kolben oder Zellkultur-Gerichte bei einem Zusammenfluss von 80%, um bilayer Wachstum zu vermeiden.
- Zellvorbereitung für Experimente
- Teilen Sie die Zellen zwei Tage vor den Experimenten und samen Sie in einer Konzentration von 2,5 x 105 Zellen pro 2 ml in einer schrägen Ebene einer Zellkulturschale (Abbildung 4). Verwenden Sie ein automatisches Zellzählergerät oder eine Neubauer-Zählkammer, um die Zellen zu zählen und das entsprechende Spaltverhältnis zu berechnen.
- Entfernen Sie das Medium einen Tag vor den Experimenten, waschen Sie die Zellen auf der Kulturschale mit 4 ml DPBS und fügen Sie frische 5 ml Zellkulturmedium hinzu. Legen Sie die Schale horizontal in den Inkubator.
- Waschen Sie die Zellen mit DPBS mindestens 0,5 h vor Experimenten und ersetzen Sie durch 2 ml FBS freies Medium. Untersuchen Sie den Zusammenfluss und die Zellmorphologie mit einem Mikroskop.
- Durchführung der Experimente in drei verschiedenen Setups.
- Verwenden Sie die Petrischale für die Experimente, wie in 4.2.3 beschrieben.
- Behandeln Sie die Zellen für 0,5 h vor Experimenten mit 10 -M-Verapamil-Hydrochlorid.
- Fügen Sie 0,98 l Verapamil-Stammlösung (20,4 mM ()-Verapamil-Hydrochlorid in DMSO) hinzu. Der endgültige DMSO-Gehalt liegt während der Behandlung bei 0,05 %.
- Inkubieren Sie die Zellen für 0,5 h mit der Fahrzeugsteuerung (DMSO). Verwenden Sie das gleiche Volumen wie für die medikamentöse Behandlung verwendet.
- Experimente des Echtzeit-Assays (für alle drei Setups)
- Schalten Sie das Gerät und den Computer ein, und stellen Sie sicher, dass sie richtig verbunden sind, und öffnen Sie dann die Steuerungssoftware.
- Wählen Sie die Option Ein Ziel, entsperren Sie die Vorlage, und passen Sie die folgende Einstellung an:
Anzahl der Positionen: 2 (zwei)
Erkennungszeit (Sek.): 3 (drei)
Erkennungsverzögerungszeit (s): 2 (zwei)
Name der ersten Phase: Baseline - Setzen Sie die Zellkulturschale in die geneigte Unterstützung des Geräts ein, um sicherzustellen, dass sich der Zellpol auf der Unterseite befindet und mit zellkulturmittel bedeckt ist.
- Starten Sie den Lauf über die Start-Taste. Das System fordert das Speichern der Datei auf. Wählen Sie einen Dateinamen und einen Speicherpfad aus. Das Kontrollzentrum wird angezeigt und die Basismessung beginnt (die Unterstützung der Zellkulturschale beginnt sich zu drehen).
- Wählen Sie unter Andere Optionen:
Zeitskala: Minuten
Nuklidkorrektur: Carbon-11 - Aktivieren Sie alle Kästchen unter Kurven im Diagramm (Hintergrund (rot), Ziel (blau) und Ziel minus Hintergrund (schwarz)).
- Qualitätskontrollparameter erhalten: Molaktivität [GBq.mol-1] und Aktivitätskonzentration [MBq.mL-1] am Ende der Synthese.
- Berechnen Sie das jeweilige Tracervolumen für 15 nM von [natC]SNAP-7941 im Assayvolumen von 2 ml.
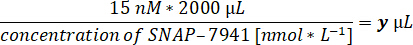
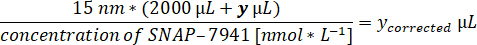
- Bereiten Sie die Pipette auf das jeweilige Volumen und ein Aliquot des Produkts [11C]SNAP-7941 in einer Bleiabschirmung vor.
- Klicken Sie im Kontrollcenterfenster auf Pause.Foren. Warten Sie, bis die Tellerrotation stoppt und die Seitenleiste mit dem Titel Angehalten und nächste Phaseauftritt.
- Öffnen Sie den Deckel des kinetinen Echtzeitgeräts. Drehen Sie die Kulturschale Unterstützung 90° nach links. Fügen Sie das berechnete Volumen des Tracers hinzu, und kehren Sie zur Ausgangsposition zurück. Schließen Sie dann den Deckel des Geräts. Drücken Sie sofort die Taste Weiter, um das Experiment zu starten.
- Beenden Sie das Experiment nach 20 min, indem Sie Pause auswählen und anschließend den Lauf beenden (drücken Sie Endlauf in der Seitenleiste).
- Datenanalyse und -verarbeitung mit einer Statistiksoftware
- Öffnen Sie die Echtzeit-Steuerungssoftware. Klicken Sie auf Dateien öffnen, um die erforderliche Kinetik abzuzurufen. Die Kinetik wird im Schaltzentralenfenster dargestellt.
- Wählen Sie mit der rechten Maustaste direkt auf die Kinetik Exportkurven. Speichern Sie die Textdatei mit den Rohdaten. Öffnen Sie das Statistikprogramm, und fügen Sie die Rohdatendatei von Echtzeitexperimenten ein.
- Beginnen Sie mit der Zeit (x-Achse) bei Zugabe von Radiotracer (keine Hintergrundmessung) und normalisieren Sie auf Prozent signal des maximalen CPS (Zählungen pro Sekunde).
- Laden Sie alle normalisierten Daten in eine neue GraphPad Prism-Datei.
- Berechnen Sie Durchschnittswerte und Standardabweichungen.
- Veranschaulichen Sie die erhaltenen Daten als Diagramm, das die Abweichung (Steigerungsrate) der Traceraufnahme aller drei Eingerichteten zeigt.
Ergebnisse
Die vollautomatische Radiosynthese von [11C]SNAP-7941 ergab 5,7 x 2,5 GBq (4,6 x 2,0 % bei EOB, 14,9 x 5,9 % basierend auf [11C]CH3OTf; n = 10) des formulierten Produkts. Die Gesamtsynthese dauerte ca. 40 min, wobei 15 min für die Vorbereitung von [11C]CH3OTf über die Gasphasenmethode erforderlich waren, weitere 5 min waren für die Radiomarkierung des Vorläufers erforderlich, gefolgt von 10 min semipräparativer RP-HPLC-Reinigung und 10 min für die C18-Patrone Festphasenextraktion und -formulierung. Anschließend wurde dem für die Qualitätskontrolle verantwortlichen Personen ein kleiner Aliquot (ca. 100-200 l) geliefert, während die Originalproduktdurchstechflasche mit dem gebrauchsfertigen Tracer an den Experimentator der kinetischen Echtzeitanalyse übergeben wurde.
Die Qualitätskontrolle wurde innerhalb von 10 min nach dem Ende der Synthese abgeschlossen. Die molare Aktivität lag in einem Bereich von 72 x 41 GBq/Mol (n = 10) und die radiochemische Reinheit betrug immer > 95%. Alle anderen Parameter (pH, Osmolalität, Restlösungsmittel) erfüllten die Freisetzungskriterien. Für den kinetischer Echtzeit-Assay wurden drei verschiedene Versuchsaufbauten ausgewählt: (A) behandelte und unbehandelte (Fahrzeug)-MDCKII-WT-Zellen, (B) nicht behandelt oder mit MDCKII-hMDR1-Zellen behandelte Fahrzeugzellen und (C) die letztere Zelllinie mit Blockierung vor der Echtzeit kinetische Assay des Transporters mit ()-verapamil. Die Anwendung von [11C]SNAP-7941 auf die Wildtyp-Zelllinie MDCKII-WT (P-gp nicht-exsokierend) und MDCKII-hMDR1 (P-gp-Exzess) zeigt ein anderes kinetisches Verhalten, da es eine schnelle Akkumulation der Wildtyp-Zelllinie gibt, während keine Akkumulation beobachtet wurde, während keine Akkumulation beobachtet wurde. für die MDCKII-hMDR1-Zellen. Die Blockierung des P-gp-Efflux-Transporters in MDCKII-hMDR1-Zellen mit ()-verapamil führte jedoch zu einer vergleichbaren Echtzeit-Kinetik, wie sie bereits für die Wildtyp-Zelllinie gesehen wurde (Abbildung 5).

Abbildung 1: Übersicht über den Arbeitsablauf. Arbeitsablauf der Radiosynthese, Qualitätskontrolle und Leistung der kinetinen Echtzeitmessung von [11C]SNAP-7941. Die schwarzen Pfeile zeigen den Transportweg der Radioaktivität an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
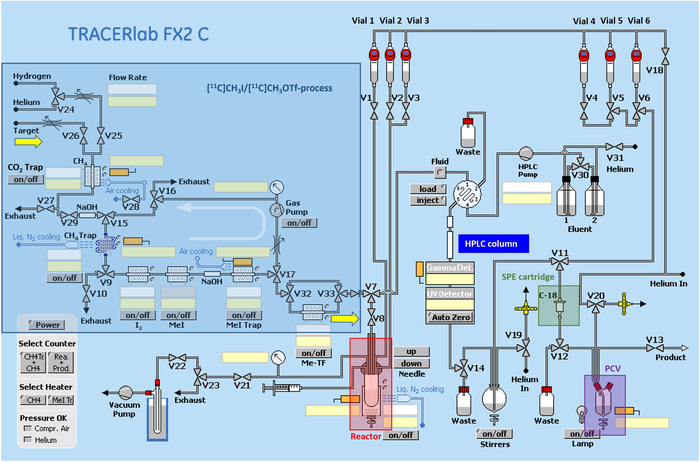
Abbildung 2: Radiosynthetisches Schema des automatisierten Synthesizers. Schaltkreis des automatisierten Synthesizers, beginnend mit der Zirkulationseinheit für [11C]CH3I/[11C]CH3OTf Produktion, Reaktor zur Einführung der Aktivität in die Vorläuferlösung und SPE-Reinigung (SPE = festes Phasenextraktion; PCV = Produktsammlungsdurchstechflasche). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
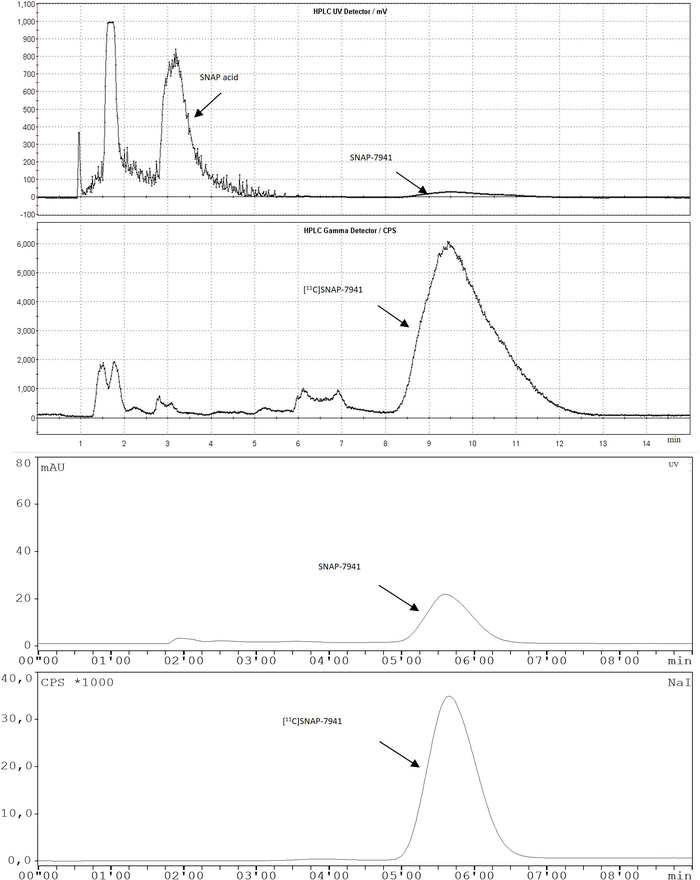
Abbildung 3: Repräsentative Chromatogramme der vollautomatischen Radiosynthese von [11C]SNAP-7841. Das halbpräparative RP-HPLC-Chromatogramm ist oben und das analytische nach der Reinigung am Boden dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
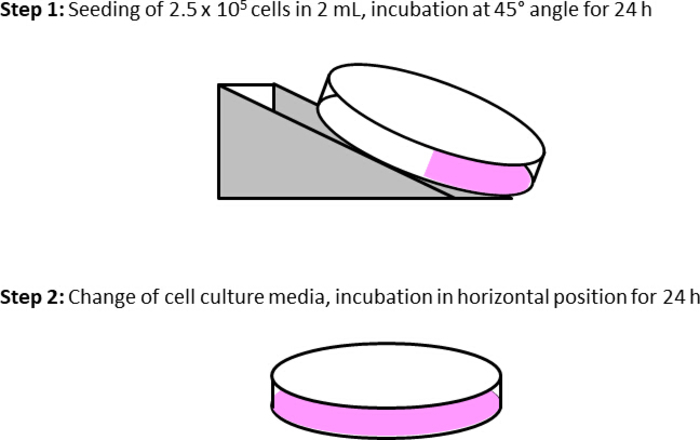
Abbildung 4: Vorbereitung von Zellkulturschalen für Echtzeitexperimente. Schritt 1 beinhaltet die Aussaat von 2,5 x 105 bis 1 x 106 je nach Zelltyp und Wachstumsrate. Anschließend wird das Kulturgericht in einer schrägen Ebene (ca. 30-45°) platziert. Daher kann das mitgelieferte Metallgerät oder der Deckel einer Zellkulturschale im Inkubator verwendet werden, um die Schräglage der Schale zu stabilisieren. Am Tag danach (24 h) wird das Gericht horizontal eingestellt, und frisches Zellkulturmedium wird hinzugefügt, um die Zelloberfläche vollständig zu bedecken. Am Tag des Experiments werden Zelllebensfähigkeit und Zusammenfluss untersucht. Nach dem Versuchsprotokoll werden die Zellen mit DPBS gewaschen, das Medium durch ein serumfreies Medium (2 ml) ersetzt und die Kulturschale bis zum Beginn der Experimente in eine schräge Position umpositioniert. Von nun an können die Zellen mit dem Inhibitor oder Fahrzeug behandelt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
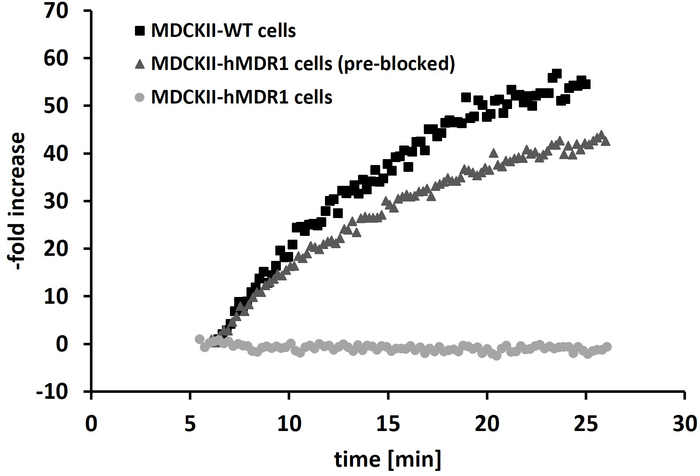
Abbildung 5: Kinetische Echtzeitmessungen von [11C]SNAP-7941. Repräsentative Echtzeitkinetik von [11C]SNAP-7941 wird in drei verschiedenen Setups dargestellt: Verwendung von MDCKII-WT-Zellen; MDCKII-hMDR1-Zellen vorblockiert mit ()-verapamil als P-gp-Hemmer und MDCKII-hMDR1-Zellen ohne Blockade. Die y-Achse veranschaulicht die Steigerungsrate der vorblockierten MDCKII-hMDR1- und WT-Zellen im Vergleich zu den Ergebnissen der unbehandelten bzw. fahrzeugbehandelten MDCKII-MDR1-Zellen (keine Aufnahme, 0%). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Radiosynthese von [11C]SNAP-7941 wurde auf einem kommerziellen Synthesemodul etabliert. Durch die Möglichkeit, das Aufbereitungsverfahren vollständig zu automatisieren, wurde die Als zuverlässig erwiesene Radiosynthese nachgewiesen und Verbesserungen beim Strahlenschutz des Bedieners erzielt. Die Herstellung des Synthesizers hat einen enormen Einfluss auf die Qualität des Radiotracers, insbesondere in Bezug auf die Molaktivität. Daher ist es wichtig, ständig unter inerten Bedingungen (z. B. Heliumatmosphäre) zu arbeiten und alle Leitungen vor dem Reaktionsgefäß zu spülen (Ziellinie, [11C]CH3I Produktionszyklus und Reaktor (siehe Abbildung 2)). Darüber hinaus erhöht das Erhitzen der jeweiligen Fallen und Öfen vor Beginn der Synthese, um Feuchtigkeit und atmosphärischen Kohlenstoff zu entfernen, die Molaktivität vorteilhaft. Insbesondere die agOTf-Säule, mit graphitisiertem Kohlenstoff imprägniert, ist extrem feuchtigkeitsempfindlich. Schon geringe Mengen einer beliebigen Feuchtigkeitsquelle stören die Umwandlung von [11C]CH3I in [11C]CH3OTf. Vor Beginn der Synthese müssen die [11C]CO 2-Falle und die [11C]CH3I-Falle wieder auf Raumtemperatur abgekühlt werden, um ein nachfolgendes Fangen zu ermöglichen. Darüber hinaus wird empfohlen, den Vorläufer kurz vor Beginn der Synthese aufzulösen und die Basis direkt in die Vorläuferlösung einzutragen.
Die Qualitätskontrolle für Carbon-11-Radiotracer muss rationell auf einen kontinuierlichen und schnellen Arbeitsablauf ausgelegt sein. Die wichtigsten Parameter für Zellkulturstudien sind jedoch radiochemische Reinheit und molaren Aktivität, um gültige Ergebnisse zu erhalten. Eine korrekte Bewertung der Molaktivität erfordert eine robuste analytische HPLC-Methode und die Kalibrierkurve muss den Konzentrationsbereich des Endprodukts abdecken. Der schwierige Teil für Radiotracer besteht darin, eine Konzentration oberhalb der Quantifizierungsgrenze (LOQ) aufgrund kleiner Mengen zu erreichen, die während der Radiosynthese erzeugt werden. Daher besteht die Kunst darin, das Gleichgewicht zwischen hohen molaren Aktivitäten zu finden, um Rezeptorsättigung und hohe Konzentrationen zu vermeiden, um das nicht-radioaktive Signal noch quantifizieren zu können.
[11C] SNAP-7941 wurde als potentes Substrat des menschlichen P-gp-Transporters bestätigt, da in den unbehandelten oder fahrzeugbehandelten MDCKII-hMDR1-Zellen aufgrund des schnellen Ausflusses keine Ansammlung beobachtet wurde. Im Gegensatz dazu lieferten beide Versuchs-Setups (MDCKII-WT- oder vorblockierte MDCKII-hMDR1-Zellen) ähnliche Ergebnisse (Akkumulation von [11C]SNAP-7941), was die Vielseitigkeit dieses In-vitro-Assays unterstützt. MDCKII-hMDR1-Zellen eignen sich aufgrund ihrer stabilen Transfektion, ihres schnellen Wachstums und der anhaltenden Scherbelastung durch die rotierende Zellkulturschale hervorragend für LigandTracer-Experimente. Das Fehlen von [11C]SNAP-7941 Aufnahme im Ratten- und Mäusehirn kann daher durch Efflux durch den P-gp Transporter verursacht werden. Aufgrund der Transfektion von Canine-Nierenzellen mit dem humanen Multi-Wirkstoffresistenz-Protein 1 (hMDR-1, P-gp) ist der Vorhersagewert dieser Methode für die Efflux-Transporterbindung beim Menschen hoch, was im Hinblick auf eine zukünftige klinische Anwendung günstig ist. Bisher wurde die Selektivität gegenüber anderen Efflux-Transportern jedoch nicht überprüft. Daher können andere Zelllinien verwendet werden, die verschiedene prominente Efflux-Transporter wie das Brustkrebsresistenzprotein (BCRP) oder das Multiple Resistenzprotein -1 (MRP-1) exprossen, um Wechselwirkungen zu diesen Transportern zu untersuchen. Die Methode ist im Vergleich zu klassischen Akkumulations- oder Transporttests sehr einfach und liefert sofort qualitative Ergebnisse. Darüber hinaus ist der größte Vorteil, dass diese Technologie die Bewertung der direkten Interaktion zwischen PET-Tracer und Ziel in Echtzeit ermöglicht, im Gegensatz zum konventionellen Experiment mittels indirekter Quantifizierung (meist Verschiebung). Darüber hinaus bietet die Echtzeit-Radioassay-Software experimentelle Flexibilität (z.B. Nuklidenzerfallskorrektur, Messzeit und Positionen, etc.) und damit hohe Freiheit für den Anwender. Auf der anderen Seite umfasst die Einschränkung der Methode einen niedrigen Probendurchsatz, da jeweils nur eine Zellschale gemessen werden kann. Darüber hinaus sollten einige andere technische und betriebliche Fragen berücksichtigt werden: Die beschriebene Technologie ist sehr empfindlich gegenüber Hintergrundstrahlung; Daher sollten Strahlungsquellen auf Distanz gehalten und der Schwerpunkt auf die Hintergrundmessung vor dem Experiment gelegt werden. Ein weiteres Problem bei Experimenten bei höheren Temperaturen als Raumtemperatur ist die Erwärmung der geneigten Stütze: Verdunstung des Zellkulturmediums könnte den Detektor beeinflussen. Anstelle des Erhitzens wird das gesamte Gerät vorzugsweise in den Inkubator gestellt. Darüber hinaus ist die Methode auf anhaftende Zelllinien beschränkt. Durch die Rotation der Zellkulturschale können sich spannungsempfindliche Zellen von der Schale lösen, was zu ungültigen Ergebnissen führen kann.
Dennoch liefert die Methode schnelle und zuverlässige Ergebnisse für die Analyse des kinetischen Verhaltens präklinischer PET-Tracer, wenn der Experimentator auf diese kleinen Nachteile achtet.
Offenlegungen
Wir haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde vom Wissenschaftsfonds (FWF P26502-B24, M. Mitterhauser) unterstützt. Wir sind dankbar für die technische Unterstützung von T. Zenz und A. Krcal. Darüber hinaus danken wir K. Pallitsch für die Vorbereitung der AgOTf und H. Spreitzer für die Verteilung des Vorläufers.
Materialien
| Name | Company | Catalog Number | Comments |
| Table 1: List of materials and instrumentation of the fully automated radiosynthesis of [11C]SNAP-7941 | |||
| Ni catalyst | Shimadzu, Kyoto, Japan | Shimalilte Ni reduced, 80/100 mesh | |
| Iodine | Merck, Darmstadt, Germany | 1.04761.0100 | |
| Acetonitrile | Merck, Darmstadt, Germany | for DNA synthesis, < 10 ppm H2O | |
| Acetonitrile | Sigma-Aldrich, St. Louis, MO, USA | HPLC grade | |
| Ammonium acetate | Merck, Darmstadt, Germany | ||
| Acetic acid | Merck, Darmstadt, Germany | glacial | |
| Ethanol | Merck, Darmstadt, Germany | 96% | |
| NaCl | B. Braun, Melsungen, Germany | 0.9% | |
| Tetrabutylammonium hydroxide | Sigma-Aldrich, St. Louis, MO, USA | ||
| Methanol | Sigma-Aldrich, St. Louis, MO, USA | HPLC grade | |
| SPE cartridge | Waters, Milford, MA, USA | SepPak C18plus | |
| Semi-preparative RP-HPLC column | Merck, Darmstadt, Germany | Chromolith SemiPrep RP-18e, 100-10 mm | |
| Precolumn | Merck, Darmstadt, Germany | Chromolith Guard RP-18e, 5-4.6 mm | |
| Precursor | University of Vienna, Austria | SNAP-acid | |
| Reference compound | University of Vienna, Austria | SNAP-7941 | |
| Silver trifluoromethanesulfonate | Sigma-Aldrich, St. Louis, MO, USA | ||
| Graphpa GC | Alltech, Deerfield, IL, USA | 80/100 mesh | |
| PET trace 860 cyclotron | GE Healthcare, Uppsala, Sweden | ||
| [11C]CO2 high pressure target | Air Liquide, Vienna, Austria | ||
| TRACERlabFX2 C | GE Healthcare, Uppsala, Sweden | ||
| N2 + 1% O2 | Air Liquide, Vienna, Austria | Target gas | |
| Name | Company | Catalog Number | Comments |
| Table 2: List of materials and instrumentation of the quality control of [11C]SNAP-7941. | |||
| Merck Hitachi LaChrom, L-7100 | Hitachi Vantara Austria GmbH (Vienna, Austria) | HPLC pump | |
| Merck Hitachi, L7400 | Hitachi Vantara Austria GmbH (Tokyo, Japan) | UV-detector | |
| NaI-radiodetector | Raytest (Straubenhardt, Germany) | NaI-radiodetector | |
| Chromolith Performance RP-18e, 100-4.6 mm | Merck (Darmstadt, Germany) | HPLC column | |
| 430-GC | Bruker (Bremen, Germany) | Gas chromatograph | |
| Capillary column ID-BP20; 12 mx0.22 mmx0.25 mm | SGE Ananlytical Science Pty. Ltd. (Victoria, Australia) | Gas capillary | |
| Wesco, osmometer Vapro 5600 | Sanoya Medical Systems (Vienna, Austria) | Osmometer | |
| g-spectrometer | g-spectrometer | ||
| Gas chromatography controlling software | VARIAN (Palo Alto, California, U.S.A) | Galaxie Version 1.9.302.952 | |
| Gamma spectrometer controlling software | ORTEC (Oak Ridge, Tenessee, U.S.A.) | Maestro for windows Version 6.06 | |
| Gamma spectrum recalling software | ORTEC (Oak Ridge, Tenessee, U.S.A.) | Winplots version 3.21 | |
| HPLC controlling software | Raytest (Straubenhardt, Germany) | Gina Star Version 5.9 | |
| inolab 740 | WTW (Weilheim, Germany) | pH meter | |
| Name | Company | Catalog Number | Comments |
| Table 3: List of materials and instrumentation for the evaluation of the real-time kinetic behaviour of [11C]SNAP-7941. | |||
| Madin-Darby Canine Kidney cell line (MDCKII-hMDR1) | Netherlands Cancer Institute (NKI, Amsterdam, Netherlands) | Expressing the human P-glycoprotein (hMDR1) | |
| Madin-Darby Canine Kidney cell line (MDCKII-WT) | Netherlands Cancer Institute (NKI, Amsterdam, Netherlands) | Wildtype (WT) | |
| DMEM GlutaMAX | VWR International GmbH, Vienna, Austria | Gibco 61965-026 | |
| Fetal Calf Serum (FCS) | VWR International GmbH, Vienna, Austria | Gibco 10270-106 | |
| Penicillin/Streptomycin | VWR International GmbH, Vienna, Austria | Gibco 15140 | |
| Cell culture dish | Greiner Bio-One GmbH, Frickenhausen, Germany | Cellstar 100 mm x 20 mm, Mfr.No. 664160 | |
| In vitro experiments | |||
| DMEM GlutaMAX | VWR International GmbH, Vienna, Austria | Gibco 61965-026 | |
| (±)-Verapamil hydrochloride | Sigma Aldrich (St. Louis, Missouri, USA) | ||
| DMSO | Sigma Aldrich (St. Louis, Missouri, USA) | 276855-100 mL | |
| Cell culture dish | Greiner Bio-One GmbH, Frickenhausen, Germany | Cellstar 100 mm x 20 mm, Mfr.No. 664160 | |
| Sterile disposable plastic pipettes | VWR International GmbH, Vienna, Austria | Sterilin, 5 mL – 25 mL | |
| Sterile pipette tips | VWR International GmbH, Vienna, Austria | Eppendorf epT.I.P.S. Biopur 20 µL – 200 µL | |
| Cell culture flasks | Greiner Bio-One GmbH, Frickenhausen, Germany | Cellstar 250 mL, 75 cm2 red filter screw cap, Mfr.No.658175 | |
| LigandTracer control Version 2.2.2 | Ridgeview Instruments AB, Uppsala, Sweden. | ||
| LigandTracer Yellow | Ridgeview Instruments AB, Uppsala, Sweden. | ||
| LigandTracer White | Ridgeview Instruments AB, Uppsala, Sweden. | ||
| GraphPad Prism 6.0 | GraphPad Software, Inc. | ||
| Handheld automated Cell Counter | Millipore Corporation Billerica MA01821 | Scepter (Cat.No. PHC00000) | |
| Cell Counter Sensors | Millipore Corporation Billerica MA01821 | Scepter Sensor 60 µm (Cat.No. PHCC60050) |
Referenzen
- Saito, Y., Maruyama, K. Identification of melanin-concentrating hormone receptor and its impact on drug discovery. Journal of Experimental Zoology. 305, 761-768 (2006).
- Philippe, C., et al. Preclinical in vitro & in vivo evaluation of [11C]SNAP-7941 - the first PET tracer for the melanin concentrating hormone receptor 1. Nuclear Medicine and Biology. 40, 919-925 (2013).
- Philippe, C., et al. Radiosynthesis of [ 11C]SNAP-7941-the first PET-tracer for the melanin concentrating hormone receptor 1 (MCHR1). Applied. Radiation and Isotopes. 70, 2287-2294 (2012).
- Philippe, C., et al. SNAPshots of the MCHR1 : a Comparison Between the PET-Tracers [ 18 F ] FE @ SNAP and [ 11 C ] SNAP-7941. Molecular Imaging Biology. , 1-12 (2018).
- Schirmer, E., et al. Syntheses of precursors and reference compounds of the melanin- concentrating hormone receptor 1 (MCHR1) Tracers [11C]SNAP-7941 and [18F]FE@SNAP for positron emission tomography. Molecules. 18, 12119-12143 (2013).
- Miller, P. W., Long, N. J., Vilar, R., Gee, A. D. Synthese von 11C-, 18F-, 15O- und 13N-Radiotracern für die Positronenemissionstomographie. Angewandte Chemie. 120, 9136-9172 (2008).
- Pichler, V., et al. An overview on PET radiochemistry: part 1 - covalent labels - 18 F, 11 C, and 13 N. Journal of Nuclear Medicine. 59, 1350-1354 (2018).
- Pichler, V., et al. Molar activity - The keystone in 11C-radiochemistry: An explorative study using the gas phase method. Nuclear Medicine and Biology. 67, 21-26 (2018).
- Larsen, P., Ulin, J., Dahlstrøm, K., Jensen, M. Synthesis of [11C]iodomethane by iodination of [11C]methane. Applied Radiation and Isotopes. 48, 153-157 (1997).
- Dahl, K., Halldin, C., Schou, M. New methodologies for the preparation of carbon-11 labeled radiopharmaceuticals. Clinical and Translational Imaging. 5, 275-289 (2017).
- Raaphorst, R. M., et al. Radiopharmaceuticals for assessing ABC transporters at the blood-brain barrier. Clinical. Pharmacollogy & Therapeutics. 97, 362-371 (2015).
- Nics, L., et al. Speed matters to raise molar radioactivity: Fast HPLC shortens the quality control of C-11 PET-tracers. Nuclear Medicine and Biology. 57, 28-33 (2018).
- Zeilinger, M., et al. New approaches for the reliable in vitro assessment of binding affinity based on high-resolution real-time data acquisition of radioligand-receptor binding kinetics. European Journal of Nuclear Medicine and Molecular Imaging (Research). 7, 22 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten