Method Article
In vivo Bewertung der mukociliären Clearance bei Mäusen
In diesem Artikel
Zusammenfassung
In dieser Publikation beschreiben wir Protokolle zur Beurteilung der Atemwegs-Mukociliären Clearance (MCC) bei Mäusen in vivo unter Verwendung von Dual-Modality-Radionuklid-Bildgebung. Dieses Protokoll ist für eine einzelne Photonenemissions-Computertomographie (SPECT) und Einerfassungsprotokoll für Computertomographie (CT) mit Maus-Ganzkörper-Kollimatoren (MWB) in einem dualen SPECT/CT-System konzipiert.
Zusammenfassung
Respiratorische motile Zilien, spezialisierte Organellen der Zelle, säumen die apikale Oberfläche der Epithelzellen, die die Atemwege auskleiden. Durch das schlagen in einer metachronalen, synchronen Weise erzeugen diese multiplen, motilen, aktinbasierten Organellen einen Cephalad-Flüssigkeitsfluss, der die Atemwege von eingeatmeten Schadstoffen und Krankheitserregern klärt. Angesichts der zunehmenden Umweltverschmutzung, neuer viraler Krankheitserreger und aufkommenden multiresistenten Bakterien ist die von Zilien erzeugte Schleimhautclearance (MCC) für die Aufrechterhaltung der Lungengesundheit unerlässlich. MCC ist auch bei mehreren angeborenen Erkrankungen wie primäre Ziliardyskinesie, Mukoviszidose sowie erworbene Erkrankungen wie chronisch obstruktive Lungenerkrankungen depressiv. Alle diese Störungen haben, in einigen Fällen mehrere, Mausmodelle etabliert. In dieser Publikation beschreiben wir eine Methode, die eine kleine Menge an Radioaktivität und dual-modaler SPECT/CT-Bildgebung verwendet, um MCC bei Mäusen in vivo genau und reproduzierbar zu messen. Die Methode ermöglicht die Rückgewinnung von Mäusen nach der Bildgebung, die Ermöglichung serieller Messungen und die Längsprüfung potenzieller Therapeutika im Laufe der Zeit. Die Daten bei Wildtypmäusen zeigen die Reproduzierbarkeit der MCC-Messung, solange ausreichend auf Details geachtet wird und das Protokoll strikt eingehalten wird.
Einleitung
Cilia sind mikrotubuliebasierte Zellorganellen, die in der Evolutionsgeschichte von Algen bis zum Menschen konserviert werden. Sie stammen von Zelloberflächen und haben eine Reihe von Funktionen1, von der Erkennung lokaler Umweltsensorsignale bis zur Beweglichkeit, Funktionen, die vom Menschen bis zu frühen einzelligen eukaryotischen Organismen zurückverfolgt werden können2,3. Cilia kann nicht-motile und Single dienen als spezialisierte Antenne einer Zelle, um Umweltsignale zu verarbeiten; oder motile und mehrfach, schlagen in synchronisierten, metachronalen Wellen, um Flüssigkeitsfluss zu erzeugen, wie in der Auskleidung der Eileiter und der oberen und unteren Atemwege, mit Ausnahme der Terminal Bronchiole, die zu den Alveolenführen 1,2.
Die ausgedehnte Epitheloberfläche der Atemwege ist einer ständigen Kontamination in Form einer Vielzahl potenziell gefährlicher eingeatmeter Schadstoffe und Krankheitserreger ausgesetzt, was eine Verteidigung erforderlich macht. Ein wichtiger Abwehrmechanismus ist der Mukociliarapparat des Tracheobronchialbaumes, bei dem ein kontinuierlicher Fluss von abgesondertem Schleim durch das Schlagen mehrerer motiler Zilien, die die apikalen Oberflächen der Tracheo-Bronchialepithelzellen säumen, mechanisch aus der Atemwege transportiert wird. Diese funktionieren, um eingeatmete Verunreinigungen einzufangen, und durch ihre kontinuierliche, synchrone Schläge, transportieren sie cephalad4,5.
Cilia hat nachweislich Schlüsselrollen, wie z. B. bei der Entwicklung von Links-Rechts-Mustern bei der Entwicklung von Embryonen, bei denen motile Zilien am embryonalen Knoten Symmetrie brechen6. Mutationen in Zilien-bezogenen Genen wurden aufgrund der asymmetrischen Struktur des Herzens mit Krankheiten wie angeborenen Herzerkrankungen (CHD) in Verbindung gebracht6. Jüngste Studien haben eine hohe Inzidenz von Ziliarfunktionsstörungen in den Atemwegen von Patienten mit CHD berichtet, sowie eine erhöhte Prävalenz von postoperativen Atemwegskomplikationen und chronischen Atemwegssymptomen in den oberen und unteren Atemwegen7,8,9,10. Patienten mit CHD und Ziliarfunktionsstörungen, mit oder ohne Heterotaxie, haben nachweislich ein erhöhtes Risiko für Atemwegskomplikationen und negative Atemfolgen postoperativ5,8,10. Über ihre Rolle bei der Signalisierung und Entwicklung hinaus wurde die Bedeutung der Atemwegszilailia durch Ciliopathien demonstriert, von denen ein Paradebeispiel die primäre Ziliardyskinesie (PCD) ist. PCD ist eine angeborene Erkrankung, die aus einer Reihe von Mutationen resultiert, die die motile Respiratil-Zilien beeinflussen, was zu wiederkehrenden Lungeninfektionen, Bronchiektase und potenziell der Notwendigkeit einer Lungentransplantation11führt. Darüber hinaus, obwohl Zilien sind normal bei Mukoviszidose (CF), häufigste angeborene Störung in der kaukasischen Bevölkerung, MCC ist durch dicken, zähflüssigen Schleim infolge von Mutationen im CFTR-Gen12beeinträchtigt. Es gibt mehrere Mausmodelle von PCD und CF, sowie eine ständig wachsende Anzahl von Modellen von CHD. Letztlich sind Zilien vielseitige Strukturen mit vielen Schlüsselrollen, und eine Methode zur Beurteilung der Funktion der motilen Atemwegszilien in vivo kann für präklinische Studien wertvoll sein, und die Bewertung der Auswirkungen von Mutationen sowie Medikamenten auf die mukociliäre Clearance (MCC)13. Die Methode wäre auch wertvoll für die Bewertung der Wirkung von neuartigen Medikamenten, Gentherapie oder Interventionen auf MCC in diesen Mausmodellen.
Es gibt viele verschiedene Modelle, die verwendet wurden, um MCC zu bewerten. Eine bemerkenswerte Methode beinhaltet die Verwendung von Methylenblaufarbstoff, der in den Bronchus eingeflößt wurde, wobei die Clearance durch Faseroptikmessung der Farbstoffbewegung14gemessen wird. Diese Methode wird durch die Fähigkeit eingeschränkt, die Bewegung des Farbstoffs zu beobachten, was beim Menschen routineistischer ist als bei präklinischen Mausmodellen. Eine weitere bemerkenswerte Methode ist die Synchrotronphasen-Kontrast-Röntgenbildgebung (PCXI), mit der einzelne Partikel in einer Atemwege verfolgt werden können. Diese Methode ist relativ neu und nicht allgemein zugänglich15. Es gibt zahlreiche ex vivo Methoden zur Beurteilung der Atemwege durch Exzisierung einer Luftröhre für die Videomikroskopie, aber diese Modelle bieten wenig Nutzen bei menschlichen Patienten16. Hochauflösende Techniken für Zilien-Bildgebung wie optische Kohärenztomographie sind auf die gleiche Weise begrenzt17.
In diesem Artikel stellen wir eine reproduzierbare Methode zur Messung von MCC in vivo vor, die verwendet wurde, um Lungenabstände in unzähligen Tiermodellen zu messen, sowie MCC bei chronisch obstruktiver Lungenerkrankung zu untersuchen und die Auswirkungen von immunsuppressiven Medikamenten18,19zu bewerten. Diese Methode verfolgt die Clearance des radiopharmazeutischen 99mTechnetium-Schwefelkolloids (99mTc-Sc), eines unlöslichen Partikelradiotracers, nach der Instillation in die Lunge. Das Radionuklid kann dann mit der Computertomographie der einzelnen Photonenemission (SPECT)18,20verfolgt werden. Wir haben diese Technik zur Messung von MCC weiter verfeinert, indem wir die duale Modalität SPECT und Computertomographie (CT) Bildgebung mit Kolokalisierung der Radioisotopenzählungen in der Lunge und Messung der Abnahme dieser Zählungen über 6 Stunden verwendet haben. Dual-Modality-Bildgebung, mit Co-Registrierung von CT- und SPECT-Bildern ermöglicht eine genaue Lokalisierung der Strahlungszählungen in unserer Interessenregion, der Lunge. Obwohl wir die Methode zur MCC-Messung bei Mäusen detailliert beschreiben, kann das Protokoll angepasst werden, um MCC bei Ratten zu untersuchen. Die Kollimatoren müssten ebenso angepasst werden wie die Strahlendosis. Unserer Ansicht nach sind Maus-MCC-Scans aufgrund der kleinen Tiergröße technisch anspruchsvoller, aber aufgrund der großen Anzahl etablierter Mausmodelle einer Reihe menschlicher Störungen nützlicher als Ratten. Darüber hinaus ist aufgrund ihrer geringeren Kosten und Wartungskosten in Tierkolonien eine größere Stichprobengröße bei Mäusen möglich.
Protokoll
Der Institutional Animal Care and Use Committee der University of Pittsburgh genehmigte alle in dieser Veröffentlichung aufgeführten Tierprotokolle, bevor er eines dieser Tierversuche durchführte.
HINWEIS: In diesem Protokoll wird erläutert, wie in vivo mukociliäre Clearance-Studien unter Verwendung von Radionuklid-Bildgebung mit einem SPECT/CT-Scanner mit doppelter Modalität durchgeführt werden. Die gezeigten Techniken sind das Laufen von Systemkalibrierungen, die Anästhesisierung von Mäusen, die Trachealintubation von Mäusen, das Einflößen des Isotops in die Lunge, dualmodale Bildgebung, Die Koregistrierung dieser Bilder und die Analyse.
1. SPECT/CT System-Setup
- Entwerfen Sie einen geeigneten Workflow und richten Sie sie vor der Durchführung von Experimenten mit lebenden Tieren ein.
- Verwenden Sie eine SPECT-Erfassung, die aus 60 Projektionen mit einer Schrittgröße von 6o zwischen den Projektionen mit einem Drehradius von 40 cm besteht. Die CT-Erfassung besteht aus 220 Projektionen mit einem Winkel von 1,6o zwischen den Projektionen.
- Stellen Sie sicher, dass das System über die richtigen MWB-Kollimatoren für Mäuse und SPECT-Bildgebung verfügt. Wenn die ungeeigneten Kollimatoren installiert sind, installieren Sie die richtigen Kolimmator-Assistenten.
- Führen Sie die erforderlichen Systemkalibrierungen aus, um das System für den Einsatz vorzubereiten.
HINWEIS: Die SPECT- und CT-Komponenten des Scanners müssen kalibriert werden. Kalibrieren Sie die CT-Komponenten einmal täglich mit einer Quellkonditionierung und einer Dark/Light (D/L)-Kalibrierung, alle 2 Wochen eine Center Offset (COS)-Kalibrierung und bewerten Sie die Röntgenhardware jeden Monat. Die SPECT-Komponenten müssen einmal im Jahr kalibriert werden.- Um die Röntgenhardware auszuwerten, aktivieren Sie das Feld Röntgenhardware auswerten während der CT-Kalibrierung (Supplemental CT Calibration Menu).
- Um die Quellkonditionierung durchzuführen, aktivieren Sie das Kontrollkästchen Quellkonditionierung während der CT-Kalibrierungen durchführen (Supplemental CT Calibration Menu).
- Um eine D/L-Kalibrierung durchzuführen, aktivieren Sie das D/L-Feld neben dem CT-Erfassungsprotokoll, das bei Experimenten während CT-Kalibrierungen verwendet wird. Deaktivieren Sie alle anderen Protokolle (Ergänzendes CT-Kalibrierungsmenü).
- Um eine COS-Kalibrierung durchzuführen, ersetzen Sie das Bett durch das Kalibrierringwerkzeug, passen Sie die Bettentypeinstellungen an die Bewegungssteuerungseinstellungen an, und aktivieren Sie das COS-Feld neben dem CT-Erfassungsprotokoll, das bei Experimenten während CT-Kalibrierungen verwendet wird. Deaktivieren Sie alle anderen Protokolle (Ergänzendes CT-Kalibrierungsmenü, Ergänzungskalibrierungsring).
2. Mausintubation und Instillation
- Wiegen Sie die zu scannenden Mäuse. Wenn Sie mehrere Mäuse scannen, achten Sie darauf, die Mäuse zu Identifikationszwecken mit Methoden wie Ohrstanzen oder Markierung des Schwanzes zu markieren.
- Anästhetisieren Sie eine Maus mit 1,5% Isofluran emit einem Gasstrom von 2 L/minO2 in einer Gaskammer für 5 Minuten, um eine Anästhesie von ausreichender Tiefe zu erzeugen, bis sich die Atmung auf 55-65 Atemzüge pro Minute verlangsamt 16 (Abbildung 1A).
- Entfernen Sie die Maus aus der Kammer und hängen Sie durch die vorderen Schneidezähne an einem Intubationsständer bei einer Steigung von 45o. Rüsten Sie den Intubationsständer mit einem Nasenkegel aus, um sicherzustellen, dass die Maus während der Intubation befruchtet wird (Abbildung 1B).
- Schließen Sie ein Ende eines 50-mm-Glasfaserdrahts an eine Lichtquelle an und fädeln Sie eine 20-Spur-Kanüle darüber, indem Sie den Draht als Führungslinie verwenden (Abbildung 1C).
- Öffnen Sie den Mund der Maus und ziehen Sie die Zunge mit stumpfer Zange nach vorne. Beleuchten Sie den Führungsdraht und verwenden Sie ihn, um die Stimmbänder zu visualisieren (Abbildung 1D).
- Passieren Sie den Führungsdraht durch die Stimmbänder, so dass der Draht direkt hinter den Stimmbändern liegt und in der oberen Luftröhre ruht. Schieben Sie die 1 Zoll Kanüle entlang des Drahtes nach vorne, um die Maus zu intubieren, und passieren Sie die Kanüle tief genug, so dass die Nabe davon gegen die Schneidezähne des Tieres ist (Abbildung 1E). Entfernen Sie den Draht, der die Kanüle an Ort und Stelle lässt.
- Testen Sie die Intubation, indem Sie die Kanüle kurz mit einem Finger verstopfen und auf Atemänderungen überprüfen. Angehaltene Atmung oder angespannte Atmung während des Verstopfens und beschleunigte Atmung bei der Freisetzung sind Anzeichen einer richtigen Trachealintubation. Wenn es keine Änderung der Atemwege beim Verstopfen der Kanüle gibt, ist letztere wahrscheinlich in der Speiseröhre.
- Bereiten Sie 0,2 mCi von 99mTechnetium-Schwefelkolloid (99mTc-Sc) in einem Volumen von 10 l und Pipette in die Kanüle vor. Lassen Sie die Maus spontan in die Lunge über 1-2 min einatmen (Abbildung 1F). Entfernen Sie die Kanüle, bevor Sie die Maus auf die Palette des Scanners übertragen.
HINWEIS: Das Radionuklid wurde von Cardinal Health vorbereitet und gefiltert.
3. SPECT/CT-Bildgebung
- Übertragen Sie die Maus auf eine 25-mm-Palette mit einem Nasenkegel und sichern Sie mit Klebeband, wobei darauf zu achten ist, Brust und Bauch nicht zu fest zu kleben, um eine Beeinträchtigung der Atmung zu vermeiden. Achten Sie darauf, alle Anstriche aus Metall zu entfernen, die an der Maus befestigt sind.
- Bereiten Sie ein radioaktives Phantom bestehend aus 0,05 mCi in 200 l vor und legen Sie diese Menge in ein 0,2 ml PCR-Rohr. Positionieren Sie das Rohr, indem Sie sich auf die Palette unter dem Unterbauch der Maus kleben, um Überlappungen mit der Lunge zu vermeiden.
HINWEIS: Das Phantom wird zum Zwecke der Ko-Registrierung von CT- und SPECT-Bildern sowie einer Negativkontrolle für die Räumung verwendet. - Legen Sie die Maus in das SPECT/CT-System ein, wählen Sie den Imaging-Workflow aus, und führen Sie Setup aus.
- Richten Sie die Positionierung der Detektoren auf der Maus ein, und führen Sie den Imaging-Workflow aus.
- Bereiten Sie einen Käfig für Mäuse vor, die nach dem Eingriff Radioaktivität erhalten haben, mit uneingeschränktem Zugang zu Nahrung und Wasser und klarer Kennzeichnung mit einem Strahlenschutzaufkleber.
- Entfernen Sie nach Abschluss des Workflows die Maus von der Bildpalette, und lassen Sie sie im vorbereiteten Käfig für eine Dauer von 6 Stunden zwischen den Scans (Ende von Scan 1 bis Anfang des Scans 2) mit ad libitum Zugang zu Nahrung und Wasser wiederherstellen. 6 h wurde gewählt, da es dem Zeitraum entspricht, in dem die lineare Clearance je nach Zilienfunktion mit sehr wenig Alveolarabstand stattfindet.
- Nach 6 Stunden, re-anästhetisieren Sie die Maus und scannen, zusammen mit dem Phantom, mit dem gleichen Workflow, um die Menge an Isotop aus den Atemwegen gelöscht zu messen.
HINWEIS: Es ist wichtig, dass sich die Maus 6 Stunden lang erholen kann, da eine ununterbrochene Anästhesie mit Isofluran zu einer signifikanten ziliendepressierenden Wirkung führt, die zu fast Null-Mukociliärabständen führt.
4. Analyse
- Führen Sie nach der Bildgebung eine Nachbearbeitung durch, um vollständige 3D-Stack-Images zu rekonstruieren.
- Histogramm die SPECT-Bilder mit den Werksstandardeinstellungen für 99mTc, und dann rekonstruieren mit einem MAP3D-Algorithmus und Punkt-Spread-Funktion (PSF) Rekonstruktion.
HINWEIS: Die Rekonstruktion wurde mit 8 Iterationen und 6 Teilmengen durchgeführt. Eine effektive Rekonstruktion erfordert ein Verhältnis von Teilmengen zu Projektionen bei 1:10 oder gleichmäßig in die Anzahl der Projektionen aufzuteilen, so dass 6 Teilmengen aufgrund der Erfassung mit 60 Projektionen verwendet wurden. - Rekonstruieren Sie die CT-Bilder mit dem Feldkamp-Algorithmus und einem Shepp-Logan-Filter.
HINWEIS: Die Rekonstruktion wurde mit 4 Iterationen durchgeführt.
- Histogramm die SPECT-Bilder mit den Werksstandardeinstellungen für 99mTc, und dann rekonstruieren mit einem MAP3D-Algorithmus und Punkt-Spread-Funktion (PSF) Rekonstruktion.
- Verarbeiten Sie die CT- und SPECT-Bilder in FIJI ImageJ21 mit dem Werkzeug Reslice, um koronale Ansichtsbilder aus den standardmäßigen axialen Bildern zu generieren. Führen Sie dann eine Z-Stack-Summenprojektion auf dem SPECT-Bild aus, um die Zähldaten aus jedem Slice hinzuzufügen und ein einzelnes Bild zu generieren, um die Analyse zu vereinfachen.
- Ändern und Registrieren der CT- und SPECT-Bilder mit der Phantom-Eppendorf-Röhre als Referenz (Abbildung 2A,B). Verfolgen und verwenden Sie konsistente Größengrößenmessungen für alle Proben.
- Binarisieren Sie das CT-Bild mithilfe der automatischen Schwellenwertierung, gefolgt von der Umkehr des Stapels und der Durchführung einer Z-Stack-Summenprojektion, um einen Umriss der Lunge für die Analyse zu generieren (Abbildung 2C).
- Drehen Sie die CT- und SPECT-Bilder, und führen Sie das Bild mit den Kanalwerkzeugen zusammen. Berechnen Sie MCC, indem Sie einen ROI um die rechte Lunge zeichnen und messen (Abbildung 2D).
ANMERKUNG: Diese Messung wird die Gesamtzahl der Werte in der rechten Lunge für die 0- und 6-Stunden-Zeitpunkte sein, wobei die 6-Stunden-Bilder für radioaktiven Zerfall mit der Formel korrigiert werden: N(t) = N0e.t. 99m Tc-Sc hat eine Zerfallskonstante von 3,21e5 pro Sekunde bei einer Halbwertszeit von 6 Stunden. Diese Werte können dann verwendet werden, um einen prozentualen Abstand zu berechnen.
HINWEIS: Die rechte Lunge wird für die ROI-Zeichnung und Messanzahl ausgewählt, da die Mukociliaary Clearance das Radioisotop aus der Lunge zum Rachen transportiert, von wo es geschluckt wird und im Magen landet. Sehr häufig können Zählungen im Magen gesehen werden, die sich mit der linken Lunge überlappen und somit fehlerhafte Zählungen erzeugen können. Diese Verwechslung kann vermieden werden, indem die Zählungen nur in der rechten Lunge gemessen werden.
Ergebnisse
Mit diesem Protokoll haben wir Mäuse in einer Isoflurankammer anästhesiert (Abbildung 1A). Nach Erreichen eines ausreichenden Anästhesieniveaus wurden Die Mäuse auf vertikale Stützen gelegt (Abbildung 1B) und die Stimmbänder wurden mit einem beleuchteten Führungsdraht visualisiert (Abbildung 1C-1D). Die Mäuse wurden intubiert und mit 0,2 mCi 99mTc-Sc in Volumen von 10 l durch eine Kanüle eingeweischt und Mäuse durften spontan in die Lunge einatmen (Abbildung 1E-1F). Nach der Bildaufnahme und -verarbeitung wurden die CT- und SPECT-Bilder kolokalisiert (Abbildung 2A) mit dem Phantomrohr als Wahrzeichen (Abbildung 2B). Masken der Lunge wurden aus dem CT-Bild(Abbildung 2C) erzeugt und verwendet, um ROIs um die rechte Lunge für die Analyse bei 0 (Abbildung 2D) und 6 Stunden (Abbildung 2E-2F) zu zeichnen. Um die Reproduzierbarkeit des Protokolls zu testen, wurden insgesamt 8 Mäuse zweimal an verschiedenen Tagen mit identischen Versuchsbedingungen gescannt, wobei die Analyse mit einem gekoppelten t-Test keinen signifikanten Unterschied zwischen den Wiederholungsscans (p-Wert=0,9904) zeigte (Abbildung 3A). Weitere 2 Mäuse wurden dreimal an verschiedenen Tagen mit identischen Versuchsbedingungen gescannt, wobei die Analyse mit einseitiger ANOVA eine signifikante Übereinstimmung zwischen den Wiederholungsscans zeigte (p-Wert 0,0041) (Abbildung 3B). Insgesamt wurden 8 Mäuse gescannt und zwei repräsentative Bilder gezeigt (Abbildung 4).
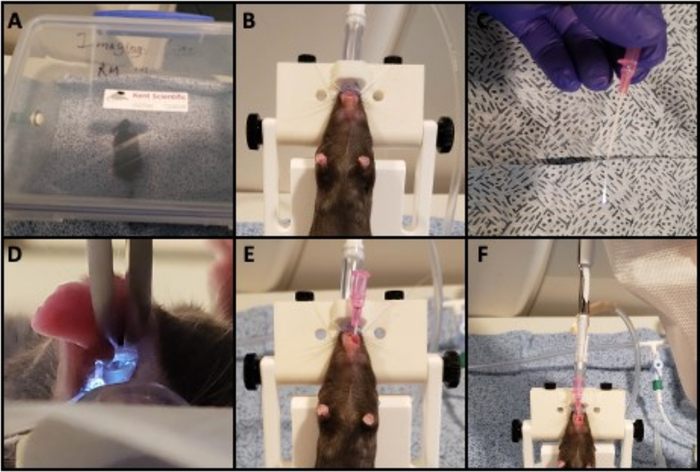
Abbildung 1: Mausintubierung und Isotopeninstillation. Bilder der Schritte, die zum Intubieren und Einflößen von Isotopen in die Atemwege erforderlich sind. A) Die Maus wird in einer Kammer bezähnstisglich anästhesiert. B) Die anästhesierte Maus wird auf einen vertikalen Träger gelegt, der von den vorderen Schneidezähnen aufgehängt wird. C) Ein beleuchteter 0,5-mm-Glasfaserdraht, der als Führungsdraht dient, wird durch einen 20 G Kanüle vorbereitet. D) Der Mund der Maus wird mit Zangen geöffnet und mit dem beleuchteten Führungsdraht beleuchtet, um die Stimmbänder zu visualisieren. E) Die Kanüle wird über die Stimmbänder geschoben und der Führungsdraht entfernt. F) Lösliches Isotop wird mit einer Pipette in die Kanüle eingeflößt und die Maus darf das Isotop spontan in die Lunge einatmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
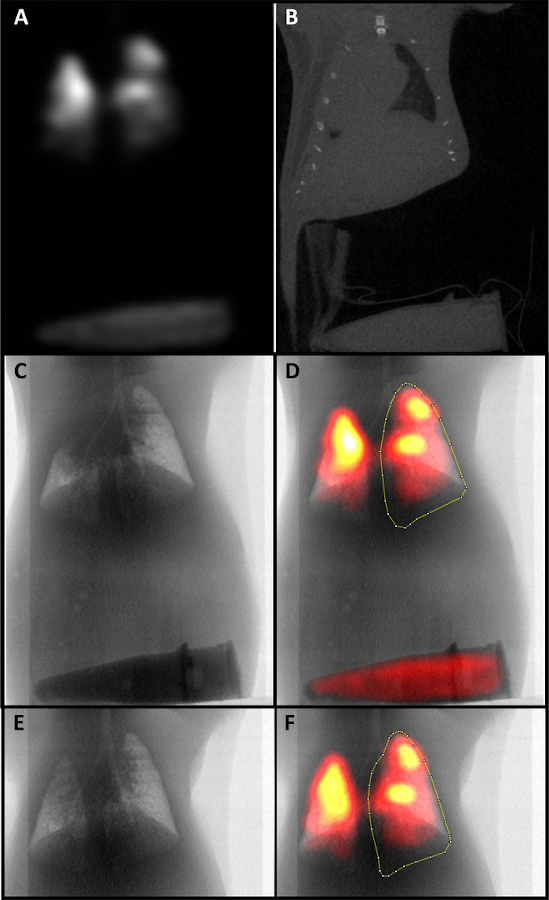
Abbildung 2: SPECT/CT-Bilder eines MCC-Scans. A) Ein SPECT-Bild, das mit einem CT-Bild kolokalisiert wurde. B) Ein CT-Bild mit einem sichtbaren Phantomrohr, das für die Kolokalisierung verwendet wurde. C) Eine Maske der Atemwege, die durch Binarisieren des CT-Bildes und Durchführung einer Z-Stack-Summenprojektion abgeleitet wird. D) Die CT-Maske ist mit dem SPECT-Bild kolokalisiert. Ein ROI für die Analyse wurde um die rechte Lunge gezogen. E) Eine Maske der Atemwege bei 6 Stunden. F) Ein CT und SPECT kolokalisiertes Bild der Atemwege bei 6 Stunden mit einem ROI für die Analyse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
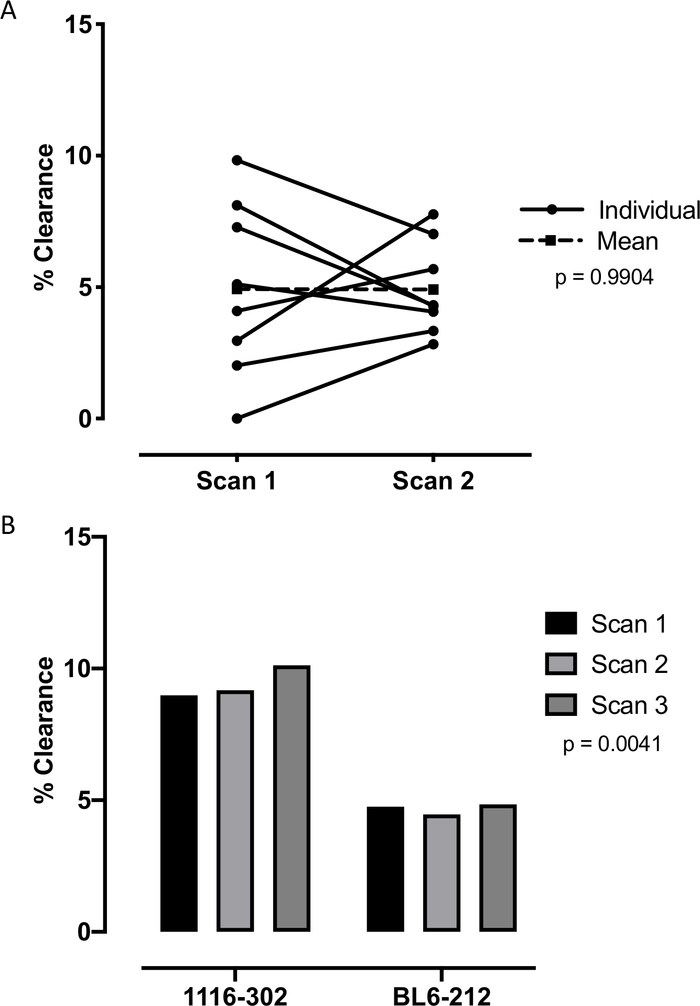
Abbildung 3: Clearance-Messungen derselben Mäuse über mehrere Scans hinweg. A) Für 8 Mäuse wurden zwei individuelle Wiederholungsabstände ohne Veränderungen der Versuchsbedingungen gemessen. Ein gekoppelter t-Test zeigte, dass es keinen signifikanten Unterschied zwischen den Wiederholungsscans mit einem p-Wert von 0,9904 gab. B) Für zwei Mäuse wurden drei einzelne Wiederholungsabstände ohne Veränderung der Versuchsbedingungen gemessen. Eine einwegige ANOVA zeigte, dass zwischen den Wiederholungsscans ein signifikanter Übereinstimmung mit einem p-Wert von 0,0041 bestand. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
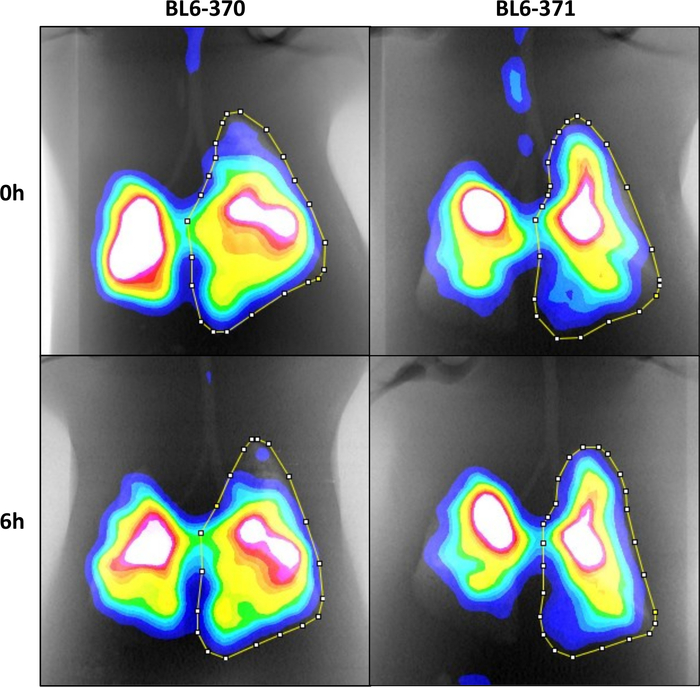
Abbildung 4: Kolokalisierte SPECT/CT-Bilder der 0- und 6-stündigen Atemwege bei 2 Mäusen mit ROIs, die bei 0 und 6 Stunden gezeichnet werden und die rechte Lunge umreißen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Ein Video der Stimmbänder, die von einem Glasfaserdraht beleuchtet werden, mit dem Effekt der Atmung visualisiert. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzende Dateien. Bitte klicken Sie hier, um diese Dateien herunterzuladen.
Diskussion
Die Rolle der motilen Respirator Zilien bei Krankheiten und Entwicklung entwickelt sich weiter und wird besser geschätzt. Synchrones, metachronales Schlagen mehrerer motiler Zilien auf der apikalen Oberfläche von Zellen, die den tracheobronchiale Baum aussäen, erzeugen cephaladen Fluss, der eine mukociliäre Clearance oder MCC erzeugt. MCC ist in Ciliopathien wie PCD22kompromittiert, erworbene Krankheiten wie COPD18, und seine Bedeutung wird in CHDs erkannt, die traditionell nicht als Ciliopathien angesehen werden. Jüngste Daten haben gezeigt, dass die Ziliarfunktionsstörung der Atemwege sowohl bei DER CHD mit Heterotaxy23 als auch ohne Heterotaxie7aufgetreten ist. Eine solche motile Ziliendysfunktion wurde gezeigt, in größere Atemwegssymptome zu übersetzen9 sowie größere postoperative Morbidität8. Die meisten, wenn nicht alle dieser Krankheiten, haben Mausmodelle zur Verfügung und unser Protokoll zur Messung von MCC bei Mäusen ist ein wertvolles Werkzeug, das verwendet werden kann, um potenzielle Therapeutika zu testen.
Tiermodelle liefern Nutzen für das Verständnis von Krankheiten und die Entwicklung von Therapien. In vivo Tierbildbietet weitere Nützlichkeit mit der Fähigkeit, mehrere Datenpunkte von den gleichen Tieren zu erfassen, ohne die Notwendigkeit, die Tiere zu opfern, so dass die Forscher Längsverlauf der Krankheit zu folgen sowie die Dauer der Behandlungseffekte zu studieren. Das Mausmodell von MCC wurde im Laufe von Jahrzehnten von mehreren Forschern entwickelt, zunächst an Beagle-Hunden mit planarer Szintigraphie durchgeführt, einer zweidimensionalen nuklearenBildgebungstechnik 24. Die Technik wurde für den Einsatz bei Mäusen ein Jahrzehnt später angepasst, gefolgt von der Anpassung an SPECT Bildgebung ein Jahrzehnt später25,26. Die Entwicklung dieser Technik in Mausmodellen war eine wichtige Entwicklung in der Relevanz dieser Technik, aufgrund der Verfügbarkeit von mehreren Mausmodellen menschlicher Krankheiten wie PCD, bei denen die Ziliarfunktion signifikant verändert wird. MCC wurde in Mausmodellen der Lungendenervation und Immunsuppression bewertet und hat das Potenzial, in Verbindung mit anderen Modellen19,26verwendet zu werden. MCC-Messstudien an menschlichen Patienten mit Atemwegserkrankungen wie CF, Asthma, PCD und Ciliopathien im Zusammenhang mit CHD wurden durchgeführt und haben Ergebnisse erbracht, dass die Technik sowohl Studien der Lungenphysiologie als auch der therapeutischen Wirksamkeit unterstützen kann13.
Ein wichtiger Teil dieses Protokolls ist das Einrichten von Erfassungen mit den richtigen Bildparametern, um genaue Bilder für die Quantifizierung zu erfassen. Eine Reihe von Faktoren sind entscheidend beim Entwerfen von SPECT-Erfassungseinstellungen, einschließlich der verwendeten Kollimatoren, der Anzahl der pro Umdrehung zu erfassenden Projektionen und der Rotationsschrittgröße. Die Auswahl des Kollimators ist ein wichtiger Faktor für die Empfindlichkeit und Auflösung der Erfassung, und die Erfassungseinstellungen müssen möglicherweise auf den verwendeten Kollimator zugeschnitten werden27. Alternativ müssten bei der Verwendung größerer Tiere wie Ratten die Kollimatoren angepasst werden. Mehrere Lochkollimatoren zum Beispiel sind empfindlicher, aber bei der Auswahl einer Schrittgröße sollte Vorsicht geboten sein, um überlappende Projektionen zu vermeiden und unerwünschtemultiples Multiplexing zu verursachen, was die Empfindlichkeit der Erfassung auf Kosten einer Bildmehrdeutigkeit, die Rekonstruktionsartefakte verursachen kann, weiter erhöhen kann25. Die Rekonstruktionseinrichtung ist auch der Schlüssel, um quantifizierbare Bilder zu generieren. MAP3D ist ein häufig verwendeter iterativer Rekonstruktionsalgorithmus, und PSF ist ein gemeinsames Rekonstruktionsmodell. Beide sind zuverlässig für die Rekonstruktion von Bildern, aber beim Festlegen der Anzahl der Iterationen und Teilmengen sollte Vorsicht geboten sein. Eine höhere Anzahl von Iterationen erhöht die Rechenzeit, die für die Rekonstruktion benötigt wird, und erhöht die Qualität der Rekonstruktion mit abnehmenden Erträgen bei weiterer Erhöhung.
Um Bilder in ImageJ zu quantifizieren, ist RawIntDen das ideale Messwerkzeug, das den Summenwert von Pixeln in einer Auswahl ausgibt. Bei der Quantifizierung von SPECT-Daten über Lungen-ROIs unterschiedlicher Größe bietet die Verwendung von RawIntDen ein absolutes Maß für die Anzahl und vermeidet eine Anpassung der Messung an den Bereich des ROI, wie die mittlere Messung21.
Diese Technik hat eine Reihe von zugeordneten Fehlerquellen, die der Prüfer bei der Anwendung dieser Technik kennen sollte. Ein bemerkenswerter Konstifter ist die Verwendung von Anästhetika. Isoflurane ist ein schnell wirkendes, inhaliertes Anästhetikum, von dem sich die Mäuse nach Abschluss einer Erfassung schnell erholen. Es sollte jedoch darauf geachtet werden, den Mäusen genügend Zeit zu geben, sich in ihren Käfigen zu erholen, und nicht länger als nötig befruchtet zu halten. In unserer persönlichen Erfahrung (unveröffentlichte Daten) zeigten Mäuse, die kontinuierlich mit inhaliertem Isofluran zwischen dem 0- und 6-Stunden-Zeitpunkt anästhesiend gehalten wurden, eine vernachlässigbare Clearance. Ebenso ist eine kontrollierte Dosis an Anästhetikum notwendig, um eine schnelle Genesung zu gewährleisten. Bei der Sicherung des Tieres auf der Palette für die Bildgebung sollte das Phantomrohr, das für die Mitregistrierung verwendet wird, auf dem Magen niedrig gehalten werden, um zu vermeiden, dass sich Artefakte mit der Lunge überlappen. Um ein hochwertiges CT-Bild zu gewährleisten, achten Sie darauf, Metall-Tags von der Maus zu entfernen, um Artefakte aus der Röntgenstreuung zu vermeiden.
Das aktuelle MCC-Protokoll kann auf unzählige Tiermodelle angewendet werden. Diese Technik hat eine vernachlässigbare Wirkung auf die Gesundheit des gescannten Tieres, wird von Mäusen gut vertragen und kann daher mit Krankheitsmodellen verwendet werden, ohne die Gesundheit bereits empfindlicher Mäuse zu gefährden. Die Stärke dieser Methode ergibt sich aus einer In-vivo-Technik, die den Erwerb konsistenter und wiederholbarer Messungen der Atemwegsfunktion ohne das Opfer von Tieren ermöglicht, Tracheas für die Videomikroskopie zu verbrauchen, die ex vivo-Modelle26erfordern. Die Konsistenz dieser Technik bei der Erstellung wiederholbarer Messungen bei mehreren Scans derselben Tiere ermöglicht es, dasselbe Tier mit verschiedenen Wirkstoffen oder potenziellen Therapeutika zu behandeln, und statistische Vergleiche zwischen demselben Tier, um die biologische Variabilität eines Tiermodells zu verringern, wodurch die Stichprobengröße verringert wird, die erforderlich ist, um statistisch signifikante Unterschiede aufzuzeigen.
Die Beurteilung der Atemwegsfunktion mit der MCC-Technik kann an eine Vielzahl von Tiermodellen angepasst und auf viele verschiedene Modelle der Atemwegsgesundheit angewendet werden, sowie neue Therapien testen. Die Atemwege von Mausmodellen von PCD können mit dieser Technik bewertet werden, sowie Modelle von COPD. Unsere Methode kann auch verwendet werden, um Differentialeffekte von verschiedenen Anästhetika auf MCC zu studieren, die im allgemeinen klinischen Einsatz sind. Schließlich können auch die Wirkungen von therapeutischen Wirkstoffen auf die Atemwege anhand dieses Modells beurteilt werden. Wie bereits erwähnt, aber trägt Wiederholung, da es sich um eine In-vivo-Messung ermöglicht es für die Wiederholung MCC-Bewertungen im Verlauf einer Krankheit, sowie Test-Vorteile der therapeutischen Interventionen im Laufe der Zeit. Darüber hinaus sind Mäuse die häufigsten Labortiere, die verwendet werden, um menschliche Krankheiten nachzuahmen/zu studieren, wobei in einigen Fällen mehrere transgene Mausmodelle menschlicher Krankheiten zur Auswahl stehen.
Offenlegungen
Keiner hat mit dieser Arbeit zu tun.
Danksagungen
M.Z. und K.S.F. und diese Arbeit wurde durch ein Stipendium unterstützt, das im Rahmen der Pitt Innovation Challenge (PInCh) durch das Clinical and Translational Science Institute der University of Pittsburgh und das NHLBI R01 Grant HL153407 an M.Z. vergeben wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| 500 µm Unjacketed Fiber Optic Wire | Edmund Optics | 02-532 | |
| 99mTechnecium-Sulfur Colloid | Cardinal Health | ||
| Anesthesia Vaporizer | Vetland Medical | A13480 | |
| Durmont #5 Forceps | Fine Science Tools | 99150-20 | |
| FIJI ImageJ 2.0.0-rc-65/1.52p Software | |||
| Introcan Safety Catheters 20G 1inch | Fisher Scientific | NC1534477 | |
| Isoflurane | Henry Schein | 118-2097 | |
| Mouse Intubation Stand | Kent Scientific | ETI-MSE-01 | |
| Siemens Inveon dual-modality SPECT/CT | Siemens | ||
| Single Channel Anesthesia Stand | Summit Anesthesia Solutions | 22860 |
Referenzen
- Afzelius, B. A. Cilia-related diseases. Journal of Pathology. 204 (4), 470-477 (2004).
- Mitchell, D. R. The evolution of eukaryotic cilia and flagella as motile and sensory organelles. Advances in Experimental Medicine and Biology. 607, 130-140 (2007).
- Carvalho-Santos, Z., Azimzadeh, J., Pereira-Leal, J. B., Bettencourt-Dias, M. Evolution: Tracing the origins of centrioles, cilia, and flagella. Journal of Cell Biology. 194 (2), 165-175 (2011).
- Randell, S. H., Boucher, R. C. University of North Carolina Virtual Lung, G. Effective mucus clearance is essential for respiratory health. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 20-28 (2006).
- Wanner, A., Salathe, M., O'Riordan, T. G. Mucociliary clearance in the airways. American Journal of Respiratory and Critical Care Medicine. 154, 1868-1902 (1996).
- Li, Y., et al. Global genetic analysis in mice unveils central role for cilia in congenital heart disease. Nature. 521 (7553), 520-524 (2015).
- Zahid, M., et al. Airway ciliary dysfunction and respiratory symptoms in patients with transposition of the great arteries. PLoS One. 13 (2), 0191605 (2018).
- Stewart, E., et al. Airway ciliary dysfunction: Association with adverse postoperative outcomes in nonheterotaxy congenital heart disease patients. Journal of Thoracic and Cardiovascular Surgery. 155 (2), 755-763 (2018).
- Garrod, A. S., et al. Airway ciliary dysfunction and sinopulmonary symptoms in patients with congenital heart disease. Annals of the American Thoracic Society. 11 (9), 1426-1432 (2014).
- Harden, B., et al. Increased postoperative respiratory complications in heterotaxy congenital heart disease patients with respiratory ciliary dysfunction. Journal of Thoracic and Cardiovascular Surgery. 147 (4), 1291-1298 (2014).
- Leigh, M. W., et al. Clinical and genetic aspects of primary ciliary dyskinesia/Kartagener syndrome. Genetics in Medicine. 11 (7), 473-487 (2009).
- Donaldson, S. H., et al. Effect of ivacaftor on mucociliary clearance and clinical outcomes in cystic fibrosis patients with G551D-CFTR. JCI Insight. 3 (24), (2018).
- Donaldson, S. H., Corcoran, T. E., Laube, B. L., Bennett, W. D. Mucociliary clearance as an outcome measure for cystic fibrosis clinical research. Proceedings of the American Thoracic Society. 4 (4), 399-405 (2007).
- Ledowski, T., Hilmi, S., Paech, M. J. Bronchial mucus transport velocity in patients receiving anaesthesia with propofol and morphine or propofol and remifentanil. Anaesthesia. 61 (8), 747-751 (2006).
- Donnelley, M., Morgan, K. S., Siu, K. K., Parsons, D. W. Dry deposition of pollutant and marker particles onto live mouse airway surfaces enhances monitoring of individual particle mucociliary transit behaviour. Journal of Synchrotron Radiation. 19, 551-558 (2012).
- Christopher, A. B., et al. The effects of temperature and anesthetic agents on ciliary function in murine respiratory epithelia. Frontiers in Pediatrics. 2, 111 (2014).
- Liu, L., et al. Method for quantitative study of airway functional microanatomy using micro-optical coherence tomography. PLoS One. 8 (1), 54473 (2013).
- Lam, H. C., et al. Histone deacetylase 6-mediated selective autophagy regulates COPD-associated cilia dysfunction. Journal of Clinical Investigation. 123 (12), 5212-5230 (2013).
- Bhashyam, A. R., et al. A pilot study to examine the effect of chronic treatment with immunosuppressive drugs on mucociliary clearance in a vagotomized murine model. PLoS One. 7 (9), 45312 (2012).
- Ortiz, J. L., et al. Evaluation of Mucociliary Clearance by Three Dimension Micro-CT-SPECT in Guinea Pig: Role of Bitter Taste Agonists. PLoS One. 11 (10), 0164399 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Solomon, G. M., et al. Assessment of ciliary phenotype in primary ciliary dyskinesia by micro-optical coherence tomography. JCI Insight. 2 (5), 91702 (2017).
- Nakhleh, N., et al. High prevalence of respiratory ciliary dysfunction in congenital heart disease patients with heterotaxy. Circulation. 125 (18), 2232-2242 (2012).
- Whaley, S. L., Renken, S., Muggenburg, B. A., Wolff, R. K. Technique for aerosol deposition restricted to the nose in beagle dogs. Journal of Toxicology and Environmental Health. 23 (4), 519-525 (1988).
- Foster, W. M., Walters, D. M., Longphre, M., Macri, K., Miller, L. M. Methodology for the measurement of mucociliary function in the mouse by scintigraphy. Journal of Applied Physiology. 90 (3), 1111-1117 (2001).
- Bhashyam, A. R., et al. Vagal control of mucociliary clearance in murine lungs: a study in a chronic preparation. Autonomic Neuroscience. 154 (1-2), 74-78 (2010).
- Van Audenhaege, K., et al. Review of SPECT collimator selection, optimization, and fabrication for clinical and preclinical imaging. Medical Physics. 42 (8), 4796-4813 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten