Method Article
Probenvorbereitung für computertomographisch basierte dreidimensionale Visualisierung von Murinen Hintergliedmaßengefäßen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine Visualisierungs- und Quantifizierungsmethode für murine Hintergliedmaßengefäße mittels Mikro-Röntgen-Computertomographie.
Zusammenfassung
Blutgefäße sind komplexe Netzwerke mit baumartigen Strukturen, und vaskuläre Netzwerke sind für die Aufrechterhaltung sowohl der Durchblutung als auch der Aufrechterhaltung der Organfunktion unerlässlich. Die Aufklärung des Mechanismus der Blutgefäßbildung ist daher äußerst nützlich, um Entwicklungsprozesse und pathologische Mechanismen aufzuklären. Murine Hintergliedmaßengefäße werden oft als Modell für physiologische und pathologische Angiogenese verwendet. Die Auswertung erfolgt hauptsächlich über eine zweidimensionale Methode unter Verwendung von Gewebeschnitten. Methoden zur Bewertung der dreidimensionalen (3D) Gefäßmorphologie sind jedoch besonders begrenzt. Dieser Beitrag stellt eine Methode zur Visualisierung der murinen Hintergliedmaßen mittels Computertomographie (CT) vor. Strahlungsundurchsichtiges Harz wird durch die absteigende Aorta injiziert und ganze Gefäße werden mit Farbstoff gefüllt. Durch die Einstellung des Zeitpunkts der Farbstoffinjektion ist auch eine arterielle Füllung möglich, und Proben können mit jedem Mikro-Röntgen-CT-Gerät gewonnen werden. Diese Kontrastmethode bietet eine grundlegende Technik für die 3D-Bewertung von murinen Blutgefäßen in den unteren Extremitäten. Darüber hinaus kann diese Methode verwendet werden, um alle Blutgefäße unterhalb des Zwerchfells zu visualisieren und Blutgefäße in den Bauchorganen zu bewerten.
Einleitung
Blutgefäße sind komplexe Netzwerke mit baumartigen Strukturen. Angiogenese und neue Gefäßbildung spielen eine wesentliche Rolle bei der Aufrechterhaltung der Organhomöostase1. Die Angiogenese ist zur Behandlung von ischämischen und malignen Erkrankungen reguliert2. Es ist daher wichtig, die zugrunde liegenden Mechanismen der Angiogenese zu verstehen. Murine Hintergliedmaßengefäße werden oft als nützliches Modell für die Gefäßforschung verwendet3; Die ipsilaterale Ligatur der Arteria iliaca oder femoralis ist ein bekanntes Modell der Ischämie der hinteren Gliedmaßen, das zur Beurteilung der Angiogenese und des vaskulären Umbaus in der physiologischen und pathologischen Angiogenese4 verwendet wird. Die Beurteilung der Angiogenese erfolgt jedoch hauptsächlich durch Schnittfärbung, und die Methoden zur Bewertung der 3D-Gefäßmorphologie sind besonders begrenzt.
Im Vergleich zur Schnittfärbung ermöglicht CT eine 3D-Visualisierung. Kürzlich berichteten Weyers et al. über ein ausgeklügeltes Protokoll, das für die CT-Bildgebung geeignet ist und die Visualisierung des murinen koronaren Kreislaufsystems bei Erwachsenen ermöglicht5. Wir modifizierten ihre Methode, um eine Probenvorbereitungsmethode zu entwickeln, die für die CT-Bildgebung der Blutgefäße der unteren Extremität geeignet ist6. Hier wird ein strahlungsundurchsichtiges Harz durch die absteigende Aorta injiziert und Gefäße in den unteren Extremitäten mit Farbstoff gefüllt. Durch die Anpassung des Zeitpunkts der Farbstoffinjektion ist auch eine arterielle Füllung möglich, und Proben können mit jedem Mikro-Röntgen-Computertomographen gewonnen werden. Diese Kontrastmethode bietet eine grundlegende Technik für die 3D-Auswertung von murinen Blutgefäßen unterhalb des Zwerchfells und in Bauchorganen und den unteren Extremitäten.
Protokoll
Alle Eingriffe wurden in Übereinstimmung mit den Tierpflegerichtlinien der Kumamoto Universität (Zulassungsnummer M30-040/A2020-105), die dem US National Institutes of Health Guide for the Care and Use of Laboratory Animals (Publikation Nr. 85-23, überarbeitet 2011) entsprechen.
1. Vorbereitung
- Vorbereitung des Perfusionsapparates und des Vasodilatatorpuffers (4 mg/L Papaverinhydrochlorid, 4 g/L; Adenosin, 1 g/L; Heparin, 1 U/ml in phosphatgepufferter Kochsalzlösung (PBS)).
HINWEIS: Die Refluxvorrichtung und die Vasodilatatorreagenzien sind die gleichen wie die von Weyers et al.5 berichteten. - Schließen Sie den 22-G-Katheter, den 2-ml-Verlängerungsschlauch und den Drei-Wege-Absperrhahn an (Abbildung 1A).
HINWEIS: Passen Sie das Messgerät entsprechend der Größe des Tieres an. Für erwachsene C57BL/6-Mäuse sind 22 G optimal. - Füllen Sie die Druckperfusionsapparatur mit dem Vasodilatatorpuffer (Abbildung 1A).
HINWEIS: Vermeiden Sie die Bildung von Blasen, um eine Unterbrechung der Füllung des Kontrastmittels zu vermeiden.
2. Perfusion
- 1 U/g Heparin in PBS 30 min vor der Operation in die intraperitoneale Höhle injizieren.
- Betäuben Sie die Maus vollständig mit Isofluran und euthanasieren Sie sie durch zervikale Luxation.
- Machen Sie nach der Enthauptung einen Mittellinienschnitt im Brustbein und fixieren Sie den offenen Thorax mit Stiften.
HINWEIS: Um ein Austreten des Kontrasts zu vermeiden, vermeiden Sie es, die Membran zu verletzen. - Schneiden Sie die aufsteigende Aorta ab und entfernen Sie das Herz.
- Entfernen Sie die Lunge und legen Sie die absteigende Aorta frei.
HINWEIS: Verletzen Sie nicht die absteigende Aorta. - Schneiden Sie die absteigende Aorta diagonal ab, um den Querschnitt freizulegen (Abbildung 1B).
HINWEIS: Ziehen Sie die Aorta nicht ab; ein diagonaler Abschnitt ist besser für die Kathetereinführung. - Führen Sie den 22 G-Katheter in die absteigende Aorta ein, während Sie den Vasodilatationspuffer laufen lassen.
HINWEIS: Das Einführen des Katheters während des Laufendens des Vasodilatationspuffers vermeidet eine Luftkontamination. - Stecken Sie die Wurzel des Katheters fest (Abbildung 1C).
- Machen Sie einen Knoten, um Leckagen durch Rückfluss zu verhindern.
- Eine erwärmte gefäßerweiternde Lösung (Papaverinhydrochlorid, 4 g/L; Adenosin, 1 g/L; Heparin, 1 U/ml) 3 min bei einem festen Druck zwischen 13 und 15 kPa perfizieren.
- Eine Lösung von 4% Paraformaldehyd wird in (PBS) für 3 min perfundiert.
HINWEIS: Der Erfolg der Fixierung kann durch die Bewegung des Fußes bestätigt werden (Abbildung 1D). - Bereiten Sie das Kontrastmittel kurz vor der Durchblutung vor.
ANMERKUNG: Passen Sie die Verdünnungsrate entsprechend der Probe an; bei erwachsenen Mäusen den Fleck und das Verdünnungsmittel im Verhältnis 1:1 mischen. - Stoppen Sie die Perfusion und füllen Sie das Verlängerungsrohr mit 2 ml verdünntem Kontrastmittel (Abbildung 1E).
HINWEIS: Das Kontrastmittel sollte langsam injiziert werden, um eine Verletzung der Blutgefäße zu vermeiden. - Ziehen Sie das Kontrastmittel mit einem festen Druck zwischen 13 und 15 kPa.
- Um arterien sichtbar zu machen, überprüfen Sie den Zehennagel, um zu bestätigen, dass das Kontrastmittel die Arterie erreicht hat (Abbildung 1F).
- Um alle Gefäße zu visualisieren, überprüfen Sie die untere Hohlvene des Zwerchfells, um die vollständige Zirkulation des Kontrastmittels zu bestätigen.
HINWEIS: Am Anfang enthält der Kontrast die gefäßerweiternde Lösung; Daher ist seine ordnungsgemäße Zirkulation unerlässlich.
- Schließen Sie den Drei-Wege-Absperrhahn, und entfernen Sie das Rohr (Abbildung 1G).
HINWEIS: Wenn der Drei-Wege-Absperrhahn nicht geschlossen ist, fließt der Kontrast rückwärts. - Die Probe über Nacht bei 4 °C inkubieren.
- Entfernen Sie die Haut und fixieren Sie sie in 10% iger Formaldehydlösung.
3. Visualisierung
HINWEIS: Die Visualisierungsprotokolle unterscheiden sich je nach CT-Scanner. In diesem Protokoll wurde ein Mikrofokus-Röntgen-CT-Scanner verwendet. Es ist notwendig, das Bildgebungsverfahren für jeden CT-Scanner zu optimieren.
- Fixieren Sie die Probe in einem 50 ml Röhrchen, das PBS enthält.
- Stellen Sie das Probenröhrchen auf den Tisch.
- Scannen Sie die Probe mit einer Spannung von 50 kV und einem Strom von 600 μA, um einen Fokus-zu-Mitte-Abstand von 75,2 mm zu gewährleisten.
HINWEIS: Eine Abmessung von 1 Voxel betrug in dieser Einstellung 28,7 μm x 28,7 μm x 28,7 μm. - Laden Sie die erfassten Bilddaten mit Fiji, einer Open-Source-Plattform für die biologische Bildanalyse.
- Bestimmen Sie den Muskelvoxelwert mit dem Musculus gastrocnemius.
- Wählen Sie den Musculus gastrocnemius mit dem Rechteckwerkzeug .
- Überprüfen Sie den Mittelwert und die Standardabweichung (SD) vom Histogramm (Analysieren | Histogramm).
- Definieren Sie die Muskelvoxeldichte als Mittelwert + 2SD des Gastrocnemius-Muskels.
- Stellen Sie die Muskelvoxeldichte als unteren Schwellenwert ein (Bild | passen Sie | Schwellenwert | | festlegen B. unterer Schwellenwert).
HINWEIS: Der Gefäßbereich und der Knochenbereich verbleiben nach dem Festlegen des Schwellenwerts in den binarisierten Daten.
Ergebnisse
Alle Gefäße in den unteren Extremitäten können visualisiert werden, wenn dieses Protokoll korrekt durchgeführt wird (Abbildung 2A). In einem Modell der Ischämie der hinteren Gliedmaßen verläuft die nicht ligatierte Oberschenkelarterie parallel zur Oberschenkelvene (Abbildung 2B), und eine ligatierte Oberschenkelarterie kann durch die Unterbrechung der Kontrastmittel bestätigt werden (Abbildung 2C). Die Ergebnisse zeigten die Entwicklung von Kollateralgefäßen (Abbildung 2D). Die Kollateralzirkulation bildet sich zwischen den Arterien proximal zur Liganterie und der Arterie im Unterschenkelbereich sowie auf der ventralen und dorsalen Seite der Oberschenkelarterie. Die Arteria glutealis inferior, die auf der dorsalen Seite des Beckens beginnt und auf der lateralen Seite des Oberschenkels verläuft, dehnt sich auf der ischämischen Seite robust aus.
Kontrastgefüllte Gefäße werden mit dem Kontrastmittel gefüllt (Abbildung 2E); Eine Störung des Kontrasts weist auf eine Vermischung von nichtkontrasten Medien (z. B. Blut, Vasodilatatorpuffer oder Blasen) oder eine unzureichende Durchblutung des Kontrasts hin (Abbildung 2F). Vasodilatation und Fixierung würden nicht gut funktionieren, wenn die Blutgefäße geschrumpft sind. Obwohl die CT-Bildgebung nur das Kontrastmittel sichtbar machen kann, ist es möglich, die Arterien auf der Körperoberfläche durch makroskopische oder stereomikroskopische Beobachtung zu betrachten (Abbildung 2G). Somit ist es einfacher, Defekte mit dem Kontrastmittel zu beurteilen (Abbildung 2H).
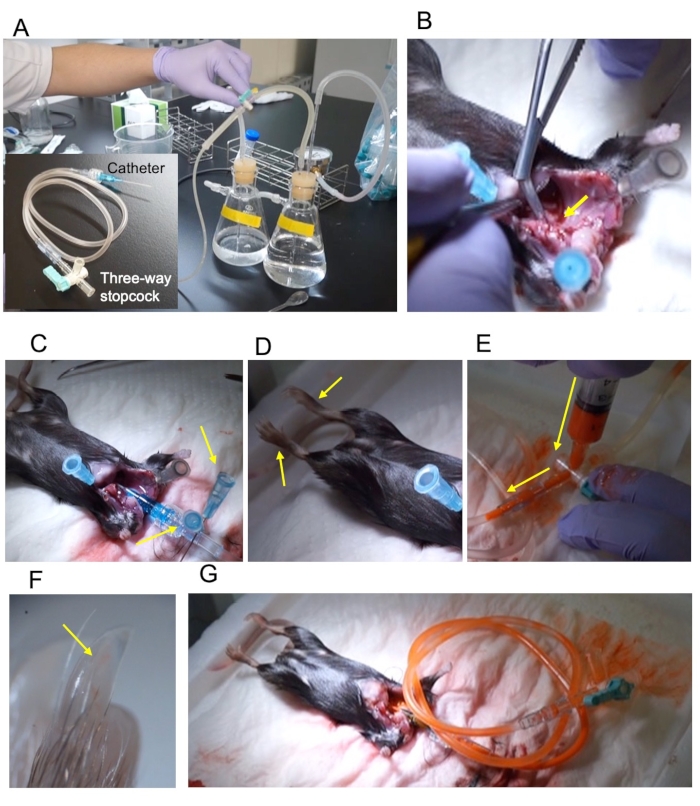
Abbildung 1: Überblick über das Verfahren. (A) Druckperfusionsapparat und der 22 G-Katheter, die über ein 2-ml-Verlängerungsrohr und einen Drei-Wege-Absperrhahn miteinander verbunden sind. (B) Die aufsteigende Aorta wird diagonal geschnitten, um den Querschnitt freizulegen (gelber Pfeil). (C) Der Katheter wurde mit zwei Stiften (gelbe Pfeile) fixiert. (D) Die festen unteren Gliedmaßen erstrecken sich bei der Fixierung (gelbe Pfeile). (E) Injektion von Kontrast durch den Drei-Wege-Absperrhahn. Die Injektionsrichtung wird durch einen gelben Pfeil angezeigt. (F) Der Hintergliedmaßennagel ist mit dem Kontrast (gelber Pfeil) gefüllt. (G) Der Absperrhahn wird geschlossen und aus dem Perfusionsapparat entfernt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
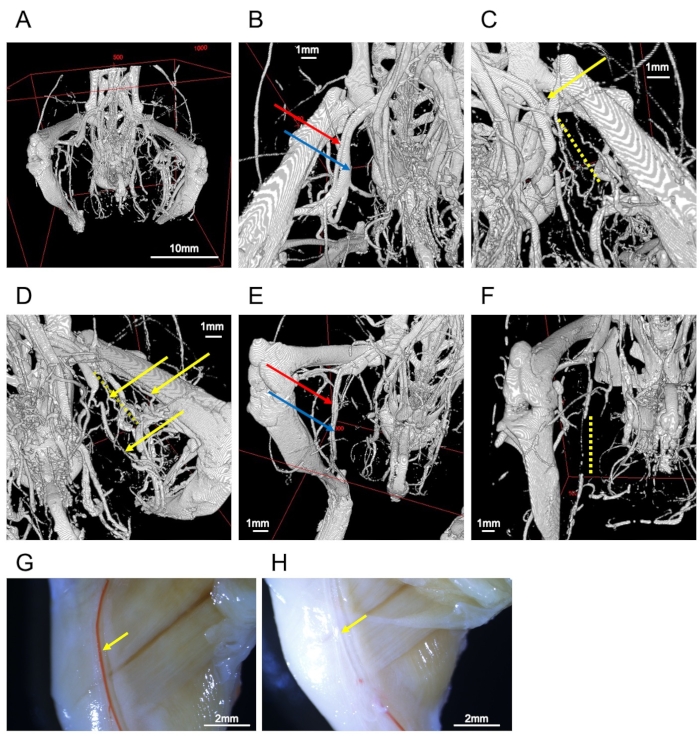
Abbildung 2: Bilder von Schiffen. (A) Ganzes Bild der Knochen und Gefäße der Hintergliedmaßen. (B) Oberschenkelarterie (roter Pfeil) und Vene (blauer Pfeil). (C) Ligierte Oberschenkelarterie (gelber Pfeil). Die Peripherie wird durch das Hindernis (gelbe gepunktete Linie) unterbrochen. (D) Kollateralgefäße in der ligierten Seite (gelbe Pfeile). Die gelb gepunktete Linie stellt die unterbrochene Oberschenkelarterie dar. (E) Eine gut gefüllte Probe der Arteria saphenus (roter Pfeil) und der Vene (blauer Pfeil). (F) Unzureichende Perfusion führt zu einer Unterbrechung der saphenasösen Gefäße (gelbe gepunktete Linie). (G) Stereomikroskopische Beobachtung einer repräsentativen Stichprobe. Die rechte Oberschenkelarterie (gelber Pfeil) ist mit Kontrastmittel gefüllt. (H) Stereomikroskopische Beobachtung einer fehlgeschlagenen Probe. Der rechten Oberschenkelarterie (gelber Pfeil) fehlt das Kontrastmittel. Mensur = 1 mm (B-F), 2 mm (G, H), 10 mm (A). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieser Bericht stellt eine ausgeklügelte Methode zur Visualisierung von Blutgefäßen im Unterkörper vor. Es gibt mehrere kritische Schritte in diesem Prozess: Der erste ist die Vorbereitung vor der Injektion von Kontrastmittel. Wenn nicht genügend Blut entfernt wird, füllt der Kontrast das System nicht aus. Zusätzlich stört die Einbeziehung von Luftblasen die Füllung des Kontrastes; daher muss die Luft im Kreislauf vollständig entfernt werden. Da das Kontrastmittel nicht unmittelbar nach der Injektion erstarrt, sollte die Probe nicht übermäßig bewegt werden.
Diese Methode ist nützlich, um die erhöhte Bildung von Blutgefäßen und Zirkulation, wie z.B. Kollateralzirkulation, zu bewerten. Umgekehrt ist es als Einschränkung schwierig, verengte Blutgefäße zu bewerten, da die Unterscheidung zwischen Stenose und einer künstlichen Reduktion des Kontrastmittels schwierig ist. Darüber hinaus ist es schwierig, Blutgefäße in Knochen zu bewerten, da die Trennung von Blut und Knochen schwierig ist.
Eine alternative Methode zur 3D-Visualisierung ist die Immunfärbung. Mit der Gewebereinigungstechnik stehen verschiedene Methoden für die 3D-Bildgebung zur Verfügung7. Die Immunfärbung ist vorteilhaft, da sie die Färbung spezifischer Proteine mit Antikörpern ermöglicht. Ein kürzlich veröffentlichter Bericht stellt die Ganzkörperbildgebung auf der Grundlage von Immunostaining in Frage8; Die CT-basierte Bildgebung erfordert jedoch keine Vorbehandlung zur Gewebereinigung.
Diese Methode ermöglicht die Visualisierung aller Gefäße unterhalb des Zwerchfells, einschließlich der Bauchorgane. Die Angiogenese in den Bauchorganen hat einen starken Einfluss auf die Aufrechterhaltung der Homöostase und die Entwicklung von Krankheiten9,10. Da dieses Protokoll für die Beurteilung der Gefäße der unteren Extremitäten optimiert wurde, würde das organspezifische Priming die Visualisierung der Angiogenese ermöglichen, die mit jedem Faktor wie Entzündungen oder Tumoren assoziiert ist.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu erklären.
Danksagungen
Wir danken Yasuyo Kimura, Megumi Nagahiro und Saeko Tokunaga für die hervorragende technische Unterstützung im Tierversuch.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | TERUMO | SS-01T | |
| 10% Formalin Solution | Fujifilm-Wako | 068-03841 | |
| 10x phosphate-buffered saline (-) (PBS) | Fujifilm-Wako | 163-25265 | Prepare 1x PBS |
| 22 G catheter (22 G S5 x 1" V(F)) | MEDIKIT | HP2140 | Only catheter is used. |
| 23 G needle | TERUMO | NN-2325R | Use as a pin |
| 4% paraformaldehyde in PBS | Fujifilm-Wako | 163-20145 | |
| 5 mL syringe | |||
| 5-0 Suture with needle | Alfresa Pharma Corporation | ER1205SB45 | |
| Adenosine | Sigma-aldrich | A9251-5G | For vasodilating solution |
| Dumont #55 Forceps | FST | No.11255-20 | |
| Extension tube | TOP | X2-FL50 | |
| Falcon 50 mL tube | CORNING | 352098 | |
| Graefe Forceps | FST | No.11051-10 | |
| Heparin Sodium 5,000 units/5 mL | Mochida Co. Ltd. | 224122458 | |
| Isoflurane | Fujifilm-Wako | 099-06571 | |
| Microfil Injection Compounds | Flow Tech Inc. | MV-117 | Mix liquid MV-Compound (stain) and MV-Diluent 1: 1 |
| Papaverine hydrochloride | Fujifilm | 164-18002 | For vasodilating solution |
| Small Animal Anesthetizer | Muromachi Kikai Co. Ltd. | MK-A100ecoW-ST | |
| Spring Scissors - Angled to Side | FST | No.15006-09 | |
| Surgical Scissors - Sharp-Blunt | FST | No.14001-12 | |
| three-way cock | TERUMO | TS-TR1K | |
| Transfer pipette | SAMCO SCIENTIFIC | SM262-1S | Use for mixing contrast medium |
| X-ray CT scanner | Toshiba IT & Control Systems Corporation | TOSHIBA TOSCANNER 32300 FPD |
Referenzen
- Folkman, J. Angiogenesis. Annual Review of Medicine. 57, 1-18 (2006).
- Folkman, J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nature Medicine. 1 (1), 27-31 (1995).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PLoS One. 8 (12), 84047(2013).
- Limbourg, A., et al. Evaluation of postnatal arteriogenesis and angiogenesis in a mouse model of hind-limb ischemia. Nature Protocols. 4 (12), 1737-1746 (2009).
- Weyers, J. J., Carlson, D. D., Murry, C. E., Schwartz, S. M., Mahoney, W. M. Retrograde perfusion and filling of mouse coronary vasculature as preparation for micro computed tomography imaging. Journal of Visualized Experiments: JoVE. (60), e3740(2012).
- Arima, Y., et al. Evaluation of collateral source characteristics with 3-dimensional analysis using micro-X-ray computed tomography. Journal of the American Heart Association. 7 (6), 007800(2018).
- Tian, T., Yang, Z., Li, X. Tissue clearing technique: Recent progress and biomedical applications. Journal of Anatomy. 238 (2), 489-507 (2021).
- Susaki, E. A., et al. Advanced CUBIC protocols for whole-brain and whole-body clearing and imaging. Nature Protocols. 10 (11), 1709-1727 (2015).
- Fernandez, M., et al. Angiogenesis in liver disease. Journal of Hepatology. 50 (3), 604-620 (2009).
- Li, S., et al. Angiogenesis in pancreatic cancer: current research status and clinical implications. Angiogenesis. 22 (1), 15-36 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten