Method Article
Durchflusszytometrische Analyse von Biomarkern zum Nachweis von Funktionsdefekten menschlicher Spermien
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll bietet eine praktische Lösung, die die Messung von Apoptose, mitochondrialem Membranpotenzial und DNA-Schäden in menschlichen Spermien mit einem einzigen Zytometer ermöglicht.
Zusammenfassung
Die konventionelle Samenparameteranalyse wird häufig zur Beurteilung der männlichen Fruchtbarkeit eingesetzt. Studien haben jedoch ergeben, dass ~15% der unfruchtbaren Patientinnen keine Anomalien in den konventionellen Samenparametern aufweisen. Es werden zusätzliche Technologien benötigt, um die idiopathische Unfruchtbarkeit zu erklären und subtile Spermiendefekte zu erkennen. Derzeit zeigen Biomarker der Spermienfunktion, einschließlich der Apoptose der Spermien, des mitochondrialen Membranpotenzials (MMP) und der DNA-Schäden, die Spermienphysiologie auf molekularer Ebene und sind in der Lage, die männliche Fruchtbarkeit vorherzusagen.
Mit Durchflusszytometrie-Techniken (FCM) kann jeder dieser Marker schnell, genau und präzise in menschlichen Samenproben gemessen werden, aber der Zeitaufwand steigt erheblich und die Ergebnisse könnten behindert werden, wenn alle Biomarker mit einem einzigen Zytometer getestet werden müssen. In diesem Protokoll wurden die Samenproben nach der Entnahme und sofortigen Inkubation bei 37 °C zur Verflüssigung mittels Annexin-V-Fluorescein-Isothiocyanat (FITC)/Propidiumiodid (PI)-Färbung weiter auf Spermienapoptose analysiert. Das MMP wurde mit einer 5,5′,6,6′-Tetrachlor-1,1′,3,3′-tetraethyl-benzimidazolylcarbocyaniniodid (JC-1)-Sonde markiert, und der DNA-Schaden wurde mit dem Spermienchromatinstruktur-Assay (SCSA) mit Acridinorange (AO)-Färbung bewertet. Daher kann die durchflusszytometrische Analyse von Spermienfunktionsmarkern ein praktisches und zuverlässiges Instrumentarium für die Diagnose von Unfruchtbarkeit und die Beurteilung der Spermienfunktion sowohl auf der Bank als auch im Bett sein.
Einleitung
Unfruchtbarkeit ist zu einem Problem der öffentlichen Gesundheit geworden, wobei männliche Unfruchtbarkeit 40%-50% aller Fälle ausmacht 1,2. Obwohl die konventionelle Samenqualitätsanalyse eine wichtige Rolle bei der Bestimmung des männlichen Fertilitätspotenzials spielt, weisen etwa 15 % der Patientinnen mit Unfruchtbarkeit normale Spermienparameter wie Spermienzahl, Beweglichkeit und Morphologie auf3. Darüber hinaus haben routinemäßige Spermienuntersuchungen eine schlechte Wiederholbarkeit, liefern nur begrenzte Informationen über die Spermienfunktion und können keine genaue Bewertung der männlichen Fruchtbarkeit geben oder die subtilen Defekte der Spermien widerspiegeln. Es wurden mehrere Techniken entwickelt, um die Spermienfunktion zu testen, wie z. B. der Hemizona-Assay (HZA), der Spermienpenetrationstest, der hypoosmotische Schwellungstest, der Anti-Spermien-Antikörpertest, aber diese Methoden sind zeitaufwändig und anfällig für subjektive Einflüsse der Betreiber. Daher ist es notwendig, schnelle und genaue Methoden für die Analyse der Spermienfunktion zu entwickeln.
FCM ist eine in den 1970er Jahren entwickelte schnelle Einzelzellanalysetechnologie, die in verschiedenen Bereichen der Zellbiologie und Medizin weit verbreitet ist. FCM ist ein robustes Werkzeug zur Bewertung der Spermienfunktion, das Spermien analysiert, die mit einer spezifischen Fluoreszenzsonde markiert sind4. Die Spermien durchlaufen Ein- oder Mehrkanallaser, wobei Streulicht und emittierte Fluoreszenz durch einen Laserstrahl erzeugt werden. Das Streulicht umfasst vorwärts gestreutes Licht (FSC) und seitliches Streulicht (SSC), das die Größe der getesteten Zelle und die Zellgranularität oder innere Struktur widerspiegelt. Diese Signale werden vom Computersystem gesammelt, angezeigt und analysiert, und folglich werden eine Reihe von Merkmalen der Spermien schnell und genau gemessen. Daher ist die FCM eine schnelle, objektive, mehrdimensionale Technik mit hohem Durchsatz, die im Bereich der Spermienanalyse zunehmend an Aufmerksamkeit gewonnen hat. Die Anwendung von FCM kann Mängel herkömmlicher Methoden ausgleichen und bietet einen neuen Ansatz für die Erkennung der inneren Struktur und Funktion von Spermien.
Die Apoptose der Spermien steht in engem Zusammenhang mit der männlichen Fruchtbarkeit5. Der Nachweis der Apoptose von Spermien ist ein wichtiger Index zur Bewertung der Spermienfunktion auf molekularer Ebene. FCM ist weithin als zuverlässige und empfindliche Methode zum Nachweis der Apoptose von Spermien mittels Annexin V-FITC/PI-Färbung anerkannt. Das Grundprinzip besteht darin, dass Phosphatidylserin (PS) im frühen Stadium der Apoptose von der inneren Schicht der Zellmembran auf ihre äußere Schicht übertragen wird. Annexin V ist einCa2+-abhängiges Phospholipidprotein (normalerweise durch FITC markiert), das eine hohe Affinität für PS aufweist und somit PS detektiert, das der äußeren Oberfläche der Zellmembran ausgesetztist 6. Nekrose und Apoptose können in Kombination mit Pl-Färbung unterschieden werden. Daher ist die Methode der Annexin V-FITC/PI-Doppelfärbung weit verbreitet, da sie schnell, einfach und leicht ist, verschiedene apoptotische Samenzellen nachzuweisen.
Ein reifes Säugetierspermium enthält etwa 72-80 Mitochondrien7, was auf einen biologischen Grund für die Retention von Spermienmitochondrienhindeutet 8. Es wurde festgestellt, dass die Mitochondrien der Spermien eine wichtige Rolle bei der Aufrechterhaltung der Beweglichkeit und Fruchtbarkeit der Spermien spielen9. Die JC-1-Färbung, die als Indikator für MMP in einer Vielzahl von Zelltypen verwendet werden kann, ist eines der beliebtesten Fluorochrome zur Beurteilung der Mitochondrienaktivität von Spermien10. JC-1 ist ein kationischer Farbstoff, der sich potentialabhängig in den Mitochondrien anreichert. JC-1 hat eine maximale Fluoreszenzemission bei 525 nm (grün) und bildet J-Aggregate 11, wenn es an Membranen mit hohem Potential (ΔΨm, 80-100 mV) bindet, was zu einer Verschiebung der Fluoreszenzemission auf ~590 nm (orange-rot) führt. Folglich wird die mitochondriale Depolarisation der Spermien durch eine Abnahme des rot/grünen Fluoreszenzintensitätsverhältnisses angezeigt, und FCM kann verwendet werden, um MMP-Spiegel in menschlichen Samenproben nachzuweisen.
Die SCSA-Methodik wurde von Evenson et al.12 erfunden und gilt als präziser und wiederholbarer Test mit einzigartigen Dual-Parameter-Daten (rote vs. grüne Fluoreszenz) auf einer 1.024 × 1.024 Kanalskala13. In geschädigten Spermien werden DNA und veränderte Proteine in Spermienkernen durch AO markiert, und Brüche des DNA-Strangs werden durch rote Fluoreszenz gemessen, während intakte Doppelstränge grüne Fluoreszenz in FCM14 emittieren. Heutzutage wurden viele Methoden entwickelt, um die Integrität der Spermien-DNA abzuschätzen. Im Gegensatz zu SCSA sind diese Assays jedoch oft arbeitsintensiv und nicht in der Lage, eine männliche Unfruchtbarkeit zu diagnostizieren. Die Ergebnisse des SCSA-Tests korrelieren signifikant mit der Schwangerschaft und Fehlgeburt der menschlichen DNA, liefern überzeugende Beweise dafür, dass SCSA bei der Analyse von menschlichem Sperma nützlich sein kann, und können als wertvolles Werkzeug für Unfruchtbarkeitskliniker dienen15.
Chromatinintegrität, MMP und Apoptose spiegeln unterschiedliche Aspekte der Spermienfunktion wider, so dass die Kombination dieser Biomarker einen umfassenderen Einblick in den Spermienstatus geben kann. FCM kann für separate Messungen der Chromatinintegrität, des MMP oder der Apoptose in menschlichen Samenproben verwendet werden. Obwohl die Kosten für FCM und Farbstoffe die breite Anwendung dieser Techniken in klinischen Labors für die reproduktive Gesundheit eingeschränkt haben, wird ihr Wert für die Schätzung der Fruchtbarkeit akzeptiert.
Da jedoch jedes der Experimente eine Vorbehandlung der Spermienproben erfordert und alle vorbehandelten Proben so schnell wie möglich getestet werden müssen, kann die gleichzeitige Messung aller drei Biomarker für eine Probe mit einem einzigen FCM zu einer langen Wartezeit für einige der Experimente führen und die Zuverlässigkeit der Ergebnisse beeinträchtigen. Dies liegt daran, dass die Spermien während des Warteprozesses zusätzlichen Schaden erleiden, wenn das Protokoll nicht unter Berücksichtigung aller drei Experimente richtig angeordnet ist. In dieser Arbeit wird ein Protokoll vorgestellt, das die fließende Messung aller drei Biomarker in einer einzigen Zytometrie ermöglicht, ohne die Experimentqualität durch längere Wartezeiten wesentlich zu beeinträchtigen.
Protokoll
HINWEIS: Der Arbeitsablauf für den Nachweis von Biomarkern für Spermienfunktionsschäden durch Durchflusszytometrie umfasst (1) Zellvorbereitung, (2) Färbung mit fluoreszierenden Reagenzien und (3) durchflusszytometrische Analyse und Dateninterpretation (Abbildung 1). Das Protokoll folgt den Richtlinien der Ethikkommissionen der Army Medical University (1.0/2013.4-12).
1. Vorbereitung der Zellen
- Gewinnen Sie menschliche Samenproben durch Masturbation in klinischen Plastikprobengläsern, vorzugsweise nach 3-5 Tagen Abstinenz.
- Die Samenproben werden sofort in einem 37 °C warmen Inkubator inkubiert und vollständig verflüssigt (bis zu 1 h).
2. Zählung der Spermien mittels computergestützter Spermienanalyse (CASA)
- Mischen Sie die verflüssigten Samenproben gründlich.
- Geben Sie 10 μl Sperma in eine Spermienzählkammer (siehe Materialtabelle).
- Scannen Sie die Objektträger im Sperm Class Analyzer (siehe Materialtabelle) und zählen Sie mindestens sechs Bereiche und 400 Spermien für die Schätzung der Spermienkonzentration.
HINWEIS: Die Samenproben müssen frisch und nicht gefroren sein, damit die Spermienapoptose und die MMP-Analyse durchgeführt werden können.
3. Färbung von Samenzellen
- Nachweis der Apoptose von Spermien mittels Annexin V-FITC/PI-Färbung
- Geben Sie 1 × 106 Samenzellen in ein 1,5-ml-Zentrifugenröhrchen.
- Waschen Sie die Zellen mit 500 μl kalter phosphatgepufferter Kochsalzlösung (PBS).
- Zentrifugieren Sie die Samenzellsuspension bei 300 × g für 7 Minuten und verwerfen Sie den Überstand.
- Resuspendieren Sie die Samenzellen in 200 μl 1x Bindungspuffer.
- 2 μl FITC Annexin V und 2 μl PI zugeben (siehe Materialtabelle).
- Die Zellen vorsichtig vortexen, 15 min bei Raumtemperatur (25 °C) im Dunkeln inkubieren und sofort zur Analyse in das Durchflusszytometer geben.
- Analyse des mitochondrialen Membranpotentials mit JC-1-Sonde
- Geben Sie 2 × 106 Samenzellen in ein 1,5-ml-Zentrifugenröhrchen und zentrifugieren Sie es 5 Minuten lang bei 600 × g .
- Resuspendieren Sie die Samenzellsuspension in 1 ml JC-1-Arbeitslösung (siehe Materialtabelle).
- Die Zellen vorsichtig vortexen und 20 min bei 37 °C im Dunkeln inkubieren.
- Die Suspension wird bei 600 × g für 5 min zentrifugiert und der Überstand entsorgt.
- Waschen Sie das Pellet zweimal mit 1 ml PBS bei einer Geschwindigkeit von 600 × g für jeweils 5 Minuten.
- Resuspendieren Sie die gefärbten Samenzellen in 1 ml PBS in Durchflusszytometerröhrchen und legen Sie die Röhrchen sofort zur Analyse in das Durchflusszytometer.
- Verwenden Sie Carbonylcyanid-m-Chlorphenylhydrazon (CCCP) als Positivkontrolle. Resuspendieren Sie die Samenzellen (wie zuvor in Schritt 3.2.1 beschrieben) in 1 ml CCCP-Arbeitslösung (siehe Materialtabelle), wirbeln Sie die Zellen vorsichtig vor und inkubieren Sie sie 20 Minuten lang bei Raumtemperatur. Die Suspension wird 5 min bei 600 × g zentrifugiert und der Überstand entsorgt. Wiederholen Sie die Schritte 3.2.2-3.2.6.
- Spermien-Chromatin-Struktur-Assay
- Geben Sie ein Aliquot von verflüssigtem Rohsperma (0,25 ml) in ein Kryoröhrchen und frieren Sie die Samenproben sofort in flüssigem Stickstoff (-196 °C) ein, bis sie für die SCSA bereit sind.
- Die Samenproben werden in einem 37 °C warmen Wasserbad aufgetaut und mit TNE-Puffer (siehe Materialtabelle) auf eine Konzentration von 1-2 × 106 Zellen/ml verdünnt.
- 200 μl der verdünnten Probe in ein Durchflusszytometer-Reagenzglas geben und mit 400 μl Säurelösung (siehe Materialtabelle) 30 s lang mischen.
- Die Proben werden mit 1,2 ml AO-Färbelösung gefärbt (siehe Materialtabelle) und sofort zur Analyse in das Durchflusszytometer gegeben.
- Verwenden Sie eine Referenzprobe als internen Standard für die Einrichtung und Kalibrierung von Durchflusszytometern. Die Referenzprobe wird mit 4 °C TNE-Puffer auf eine Konzentration von 1-2 × 106 Zellen/ml verdünnt. Wiederholen Sie die Schritte 3.3.1-3.3.4.
HINWEISE: Alle Lösungen und Puffer werden bei 4 °C gelagert. (1) Das Sperma sollte vor dem Schockfrosten nicht verdünnt werden. Rohe Samenproben sollten zum Zeitpunkt der Durchflusszytometrie-Messungen aufgetaut und mit TNE-Puffer verdünnt werden. (2) Für Unfruchtbarkeitskliniken sollten ~0,25 ml Rohsperma in einem ultrakalten Gefrierschrank oder einem LN2-Tank schockgefroren werden. Diese gefrorenen Aliquots können dann auf Trockeneis oder in einem LN2-Trockenversender an ein SCSA-Diagnoselabor geschickt werden. (3) Eine menschliche Ejakulatprobe, die eine Heterogenität der DNA-Integrität aufweist (z. B. 15 % DNA-Fragmentierungsindex [DFI]), wurde als interne Standardreferenz verwendet.
4. Einrichtung des Durchflusszytometers
HINWEIS: Vor dem Start des Durchflusszytometers sollte eine Systemprüfung des Geräts durchgeführt werden, um die analytische Leistung zu überprüfen. Führen Sie die Beispiele aus, nachdem alle Überprüfungen abgeschlossen und bestanden wurden.
- Öffnen Sie die Durchflusszytometer-Software und starten Sie das Zytometer.
- Sammeln Sie Beispieldaten.
- Laden Sie zunächst eine Kontrollprobe auf das Durchflusszytometer und klicken Sie auf AUSFÜHREN, um die Datenerfassung zu starten (passen Sie die Einstellungen bei Bedarf an). Warten Sie, bis das Gerät mit der Absaugung der Probe beginnt, und geben Sie eine Echtzeitvorschau der erkannten Ereignisse an.
HINWEIS: Die Kontrollprobe: eine Negativkontrolle (ungefärbte Samenzellen) für Spermienapoptose; eine Positivkontrolle (CCCP-behandelte Zellen) für MMP; eine Referenzprobe für SCSA. - Erstellen Sie Punktdiagramme zum Anzeigen von Daten, und wählen Sie die Parameter der X/Y-Achse (z. B. FSC, SSC) und "linear" aus, um anzugeben, dass Daten angezeigt werden. Wählen Sie ein polygonales Gate aus und wenden Sie es an, um die Spermienpopulation für die Analyse abzugrenzen und damit das Gerät erkannte Ereignisse in Echtzeit aufzeichnet.
- Analysieren Sie die Spermienereignisse in der Region.
- Für die Spermienapoptose stellen Sie FL1 als x-Achse und FL2 als x-Achse ein. Um die lebenden, apoptotischen oder nekrotischen Zellen zu isolieren, tippen und ziehen Sie das Quadrantentor, um die Spermienpopulationen auf vier bestimmte Populationen zu unterteilen.
- Legen Sie für MMP FL1 als x-Achse und FL2 als y-Achse fest. Erstellen Sie ein polygonales Tor, um die Spermienpopulationen auf zwei bestimmte Populationen zu unterteilen.
- Stellen Sie für SCSA den FL4 als x-Achse (rote Fluoreszenz, 125/1.024 Durchflusszytometriekanäle) und den FL1 als y-Achse (grüne Fluoreszenz, 475/1.024 Durchflusszytometriekanäle) ein. Zeichnen Sie die Tore in einem Winkel von 45°, um Signale von Zelltrümmern auszuschließen.
- Legen Sie ein Ausführungslimit fest, um anzugeben, wann die Datenerfassung beendet werden soll. Berechnen Sie insgesamt 10.000 Samenzellen für jede Probe für Spermien-Apoptose-, MMP- und SCSA-Analysen.
- Legen Sie die Fluidikrate (langsam, mittel und schnell oder eine benutzerdefinierte Fluidikrate) in Abhängigkeit von der Zellenanzahl fest.
HINWEISE: Für die SCSA-Analyse tauen Sie die gefrorene Rohprobe auf, um die Spermienkonzentration zu bestimmen, und lassen Sie sie auf dem FCM laufen. Wenn die Durchflussrate >250/s beträgt, wird die Probe auf die richtige Durchflussrate verdünnt. Messen Sie alle Proben unabhängig voneinander zweimal und berechnen Sie die Mittelwerte. Eine Referenzprobe wurde getestet, wenn alle 10-15 Proben gemessen wurden, um die Standardisierung und Stabilität des Instruments von Tag zu Tag zu gewährleisten. - Legen Sie den Schwellenwert fest, um Ablagerungen und Rauschen aus Zellproben zu entfernen. Wenden Sie diese Einstellungen auf alle Beispiele im Experiment an.
- Stellen Sie bei Bedarf die Farbkompensation ein, um den Fluoreszenz-Spillover zu korrigieren.
- Pipettieren Sie die Proben vorsichtig zurück, bevor Sie sie in das Durchflusszytometer laden, benennen Sie die Probe und führen Sie die Proben aus.
- Nachdem alle Beispiele ausgeführt wurden, speichern Sie die Beispieldaten als FCS-Dateien, indem Sie ihnen einen Dateinamen für die weitere Softwareanalyse geben. Speichern Sie die Arbeitsvorlage des aktuellen Experiments für den Abruf in zukünftigen Ausführungen (optional).
- Laden Sie zunächst eine Kontrollprobe auf das Durchflusszytometer und klicken Sie auf AUSFÜHREN, um die Datenerfassung zu starten (passen Sie die Einstellungen bei Bedarf an). Warten Sie, bis das Gerät mit der Absaugung der Probe beginnt, und geben Sie eine Echtzeitvorschau der erkannten Ereignisse an.
5. Datenanalyse
- Importieren Sie die Daten in die Datenanalysesoftware für das Durchflusszytometer (siehe Materialtabelle).
- Doppelklicken Sie auf das erste Beispiel im Arbeitsbereich. Warten Sie, bis ein Diagrammfenster geöffnet wird, in dem ein Diagramm der Ereignisse entlang der FSC- und SSC-Parameter angezeigt wird. Erstellen Sie ein Tor, das die Spermienpopulation isoliert, die innerhalb des Gatters enthalten ist, und erzeugen Sie eine "untergeordnete" Population aus dem übergeordneten Satz von Ereignissen.
- Doppelklicken Sie in den abgegrenzten Bereich, und öffnen Sie ein neues Diagrammfenster , das nur die Spermienereignisse enthält. Stellen Sie die Parameter der x- und y-Achse ein, um den Fluoreszenzkanal auszuwählen.
- Wählen Sie das Gate-Werkzeug aus. Klicken Sie in das Diagramm, um die Gatter anzuzeigen, so dass die erstellten Gatter die verschiedenen Zellpopulationen isolieren.
- Klicken Sie mit der rechten Maustaste (oder bei gedrückter Ctrl-Taste) auf eine der markierten Zeilen, und wählen Sie Analyse in Gruppe kopieren aus. Wenden Sie den Anschnittbaum auf alle Proben innerhalb der Gruppe an.
- Speichern und exportieren Sie die Datentabelle.
Ergebnisse
Abbildung 2 zeigt die Messung der Apoptose von Spermien mittels Annexin V-FITC/PI-Färbung. Das FITC-Signal (grüne Fluoreszenz) wurde im FL1-Kanal und das PI-Signal (rote Fluoreszenz) im FL2-Kanal gemessen. In der bivariaten Analyse von Annexin V/PI identifizierten die Quadrantenhersteller vier unterschiedliche Spermienpopulationen. Die Ergebnisse wurden als Prozentsätze von Annexin V-/PI−-Spermien (lebensfähige oder lebende Zellen), Annexin V+/PI−-Spermien (frühe apoptotische Zellen oder apoptotische Zellen), Annexin V+/PI+-Spermien (späte apoptotische Zellen) und Annexin V−/PI+-Spermien (nekrotische Zellen) ausgedrückt16,17 (Abbildung 2B). Eine Negativkontrolle (ungefärbte Samenzellen) wurde ebenfalls verwendet, um Kompensation und Quadranten einzurichten (Abbildung 2A).
Abbildung 3 zeigt die Messung von MMP mit der JC-1-Sonde in menschlichen Spermien. MMP % wird als orange-rot/(grün + orange-rot) Fluoreszenzverhältnis durch Analyse des Zytogramms dargestellt. Eine Samenprobe von guter Qualität weist in der Regel eine hohe orange-rote Fluoreszenz und eine niedrige grüne Fluoreszenz auf (aktive Mitochondrien, oberer linker Quadrant) (Abbildung 3A). Umgekehrt zeigt eine Samenprobe von schlechter Qualität in der Regel eine niedrige orange-rote Fluoreszenz und eine hohe grüne Fluoreszenz (inaktive Mitochondrien, unterer rechter Quadrant), möglicherweise aufgrund einer mitochondrialen Störung (Abbildung 3B).
Abbildung 4 zeigt die Daten von SCSA13,14. Diese typischen SCSA-Zytogramme wurden aus zwei Einzelproben gewonnen. Probe A stammte von einem fruchtbaren Mann und Probe B von einem unfruchtbaren Mann. Die Analyse der durchflusszytometrischen Daten wurde mit der FlowJo-Software durchgeführt. Zytogramme zeigen die Quelle jeder Komponente von SCSA-Daten. Die x-Achse (rote Fluoreszenz mit 1.024 Abstufungen roter Fluoreszenz) zeigt fragmentierte DNA an; Die y-Achse (grüne Fluoreszenz mit 1.024 Abstufungen) zeigt die native DNA-Färbbarkeit an. Die gestrichelte Linie bei y = 750 stellt die Grenze der normalen Spermien dar. Oberhalb dieser Linie von y = 750 befinden sich Spermien mit teilweise unkondensiertem Chromatin, die als unreife Spermien bestimmt wurden.

Abbildung 1: Workflow zur Detektion von Biomarkern für Spermienfunktionsschäden mittels Durchflusszytometrie. Samenproben wurden entnommen und vorbehandelt, wie in Protokollschritt 1 beschrieben. (1) Zellvorbereitung, (2) Färbung mit fluoreszierenden Reagenzien und (3) durchflusszytometrische Analyse und Dateninterpretation. Abkürzungen: MMP = mitochondriales Membranpotential; SCSA = Spermien-Chromatin-Struktur-Assay; PBS = phosphatgepufferte Kochsalzlösung; AO = Acridin-Orange. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
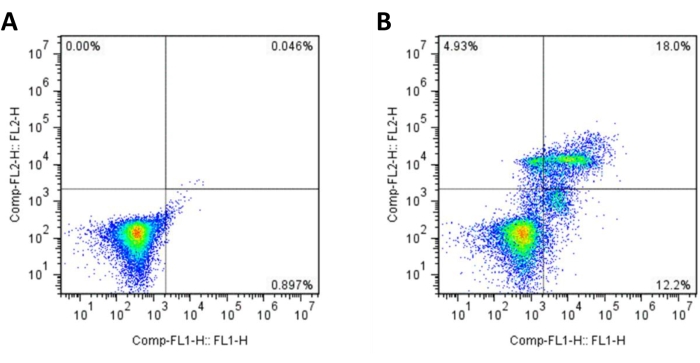
Abbildung 2: Repräsentative Ergebnisse der Spermienapoptose mittels Annexin V-FITC/PI-Färbung. Der untere linke Quadrant enthält Annexin V-/PI− Spermien (lebensfähige oder lebende Zellen), der untere rechte Quadrant zeigt Annexin V+/PI− Spermien (frühe apoptotische Zellen oder apoptotische Zellen), der obere rechte Quadrant repräsentiert Annexin V+/PI+ Spermien (späte apoptotische Zellen) und der obere linke Quadrant enthält Annexin V−/PI+ Spermien (nekrotische Zellen). (A) Negativkontrolle (ungefärbte Samenzellen); (B) eine Probe mit Spermienapoptose. Abkürzungen: FITC = Fluoresceinisothiocyanat; PI = Propidiumiodid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Messung des mitochondrialen Membranpotentials mit der JC-1-Sonde . (A) Die Spermiensubpopulation mit hohem MMP. (B) Die Spermiensubpopulation mit niedrigem MMP. Stellen Sie FL1-A und FL2-A als x-Achse (grüne Fluoreszenz) bzw. y-Achse (orange-rote Fluoreszenz) ein. Abkürzungen: MMP = mitochondriales Membranpotential. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
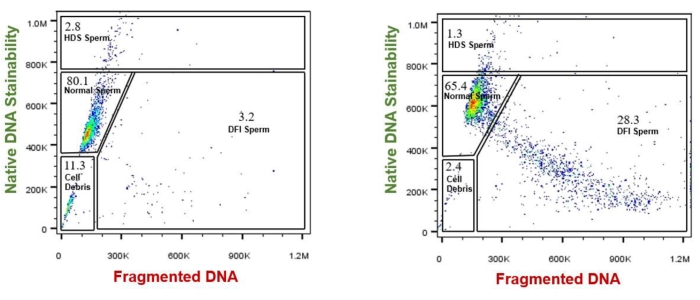
Abbildung 4: Nachweis von DNA-Schäden in menschlichen Spermien mit Hilfe des Spermien-Chromatin-Struktur-Assays . (A) Eine Samenprobe mit normaler Chromatinstruktur. (B) Eine Samenprobe mit einem hohen Anteil an Spermien mit abnormaler Chromatinstruktur. Die FlowJo-Software wurde verwendet, um Computergatter um die Zellpopulationen zu erstellen, die wie folgt identifiziert wurden: 1) normale Spermien, 2) HDS-Spermien, 3) DFI-Spermien und 4) Zelltrümmer, und die Prozentsätze der HDS- und DFI-Spermien wurden berechnet. Abkürzung: SCSA = Spermien-Chromatin-Struktur-Assay; HDS = hohe DNA-Färbebarkeit; DFI = DNA-Fragmentierungsindex. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Chromatinintegrität, MMP und Apoptose menschlicher Spermien haben sich als wertvolle Prädiktoren für Fortpflanzungsergebnisse erwiesen. Auch im zuletzt veröffentlichten WHO-Laborhandbuch für die Untersuchung und Verarbeitung von menschlichem Sperma (sechste Auflage) wurden einige dieser Indikatoren (Chromatinintegrität und Apoptose) als erweiterte Untersuchungen hervorgehoben, die über die grundlegende Untersuchung von Routineparametern wie der Spermienzahl hinausgehen18. Jüngste Veröffentlichungen deuten auch darauf hin, dass diese Indikatoren empfindlichere Marker für die Reaktion auf externe gefährliche Expositionen sein könnten, was auf ihr Potenzial für die Identifizierung von Fortpflanzungsschäden in einem früheren Stadium hinweist19,20. Die Kombination dieser Indikatoren mit Routineuntersuchungen kann auch ein umfassenderes Verständnis des Profils der Spermiendysfunktion und der Komplexität der männlichen Fortpflanzungsschäden in der Bevölkerung liefern.
Es gibt mehrere Schlüsselfaktoren, die den Erfolg der Spermienanalyse mit FCM maßgeblich bestimmen. Zunächst erfordert die Messung von MMP und Apoptose der Spermien eine sofortige Untersuchung nach der Verflüssigung des Samens. Um den Zeitaufwand zu minimieren, können zwei Techniker die Vorbehandlung von MMP und die Apoptoseanalyse einer Probe separat übernehmen. Da die Vorbehandlung der Apoptose einfacher ist, würde sie schneller in den durchflusszytometrischen Schritt übergehen als die MMP-Analyse. Für die SCSA-Analyse sollten frische Samenproben sofort nach Verfügbarkeit nach der Verflüssigung kryokonserviert werden. Die Samenproben können dann relativ lange in flüssigem Stickstoff gelagert werden und müssen nicht sofort untersucht werden.
Dementsprechend kann der Zeitaufwand des Experiments vor Ort auf 40 Minuten komprimiert werden, was der Dauer der MMP-Analyse zuzüglich des durchflusszytometrischen Schritts der Spermienanalyse entspricht. Zweitens muss der Aufbau des Anschnitts in der durchflusszytometrischen Plattform für jede Probencharge separat entschieden werden. Die Spermienproben mit klaren Zelluntergruppen im Streudiagramm können als Referenz ausgewählt werden, um den Gating-Bereich zu zeichnen. Drittens, da es keine allgemein akzeptierten klinischen Referenzwerte für die Indikatoren dieses Experiments gibt, können historische Ergebnisse als wichtiges Instrument für die Qualitätskontrolle verwendet werden. Es wird auch empfohlen, Positiv- und Negativkontrollen in jeder Messcharge festzulegen, insbesondere für SCSA und MMP.
Die hier dargestellten repräsentativen Ergebnisse der Spermienanalyse wurden mit einem Accuri C6 abgeleitet. Die Technik könnte jedoch mit geringfügigen Modifikationen auch auf andere kommerzielle Plattformen angewendet werden. In der Regel werden insgesamt 5 × 106 Samenzellen benötigt, um die Anforderung für die Messung aller Indikatoren zu erfüllen. Wenn die Spermienkonzentration einer Probe viel niedriger als der Durchschnitt ist, würde der Bedarf an Samenvolumen steigen.
Ähnlich wie bei den routinemäßigen Spermienparametern gibt es auch bei menschlichen Spermien eine auffällige intraindividuelle Variation der Chromatinintegrität, des MMP und der Apoptose21. Dementsprechend können mehrere Tests von Proben, die zu unterschiedlichen Zeitpunkten entnommen wurden, eine genauere Schätzung des Schadensgrads der Spermienfunktion liefern. Obwohl es keine empfohlene Abstinenzzeit vor der Spermienentnahme für die durchflusszytometrische Analyse gibt, können 2-7 Tage ejakulatorische Abstinenz, die von der WHO für die routinemäßige Spermienanalyse empfohlen werden, angenommen werden. Es kann dazu beitragen, die Vergleichbarkeit der Ergebnisse zwischen Laboratorien und zwischen verschiedenen Proben, die von denselben Männern entnommen wurden, zu verbessern.
Eine wesentliche Einschränkung dieser Methode besteht darin, dass zwei der drei getesteten Biomarker - die Apoptose und das mitochondriale Membranpotenzial - frische Samenproben erfordern. Dies kann ihre Anwendung auf Männer beschränken, die dem Labor Samenproben zur Verfügung stellen können. Für den Test von DNA-Schäden (SCSA) sollten vor dem Experiment Referenzproben vorbereitet werden, um das Durchflusszytometer zu kalibrieren. Zu beachten ist, dass die Anwendung des vorliegenden Protokolls ein FCM-Gerät im Labor erfordert, was für viele klinische Laboratorien immer noch eine erhebliche Herausforderung darstellt, obwohl die Zusammenarbeit mit einem Drittanbieter in einigen Regionen eine Alternative sein kann.
Darüber hinaus sind die Kosten für die Farbstoffe und andere Reagenzien auch ein finanzieller Faktor für Männer, die die Untersuchung benötigen. Schließlich muss das Protokoll möglicherweise geändert werden, wenn verschiedene Marken oder Versionen von FCM verwendet werden, um die Biomarker zu untersuchen. Zusammenfassend wird in dieser Arbeit ein praktischer Ansatz zur Schätzung von drei Biomarkern für menschliche Spermienschäden mit einem einzigen Durchflusszytometriegerät vorgestellt. Dies kann wertvolle Informationen über die männliche reproduktive Gesundheit liefern und die routinemäßige Spermienuntersuchung ergänzen.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Wir danken allen Feldarbeitern für ihre Hilfe und den Interviewpartnern für ihre Mitarbeit.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.1 M citric acid buffer | Sigma-Aldrich Chemical Co., USA | 251275-5G | Add 21.01 g/L citric acid monohydrate (FW = 210.14; 0.10 M) to 1.0 L H2O. Store up to several months at 4 °C. |
| 0.2 M Na2PO4 buffer | Sigma-Aldrich Chemical Co., USA | V900061-500G | Add 28.4 g sodium phosphate dibasic (FW = 141.96; 0.2 M) to 1.0 L H2O. Store up to several months at 4 °C. |
| 10 mM CCCP stock solution | Sigma-Aldrich Chemical Co., USA | C2759 | Add 20.46 mg CCCP to 10.0 mL DMSO,making up to the final of CCCP in a concentration of 10mM, aliquot and store at −80 °C. |
| 10 µM CCCP working solution | Add 10 mL of PBS to a 15 mL polypropylene centrifuge tube and add 10 μL CCCP stock solution, making up to the final of CCCP in a concentration of 10 µM. | ||
| 1 mM JC-1 stock solution | Sigma-Aldrich Chemical Co., USA | T4069 | JC-1 is purchased lyophilized. Add a small quantity of DMSO to the vial and vortex for several minutes until all the dye has dissolved. Transfer the solution to a light-tight tube and rinse the vial with appropriate volume of DMSO, making up to the final of JC-1 in a concentration of 1 mg/mL aliquot and store at −20 °C. |
| 37 °C incubator | Thermo Scientific, USA | ||
| 5 µM JC-1 working solution | Add 10 mL of PBS to a 15 mL polypropylene centrifuge tube and add 50 μL from a thawed JC-1 stock aliquot. Stir gently to assure a homogenous dilution. This solution must be stored in the dark and used promptly. | ||
| Accuri C6 Flow cytometer | BD Pharmingen, San Diego, CA, United States | ||
| Acid solution, pH 1.2 | Combine 20.0 mL of 2.0 N HCl (0.08 N), 4.39 g of NaCl (0.15 M), and 0.5 mL of Triton X-100 (0.1%) in H2O for a final volume of 500 mL. Adjust pH to 1.2 with 5 mol/L HCl. | ||
| Acridine Orange (AO) stock solution, 1.0 mg/mL | Polysciences, Inc, Warrington, Pa | 65-61-2 | Dissolve chromatographically purified AO in dd-H2O at 1.0 mg/mL. |
| AO staining solution (working solution) | Add 600 μL of AO stock solution to each 100 mL of staining buffer. | ||
| Biological safety hood | Airtech, USA | ||
| Computer-aided sperm analysis system (CASA ) | Microptic, Barcelona, Spain | Sperm Class Analyzer 5.3.00 | |
| Sperm Counting Chamber | Goldcyto, Spain | ||
| Equipments | |||
| FITC Annexin V Apoptosis Detection Kit I | BD Biosciences, San Jose, CA | 556547 | Included: (1) FITC Annexin V is bottled at 100 ng/µL; (2) Propidium Iodide (PI):The PI Staining Solution is composed of 50 µg PI/mL in PBS (pH 7.4) and is 0.2 µM sterile filtered; (3) 10x Binding Buffer: 0.1 M Hepes (pH 7.4), 1.4 M NaCl, 25 mM CaCl2. For a 1x working solution, dilute 1 part of the 10x Annexin V Binding Buffer to 9 parts of distilled water. Store at 4 °C and protected from prolonged exposure to light. Do not freeze. |
| FlowJo 10 | Tree Star, Inc., San Carlos, CA, USA | ||
| Horizontal centrifuge | Thermo Scientific, USA | ||
| liquid nitrogen tank | Thermolyne, USA | ||
| Materials | |||
| PBS | Beyotime, Shanghai, China | C0221A | Ready-to-use PBS buffers is purchased and stored at room temperature |
| Staining buffer, pH 6.0 | Combine 370 mL of 0.10 M citric acid buffer, 630 mL of 0.20 M Na2PO4 buffer, 372 mg of EDTA (disodium, FW = 372.24; 1 mM), and 8.77 g of NaC1 (0.15 M). Mix overnight on a stir plate to insure that the EDTA is entirely in solution. pH to 6.0 with saturated NaOH solution. | ||
| The reference sample for SCSA analysis | The reference sample was diluted with cold (4 °C) TNE buffer to a working concentration of 1–2 × 106 cells/mL, and used to set the green at 475/1,024 flow cytometry channels and set the red at 125/1,024 flow cytometry channels. | ||
| TNE buffer, 1x, pH 7.4 (working solution) | Combine 60 mL of 10x TNE and 540 mL of H2O. Check pH (7.4). | ||
| TNE buffer, 10x, pH 7.4 | Perfemiker, Shanghai, China | PM11733 | Ready-to-use buffers is purchased and stored at 4 °C. |
Referenzen
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reproductive Biology and Endocrinology. 13 (1), 1-9 (2015).
- Nachtigall, R. D. International disparities in access to infertility services. Fertility and Sterility. 85 (4), 871-875 (2006).
- Agarwal, A., Allamaneni, S. S. R. Sperm DNA damage assessment: a test whose time has come. Fertility and Sterility. 84 (4), 850-853 (2005).
- Peña, F. J., Ortega Ferrusola, C., Martín Muñoz, P. New flow cytometry approaches in equine andrology. Theriogenology. 86 (1), 366-372 (2016).
- Oosterhuis, G. J., et al. Measuring apoptosis in human spermatozoa: a biological assay for semen quality. Fertility and Sterility. 74 (2), 245-250 (2000).
- Koopman, G., et al. Annexin V for flow cytometric detection of phosphatidylserine expression on B cells undergoing apoptosis. Blood. 84 (5), 1415-1420 (1994).
- Freitas, M. J., Vijayaraghavan, S., Fardilha, M. Signaling mechanisms in mammalian sperm motility. Biology of Reproduction. 96 (1), 2-12 (2017).
- Lehti, M. S., Sironen, A. Formation and function of sperm tail structures in association with sperm motility defects. Biology of Reproduction. 97 (4), 522-536 (2017).
- Durairajanayagam, D., Singh, D., Agarwal, A., Henkel, R. Causes and consequences of sperm mitochondrial dysfunction. Andrologia. 53 (1), 13666 (2021).
- Agnihotri, S. K., et al. Mitochondrial membrane potential (MMP) regulates sperm motility. In Vitro Cellular and Developmental Biology. Animal. 52 (9), 953-960 (2016).
- Smiley, S. T., et al. Intracellular heterogeneity in mitochondrial membrane potentials revealed by a J-aggregate-forming lipophilic cation JC-1. Proceedings of the National Academy of Sciences of the United States of America. 88 (9), 3671-3675 (1991).
- Evenson, D. P., Darzynkiewicz, Z., Melamed, M. R. Relation of mammalian sperm chromatin heterogeneity to fertility. Science. 210 (4474), 1131-1133 (1980).
- Evenson, D. P., Djira, G., Kasperson, K., Christianson, J. Relationships between the age of 25,445 men attending infertility clinics and sperm chromatin structure assay (SCSA®) defined sperm DNA and chromatin integrity. Fertility and Sterility. 114 (2), 311-320 (2020).
- Evenson, D. P. Sperm chromatin structure assay (SCSA®). Methods in Molecular Biology. 927, 147-164 (2013).
- Agarwal, A., Said, T. M. Role of sperm chromatin abnormalities and DNA damage in male infertility. Human Reproduction Update. 9 (4), 331-345 (2003).
- Ricci, G. Apoptosis in human sperm: its correlation with semen quality and the presence of leukocytes. Human Reproduction. 17 (10), 2665-2672 (2002).
- Zhang, H. -. B., et al. Early apoptotic changes in human spermatozoa and their relationships with conventional semen parameters and sperm DNA fragmentation. Asian Journal of Andrology. 10 (2), 227-235 (2008).
- . WHO laboratory manual for the examination and processing of human semen Available from: https://www.who.int/publications/i/item/9789240030787 (2022)
- Evenson, D. P., Wixon, R. Environmental toxicants cause sperm DNA fragmentation as detected by the Sperm Chromatin Structure Assay (SCSA). Toxicology and Applied Pharmacology. 207 (2), 532-537 (2005).
- Wang, Y. X., et al. Phthalate exposure in association with serum hormone levels, sperm DNA damage and spermatozoa apoptosis: A cross-sectional study in China. Environmental Research. 150, 557-565 (2016).
- Ni, W., et al. Diurnal variation in sperm DNA fragmentation: analysis of 11,382 semen samples from two populations and in vivo animal experiments. Chronobiology International. 36 (11), 1455-1463 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten