Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bildgebung des mikrostrukturellen Versagensmechanismus in der menschlichen Hüfte
In diesem Artikel
Zusammenfassung
Das Protokoll ermöglicht die Messung der Verformung der Knochenmikrostruktur im gesamten proximalen menschlichen Oberschenkelknochen und seiner Zähigkeit durch die Kombination von großvolumigem Mikro-CT-Scanning, einem maßgeschneiderten Kompressionstisch und fortschrittlichen Bildverarbeitungswerkzeugen.
Zusammenfassung
Die Abbildung der Knochenmikrostruktur unter progressiv zunehmender Belastung ermöglicht es, das mikrostrukturelle Versagensverhalten des Knochens zu beobachten. Hier beschreiben wir ein Protokoll zur Erstellung einer Sequenz von dreidimensionalen mikrostrukturellen Bildern des gesamten proximalen Femurs unter progressiv zunehmender Verformung, die klinisch relevante Frakturen des Oberschenkelhalses verursacht. Das Protokoll wird anhand von vier Femora von Spenderinnen im Alter von 66 bis 80 Jahren am unteren Ende der Knochenmineraldichte in der Bevölkerung demonstriert (T-Score-Bereich = −2,09 bis −4,75). Ein radiotransparenter Kompressionstisch wurde entwickelt, um die Proben zu belasten, die einen einbeinigen Stand nachahmen, während die aufgebrachte Last während der Mikro-Computertomographie (Mikro-CT) aufgezeichnet wird. Das Sichtfeld war 146 mm breit und 132 mm hoch, die isotrope Pixelgröße betrug 0,03 mm. Die Krafterhöhung basierte auf Finite-Elemente-Vorhersagen der Bruchlast. Die Druckstufe wurde verwendet, um die Verschiebung auf die Probe aufzubringen und die vorgeschriebenen Kraftschritte zu bewirken. Subkapitale Frakturen durch Öffnung und Scherung des Schenkelhalses traten nach vier bis fünf Belastungsschritten auf. Die Mikro-CT-Bilder und die Reaktionskraftmessungen wurden verarbeitet, um die Knochendehnung und die Energieabsorptionskapazität zu untersuchen. Eine Instabilität des Kortex trat bei den frühen Belastungsschritten auf. Der subchondrale Knochen im Hüftkopf zeigte große Verformungen von bis zu 16 % vor der Fraktur und eine fortschreitende Zunahme der Stützkapazität bis zur Fraktur. Die Verformungsenergie stieg linear mit der Verschiebung bis zum Bruch an, während die Steifigkeit unmittelbar vor dem Bruch auf Werte nahe Null abnahm. Drei Viertel der Bruchenergie wurden von der Probe während des letzten Kraftanstiegs von 25 % aufgenommen. Zusammenfassend lässt sich sagen, dass das entwickelte Protokoll eine bemerkenswerte Energieabsorptionskapazität oder Schadenstoleranz und eine synergistische Interaktion zwischen kortikalem und trabekulärem Knochen im fortgeschrittenen Spenderalter aufzeigte.
Einleitung
Frakturen des Oberschenkelhalses sind eine große Belastung für die alternde Bevölkerung. Die mikrocomputertomographische Bildgebung (Mikro-CT) und die begleitende mechanische Prüfung ermöglichen es, die Mikrostruktur des Knochens zu beobachten und ihre Beziehung zur Knochenfestigkeit, ihre altersbedingten Veränderungen und Verschiebungen unter Belastung zu untersuchen 1,2. Bis vor kurzem waren Mikro-CT-Untersuchungen von Knochen unter Belastung jedoch auf exzidierte Knochenkerne3, Kleintiere4 und menschliche Wirbelsäuleneinheiten5 beschränkt. Das vorliegende Protokoll kann die Verschiebung der Mikrostruktur des gesamten proximalen menschlichen Femurs unter Belastung und nach einer Fraktur quantifizieren.
Es wurden mehrere Studien durchgeführt, um das Versagen des menschlichen Oberschenkelknochens zu untersuchen, und manchmal kamen diese zu gegensätzlichen Ergebnissen. Zum Beispiel wird angenommen, dass die altersbedingte Ausdünnung der kortikalen und trabekulären Strukturen die altersbedingte Frakturanfälligkeit bestimmt, indem sie eine elastische Instabilität des Knochens verursacht6,7, was in offensichtlichem Gegensatz zu dem hohen Bestimmungskoeffizienten der kortikalen Dehnung und der Vorhersagen der Femurfestigkeit steht, die keine elastische Instabilität annehmen (R2 = 0,80-0,97)8,9. Nichtsdestotrotz haben solche Studien die femorale Festigkeit systematisch unterschätzt (um 21%-29%), was die in den Modellen implementierten spröden und quasi-spröden Knochenreaktionen in Frage stellt 8,10. Eine mögliche Erklärung für diese scheinbar gegensätzlichen Befunde könnte in einem anderen Frakturverhalten ganzer Knochen im Vergleich zu isolierten Knochenkernen liegen. Daher kann die Beobachtung der Deformations- und Frakturreaktionen der Knochenmikrostruktur in ganzen proximalen Oberschenkelknochen das Wissen über die Mechanik von Hüftfrakturen und verwandte Anwendungen erweitern.
Derzeitige Methoden zur Abbildung ganzer menschlicher Knochen mit mikrometrischer Auflösung sind begrenzt. Die Gantry und die Detektorgröße müssen ein geeignetes Arbeitsvolumen für den menschlichen proximalen Oberschenkelknochen (ca. 13 cm x 10 cm, Breite x Länge) und möglicherweise eine Pixelgröße in der Größenordnung von 0,02 bis 0,03 mm bereitstellen, um sicherzustellen, dass relevante mikroarchitektonische Merkmale erfasst werden können11. Diese Spezifikationen können derzeit von einigen Synchrotronanlagen1 und einigen kommerziell erhältlichen großvolumigen Mikro-CT-Scannern12,13 erfüllt werden. Die Druckstufe muss radiotransparent sein, um die Röntgenstrahlung zu minimieren und gleichzeitig eine Kraft zu erzeugen, die ausreicht, um eine Fraktur des menschlichen Oberschenkelknochens zu verursachen (z. B. zwischen 0,9 kN und 14,3 kN bei älteren weißen Frauen)14. Diese große Bruchlastvariation erschwert die Planung der Anzahl der zu brechenden Lastschritte, der Gesamtversuchszeit und der entsprechenden Datenmenge. Um dieses Problem zu lösen, können die Frakturlast und -lokalisation mittels Finite-Elemente-Modellierung geschätzt werden, indem die Knochendichteverteilung der Probe aus klinischen Computertomographie-Bildern (CT) verwendet wird 1,2. Nach dem Experiment muss die große Menge an generierten Daten schließlich verarbeitet werden, um die Versagensmechanismen und die Energiedissipationskapazität im gesamten menschlichen Oberschenkelknochen zu untersuchen.
Hier beschreiben wir ein Protokoll zur Gewinnung einer Sequenz von dreidimensionalen mikrostrukturellen Bildern des gesamten proximalen Femurs unter progressiv zunehmender Verformung, die klinisch relevante Frakturen des Oberschenkelhalses verursacht2. Das Protokoll umfasst die Planung der schrittweisen Inkrementierung der Probenkompression, die Belastung über einen kundenspezifischen radiotransparenten Kompressionstisch, die Bildgebung über einen großvolumigen Mikro-CT-Scanner sowie die Verarbeitung der Bilder und der Belastungsprofile.
Protokoll
Das Protokoll wurde mit 12 Oberschenkelproben aus einem Körperspendeprogramm entwickelt und getestet. Die Proben wurden frisch gewonnen und bei −20 °C im Biomechanics and Implants Laboratory der Flinders University (Tonsley, South Australia, Australien) gelagert. Die Knochenfeuchtigkeit wurde während des gesamten Experiments aufrechterhalten. Bei den Spenderinnen handelte es sich um kaukasische Frauen (66-80 Jahre). Die Ethik-Freigabe wurde vom Social and Behavioural Research Ethics Committee (SBREC) der Flinders University (Projekt # 6380) eingeholt.
1. Planung einer probenspezifischen Lastschritterhöhung
- Scannen Sie die Oberschenkelprobe mit einem klinischen CT-Scanner, der auf eine Schichtdicke und eine Pixelgröße in der Ebene von ca. 0,5-0,7 mm abzielt. Dieser Schritt kann von einem erfahrenen Röntgenassistenten in jeder öffentlichen Bildgebungseinrichtung durchgeführt werden, wobei standardmäßige, voraufgezeichnete Bildgebungsprotokolle für die Knochenvisualisierung verwendet werden.
- Zusammen mit der Probe wird ein CT-Densitometrie-Kalibrierphantom mit fünf bekannten Konzentrationen von Dikaliumhydrogenphosphat (K2HPO4, äquivalenter Dichtebereich zwischen 59 mg∙cm−3 und 375 mg∙cm−3) gescannt.
- Segmentieren Sie die Knochengeometrie aus den klinischen CT-Bildern15, vernetzen Sie die segmentierte Geometrie des Knochens und ordnen Sie die isotropen Materialeigenschaften Element für Element den kalibrierten Knochendichtewerten zu, indem Sie die von Schileo et al.8 beschriebene Beziehung zwischen Dichte und elastischem Modul verwenden. Speichern Sie das Netz zur weiteren Analyse in der Finite-Elemente-Software. Führen Sie jeden Schritt aus, indem Sie die entsprechenden Richtlinien befolgen, die mit der Segmentierungs- und Finite-Elemente-Software bereitgestellt werden.
- Importieren Sie das Netz in die Finite-Elemente-Software. Beschränken Sie das 3-6 mm distale Ende des Modells vollständig. Es wird eine Nennkraft von 1.000 N aufgebracht, die um 8° von der Hüftschaftachse in die koronale Ebene adduziert wird und durch die Mitte des Hüftkopfes verläuft. Diese Belastungsbedingung ahmt eine statische einbeinige Standaufgabe (orthoload.com).
- Lösen Sie das Finite-Elemente-Modell mit dem integrierten PCG-Solver (Konvergenztoleranz: 1 x 10−7).
HINWEIS: Hier wurde die Finite-Elemente-Software ANSYS verwendet.- Generieren Sie eine Elementtabelle, die die erste und dritte Hauptdehnungskomponente am Elementschwerpunkt enthält, indem Sie die folgenden Befehle ausführen:
/POST1
ETABLE,, EPTO1,1
ETABLE,, EPTO3,3 - Berechnen Sie das Dehnungsverhältnis zwischen der ersten und dritten Hauptdehnungskomponente im Modell und der Knochenertragsdehnung bei Zug (0,73 % Dehnung) und Druck (1,04 % Dehnung)8 (Abbildung 1), indem Sie die folgenden Befehle ausführen:
SMULT,RFT,EPTO1, ,1/0,0074,1,
SMULT, RFT,EPTO3, ,1/0.0104,1,
- Generieren Sie eine Elementtabelle, die die erste und dritte Hauptdehnungskomponente am Elementschwerpunkt enthält, indem Sie die folgenden Befehle ausführen:
- Skalieren Sie die Nennkraft mit dem Spitzendehnungsverhältnis sowohl bei Zug als auch bei Druck und verwerfen Sie die größte der beiden, um eine Schätzung der Bruchlast zu erhalten. Bestimmen Sie die Lasterhöhung als 1/4 der berechneten Bruchlast1.
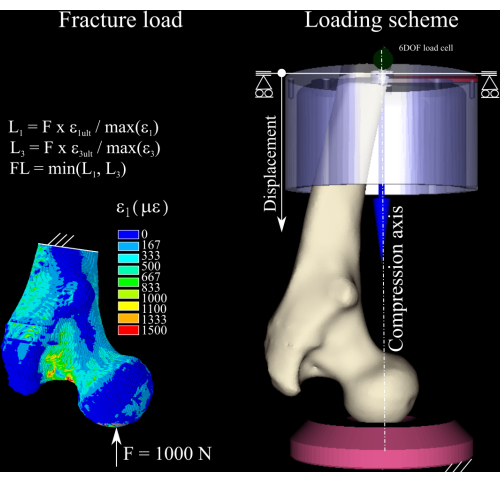
Abbildung 1: Die Berechnung der Bruchlast. Die Finite-Elemente-Dehnungskarte, die Gleichungen zur Umrechnung der Nennkraft in die Bruchlast (links) und das Belastungsschema mit dem Oberschenkelknochen (Mitte rechts), dem distalen Aluminiumbecher (oben rechts) und dem Polyethylen-Druckstutzen (unten rechts). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Vorbereitung der Femurprobenanordnung (Abbildung 2)
- Nehmen Sie die Probe aus dem Gefrierschrank (−20 °C).
- Tauen Sie die Probe 24 Stunden lang bei Raumtemperatur (RT) auf, während Sie die Probe in einem wasserdichten Plastikbeutel aufbewahren, der in saugfähiges Material eingewickelt ist, das in einer physiologischen Lösung getränkt ist, um die Knochenfeuchtigkeit zu erhalten.
- Schneiden Sie die Femurdiaphyse 180 mm vom proximalen Hüftkopf entfernt.
- Zentrieren Sie den Hüftkopf auf der vertikalen Achse des Ausrichtungssystems, indem Sie die konkav geformte Polyethylen-Druckbuchse (Abbildung 2D) und den Femurkopf ausrichten.
- Richten Sie die Ebene, die den Oberschenkelhals und die Diaphysenachse enthält, an der Frontalebene aus (Abbildung 2).
- Drehen Sie die diaphysäre Achse auf 8° Adduktion, so dass die vertikale Achse die Ausrichtung der Hüftreaktionskraft während eines statischen einbeinigen Standes darstellt (Abbildung 2).
- Bereiten Sie den Zahnzement vor, indem Sie die Anweisungen des Herstellers befolgen.
- Topfen Sie das distale Ende der Probe in einen 55 mm tiefen Aluminium-Vergussbecher und füllen Sie den Aluminiumbecher mit Zahnzement. Warten Sie mindestens 30 Minuten, bis der Zement vollständig ausgehärtet ist.
- Lagern Sie die Probenbaugruppe bei −20 °C.
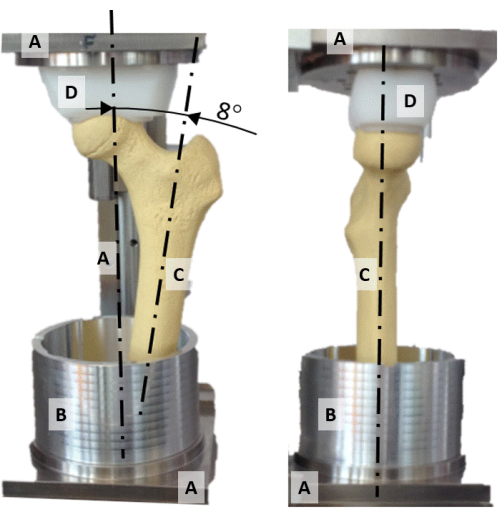
Abbildung 2: Das Ausrichtungsrigg. Ein frontales (links) und seitliches (rechts) Foto des Ausrichtungssystems, das (A) den Rahmen, (B) den Aluminium-Vergussbecher, (C) ein synthetisches Oberschenkelmodell und (D) die kugelförmige Druckbuchse zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Montage der Kompressionsstufe
HINWEIS: Die Außenmaße der Kompressionsstufe betragen 245 mm Durchmesser, 576 mm Höhe und 14 kg Gewicht, ohne Probe. Die Kompressionsstufe besteht aus zwei Hauptteilen: der Kompressionskammer und dem Aktuator, die wie folgt zusammengesetzt sind:
- Kompressionskammer
- Montieren Sie die Polyethylen-Druckstutzen (104 mm Durchmesser, 60 mm Höhe) an der Unterseite des Aluminiumzylinders (203 mm Durchmesser, 3 mm Wandstärke), der an einem Ende (unten) durch eine geschweißte Aluminiumplatte verschlossen wird.
- Stellglied
- Montieren Sie die obere Struktur mit der Scheibe, den drei Stäben, der dreieckigen Platte und der vertikalen Schiene (Abbildung 3).
- Montieren Sie den Hubmechanismus (Hub: 150 mm, maximale Belastung: 10.000 N, Übersetzung: 27:1, Hubraum pro Umdrehung: 0,148 mm) auf der dreieckigen Platte.
- Montieren Sie den Winkeladapter auf der Linearschiene.
- Montieren Sie den reibungsarmen x-y-Tisch auf dem Winkeladapter.
- Montieren Sie die Wägezelle mit sechs Freiheitsgraden (maximaler Messfehler: 0,005 %; maximale Kraft: 10.000 N; maximales Drehmoment: 500 Nm) auf dem reibungsarmen Tisch, indem Sie die x-z-Ebene der Wägezelle auf die Frontalebene der oberen Struktur ausrichten.
- Verbinden Sie die Betätigungsschraube mit dem Winkeladapter.

Abbildung 3: Die maßgeschneiderte radiotransparente Kompressionsstufenbaugruppe. Ein Foto (links) und ein Modell (rechts) des Drucktisches. (A) die Kompressionskammer, bei der es sich um einen 3 mm dicken Aluminiumzylinder handelt, der unten geschlossen ist; (B) die Aktuatorbaugruppe mit der oberen Struktur; c) den Spindelhubmechanismus; (D) der reibungsarme x-y-Tisch; und (E) die sechsachsige Wägezelle werden auf dem Modell angezeigt und angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Einrichten des Experiments
- Tauen Sie die Probe bei RT 24 Stunden lang auf, während Sie sie in einem wasserdichten Plastikbeutel aufbewahren, der in saugfähiges Material eingewickelt ist, das in einer physiologischen Lösung getränkt ist, um die Knochenfeuchtigkeit zu erhalten.
- Montieren Sie die Aluminiumschalen-Probenbaugruppe an der Wägezelle, indem Sie die Frontebene der Probenbaugruppe an der des Aktuators ausrichten.
- Montieren Sie die obere Struktur, einschließlich der Probe, in die Kompressionskammer. Achten Sie darauf, den Hüftkopf mit der sphärischen Konkavität an der Polyethylen-Druckbuchse auszurichten. Stellen Sie sicher, dass der Hüftkopf eingerastet, aber innerhalb des kugelförmigen Hohlraums der Druckbuchse locker ist.
- Platzieren Sie den Kompressionstisch auf dem Rotationstisch des Mikro-CT-Scanners an der Imaging and Medical Beamline (IMBL).
- Schließen Sie die Wägezelle (Fehler < 0,005 %; maximale Kraft: 10.000 N; maximales Drehmoment: 500 Nm) an den Dehnungsverstärker an.
- Schließen Sie den Dehnungsverstärker über USB an einen Laptop an, der mit der mit der Wägezelle gelieferten Anwendungssoftware ausgestattet ist.
- Betätigen Sie den Schraubmechanismus in der Kompressionsstufe, indem Sie die Probe nach unten in Richtung der Druckbuchse bewegen, während Sie die von der Wägezelle im Laptop gemessene Reaktionskraft überwachen. Stoppen Sie den Schraubmechanismus, sobald eine Druckkraft von 100 N erreicht ist. Die Probe wird auf 50 N Vorspannung entladen.
- Wählen Sie den linsengekoppelten Szintillator "Ruby" (http://archive.synchrotron.org.au/31-australian-synchrotron/imbl/811-preparation-for-imaging-experiments) mit einem einzelnen pco.edge-Sensor.
- Stellen Sie das Sichtfeld auf 76,31 mm x 64,39 mm ein, was für die Arraygröße von 2.560 x 2.160 Pixeln eine Pixelgröße von 29,81 μm ergibt.
- Stellen Sie die Achse des Drehtisches auf 8 mm (horizontal) von der Achse des Sichtfeldes (Offset-Scanmodus) ein, um das Sichtfeld auf 145,71 mm x 64,39 mm bei einer Pixelgröße von 29,81 μm zu erweitern.
- Stellen Sie die Scanparameter auf eine Strahlenergie von 60 keV, ein Rotationsinkrement von 0,1°, zwei Chargen mit 180°-Drehung (Offset-Scanning), eine Belichtungszeit von 50 μs und eine Bildmittelung von zwei pro Drehposition ein.
- Stellen Sie den Scan so ein, dass fünf aufeinanderfolgende, vertikal gestapelte Scans mit jeweils einer vertikalen Verschiebung von 26 mm aufgenommen werden, sodass die Gesamthöhe des gescannten Volumens 132,2 mm für eine Gesamtscanzeit von 30 Minuten beträgt.
5. Mechanische Prüfung mit begleitender mikrostruktureller Bildgebung
- Führen Sie zweimal eine Mikro-CT-Bildgebung (Pixelgröße: 0,03 mm) unter der Referenzbedingung durch (aufgenommen als Null-Dehnungs-Bedingung).
- Wenden Sie die Krafterhöhung an, indem Sie den Spindelhubmechanismus manuell mit einer konstanten Geschwindigkeit von ca. 1 s pro Runde betätigen (0,1-0,2 mm/s).
- Führen Sie eine Mikro-CT-Bildgebung durch.
- Wiederholen Sie die Schritte 5.2 und 5.3 bis zur Fraktur der Probe, die durch einen plötzlichen Abfall der Reaktionskraft angezeigt wird.
- Führen Sie eine Mikro-CT-Bildgebung der gebrochenen Probe durch.
- Fügen Sie die 1.800 Projektionsbilder zusammen (2.560 x 896 Pixel groß, 76,8 mm x 26,88 mm, Breite x Höhe, 32-Bit-Gleitkommabilder). Bei diesem Verfahren werden zwei Projektionsbilder (aufgenommen im horizontalen Offset-Scan-Modus) und die fünf vertikal verschobenen Bilder zusammengefügt, wodurch ein einzelnes Projektionsbild entsteht.
- Rekonstruieren Sie das Volumen der Querschnittsbilder (4.407 Bilder, jedes Bild 4.888 x 4.888 Pixel groß) und speichern Sie sie als 32-Bit-Gleitkommadateien in . TIFF-Format (belegt 392 GB Speicherplatz).
- Wenden Sie einen 3 x 3 Gauß-Filter an, um das Rauschen zu reduzieren. Konvertieren Sie die Bilder in 8-Bit (256 Graustufenbilder, die im Bitmap-Format gespeichert werden und ca. 100 GB pro Volume belegen).
ANMERKUNG: In dieser Arbeit wurde die Verarbeitung der Bilder mit einer Software durchgeführt, die am australischen Synchrotron unter der Leitung des Betreibers des IMBL zur Verfügung steht.
6. Berechnung des Verschiebungs- und Dehnungsfeldes
- Subsampling der Querschnittsbilder um vier (120 μm/Pixel), um die Rechenzeit zu reduzieren.
- Registrieren Sie die Bilder der Probe unter Belastung starr im Raum mit denen der Probe im unbelasteten Referenzzustand. Verwenden Sie die distale Diaphyse als Ziel der Mitregistrierung (Ergänzungsdatei 1 und Ergänzungsdatei 2).
- Erstellen von dreidimensionalen Oberflächenmodellen (. STL-Dateien) zur Visualisierung nach der Binarisierung der Mikro-CT-Bilder11.
- Registrieren Sie das Bildvolumen elastisch auf dem Referenzvolumen mit einer Rastergröße von 50 Pixeln (SDER = 0,076 % Dehnungsfehler, BoneDVC, https://bonedvc.insigneo.org/dvc/), um die Verschiebungen an den Knoten des Rasters zu bestimmen.
- Konvertieren Sie das Raster in ein Finite-Elemente-Modell. Wenden Sie die von BoneDVC berechnete Knotenverschiebung auf das Modell an. Lösen Sie das Modell, um den Dehnungstensor über das gesamte Knochenvolumen zu bestimmen.
- Wiederholen Sie die Analyse in dem Bereich, in dem die höchsten Dehnungswerte angezeigt werden, mit den Bildern in voller Auflösung.
- Ordnen Sie die DVC-Dehnungszuordnungen den Bildern in voller Auflösung zu, indem Sie kubische Interpolation mit der interp3-Funktion (Matlab)2 verwenden.
- Visualisieren Sie die Verschiebungen, Dehnungen und mikrostrukturellen Bilder für die großvolumige Visualisierung und Animation (Matlab)2.
7. Würdigung
- Zeigen Sie die dauerhafte Verformung des Knochens (Schädigung) an, indem Sie die Bilder überlagern, die unter unbelasteten Bedingungen und nach der Fraktur aufgenommen wurden2.
- Darstellung der fortschreitenden mikrostrukturellen Verformung des Knochens durch Überlagerung der dreidimensionalen Modelle unter unbelasteten Bedingungen, bei steigender Belastung und nach Fraktur2.
- Zeigen Sie die Dehnung des Knochens an der Frakturstelle2 an.
- Analysieren Sie die Verformungsenergie, Steifigkeit und Verschiebung mit Hilfe von deskriptiver Statistik und Regressionsmethoden2.
Ergebnisse
Die Bilder zeigen den gesamten proximalen Oberschenkelknochen, den Druckfach, den Zahnzement, die Aluminiumpfanne und das Wickelgewebe. Die Mikroarchitektur des Knochens verformt sich progressiv, wenn die Belastung vor und nach der Fraktur zunimmt (Abbildung 4).

Abbildung 4: Die Kompressionsstufe, die an den ...
Diskussion
Das vorliegende Protokoll ermöglicht es, die verstrichene Mikromechanik von Hüftfrakturen in drei Dimensionen ex vivo zu untersuchen. Eine radiotransparente (Aluminium-)Druckstufe, die in der Lage ist, eine progressive Verformung auf die proximale Hälfte des menschlichen Oberschenkelknochens anzuwenden und die Reaktionskraft zu messen, wurde speziell entwickelt, hergestellt und getestet. Ein großvolumiger Mikro-CT-Scanner wird in diesem Protokoll verwendet, um eine zeitliche Abfolge von Bildvolumina zu liefe...
Offenlegungen
Alle Autoren erklären, dass keine Interessenkonflikte vorliegen.
Danksagungen
Förderung durch den Australian Research Council (FT180100338; IC190100020) wird dankbar zur Kenntnis genommen.
Materialien
| Name | Company | Catalog Number | Comments |
| Absorbent tissue | N/A | Maintain the bone moisture throughout the experiment | |
| Alignment rig | Custom-made | Rig for positioning the specimen in the potting cup | |
| Aluminium potting cup | Custom-made | Potting cup | |
| Bone saw | N/A | Cut the specimen to size | |
| Calibration phantom QCT Pro | Mindways Software, Inc., Austin, USA | CT Calibration 13002 | Calibrate grey levels in the images into equivalent bone mineral (ash) density levels |
| Clinical Computed-Tmography scanner | General Electric Medical Systems Co., Wisconsin, USA | Optima CT660 | Preliminary imaging for the prediction of the load step to fracture |
| Compressive stage | Custom-made | A 10 kg, radiotransparent compressive stage for applying and maintaining throught imaging a prescribed deformation to the specimen. | |
| Dental cement | Soesterberg, The Netherlands | Vertex RS | |
| Femur specimen | Science Care, Phoenix, USA | ||
| Finite-element analysis software | ANSYS Inc., Canonsburg, USA | ANSYS Mechanical APDL | Finite-element software package |
| Freezer | N/A | Store specimens at -20 °C | |
| Hard Drive | Dell | Disk space: 500 GB per volume | |
| Image bnarization and segmentation software | Skyscan-Bruker, Kontich, Belgium | CT analyzer | Image processing software |
| Image elastic segmentation | The University of Sheffield | Bone DVC | https://bonedvc.insigneo.org/dvc/ |
| Image processing and automation software | The MathWork Inc. | Matlab | Image processing software |
| Image registration software | Skyscan-Bruker, Kontich, Belgium | DataViewer | Image processing software |
| Image segmentation and FE modelling software | Simpleware, Exeter, UK | Scan IP | Bone egmentation software |
| Image stiching script | Australian syncrotron, Clayton, VIC, AU | The script is available at IMBL | |
| Image visualization | Kitware, Clifton Park, NY, USA | Paraview | Image visualization |
| Image visualization | Australian National University | Dristhi | Image visualization: doi:10.1117/12.935640 |
| Imaging and Medical beamline | Australian syncrotron, Clayton, VIC, AU | Large object micro-CT beamline at the Australian Synchrotron | |
| Laptop | Dell Inc., USA | ||
| Low-friction x-y table | THK Co., Tokyo, Japan | ||
| NI signal acquisition software | National Instruments, Austin, TX | NI-DAQmx | |
| Phosphate-buffered saline solution | Custom-made | Maintain the bone moisture throughout the experiment | |
| Plastic bag | N/A | Maintain the bone moisture throughout the experiment | |
| Rail | SKF Inc., Lansdale, PA, USA | ||
| Screw-jack mechanism | Benzlers, Örebro, Sweden | Serie BD (warm gear unit) | stroke: 150 mm, maximal load: 10,000 N, gear ratio: 27:1, a displacement per revolution: 0.148 mm |
| Single pco.edge sensor, lens coupled scintillator | Australian syncrotron, Clayton, VIC, AU | Detector Ruby FOV: 141 x 119 mm; 2560 x 2160 px; 55 µm/px; 50 fps | |
| Six axis load cell | ME-Meßsysteme GmbH, Hennigsdorf, GE | K6D6 | Maximal measurement error: 0.005%; maximal force: 10000 N; maximal torque: 500 Nm |
| Strain amplifier | ME-Meßsysteme GmbH, Hennigsdorf, GE | GSV-1A8USB K6D/M16 |
Referenzen
- Martelli, S., Perilli, E. Time-elapsed synchrotron-light microstructural imaging of femoral neck fracture. Journal of the Mechanical Behavior of Biomedical Materials. 84, 265-272 (2018).
- Martelli, S., Giorgi, M., Dall' Ara, E., Perilli, E. Damage tolerance and toughness of elderly human femora. Acta Biomaterialia. 123, 167-177 (2021).
- Perilli, E., et al. Dependence of mechanical compressive strength on local variations in microarchitecture in cancellous bone of proximal human femur. Journal of Biomechanics. 41 (2), 438-446 (2008).
- Thurner, P. J., et al. Time-lapsed investigation of three-dimensional failure and damage accumulation in trabecular bone using synchrotron light. Bone. 39 (2), 289-299 (2006).
- Jackman, T. M. Quantitative, 3D visualization of the initiation and progression of vertebral fractures under compression and anterior flexion. Journal of Bone and Mineral Research. 31 (4), 777-788 (2016).
- Mayhew, P. M., et al. Relation between age, femoral neck cortical stability, and hip fracture risk. Lancet. 366 (9480), 129-135 (2005).
- Nazarian, A., Stauber, M., Zurakowski, D., Snyder, B. D., Müller, R. The interaction of microstructure and volume fraction in predicting failure in cancellous bone. Bone. 39 (6), 1196-1202 (2006).
- Schileo, E., et al. To what extent can linear finite element models of human femora predict failure under stance and fall loading configurations. Journal of Biomechanics. 47 (14), 3531-3538 (2014).
- Schileo, E., et al. An accurate estimation of bone density improves the accuracy of subject-specific finite element models. Journal of Biomechanics. 41 (11), 2483-2491 (2008).
- Dall'ara, E., et al. A nonlinear QCT-based finite element model validation study for the human femur tested in two configurations in vitro. Bone. 52 (1), 27-38 (2013).
- Perilli, E., Parkinson, I. H., Reynolds, K. J. Micro-CT examination of human bone: from biopsies towards the entire organ. Annali dell'Istituto Superiore di Sanità. 48 (1), 75-82 (2012).
- Wearne, L. S., Rapagna, S., Taylor, M., Perilli, E. Micro-CT scan optimisation for mechanical loading of tibia with titanium tibial tray: A digital volume correlation zero strain error analysis. Journal of the Mechanical Behavior of Biomedical Materials. 134, 105336 (2022).
- Bennett, K. J., et al. Ex vivo assessment of surgically repaired tibial plateau fracture displacement under axial load using large-volume micro-CT. Journal of Biomechanics. 144, 111275 (2022).
- Falcinelli, C., et al. Multiple loading conditions analysis can improve the association between finite element bone strength estimates and proximal femur fractures: A preliminary study in elderly women. Bone. 67, 71-80 (2014).
- Orthopedic Image Segmentation. Synopsys Available from: https://www.synopsys.com/simpleware/news-and-events/ortho-medical-image-segmentation.html (2020)
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten