Gleichzeitige Isolierung der wichtigsten Zelltypen des Zentralnervensystems aus adulten Autoimmun-Enzephalomyelitis-Mäusen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Bis heute sind Protokolle für die gleichzeitige Isolierung aller wichtigsten Zelltypen des Zentralnervensystems aus derselben Maus ein ungedeckter Bedarf. Das Protokoll zeigt ein Verfahren, das in naiven und experimentellen autoimmunen Enzephalomyelitis-Mäusen angewendet werden kann, um komplexe zelluläre Netzwerke während der Neuroinflammation zu untersuchen und gleichzeitig die erforderliche Anzahl von Mäusen zu reduzieren.
Zusammenfassung
Die experimentelle autoimmune Enzephalomyelitis (EAE) ist das häufigste Mausmodell für Multiple Sklerose (MS) und wird häufig verwendet, um die noch unbekannte Ätiologie der MS weiter aufzuklären und neue Behandlungsstrategien zu entwickeln. Das EAE-Modell des Myelin-Oligodendrozyten-Glykoproteinpeptids 35-55 (MOG35-55) reproduziert einen selbstlimitierenden monophasischen Krankheitsverlauf mit aufsteigender Lähmung innerhalb von 10 Tagen nach der Immunisierung. Die Mäuse werden täglich mit einem klinischen Scoring-System untersucht. MS wird durch verschiedene Pathomechanismen mit einem bestimmten zeitlichen Muster angetrieben, daher ist die Untersuchung der Rolle von Zelltypen des Zentralnervensystems (ZNS) während des Krankheitsverlaufs von großem Interesse. Das einzigartige Merkmal dieses Protokolls ist die gleichzeitige Isolierung aller wichtigsten ZNS-residenten Zelltypen (Mikroglia, Oligodendrozyten, Astrozyten und Neuronen), die bei erwachsenen EAE und gesunden Mäusen anwendbar sind. Auf die Dissoziation des Gehirns und des Rückenmarks von erwachsenen Mäusen folgt die magnetisch aktivierte Zellsortierung (MACS), um Mikroglia, Oligodendrozyten, Astrozyten und Neuronen zu isolieren. Die Durchflusszytometrie wurde verwendet, um Qualitätsanalysen der gereinigten Einzelzellsuspensionen durchzuführen, die die Lebensfähigkeit nach der Zellisolierung bestätigten und die Reinheit jedes Zelltyps von etwa 90 % angaben. Zusammenfassend lässt sich sagen, dass dieses Protokoll eine präzise und umfassende Möglichkeit bietet, komplexe zelluläre Netzwerke in gesunden und EAE-Mäusen zu analysieren. Darüber hinaus kann die Anzahl der benötigten Mäuse erheblich reduziert werden, da alle vier Zelltypen aus denselben Mäusen isoliert werden.
Einleitung
Multiple Sklerose (MS) ist eine chronisch-entzündliche Autoimmunerkrankung des Zentralnervensystems (ZNS), die durch Demyelinisierung, axonale Schäden, Gliose und Neurodegeneration gekennzeichnet ist. Trotz zahlreicher Forschungsansätze auf diesem Gebiet ist die Pathophysiologie der MS noch nicht vollständig verstanden 1,2,3,4. Das häufigste Tiermodell zur Untersuchung von MS ist die durch Myelin-Oligodendrozyten induzierte experimentelle autoimmune Enzephalomyelitis (EAE) mit Myelin-Oligodendrozyten-Glykoproteinpeptid 35-55 (MOG35-55), die viele ihrer klinischen und pathophysiologischen Merkmale aufweist 5,6,7,8,9 . Sie basiert auf der Reaktion des Immunsystems auf ZNS-spezifische Antigene, die zu Entzündungen, Demyelinisierung und neuroaxonaler Degeneration führen. Die experimentelle autoimmune Enzephalomyelitis (EAE) ist ein geeignetes Modell für die Untersuchung neuroinflammatorischer Signalwege und Signalkaskaden bei MS.
Derzeitige Therapiemöglichkeiten bei MS sind nur bedingt wirksam und konzentrieren sich vor allem auf die initiale Entzündungsphase der Erkrankung. Die neurodegenerative Komponente der MS scheint jedoch die größte Herausforderung für langfristige Therapieansätze zu sein. Daher sind reproduzierbare und präzise Zellisolationsprotokolle erforderlich, um molekulare und zelluläre Mechanismen bei Autoimmunerkrankungen umfassend zu untersuchen. Auch wenn einige Protokolle für die Isolierung eines einzelnen Zelltyps existieren 10,11,12,13,14,15, besteht ein ungedeckter Bedarf an der gleichzeitigen Isolierung mehrerer ZNS-residenter Zellpopulationen auf einmal. Bisherige Protokolle zur Isolierung von ZNS-residenten Zellen sind nicht in der Lage, die zelluläre Funktionalität und Reinheit zu erhalten, was zu einer Kokultivierung mit benachbarten Zellenführt 16,17,18 oder der Ungeeignetheit für komplexe Analysen intrazellulärer Netzwerke ex vivo19,20,21,22.
Das Ziel dieses Protokolls war es, eine reproduzierbare und umfassende Methode zur gleichzeitigen Isolierung von reinen, lebensfähigen Einzelzellsuspensionen aller wichtigsten ZNS-residenten Zelltypen zu etablieren, die in adulten gesunden und EAE-Mäusen anwendbar sind. Die verschiedenen Zelltypen wurden mittels magnetisch aktivierter Zellsortierung (MACS) isoliert23. Die Zelltrennung kann entweder durch positive Selektion, d.h. magnetische Markierung von zelltypspezifischen Oberflächenmarkern, oder durch negative Selektion durch Biotinylierung und Depletion aller unerwünschten Zellen erfolgen. Die Durchflusszytometrie wurde angewendet, um eine Reinheit von über 90 % und eine Viabilität von mindestens 80 % der isolierten Einzelzellsuspensionen sicherzustellen.
Zusammenfassend war das Hauptziel, ein Protokoll für die gleichzeitige Isolierung aller wichtigen ZNS-residenten Zelltypen als vielseitiges Werkzeug für die Untersuchung neuroinflammatorischer Signalwege zu etablieren, das eine umfassende und präzise Analyse komplexer zellulärer Netzwerke und biochemischer Signalkaskaden in gesunden und EAE-Mäusen ermöglicht.
Protokoll
Alle EAE-Experimente wurden an weiblichen C57BL/6J-Mäusen im Alter von 10-12 Wochen induziert und von den lokalen Behörden (Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen) genehmigt. Auch die Einhaltung des deutschen und EU-Tierschutzrechts wurde zu jedem Zeitpunkt der Versuche sichergestellt. Alle Mäuse wurden in einzeln belüfteten Käfigen gehalten.
ANMERKUNG: Die folgenden Reagenzvolumina beziehen sich auf ein erwachsenes murines Gehirn und Rückenmark, die im Folgenden als ZNS-Zellsuspension bezeichnet werden und etwa 20 mg bis 500 mg wiegen. Wenn die Dissoziation von mehr als einer ZNS-Zellsuspension geplant ist, müssen alle Reagenzienvolumina und -materialien entsprechend skaliert werden. Es wird empfohlen, die phosphatgepufferte Kochsalzlösung (D-PBS; 1x) von Dulbecco mit Calcium und Magnesium, ergänzt mit 1 g/L Glucose und 36 mg/L Natriumpyruvat) während des gesamten Experiments kontinuierlich auf Eis zu lagern. Wenn die Zellkultivierung im Nachhinein geplant ist, führen Sie alle Schritte unter sterilen Bedingungen unter Verwendung von Hauben durch. Andernfalls muss keiner der folgenden Protokollabschnitte unter einer Haube ausgeführt werden. Bewahren Sie die Puffer auf Eis auf. Verwenden Sie nur vorgekühlte Lösungen und vermeiden Sie Wirbel während des gesamten Experiments. Siehe Abbildung 1 für den allgemeinen Workflow.
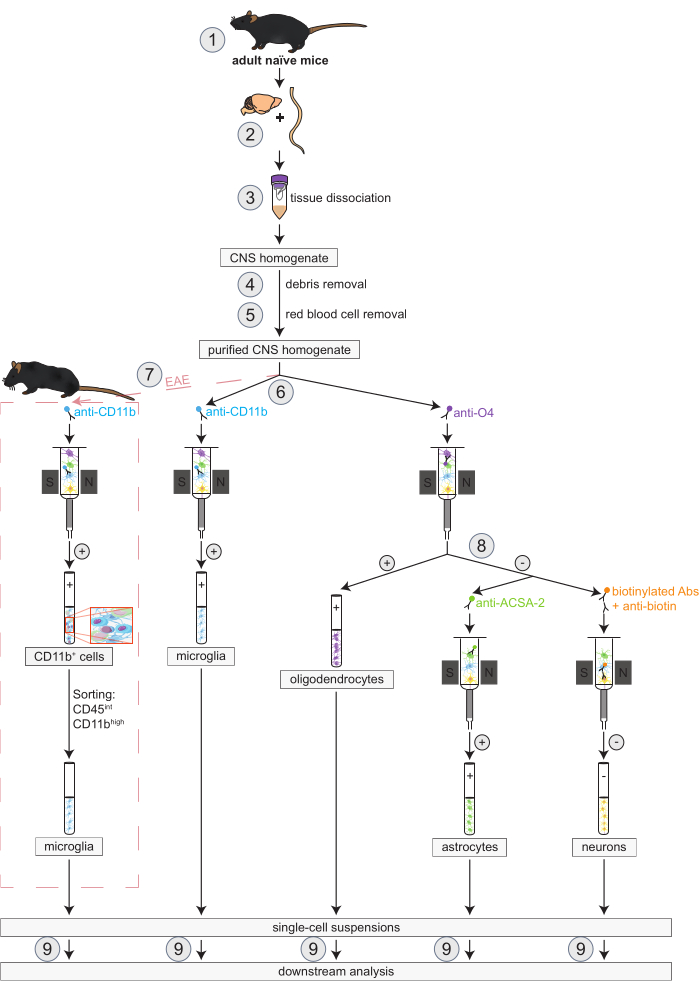
Abbildung 1: Arbeitsablauf für die gleichzeitige Isolierung von Oligodendrozyten, Mikroglia, Astrozyten und Neuronen in naiven und EAE-Mäusen. Die ersten Schritte des Arbeitsablaufs sind sowohl für naive als auch für EAE-Mäuse gleich. Wenn mit einem EAE-Replikat gearbeitet werden soll, muss zuvor eine EAE-Induktion durchgeführt werden (1). Kurz gesagt, das Protokoll beginnt mit der Dissektion (2) und Dissoziation (3) von Gehirn und Rückenmark der Maus, gefolgt von der Entfernung von Trümmern (4) und roten Blutkörperchen (5). Anschließend wird die resultierende gereinigte ZNS-Zellsuspension zur gleichzeitigen Isolierung von Oligodendrozyten und Mikroglia mittels MACS in zwei Fraktionen aufgespalten (6). Mikroglia werden über Anti-CD11b-Mikrokügelchen detektiert, während Oligodendrozyten mit Anti-O4-Mikrokügelchen isoliert werden (positive Selektion). Aus dem negativen Durchfluss der Oligodendrozyten (8) werden Astrozyten über Anti-ACSA-2-Mikrokügelchen (positive Selektion) und Neuronen durch Biotinmarkierung und Depletion aller nicht-neuronalen Zellen (negative Selektion) isoliert. In EAE-Mäusen folgt auf die Isolierung von CD11b+-Zellen eine fluoreszenzaktivierte Zellsortierung von CD45inCD11b-Hochzellen, um andere CD11b+-Immunzellen wie Makrophagen, dendritische Zellen, Monozyten, Granulozyten und natürliche Killerzellen zu eliminieren, von denen bekannt ist, dass sie während des EAE-Verlaufs an Neuroinflammationsprozessen beteiligt sind (7)27,28,48. Nach der Isolierung der verschiedenen ZNS-residenten Zelltypen können Reinheitsanalysen durchgeführt werden (9). Abkürzungen: Abs = Antikörper; ACSA-2 = Antigen-2 auf der Oberfläche von Astrozyten; CD11b = Cyclin-abhängige Kinase 11B; CD45 = Tyrosin-Protein-Phosphatase C; ZNS = Zentrales Nervensystem; EAE = experimentelle autoimmune Enzephalomyelitis; MACS = magnetisch aktivierte Zellsortierung; O4 = Oligodendrozytenmarker O4. Diese Zahl wurde von49 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Induktion der aktiven EAE
- Herstellung von Reagenzien
- Für die Zelltrennung: Bereiten Sie den PB-Puffer vor und lagern Sie ihn bei 2-8 °C für maximal 1 Woche. Zur Herstellung der Stammlösung 475 ml 1x PBS ohne Zusätze (pH 7,2) + 25 ml 0,5%iges Rinderserumalbumin (BSA) hinzufügen. Verwenden Sie eine 1:20-Verdünnung, die in BSA hergestellt wurde.
- Für Durchflusszytometrie und fluoreszenzaktivierte Zellsortierung (FACS): FACS-Puffer PBS mit 2 % fötalem Kälberserum (FCS) und 2 mM EDTA vorbereiten und bei 2-8 °C lagern. Zur Zubereitung 500 ml 1x PBS ohne Zusätze und 10 ml FCS + 2 ml EDTA (aus 0,5 Mio. EDTA-Vorrat) hinzufügen
- Führen Sie die Immunisierung gemäß dem Protokoll von Bittner et al. 5 durch. Kurz gesagt, induzieren Sie EAE durch subkutane Injektion einer Emulsion, die 200 μg MOG35-55 Peptid und 200 μl des vollständigen Freud-Adjuvans, einschließlich 200 μg Mycobacterium tuberculosis, enthält.
- Betäuben Sie die Maus mit 2% Isofluran, indem Sie eine Anästhesiekammer mit einem Isofluran-Verdampfer verwenden. Verwenden Sie Tierarztsalbe auf den Augen des Tieres, um Trockenheit während der Narkose zu verhindern.
- Injizieren Sie nach 2 h eine intraperitoneale Injektion von 100 ng Pertussistoxin (PTx), gelöst in 100 μl 1x PBS gemäß dem Protokoll von Huntemann et al.24. Wiederholen Sie die PTx-Injektion am Tag 2 nach der Impfung.
VORSICHT: Beobachten Sie jedes Tier, bis es wieder zu Bewusstsein gekommen ist, um das Brustbein zu halten. Mäuse, die sich den Injektionsprozeduren unterzogen haben, werden erst dann in die Gesellschaft der anderen Mäuse zurückgebracht, wenn sie sich vollständig erholt haben. Bei Mycobacterium tuberculosis und PTx: Einatmen, Verschlucken und Kontakt mit Haut und Augen vermeiden. Mycobacterium tuberculosis ist ein Aktivator des angeborenen Immunsystems. PTx hat viele biologische Wirkungen. - Überwachen Sie das Fortschreiten der EAE täglich, durchgeführt von zwei verblindeten Prüfärzten, die das Gewicht überwachen und die Mäuse klinisch untersuchen.
- Zu diesem Zweck wurde folgendes Bewertungssystem verwendet: Grad 0 - keine klinischen Anzeichen von EAE, Grad 1 - partielle Schwanzparese, Grad 2 - vollständige Schwanzparese, Grad 3 - mäßige Schwäche der Hintergliedmaßen, Grad 4 - vollständige Schwäche der hinteren Gliedmaßen und ataktischer Gang, Grad 5 - leichte Paraparese, Grad 6 - Paraparese, Grad 7 - Paraplegie, Grad 8 - Tetraparese, Grad 9 - Tetraplegie, und Grad 10 – Tod.
- Verwenden Sie die folgenden Ausschlusskriterien für die weitere Teilnahme am Experiment: Klinischer Score > 7 oder ein Gewichtsverlust von mehr als 20 % des ursprünglichen Körpergewichts.
- Für die Sektion des Gehirns und des Rückenmarks werden EAE-Mäuse am Tag 16 nach der EAE-Induktion euthanasiert, was das Krankheitsmaximum darstellt.
2. ZNS-Gewebevorbereitung (Dauer: ca. 10 Minuten pro Maus)
- Nachdem Sie Mäuse mit Kohlendioxid geopfert haben, beginnen Sie mit der transkardialen Perfusion jeder Maus mit 20 ml 1x PBS. Wiederholen Sie die Perfusion erneut mit 20 ml 1x PBS.
- Bringen Sie die Maus in Rückenlage und fixieren Sie die Gliedmaßen mit Kanülen. Tragen Sie 75%iges Ethanol auf den vorderen Körper des Tieres auf. Weitere Sterilitätsmaßnahmen sind zu diesem Zeitpunkt nicht notwendig.
- Öffnen Sie den Bauch und den Thorax, indem Sie mit Hilfe einer Schere einen Längsschnitt durch Haut und Faszien machen.
- Schneiden Sie die Rippen seitlich ab und klappen Sie den Thorax hoch, um freien Zugang zum Herzen zu erhalten. Fixieren Sie den nach oben geklappten Brustkorb mit Kanülen.
- Öffne den rechten Vorhof mit einer Schere. Tragen Sie 20 ml 1x PBS mit einer Kanüle in die linke Herzkammer auf, um das Blut durch den eingeschnittenen rechten Vorhof auszuspülen.
- Legen Sie den Schädel frei, indem Sie die Haut auf der Oberseite des Mäusekopfes mit einem Längsschnitt durchtrennen und die Haut mit einer Zange um den Kopf herum verschieben. Schneiden Sie den Schädel mit Hilfe einer Schere entlang der sagittalen Naht ein.
- Führen Sie die Spitze einer Pinzette entlang der Inzisionslinie ein, um die Kalotte aufzubrechen. Entfernen Sie die restlichen Teile der Kalotte mit einer Pinzette, so dass das Gehirn vollständig freigelegt ist.
- Entferne das Gehirn vorsichtig und setze es in eine murine Gehirnmatrix ein. Schneiden Sie das Gehirn mit einer Rasierklinge in 1 mm dicke sagittale Scheiben.
- Schneiden Sie die Wirbelsäule mit Hilfe einer Schere knapp über dem Beckenkamm durch, damit die Spritze in den Wirbelkanal eingeführt werden kann.
HINWEIS: Der einfachste Weg, das Rückenmark zu entfernen, besteht darin, es mit PBS aus dem Wirbelkanal zu spülen. Ansonsten müssen die Wirbelbögen einzeln mit einer Schere geöffnet werden und anschließend kann das Rückenmark entfernt werden. - Spülen Sie das Rückenmark aus dem Spinalkanal von kaudal nach kranial, indem Sie eine 20-ml-Spritze mit einer 20-G-Nadel verwenden, die 1x PBS enthält. Schneiden Sie das Rückenmark mit einem Skalpell in 0,5 cm lange Segmente.
- Bewahren Sie jede ZNS-Zellsuspension, bestehend aus Gehirn und entsprechendem Rückenmark, in einer separaten Petrischale pro Maus auf, die mit ca. 3 ml kaltem D-PBS gefüllt ist. Bewahren Sie die Gerichte bis zur weiteren Verarbeitung auf Eis auf.
3. ZNS-Gewebedissoziation (Dauer: ca. 1-1,5 h je nach Anzahl der ZNS-Zellsuspensionen)
HINWEIS: Nervengewebe von erwachsenen Mäusen wird durch Kombination von mechanischer Dissoziation mit enzymatischem Abbau der extrazellulären Matrix dissoziiert. Dadurch bleibt die strukturelle Integrität erhalten und die Zellsuspension kann für weitere Zellisolierungsverfahren verwendet werden.
- Bereiten Sie das entsprechende Volumen der Enzymmischung 1 vor, bestehend aus 50 μl Enzym P und 1.900 μl Puffer Z pro ZNS-Zellsuspension. Beide Reagenzien gehören zum Dissoziationskit für das Gehirn von Erwachsenen.
- Bereiten Sie das entsprechende Volumen der Enzymmischung 2 vor, bestehend aus 10 μl Enzym A und 20 μl Puffer Y pro ZNS-Zellsuspension. Beide Reagenzien gehören zum Dissoziationskit für das Gehirn von Erwachsenen.
- 1.950 μl Enzymmischung 1 in das C-Röhrchen überführen und anschließend die Gewebestücke einer ZNS-Zellsuspension hinzufügen. Verwenden Sie ein C-Röhrchen pro Maus.
- Geben Sie 30 μl Enzymmischung 2 in jedes C-Röhrchen. Verschließen Sie die C-Röhrchen fest und befestigen Sie sie kopfüber an der Hülse des Zelldissoziators mit Heizelementen.
- Führen Sie das entsprechende Programm mit dem Namen 37C_ABDK_01 aus (dauert 30 Minuten). Beachten Sie mindestens die ersten 5 Minuten des Programms, um sicherzustellen, dass sich alle Röhren mit der gleichen Geschwindigkeit drehen. Das Auftreten von Fehlern während des Laufs ist möglich. Fahren Sie dann mit Schritt 6 fort.
- In den letzten 2 Minuten des Programms wird ein 70-μm-Sieb für jede dissoziierte ZNS-Zellsuspension auf ein 50-ml-Röhrchen gegeben. Befeuchten Sie diese Siebe mit 2 ml D-PBS vor.
- Nach Beendigung des Programms werden die C-Röhrchen aus dem Dissoziator angebracht und in eine Zentrifuge gegeben. Die Proben werden 1 Minute lang bei 300 x g und 4 °C zentrifugiert, um die Probe am Boden des Röhrchens aufzufangen.
- Resuspendieren Sie die Probe und tragen Sie sie auf das vorbefeuchtete Sieb auf. Geben Sie 10 ml kaltes D-PBS in das leere C-Röhrchen und verschließen Sie es. Schütteln Sie es vorsichtig und tragen Sie die Suspension auf das entsprechende Sieb auf.
- Entsorgen Sie die Siebe und verschließen Sie die 50-ml-Röhrchen. Die Zellsuspension wird erneut bei 300 x g und 4 °C für 10 min zentrifugiert. Anschließend den gesamten Überstand sehr vorsichtig absaugen.
4. Entfernung von Ablagerungen (Dauer: ca. 1,5-2 Stunden, abhängig von der Anzahl der ZNS-Zellsuspensionen)
HINWEIS: Die Dissoziation von Gewebe führt häufig zu Myelin und Zelltrümmern, die die nachgeschaltete Analyse beeinträchtigen können. Durch die Zugabe einer Lösung zur Entfernung von Ablagerungen können diese Ablagerungen effizient aus der ZNS-Zellsuspension entfernt werden.
- Resuspendieren Sie das Zellpellet vorsichtig mit 3.100 μl D-PBS für jede ZNS-Zellsuspension. Keine Wirbel machen.
- Wenn Sie mit mehr als einer ZNS-Zellsuspension arbeiten, fassen Sie maximal zwei ZNS-Zellsuspensionen, die von einer Bedingung oder einer Versuchsgruppe stammen, in einem 15-ml-Röhrchen zusammen.
- 900 μl der Trümmerentfernungslösung aus dem Gehirndissoziationskit für Erwachsene zu einer ZNS-Zellsuspension oder 1.800 μl Trümmerentfernungslösung zu zwei gepoolten ZNS-Zellsuspensionen hinzufügen.
- Drehen Sie das Rohr um und mischen Sie die Suspension. Anschließend ganz vorsichtig mit 4 ml kaltem D-PBS überziehen. Ein deutlicher Farbverlauf sollte sichtbar sein (Abbildung 2A).
- Die Röhrchen 10 min bei 3000 x g und 4 °C bei voller Beschleunigung und ohne Bremse zentrifugieren.
- Erfolgt die Trennung wie vorgesehen, bilden sich drei Phasen (Abbildung 2C). Die beiden oberen Phasen vollständig absaugen (Abbildung 2C-1,2) und verwerfen. Wichtig ist, dass keine Myelinreste zurückbleiben (Abbildung 2E).
HINWEIS: Wenn der Gradient nicht funktioniert hat und die Zellen dringend benötigt werden, saugen Sie die beiden oberen Phasen nicht ab. Füllen Sie stattdessen das 15-ml-Röhrchen mit kaltem D-PBS bis zu 15 ml und wenden Sie es mehrmals um. Nochmals bei 1000 x g für 10 min bei 4 °C bei voller Beschleunigung und ohne Bremse zentrifugieren. Saugen Sie den Überstand ab und wiederholen Sie die Schritte 4.1- 4.4. - Füllen Sie das Röhrchen mit kaltem D-PBS bis zu 14 ml und verschließen Sie es. Drehen Sie das Röhrchen auf der Werkbank kräftig um, bis sich das Zellpellet vom Boden des Röhrchens löst. Keine Wirbel machen.
- Die Probe wird erneut bei 1000 x g und 4 °C für 10 min zentrifugiert. Stellen Sie die volle Beschleunigung und die Vollbremsung ein. Saugen Sie den Überstand vorsichtig und vollständig an.

Abbildung 2: Do's und Dont's bei der Beseitigung von Schmutz. (A) Positives Beispiel für den Gradienten nach Überlagerung mit 4 mL PBS. Die obere Phase, die aus 4 ml PBS besteht, unterscheidet sich deutlich von der unteren Phase, die aus der ZNS-Zellsuspension mit der Trümmerentfernungslösung besteht. (B) Negativbeispiel für den Gradienten nach Überlagerung mit 4 mL PBS. Dem Gradienten fehlt eine klare Trennung zwischen dem PBS und der darunter liegenden Zellsuspension. Ein Teil des PBS wird in die Zellsuspension diffundiert. (C) Positives Beispiel für den Gradienten nach der Zentrifugation. Drei verschiedene Phasen lassen sich leicht unterscheiden. In der oberen (1) oder unteren Phase (3) des Gradienten sind keine Myelinreste sichtbar. Die mittlere Phase enthält das gesamte Myelin (2). Das Zellpellet ist am Boden des 15-ml-Röhrchens sichtbar. (D) Negativbeispiel für den Gradienten nach der Zentrifugation. Eine genaue Trennung zwischen den drei Phasen ist nicht möglich. Einige Myelinreste sind in der oberen (1) und unteren Phase (3) des Gradienten sichtbar. (E) Positives Beispiel für den Gradienten nach dem Absaugen der beiden oberen Phasen. Die resultierende Probe enthält nur das Zellpellet und einen klaren Überstand darüber. Es bleiben keine Myelinrückstände zurück. (F) Negativbeispiel für den Gradienten nach dem Absaugen der beiden oberen Phasen. Die Probe enthält noch einige Myelinreste (schwarzer Pfeil). Abkürzungen: ZNS = Zentralnervensystem; PBS = phosphatgepufferte Kochsalzlösung Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Entfernung roter Blutkörperchen (Dauer: ca. 1 Stunde, abhängig von der Anzahl der ZNS-Zellsuspensionen)
HINWEIS: Dieser Schritt verhindert eine spätere Kontamination durch rote Blutkörperchen und gewährleistet eine optimale Lyse der Erythrozyten mit minimalen Auswirkungen auf die anderen aus dem ZNS-Gewebe isolierten Zelltypen. Die folgenden Volumina sind für Zellsuspensionen indiziert, die aus 100 mg bis 1 g neuronalem Gewebe gewonnen werden, das zwei erwachsenen Mäusegehirnen und Rückenmark entspricht. Wenn Sie mit mehr als zwei ZNS-Zellsuspensionen arbeiten, skalieren Sie alle Reagenzien und Gesamtvolumina entsprechend hoch.
- Beginnen Sie mit der Herstellung einer Lösung zur Entfernung roter Blutkörperchen (RBCRS): pro zwei gepoolte ZNS-Zellsuspensionen. Verdünnen Sie 100 μl Stammlösung zur Entfernung roter Blutkörperchen (10x) aus dem Gehirndissoziationskit für Erwachsene in 900 μlddH2O, um eine endgültige Verdünnung von 1:10 zu erreichen.
- Lagern Sie die RBCRS bis zur Verwendung bei 2-8 °C. Entsorgen Sie ungenutzte Reste am Ende des Tages.
- Resuspendieren Sie das Zellpellet von bis zu zwei ZNS-Zellsuspensionen in 1 ml des RBCRS. Vermeiden Sie Wirbel. Die Lösung wird 10 min bei 4 °C inkubiert.
- Geben Sie 10 ml kalten PB-Puffer zu zwei gepoolten Zellsuspensionen. Die Probe wird bei 300 x g und 4 °C für 10 min zentrifugiert und anschließend der Überstand vollständig abgesaugt.
- Resuspendieren Sie jedes Zellpellet aus einer ZNS-Zellsuspension in 80 μl PB-Puffer, indem Sie langsam auf und ab pipettieren. Verwenden Sie daher 160 μl, um Zellpellets aus zwei ZNS-Zellsuspensionen zu resuspendieren.
- Wenn Sie mit mehreren ZNS-Zellsuspensionen aus der gleichen Versuchsbedingung arbeiten, poolen Sie alle diese Zellsuspensionen.
- Bestimmen Sie die Zellzahl, z.B. mit Hilfe einer verbesserten Zählkammer. Die Zellsuspensionen wurden üblicherweise 1:50 in PB-Puffer verdünnt, gefolgt von einer weiteren Verdünnung von 1:10 in 0,4%iger Trypanblaulösung.
6. Magnetisches Beads-Protokoll bei naiven und EAE-Mäusen (Dauer: ca. 1 h)
- Magnetische Markierung der verschiedenen ZNS-Zelltypen mit MicroBeads, die für ihr Oberflächenantigen spezifisch sind. Platzieren Sie dann die Zellsuspension in der Säule und trennen Sie magnetisch markierte Zellen, die in der Säule verbleiben, und unmarkierte Zellen, die durchlaufen.
- Nachdem Sie die Säule aus dem Magnetfeld genommen haben, spülen Sie magnetisch markierte Zellen aus der Säule in ein Röhrchen als positiv selektierte Zellfraktion.
HINWEIS: Die Volumina für den magnetischen Markierungsprozess werden für bis zu 1 x 107 Gesamtzellen berechnet. Wenn mehr Zellen gewonnen werden, skalieren Sie alle Reagenz- und Gesamtvolumina entsprechend hoch. Es wird empfohlen, schnell zu arbeiten und nur vorgekühlte Lösungen zu verwenden, um das Kappen von Antikörpern auf der Zelloberfläche und eine unspezifische Zellmarkierung zu verhindern sowie eine hohe Lebensfähigkeit der isolierten Zellpopulationen zu gewährleisten. Es ist auch wichtig, die Waschschritte durchzuführen, sobald das Säulenreservoir leer ist, indem der PB-Puffer hinzugefügt wird, damit die Säulen nicht austrocknen. - Teilen Sie die gereinigte unverdünnte ZNS-Zellsuspension in zwei Fraktionen für die folgenden Isolierungen von Mikroglia und Oligodendrozyten. Das Verhältnis beider Fraktionen hängt von der gewünschten Zellzahl des jeweiligen Zelltyps ab.
HINWEIS: Weitere Details (Dauer der Inkubation, detaillierte Protokollschritte, Volumina, Reagenzien und Zellzählmethode) sind in Tabelle 1 angegeben.
Tabelle 1: Arbeitsablauf für die gleichzeitige magnetische Markierung und Isolierung von Oligodendrozyten und Mikroglia aus naiven und EAE-Mäusen. Beide Zelltypen werden über eine positive Selektion isoliert. Schritte, die in derselben Zeile aufgeführt sind, werden als sofort ausgeführt angezeigt. Abkürzungen: CD11b = Cyclin-abhängige Kinase 11B; EAE = experimentelle autoimmune Enzephalomyelitis; FcR = Fc-Rezeptor-ähnliches Protein; O4 = Oligodendrozytenmarker O4. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
7. Protokolländerung: zusätzliche Sortierung zur Isolierung von Mikroglia in EAE-Mäusen (Dauer: ca. 1,5-2 h)
HINWEIS: Bei der Arbeit mit EAE-Mäusen ist es notwendig, das MACS-basierte Zellisolationsprotokoll von FACS zu ergänzen, um andere CD11b+ -Zellpopulationen als Mikroglia (z. B. Monozyten, Makrophagen, natürliche Killerzellen, Granulozyten oder dendritische Zellen) aus der CD11b+ -Zellfraktion zu entfernen. Andernfalls kann dieser Schritt ignoriert werden.
- Bereiten Sie den Färbe-Mastermix mit 1x PBS an, ergänzt durch CD11b FITC (Klon M1/70, 1:50) und CD45 APC/Cy7 (Klon 30-F11, 1:200). Verwenden Sie 100 μl der Färbe-Mastermischung pro 5 x 106 Zellen. Alle Antikörper vor der Anwendung vortexen.
- Die Mikroglia-Zellsuspension wird bei 300 x g und 4 °C für 10 min zentrifugiert und der Überstand vorsichtig abgesaugt.
- Resuspendieren Sie das Zellpellet mit 100 μl der vorbereiteten Färbe-Mastermischung pro 5 x 106 Zellen. 15 Minuten im Dunkeln bei Raumtemperatur (RT) inkubieren.
- Stoppen Sie die Reaktion durch Zugabe von 500 μl PBS und zentrifugieren Sie die Probe erneut bei 300 x g und 4 °C für 10 Minuten.
- Saugen Sie den Überstand vorsichtig ab und resuspendieren Sie das Zellpellet mit 1x PBS, ergänzt durch 10 μg/mL DNAse, um eine Endkonzentration von 1 x 107 Zellen pro ml zu erreichen. Lagern Sie die Zellen bei 4 °C, bis die Sortierung beginnt.
- Tragen Sie die Zellsuspension auf ein 100-μm-Sieb auf, das unmittelbar vor Beginn der Sortierung auf ein neues FACS-Röhrchen gelegt wird.
- Stellen Sie die Durchflussrate auf 1000 Ereignisse pro Sekunde ein und verwenden Sie die 100-μm-Düse. Sortieren Sie die gewünschte Zellpopulation von CD45intCD11b-Hochzellen in ein neues 15-ml-Röhrchen, das mit 1x PBS bei RT präpariert wird.
8. Vorbereitung des negativen Durchflusses von Oligodendrozyten zur Isolierung von Neuronen und Astrozyten (Dauer: ca. 1 h)
HINWEIS: Der negative Durchfluss von Oligodendrozyten aus Schritt 6 wird für die weitere Isolierung von Neuronen und Astrozyten gesammelt. Dazu wird die Zellsuspension in zwei Teile gespalten. Durch die vorangegangene Isolierung von Oligodendrozyten aus der ZNS-Zellsuspension wird die sonst beobachtete Kontamination durch O4+ -Zellen minimiert.
- Den negativen Durchfluss der Oligodendrozyten bei 300 x g und 4 °C für 10 min zentrifugieren und den Überstand vorsichtig absaugen.
- Resuspendieren Sie das Zellpellet in 80 μl PB-Puffer pro gepoolter ZNS-Zellsuspension, die zuvor für die Isolierung der Oligodendrozyten-positiven Fraktion verwendet wurde.
- Zähle die Zellen. Die Zählung der Zellen, von denen angenommen wird, dass es sich um O4- handelt, wird in einer verbesserten Zählkammer durchgeführt, nachdem die Zellsuspension 1:50 in PB-Puffer verdünnt wurde, gefolgt von einer weiteren 1:10-Verdünnung in 0,4%igem Trypanblau.
- Teilen Sie die gereinigte unverdünnte Zellsuspension in zwei Fraktionen auf, um anschließend gleichzeitig Neuronen und Astrozyten zu isolieren. Das Verhältnis beider Fraktionen hängt von der bevorzugten Menge des jeweiligen Zelltyps ab.
HINWEIS: Weitere Details (Dauer der Inkubation, detaillierte Protokollschritte, Volumina, Reagenzien und Zellzählmethode) sind in Tabelle 2 angegeben.
Tabelle 2: Arbeitsablauf für die gleichzeitige magnetische Markierung und Isolierung von Neuronen und Astrozyten aus naiven und EAE-Mäusen. Beide Zelltypen werden aus dem negativen Durchfluss von Oligodendrozyten isoliert. Astrozyten werden als positive Selektion über Anti-ACSA-2-Mikrokügelchen getrennt, während Neuronen durch Biotinylierung und Depletion aller nicht-neuronalen Zellen als negative Selektion gereinigt werden. Schritte, die in derselben Zeile aufgeführt sind, werden als sofort ausgeführt angezeigt. Abkürzungen: Anti-ACSA-2 = Antigen-2 auf der Oberfläche von Astrozyten; EAE = experimentelle autoimmune Enzephalomyelitis; FcR = Fc-Rezeptor-ähnliches Protein; MACS = magnetisch aktivierte Zellsortierung. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
9. Reinheitsanalysen der isolierten ZNS-residenten Zelltypen (Dauer: ca. 2 h)
HINWEIS: Es wird empfohlen, eine Durchflusszytometrie aller vier isolierten ZNS-residenten Zellpopulationen durchzuführen, um ihre Reinheit und Lebensfähigkeit zu messen und zu vergleichen. Daher ist es notwendig, alle Zelltypen mit einem Antikörper zu färben, der mit Fluorophor markiert ist. Die Färbung lebender/toter Zellen wird mit einem fixierbaren Viabilitätsfarbstoff (1:10.000) durchgeführt.
- Reinheitspanel - extrazelluläres Färbeprotokoll
- Verwenden Sie 1 x 105 Zellen, gelöst in 50 μl PBS pro Färbung.
- Bereiten Sie den in PBS gelösten Färbe-Mastermix mit 2 % FCS/2 mM EDTA vor, der aus den folgenden Fluorochrom-konjugierten monoklonalen Antikörpern besteht, die auf zelltypspezifische Oberflächenmarker abzielen: CD11b FITC (Klon 1/70, 1:100)25,26,27,28, Biotin-PE (Klon Bio3-18E7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (Klon REA-969, 1:200)33,34,35, O4 APC (Klon REA-576, 1:400) und CD45 BV510 (Klon 30-F11, 1:150)36,37. 1 μg Anti-CD16/32 pro 1 x 106 Zellen hinzufügen, um den Fc-Rezeptor3 8,39 zu blockieren. Vortex alle Antikörper vor der Anwendung.
- Die Zellsuspension wird 5 min bei 540 x g und 4 °C zentrifugiert und der Überstand vorsichtig abgesaugt.
- Resuspendieren Sie das Zellpellet in 100 μl des jeweiligen Mastermixes und inkubieren Sie die Probe für 15 min bei RT im Dunkeln.
- Waschen Sie die Zellen mit 500 μl 1x PBS mit 2 % FCS/2 mM EDTA und zentrifugieren Sie die Probe 5 min lang bei 540 x g und 4 °C.
- Saugen Sie den Überstand an und resuspendieren Sie das Zellpellet mit 70 μl 1x PBS mit 2% FCS/2 mM EDTA.
- Wirbeln Sie die Probe, um das Zellpellet vollständig zu dissoziieren. Anschließend ist die Probe bereit für die durchflusszytometrische Analyse.
- Reinheitspanel - intrazelluläres Färbeprotokoll mit NeuN
- Verwenden Sie 1 x 105 Zellen jeder Zellpopulation für die intrazelluläre Färbung von NeuN, einem neuronenspezifischen Kernmarker 40,41. Dies ist eine zusätzliche Möglichkeit, lebensfähige Neuronen zu färben.
- Übertragen Sie 1 x 105 Zellen jeder Zellpopulation in ein FACS-Röhrchen. Fügen Sie 1 ml PBS mit 2 % FCS/2 mM EDTA pro Röhrchen hinzu. Die Röhrchen werden bei 540 x g und 4 °C für 5 min zentrifugiert.
- In der Zwischenzeit wird der in PBS gelöste Mastermix mit 2 % FCS/2 mM EDTA hergestellt, der aus den folgenden Fluorochrom-konjugierten monoklonalen Antikörpern besteht, die auf zelltypspezifische Oberflächenmarker abzielen: CD11b FITC (Klon M1/70, 1:100)25,26,27,28, Biotin-PE (Klon Bio3-18E7, 1:200)29,30,31,32, ACSA-2 PE-Vio615 (Klon REA-969, 1:200)33,34,35 und CD45 BV510 (Klon 30-F11, 1:150)36,37.
- Der Überstand wird abgesaugt und die Zellen in 100 μl des vorbereiteten Mastermixes resuspendiert und die Probe 10 min lang bei RT im Dunkeln inkubiert.
- Waschen Sie die Zellen mit 100 μl PBS mit 2 % FCS/2 mM EDTA und zentrifugieren Sie sie erneut bei 540 x g und 4 °C für 5 min.
- In der Zwischenzeit 200 μl der Fixierungs-/Permeabilisierungslösung vorbereiten: 50 μl des konzentrierten Fixierungs-/Permeabilisierungskonzentrats zu 150 μl Fixierungs-/Permeabilisierungsverdünnungsmittel hinzufügen, um eine endgültige Verdünnung von 1:4 zu erreichen.
- Saugen Sie den Überstand ab und resuspendieren Sie die Zellen in 100 μl 1x Fixierungs-/Permeabilisierungslösung. Die Probe wird 30 min bei 4 °C inkubiert.
- In der Zwischenzeit wird 1 ml 1x Permeabilisierungs-/Waschpuffer hergestellt, indem 100 μl des Permeabilisierungspuffermaterials zu 900 μlddH2Ohinzugefügt werden, um eine endgültige Verdünnung von 1:10 zu erreichen.
- Waschen Sie die Zellen 1x mit 100 μl 1x Permeabilisierungs-/Waschpuffer und zentrifugieren Sie die Probe bei 540 x g und 4 °C für 5 min.
- In der Zwischenzeit bereiten Sie einen weiteren Mastermix in 1x Permeabilisierungs-/Waschpuffer vor, der nur aus NeuN (NeuN AF647, Klon EPR12763, 1:200) und 1 μg Anti-CD16/32 pro 106 Zellen besteht, um den Fc-Rezeptor zu blockieren.
- Saugen Sie den Überstand ab. Die fixierten und permeabilisierten Zellen werden in 50 μl des zweiten Mastermixes resuspendiert und 30 min bei 4 °C inkubiert.
- Die Probe wird mit 100 μl 1x Permeabilisierungs-/Waschpuffer gewaschen und bei 540 x g und 4 °C 5 min lang zentrifugiert.
- Verwerfen Sie den Überstand und resuspendieren Sie das Zellpellet in 70 μl PBS mit 2 % FCS/2 mM EDTA. Anschließend ist die Probe bereit für die durchflusszytometrische Analyse.
- Nachdem Sie das Bedienfeld am Durchflusszytometer eingerichtet haben, erfassen Sie die Zellen für die Reinheitsanalyse mit einer Durchflusszytometrie-Analysesoftware.
10. Statistische Analyse
- Führen Sie statistische Analysen durch und entwerfen Sie Diagramme mit einem grafischen Analyseprogramm. Die Daten werden als Mittelwert ± SEM dargestellt.
Repräsentative Ergebnisse
Das derzeitige Protokoll bietet die Möglichkeit, alle wichtigsten ZNS-residenten Zellen, d.h. Mikroglia, Oligodendrozyten, Astrozyten und Neuronen, gleichzeitig aus einem einzigen ZNS-Replikat zu isolieren. Dies ist wichtig, um die Anzahl der Mäuse zu reduzieren, die für diese Art von Experimenten benötigt werden, und um die Vergleichbarkeit molekularer und biochemischer Analysen auf zellulärer Ebene zu gewährleisten. Werden die einzelnen Zelltypen aus unterschiedlichen ZNS-Replikaten isoliert, können zelluläre Interaktionen nicht wahrheitsgetreu abgebildet werden und mögliche technische Abweichungen während der Isolierungsprozesse könnten weitere nachgelagerte Analysen verzerren. Darüber hinaus wären die molekularen und biochemischen Befunde der einzelnen Zelltypen nicht miteinander vergleichbar, da sie nicht aus demselben EAE-Kontext stammen. Ein bereits bestehendes MACS-Protokoll unter Verwendung eines kommerziellen Systems/Kits wurde angepasst, um die gleichzeitige Isolierung der oben genannten Zelltypen zu ermöglichen.
Die Isolierung der Mikroglia wurde mit Anti-CD11b-Mikrokügelchen durchgeführt, Oligodendrozyten wurden über Anti-O4-Mikrokügelchen isoliert (Tabelle 1) und Anti-ACSA-2-Mikrokügelchen wurden verwendet, um Astrozyten zu isolieren (Tabelle 2). Im Gegensatz dazu stellt die Isolierung von Neuronen eine negative Selektion dar und wurde durch Biotinylierung und magnetische Markierung aller nicht-neuronalen Zellen erreicht (Tabelle 2). Alle nicht-neuronalen Zellen (z. B. Oligodendrozyten, Mikroglia, Astrozyten, Endothelzellen und Fibroblasten) mit Ausnahme von Blutzellen können magnetisch markiert werden, indem ein Biotin-konjugierter Antikörper verwendet wird, der spezifisch gegen ein Oberflächenantigen gerichtet ist, das auf diesen nicht-neuronalen Zellen exprimiert wird (Tabelle 2). Durch Depletion dieser magnetisch markierten nicht-neuronalen Zellen können hochreine und lebensfähige neuronale Zellpopulationen erzeugt werden 30,42,43.
Es wurden zwei neue Durchflusszytometrie-Panels für die Reinheitsanalysen der erzeugten Einzelzellsuspensionen entwickelt. Hier wurden zelltypspezifische Oberflächen- und Kernmarker in Kombination mit Lebend-/Totzell-Unterscheidung verwendet.
Die resultierenden Zellausbeuten pro Maus und Zelltyp (Abbildung 3A) wurden analysiert und führten zu einem Durchschnitt von 8. 4 x 105 ± 3 x 104 Mikroglia, 3,23 x 106 ± 1 x 105 Oligodendrozyten, 8,6 x 105 ± 2 x 104 Astrozyten und 4,5 x 105 ± 1 x 104 Neuronen pro naiver Maus.
Im Rahmen des Ziels, Krankheitsmodelle der Neuroinflammation zu untersuchen, wurde das Protokoll auch auf ein Mausmodell der EAE angewendet. Die Mäuse wurden am 16. Tag nach der EAE-Induktion euthanasiert, was das Krankheitsmaximum darstellt. In diesem EAE-Setting wurden etwa 2,9 x 106 ± 6,7 x 105 Oligodendrozyten, 5,2 x 105 ± 9 x 104 Astrozyten und 4,4 x 105 ± 4 x 104 Neuronen isoliert. Die Ausbeute an Mikrogliazellen wurde aufgrund der zusätzlichen Zellsortierung nach den MACS-Schritten auf etwa 1,7 x 105 ± 4 x 104 Mikroglia pro EAE-Maus verringert (Abbildung 3A).
Nach der Isolierung zeigten phänotypische Charakterisierungen der verschiedenen Zellpopulationen mittels Durchflusszytometrie, dass lebensfähige Einzelzellsuspensionen mit einer Reinheit von ca. 90% für alle wichtigen ZNS-residenten Zelltypen erreicht werden konnten (Abbildung 3B). Die Mikroglia wurden als CD45intCD11bhoch eingestuft, wie in der Literatur definiert 44,45,46,47.
Bei der EAE mussten die Mikroglia aus allen CD11b+-Zellen sortiert werden, um sie von anderen CD11b+-Immunzellen wie Monozyten, Neutrophilen, natürlichen Killerzellen, Granulozyten und Makrophagen zu unterscheiden, die während der Neuroinflammation in das ZNS einwandern 27,28,48. Daher wurden die Mikroglia als CD45intCD11high cells aus der CD11b+ Zellsuspension sortiert. Die gesamte Sortierstrategie der Mikroglia ist in Abbildung 4 dargestellt. In naiven Mäusen betrug die Mikroglia-Population 91,16 % aller lebenden Einzelzellen (96 % der gesamten CD11b+-Population) (Abbildung 4A). In EAE-Mäusen betrug die Mikroglia-Population 46,85 % aller lebenden Einzelzellen (55 % der gesamten CD11b+-Population) (Abbildung 4B). Obwohl sowohl MACS- als auch FACS-Verfahren die einzelnen Zellen mechanisch belasten, waren 75,41 % ± 8,63 % der sortierten gereinigten Mikroglia lebensfähig (Abbildung 3B).
Astrozyten und Neuronen, die direkt aus der initialen ZNS-Zellsuspension isoliert wurden, zeigten eine relevante Kontamination mit Oligodendrozyten, was zu der Annahme führte, dass die gleichzeitige Isolierung von Neuronen und Astrozyten aus dem negativen Durchfluss von Oligodendrozyten diese Kontamination verhindern könnte. Durchflusszytometrische Analysen bestätigten, dass Astrozyten, die aus dem negativen Durchfluss von Oligodendrozyten isoliert wurden, eine Reinheit von 89,23 % ± 2,78 % aufwiesen und eine Lebensfähigkeit von 80,56 % ± 1,41 % aufwiesen. Ähnlich wie bei diesen Ergebnissen betrug die Reinheit der aus der O4-Zellfraktion isolierten Neuronen 81,25 % ± 3,31 % und die Viabilität betrug 83,90 % ± 2,61 % (Abbildung 3B). Diese Ergebnisse bestätigen auch, dass die gleichzeitige Isolierung dieser beiden Zelltypen erst im Anschluss an die Isolierung von Oligodendrozyten keinen Einfluss auf die Anzahl lebensfähiger funktionsfähiger Zellen hat.
Die Ergebnisse bezüglich der Lebensfähigkeit und Reinheit der isolierten Einzelzellsuspensionen waren bei EAE-Mäusen sehr ähnlich wie bei naiven Mäusen, was bestätigt, dass dieses Protokoll sowohl für gesunde Mäuse als auch im Zusammenhang mit EAE geeignet ist (Abbildung 3B).
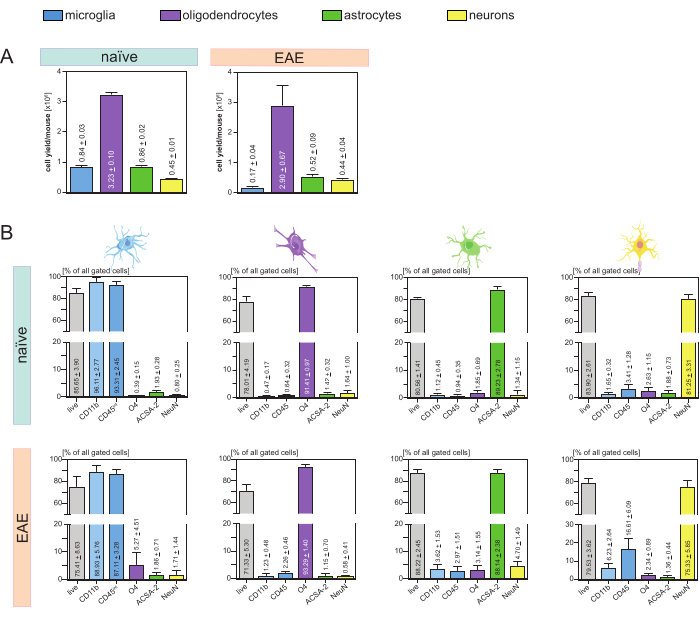
Abbildung 3: Zellausbeuten und durchflusszytometrische Validierung von isolierten ZNS-residenten Zellen. (A) Zellausbeute pro Maus und Zelltyp nach Isolierung von ZNS-residenten Zellen in naiven und EAE-Mäusen. Balkendiagramme visualisieren die Anzahl der Zellausbeuten pro Maus und Zelltyp nach der Implementierung des vorgestellten Protokolls. Fünf biologische Replikate wurden für die Ergebnisse in naiven Mäusen verarbeitet, und vier biologische Replikate wurden in EAE-Mäusen analysiert. Dargestellt sind die jeweiligen Mittel ± SEMs. (B) Entsprechende Reinheits- und Viabilitätsanalysen der gereinigten Zellfraktionen. Balkendiagramme zeigen die Lebensfähigkeit und Reinheit der resultierenden Einzelzellsuspensionen basierend auf ihrer Expression von zelltypspezifischen Markern. NeuN wurde als zelltypspezifischer Kernmarker für Neuronen verwendet. Fünf biologische Replikate wurden für jeden Zelltyp sowohl für gesunde als auch für EAE-Mäuse aufgenommen und verglichen. Entsprechende Mittelwerte ± SEMs sind angegeben. Abkürzungen: Anti-ACSA-2 = Antigen-2 auf der Oberfläche von Astrozyten; CD11b = Cyclin-abhängige Kinase 11B; CD45 = Tyrosin-Protein-Phosphatase C; ZNS = Zentrales Nervensystem; EAE = experimentelle autoimmune Enzephalomyelitis; MACS = magnetisch aktivierte Zellsortierung; NeuN =RNA-bindendes Protein fox-1 Homolog 3; O4 = Oligodendrozytenmarker O4; SEM = Standardfehler des Mittelwerts. Diese Zahl wurde von49 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
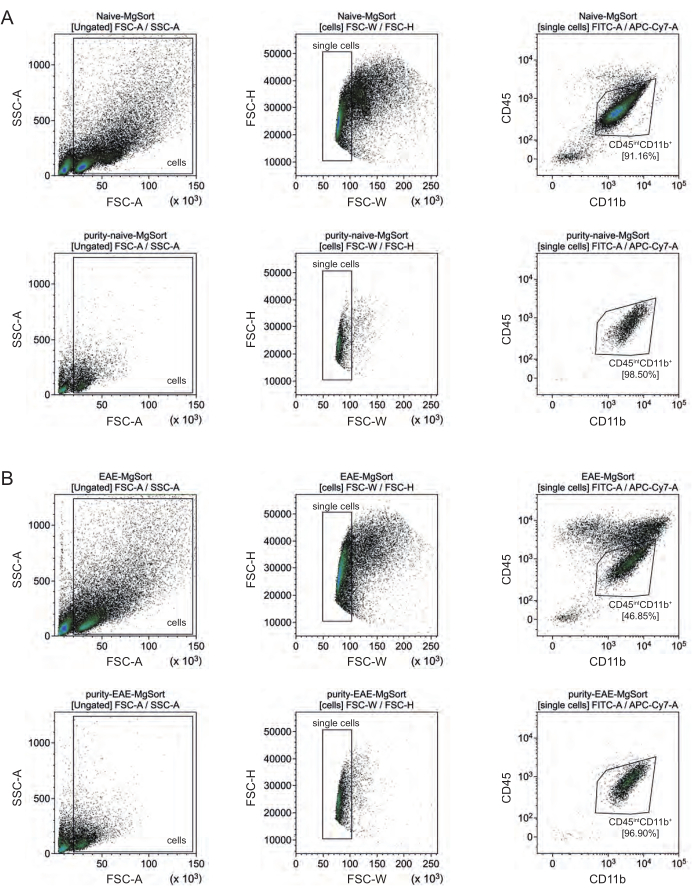
Abbildung 4: Gating-Strategie für die Zellsortierung von Mikroglia nach Isolierung von CD11b+ Zellen. (A) Gating-Strategie bei naiven und (B) EAE-Mäusen. Die obere Zeile jedes Fensters zeigt Punktdiagramme vor dem Sortieren und die untere Zeile nach dem Sortieren. Nach Selektion von lebenden (SSC-A / FSC-A) und Einzelzellen (FCS-H / FSC-W) wurde die Population von CD45undCD11b+ Zellen als Mikrogliapopulation sortiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Bisher bieten Methoden zur Kartierung von ZNS-residenten Zellen ex vivo durch die Kombination von Massenspektrometrie und RNA-Sequenzierung ein sehr präzises zelluläres Profiling in Gesundheit und Krankheit, erfordern jedoch ehrgeizige technische Kenntnisse und Expertise auf diesem Gebiet50,51. Darüber hinaus erlauben sie keine Funktionsanalysen und sind sehr teuer. Darüber hinaus bieten mikrofluidische Brain-on-a-Chip-Systeme ein schnelles und kostengünstiges Screening auf Krankheitsmechanismen und die Erprobung neuer therapeutischer Ansätze mit der Einschränkung des Zellwachstums und der Zellmigration 52,53,54,55. ZNS-Organoide könnten in Zukunft auch eine gleichwertige Alternative für die Untersuchung von zellulärer Modellierung, interzellulären Verbindungen und Interaktionen während Krankheitsverläufen darstellen 56,57,58,59. Fluoreszenz- und magnetisch aktivierte Zellsortierung sind jedoch derzeit die effektivsten Methoden, um reine und lebensfähige Einzelzellsuspensionen ex vivo zu erzeugen 35,60,61. Auch wenn andere etablierte Fertigungsprotokolle zur Isolierung von ZNS-residenten Zelltypen hinsichtlich der einzelnen Schritte der magnetischen Isolierung und der vorangegangenen Zelldissoziation ähnlich sind, sollen sie für jeden Zelltyp separat durchgeführt werden. Im Gegensatz dazu integriert das derzeitige Protokoll verschiedene Isolationsmethoden für jeden ZNS-residenten Zelltyp in einen logischen Kontext, so dass sie gleichzeitig und aus einer einzigen ZNS-Zellsuspension durchgeführt werden können (Tabelle 1, Tabelle 2). So ermöglicht es Multi-Omics-Analysen aus einer einzigen ZNS-Zellsuspension und schließlich die Erforschung komplexer neuronaler Netzwerke. Auch wenn es nicht unbedingt notwendig ist, mehrere Gewebe von mehreren Tieren zu poolen, um dieses Protokoll durchzuführen, stellt dieses Pooling eine ausreichende Anzahl isolierter Zellen für die weitere nachgeschaltete Analyse sicher. Die Verwendung verschiedener Mäuse zur Isolierung der einzelnen Zelltypen würde die Analyse möglicher zellulärer Interaktionen ausschließen. Darüber hinaus spart die Kombination individueller Isolationsmethoden für die verschiedenen ZNS-Zelltypen, die alle einer vorherigen ZNS-Dissoziation folgen, Materialkosten, indem eine dissoziierte ZNS-Zellsuspension für alle folgenden magnetischen Isolationsschritte verwendet wird. Darüber hinaus wird eine mögliche technische Verzerrung, die durch die Verwendung verschiedener Mäuse verursacht wird, minimiert.
Eine Einschränkung des Protokolls könnte die fast ausschließliche Verwendung von weiblichen C57BL/6J-Mäusen sein. Das EAE-Immunisierungsprotokoll wurde für weibliche Mäuse entwickelt und etabliert, so dass dieses Zellisolationsprotokoll auch bei weiblichen C57BL/6J-Mäusen implementiert wurde. Nichtsdestotrotz wurden bei der Entwicklung dieses Protokolls auch naive männliche Mäuse verwendet, ohne einen Einfluss auf die resultierende Zellzahl oder Reinheit zu erkennen. Eine weitere Einschränkung betrifft die magnetische Zellisolierung von Neuronen, da es keine spezifischen Mikrokügelchen für die Isolierung von Neuronen im Sinne einer positiven Selektion gibt. Es wurde angenommen, dass eine reine Einzelzellsuspension durch Biotinmarkierung und Depletion aller nicht-neuronalen Zellen erhalten werden kann (Tabelle 2). Diese Annahme wurde durch die Verwendung von NeuN als spezifischer nukleärer Marker für Neuronen verifiziert, der in das erwähnte Durchflusszytometrie-Reinheitspanel integriert ist. Eine weitere Einschränkung betrifft die Isolierung von Mikroglia in EAE-Mäusen. Hier sind die resultierenden Zellausbeuten im Vergleich zu den anderen Zelltypen aufgrund des zusätzlichen Sortierschritts nach dem MACS-Protokoll geringer. Darüber hinaus könnte man argumentieren, dass die Sortierung die mechanische Belastung der Mikroglia im Vergleich zu den anderen Zellpopulationen erhöht. Individuelle Sortierstrategien können zu unterschiedlich hohen Zellausbeuten führen. Wenn die Anzahl der isolierten Zellen geringer ist als erwartet oder gewünscht, wird empfohlen, den Gating-Aufbau anzupassen und/oder die Unterscheidung zwischen lebend und tot zu verbessern.
Ein kritischer Schritt im Protokoll stellt die Entfernung von Ablagerungen dar. Der Farbverlauf muss sehr langsam und sanft geschichtet werden, um die drei gewünschten separaten Phasen zu erzeugen (Abbildung 2A). Nur wenn das Myelin und andere Trümmerrückstände in den beiden oberen Phasen vollständig entfernt werden (Abbildung 2E), können reine Einzelzellsuspensionen erzeugt und weitere Kontaminationen reduziert werden. Wenn es den resultierenden Zellsuspensionen an Reinheit mangelt, ist dies wahrscheinlich der Abschnitt des Protokolls, der neben der Sicherstellung der richtigen Verwendung aller Mikrokügelchen zuerst verbessert werden sollte.
Das Erreichen eines hohen Reinheits- und Lebensfähigkeitsniveaus kann bei dieser Art von Experimenten eine Herausforderung sein. Einige Empfehlungen zur Fehlerbehebung sind:
-Das Arbeiten unter sterilen Bedingungen ist zwingend erforderlich, um eine Kontamination der verschiedenen Mikrokügelchen zu verhindern und eine wiederholte Verwendung zu ermöglichen, insbesondere für die anschließende Kultivierung.
-Es wird dringend empfohlen, jedes Röhrchen zu beschriften, um Verwechslungen zu vermeiden.
-Vermeiden Sie die Verwendung von ungekühlten Reagenzien/Puffern. Lagern Sie alle Zellsuspensionen während des gesamten Experiments auf Eis, um eine hohe Lebensfähigkeit zu gewährleisten.
-Halten Sie die Zeit zwischen den verschiedenen Arbeitsschritten so kurz wie möglich. Es gibt keinen bestimmten Teil im Protokoll, in dem das Anhalten des Experiments empfohlen wird.
-Es ist von hoher Relevanz, die angegebenen Inkubationszeiten einzuhalten.
Zusammenfassend lässt sich sagen, dass dieses aktuelle Protokoll zur gleichzeitigen Isolierung aller wichtigen ZNS-residenten Zelltypen aus einem ZNS-Replikat die Möglichkeit bietet, komplexe neuronale Netzwerke und neuroinflammatorische Signalwege ex vivo aus einer ZNS-Zellsuspension zu analysieren. So können ZNS-residente Zellen in verschiedenen Stadien von Krankheitsverläufen untersucht werden, z.B. während der Neuroinflammation, Neurodegeneration und/oder Remission bei EAE. Darüber hinaus können Zell-Zell-Interaktionen und biochemische Signalwege auf individueller Ebene untersucht und die Variabilität innerhalb von Versuchsgruppen reduziert werden. Es besteht auch die Möglichkeit, Fraktionen der isolierten ZNS-Zellen in Monokulturen für weitere funktionelle Assays und Validierungen zu kultivieren. Alles in allem bietet dieses Protokoll bedeutende Fortschritte, die sich potenziell auf präklinische und klinische Forschungsansätze auswirken.
Offenlegungen
Alle Autoren erklären, dass sie keine Interessenkonflikte haben.
Danksagungen
Die Figuren wurden mit Adobe Illustrator (Version 2023) und Servier Medical Art (https://smart.servier.com) erstellt. Antonia Henes wurde von der Jürgen Manchot Stiftung unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 70 μm cell strainers | Corning, MA, USA | 352350 | CNS tissue dissociation |
| ACSA-2 Antibody, anti-mouse, PE-Vio 615 (clone REA-969) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-116-244 | Flow cytometry, store at 4 °C |
| Adult Brain Dissociation Kit, mouse, and rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-107-677 | Tissue dissociation,contains debris and red blood cell removal solutions; prepare aliquots of enzyme A and P upon arrival and store them at -20 °C; store the remaining kit at 4 °C |
| Anti-ACSA-2 MicroBead Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-097-678 | MACS of astrocytes, store at 4 °C |
| Anti-mouse CD16/32 antibody | BioLegend, London, UK | 101301 | Flow cytometry, store at 4 °C |
| Anti-O4 MicroBeads, human, mouse, rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-094-543 | MACS of oligodendrocytes, store at 4 °C |
| AstroMACS Separation buffer | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-221 | MACS of astrocytes, store at 4 °C |
| Biotin Antibody, PE (clone Bio3-18E7) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-113-853 | Flow cytometry, store at 4 °C |
| BRAND Neubauer counting chamber | Thermo Fisher Scientific,Waltham, MA, USA | 10195580 | Cell counting |
| Brilliant Violet 510 anti-mouse CD45 Antibody (clone 30-F11) | BioLegend, London, UK | 103137 | Flow cytometry, store at 4 °C |
| CD11b MicroBeads, human, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-049-601 | MACS of microglia, store at 4 °C |
| DNAse I, recombinant, Rnase-free | Merck KGaA, Darmstadt, Germany | 4716728001 | Flow cytometry, store at -20° C |
| D-PBS with Calcium, Magnesium, Glucose, Pyruvat | Thermo Fisher Scientific,Waltham, MA, USA | 14287080 | Buffer, store at 4 °C |
| D-PBS, without calcium, without magnesium | Thermo Fisher Scientific,Waltham, MA, USA | 14190250 | Buffer, store at 4 °C |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific,Waltham, MA, USA | 65-0865-14 | Flow cytometry, store at 4 °C |
| eBioscience Foxp3/Transcription factor staining buffer set | Thermo Fisher Scientific,Waltham, MA, USA | 00-5523-00 | Flow cytometry, store at 4°C |
| Falcon (15 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 11507411 | Cell tube |
| Falcon (50 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 10788561 | Cell tube |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Thermo Fisher Scientific,Waltham, MA, USA | 08-771-23 | Flow cytometry |
| FcR Blocking Reagent, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-092-575 | MACS of oligodendrocytes, store at 4 °C |
| Female C57BL/6J mice | Charles River Laboratories, Sulzfeld, Germany | Active EAE induction | |
| Fetal calf serum (FCS) | Merck KGaA, Darmstadt, Germany | F2442-50ML | Flow cytometry, store at -5 to -20 °C |
| FITC Rat Anti-CD 11b (clone M1/70) | BD Biosciences, San Jose, CA, USA | 553310 | Flow cytometry, store at 4 °C |
| Freund’s Complete adjuvant | Merck KGaA, Darmstadt, Germany | AR001 | Active EAE induction, store at 4 °C |
| GentleMACS C Tubes | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-093-237 | CNS tissue dissociation |
| GentleMACS Octo Dissociator with Heaters | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-096-427 | CNS tissue dissociation |
| Graphpad Prism 8.4.3 | Graphpad by Dotmatics | Graphical Analysis | |
| Isoflurane | AbbVie, North Chicago, IL, USA | Active EAE induction, store at 4 °C | |
| Kaluza Analysis Software V2.1.1 | Beckman Coulter, Indianapolis, IN, USA | Flow cytometry analysis | |
| LS Columns | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-401 | MACS |
| MACS BSA Stock Solution | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-376 | PB-buffer |
| MACS MultiStand | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-303 | MACS |
| MOG35–55 peptide | Charité, Berlin, Germany; alternatives: Genosphere Biotechnologies (Paris, France) or sb-Peptide (Saint Egrève, France) | Active EAE induction, store at -20 °C | |
| Mycobacterium tuberculosis strain H37 Ra | Becton, Dickinson and Company (BD),Franklin Lakes, NJ, USA | Active EAE induction, store at 4 °C | |
| Neuron Isolation Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-115-390 | MACS of neurons, store at 4 °C |
| O4 Antibody, anti-human/mouse/rat, APC, (clone REA-576) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-119-897 | Flow cytometry, store at 4 °C |
| Pertussis toxin in glycerol | Hooke Laboratories Inc., Lawrence, MA, USA | BT-0105 | Active EAE induction; store at -20 °C |
| pluriStrainer Mini 100 μm | pluriSelect Life Science UG, Leipzig, Sachsen, Germany | 43-10100-40 | Flow cytometry |
| QuadroMACS Separator | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-090-976 | MACS |
| Recombinant Alexa Fluor 647 Anti-NeuN antibody (clone EPR12763) | Abcam, Cambridge, UK | EPR12763 | Flow cytometry, store at -20 °C |
| Stainless Steel Brain Matrices, 1 mm | Ted Pella, Redding, CA, USA | 15067 | CNS tissue dissection |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific,Waltham, MA, USA | 15250061 | Cell counting |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific,Waltham, MA, USA | 15575020 | Flow cytometry, store at room temperature |
Referenzen
- Trapp, B. D., Nave, K. A. Multiple Sclerosis: An Immune or Neurodegenerative Disorder. Annu Rev Neurosci. 31 (1), 247-269 (2008).
- Stys, P. K., Zamponi, G. W., van Minnen, J., Geurts, J. J. Will the real multiple sclerosis please stand up. Nat Rev Neurosci. 13 (7), 507-514 (2012).
- Korn, T. Pathophysiology of multiple sclerosis. J Neurol. 255 (Suppl 6), 2-6 (2008).
- Ward, M., Goldman, M. D. Epidemiology and Pathophysiology of Multiple Sclerosis. CONTINUUM. 28 (4), 988-1005 (2022).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin Oligodendrocyte Glycoprotein (MOG35-55) Induced Experimental Autoimmune Encephalomyelitis (EAE) in C57BL/6 Mice. J Vis Exp. (86), 51275 (2014).
- Bittner, S., et al. The TASK1 channel inhibitor A293 shows efficacy in a mouse model of multiple sclerosis. Exp Neurol. 238 (2), 149-155 (2012).
- Göbel, K., et al. Plasma kallikrein modulates immune cell trafficking during neuroinflammation via PAR2 and bradykinin release. Proc Natl Acad Sci U S A. 116 (1), 271-276 (2019).
- Ballerini, C. Experimental Autoimmune Encephalomyelitis. Methods Mol Biol. 2285, 375-384 (2021).
- Birmpili, D., Charmarke Askar, I., Bigaut, K., Bagnard, D. The Translatability of Multiple Sclerosis Animal Models for Biomarkers Discovery and Their Clinical Use. Int J Mol Sci. 23 (19), 11532 (2022).
- Tsatas, O., Ghasemlou, N. Isolation and RNA purification of macrophages/microglia from the adult mouse spinal cord. J Immunol Methods. 477, 112678 (2020).
- Calvo, B., Rubio, F., Fernández, M., Tranque, P. Dissociation of neonatal and adult mice brain for simultaneous analysis of microglia, astrocytes and infiltrating lymphocytes by flow cytometry. IBRO Rep. 8, 36-47 (2020).
- Diaz-Amarilla, P., et al. Isolation and characterization of neurotoxic astrocytes derived from adult triple transgenic Alzheimer's disease mice. Neurochem Int. 159, 105403 (2022).
- Galatro, T. F., Vainchtein, I. D., Brouwer, N., Boddeke, E. W. G. M., Eggen, B. J. L. Isolation of Microglia and Immune Infiltrates from Mouse and Primate Central Nervous System. Methods Mol Biol. 1559, 333-342 (2017).
- Altendorfer, B., et al. Transcriptomic Profiling Identifies CD8+ T Cells in the Brain of Aged and Alzheimer's Disease Transgenic Mice as Tissue-Resident Memory T Cells. J Immunol. 209 (7), 1272-1285 (2022).
- Lanfranco, M. F., Sepulveda, J., Kopetsky, G., Rebeck, G. W. Expression and secretion of apoE isoforms in astrocytes and microglia during inflammation. Glia. 69 (6), 1478-1493 (2021).
- Swire, M., Ffrench-Constant, C. Oligodendrocyte-Neuron Myelinating Coculture. Methods Mol Biol. 1936, 111-128 (2019).
- Park, J., Koito, H., Li, J., Han, A. Microfluidic compartmentalized co-culture platform for CNS axon myelination research. Biomed Microdevices. 11 (6), 1145-1153 (2009).
- Facci, L., Barbierato, M., Skaper, S. D. Astrocyte/Microglia Cocultures as a Model to Study Neuroinflammation. Methods Mol Biol. 1727, 127-137 (2018).
- Speicher, A. M., Wiendl, H., Meuth, S. G., Pawlowski, M. Generating microglia from human pluripotent stem cells: novel in vitro models for the study of neurodegeneration. Mol Neurodegener. 14 (1), 46 (2019).
- Homayouni Moghadam, F., et al. Isolation and Culture of Embryonic Mouse Neural Stem Cells. J Vis Exp. (141), 58874 (2018).
- Santos, R., et al. Differentiation of Inflammation-Responsive Astrocytes from Glial Progenitors Generated from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 8 (6), 1757-1769 (2017).
- Tcw, J., et al. An Efficient Platform for Astrocyte Differentiation from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 9 (2), 600-614 (2017).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Huntemann, N., et al. An optimized and validated protocol for inducing chronic experimental autoimmune encephalomyelitis in C57BL/6J mice. J Neurosci Methods. 367, 109443 (2022).
- Martin, E., El-Behi, M., Fontaine, B., Delarasse, C. Analysis of Microglia and Monocyte-derived Macrophages from the Central Nervous System by Flow Cytometry. J Vis Exp. (124), 55781 (2017).
- Sarkar, S., et al. Rapid and Refined CD11b Magnetic Isolation of Primary Microglia with Enhanced Purity and Versatility. J Vis Exp. (122), 55364 (2017).
- Rodríguez Murúa, S., Farez, M. F., Quintana, F. J. The Immune Response in Multiple Sclerosis. Annu Rev Pathol. 17, 121-139 (2021).
- Engelhardt, B., Ransohoff, R. M. Capture, crawl, cross: the T cell code to breach the blood-brain barriers. Trends Immunol. 33 (12), 579-589 (2012).
- Elia, G. Biotinylation reagents for the study of cell surface proteins. Proteomics. 8 (19), 4012-4024 (2008).
- Berl, S., et al. Enrichment and isolation of neurons from adult mouse brain for ex vivo analysis. J Neurosci Methods. 283, 15-22 (2017).
- Turvy, D. N., Blum, J. S. Biotin Labeling and Quantitation of Cell-Surface Proteins. Curr Protoc Immunol. 18 (7), (2001).
- Mao, S. Y. Biotinylation of Antibodies. Methods Mol Biol. 115, 39-41 (1999).
- Kantzer, C. G., et al. Anti-ACSA-2 defines a novel monoclonal antibody for prospective isolation of living neonatal and adult astrocytes. Glia. 65 (6), 990-1004 (2017).
- Batiuk, M. Y., et al. An immunoaffinity-based method for isolating ultrapure adult astrocytes based on ATP1B2 targeting by the ACSA-2 antibody. J Biol Chem. 292 (21), 8874-8891 (2017).
- Pan, J., Wan, J. Methodological comparison of FACS and MACS isolation of enriched microglia and astrocytes from mouse brain. J Immunol Methods. 486, 112834 (2020).
- Donovan, J. A., Koretzky, G. A. CD45 and the immune response. J Am Soc Nephrol. 4 (4), 976-985 (1993).
- Hathcock, K. S., Hirano, H., Hodes, R. J. CD45 expression by murine B cells and T cells: Alteration of CD45 isoforms in subpopulations of activated B cells. Immunol Res. 12 (1), 21-36 (1993).
- Balogh, P., Tew, J. G., Szakal, A. K. Simultaneous blockade of Fc? receptors and indirect labeling of mouse lymphocytes by the selective detection of allotype-restricted epitopes on the kappa chain of rat monoclonal antibodies. Cytometry. 47 (2), 107-110 (2002).
- Becerril-García, M. A., et al. Langerhans Cells From Mice at Birth Express Endocytic- and Pattern Recognition-Receptors, Migrate to Draining Lymph Nodes Ferrying Antigen and Activate Neonatal T Cells in vivo. Front Immunol. 11, 744 (2020).
- Dent, M. A., Segura-Anaya, E., Alva-Medina, J., Aranda-Anzaldo, A. NeuN/Fox-3 is an intrinsic component of the neuronal nuclear matrix. FEBS Lett. 584 (13), 2767-2771 (2010).
- Duan, W., et al. Novel Insights into NeuN: from Neuronal Marker to Splicing Regulator. Mol Neurobiol. 53 (3), 1637-1647 (2016).
- Monteiro, R., Sivasubramanian, M. K., Balasubramanian, P., Subramanian, M. Obesity-Induced Sympathoexcitation is Associated with Glial Senescence in the Brainstem. FASEB J. 34 (S1), 1-1 (2020).
- Li, S., Chang, L., Teissie, J. . Electroporation protocols: mircroorganism, mammalian system, and nanodevice. , (2020).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiol Rev. 91 (2), 461-553 (2011).
- Haage, V., et al. Comprehensive gene expression meta-analysis identifies signature genes that distinguish microglia from peripheral monocytes/macrophages in health and glioma. Acta Neuropathol Commun. 7 (1), 20 (2019).
- Kosior, N., Petkau, T. L., Connolly, C., Lu, G., Leavitt, B. R. Isolating cells from adult murine brain for validation of cell-type specific cre-mediated deletion. J Neurosci Methods. 328, 108422 (2019).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of General and Discriminating Markers of Differential Microglia Phenotypes. Front Cell Neurosci. 14, 198 (2020).
- Man, S., Ubogu, E. E., Ransohoff, R. M. Inflammatory Cell Migration into the Central Nervous System: A Few New Twists on an Old Tale. Brain Pathol. 17 (2), 243-250 (2007).
- Schroeter, C. B., et al. One Brain-All Cells: A Comprehensive Protocol to Isolate All Principal CNS-Resident Cell Types from Brain and Spinal Cord of Adult Healthy and EAE Mice. Cells. 10 (3), 651 (2021).
- Sankowski, R., et al. Mapping microglia states in the human brain through the integration of high-dimensional techniques. Nate Neurosci. 22 (12), 2098-2110 (2019).
- Brennan, F. H., et al. Microglia coordinate cellular interactions during spinal cord repair in mice. Nat Commun. 13 (1), 4096 (2022).
- Enright, H. A., et al. Functional and transcriptional characterization of complex neuronal co-cultures. Sci Rep. 10 (1), 11007 (2020).
- Mofazzal Jahromi, M. A., et al. Microfluidic Brain-on-a-Chip: Perspectives for Mimicking Neural System Disorders. Mol Neurobiol. 56 (12), 8489-8512 (2019).
- Chin, E., Goh, E. Blood-brain barrier on a chip. Methods Cell Biol. 146, 159-182 (2018).
- Miccoli, B., Braeken, D., Li, Y. E. Brain-on-a-chip Devices for Drug Screening and Disease Modeling Applications. Curr Pharm Des. 24 (45), 5419-5436 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nat Neurosci. 22 (4), 669-679 (2019).
- Pellegrini, L., et al. Human CNS barrier-forming organoids with cerebrospinal fluid production. Science. 369 (6500), eaaz5626 (2020).
- Chhibber, T., et al. CNS organoids: an innovative tool for neurological disease modeling and drug neurotoxicity screening. Drug Discov Today. 25 (2), 456-465 (2020).
- Tang, X. Y., et al. Human organoids in basic research and clinical applications. Signal Transduct TargetTher. 7 (1), 168 (2022).
- Sutermaster, B. A., Darling, E. M. Considerations for high-yield, high-throughput cell enrichment: fluorescence versus magnetic sorting. Sci Rep. 9 (1), 227 (2019).
- Doughty, D., et al. Development of a novel purification protocol to isolate and identify brain microglia. Exp Biol Med. 247 (16), 1433-1446 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten