14.3 : Equilibrios para Reacciones Gaseosas y Reacciones Heterogéneas
Equilibrios homogéneos para reacciones gaseosas
Para las reacciones en fase gaseosa, la constante de equilibrio puede expresarse en términos de las concentraciones molares (Kc) o de las presiones parciales (Kp) de los reactivos y productos. Una relación entre estos dos valores K puede obtenerse simplemente a partir de la ecuación de los gases ideales y de la definición de molaridad. Según la ecuación de los gases ideales:
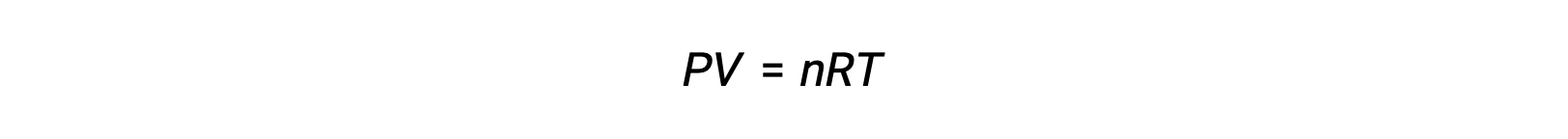
La concentración molar o la molaridad está dada por el número de moles dividido por el volumen:
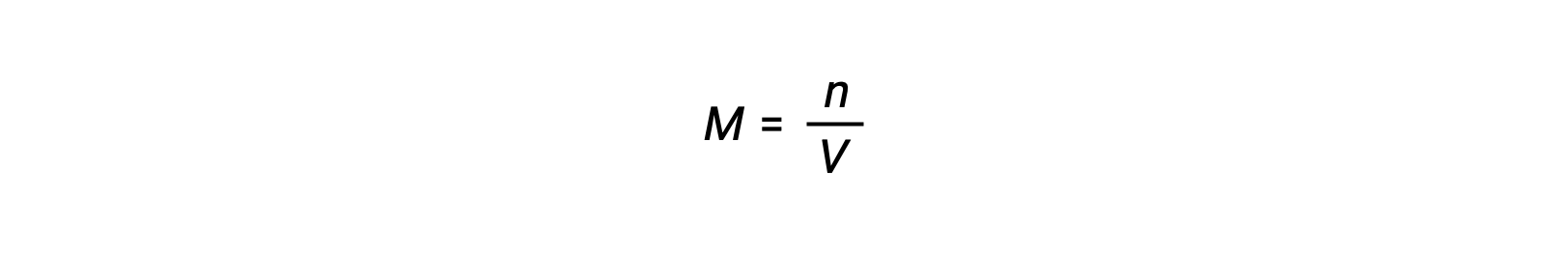
Así,
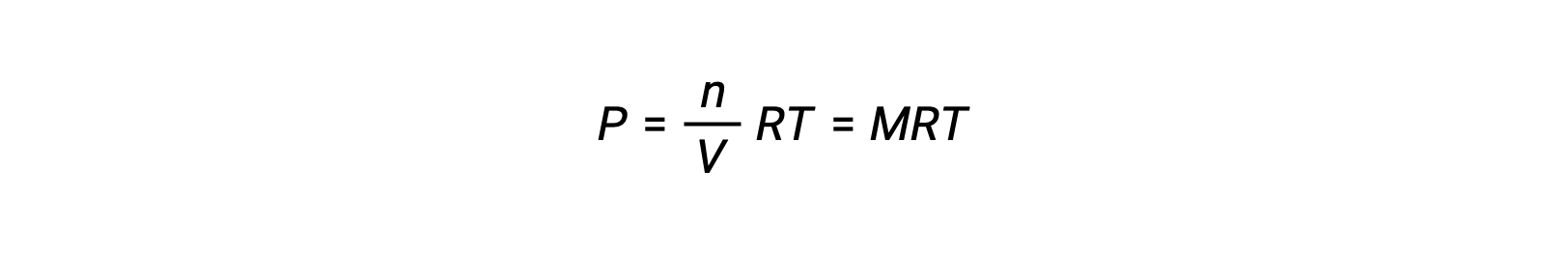
Donde P es la presión parcial, V es el volumen, n es el número de moles, R es la constante de gas, T es la temperatura y M es la concentración molar.
Para la reacción en fase gaseosa: mA + nB ⇌ xC + yD
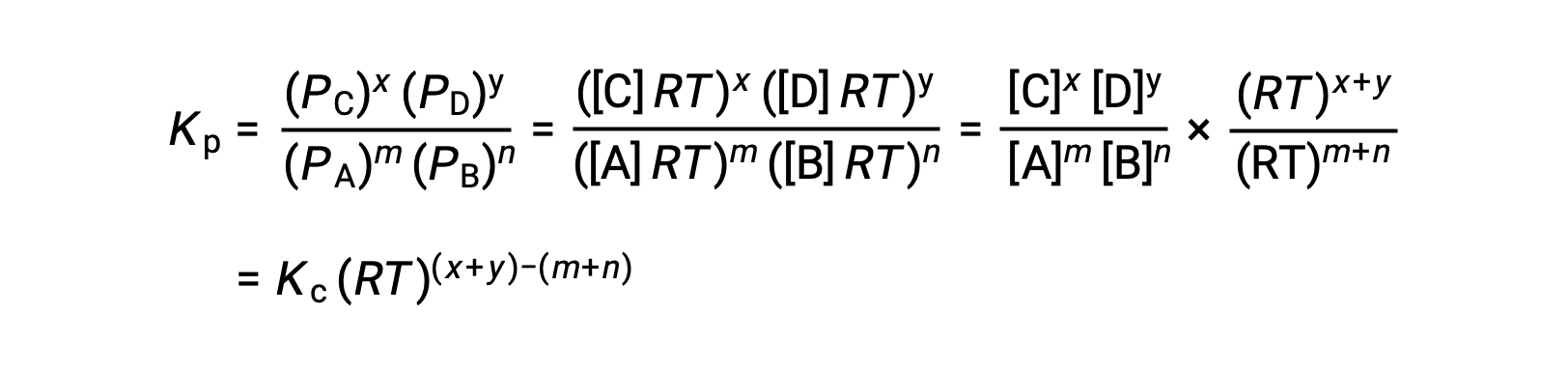
Y así, la relación entre Kc y Kp es
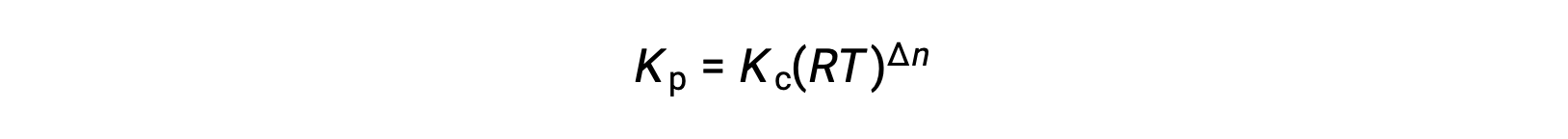
Donde Δn es la diferencia en las cantidades molares de gases del producto y los reactivos, en este caso:
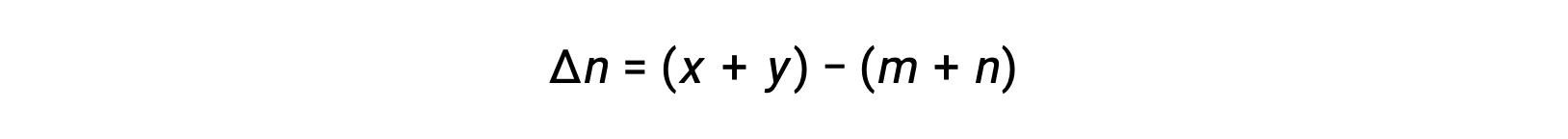
Este texto ha sido adaptado de Openstax, Química 2e, Sección 13.2: Las Constantes de Equilibrio.
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados