Equilibrios homogéneos para reacciones gaseosas
Para las reacciones en fase gaseosa, la constante de equilibrio puede expresarse en términos de las concentraciones molares (Kc) o de las presiones parciales (Kp) de los reactivos y productos. Una relación entre estos dos valores K puede obtenerse simplemente a partir de la ecuación de los gases ideales y de la definición de molaridad. Según la ecuación de los gases ideales:
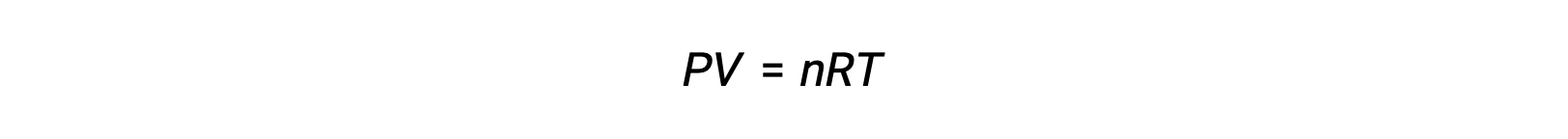
La concentración molar o la molaridad está dada por el número de moles dividido por el volumen:
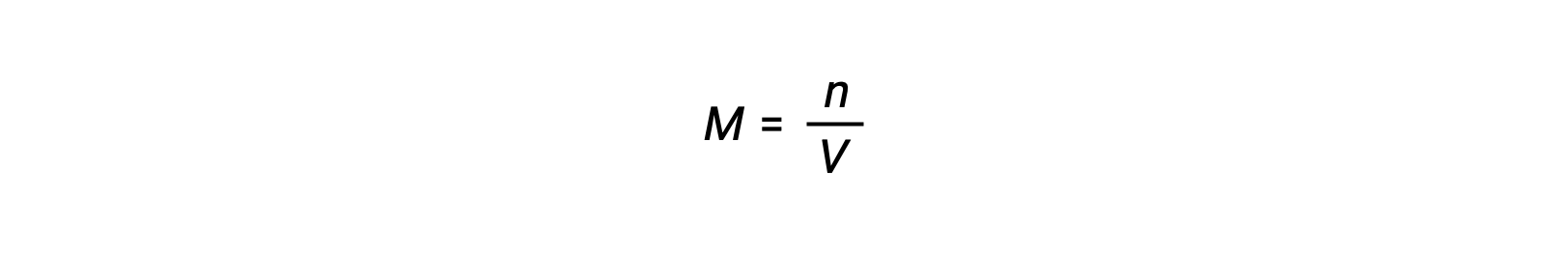
Así,
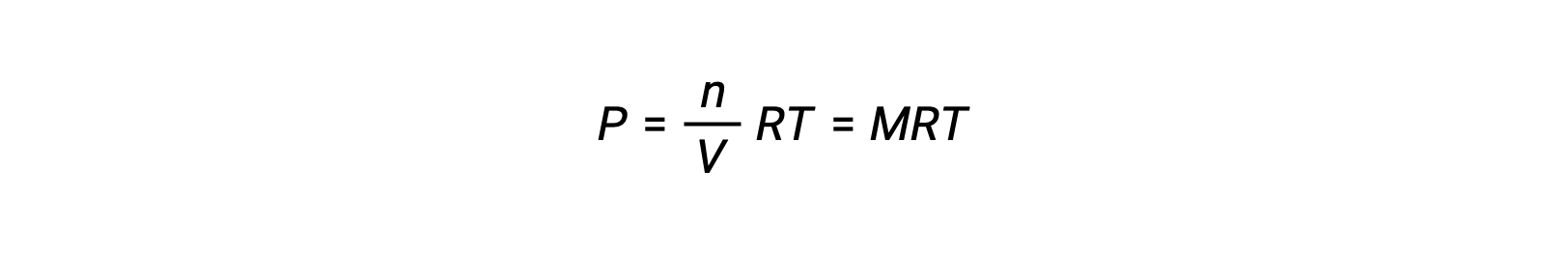
Donde P es la presión parcial, V es el volumen, n es el número de moles, R es la constante de gas, T es la temperatura y M es la concentración molar.
Para la reacción en fase gaseosa: mA + nB ⇌ xC + yD
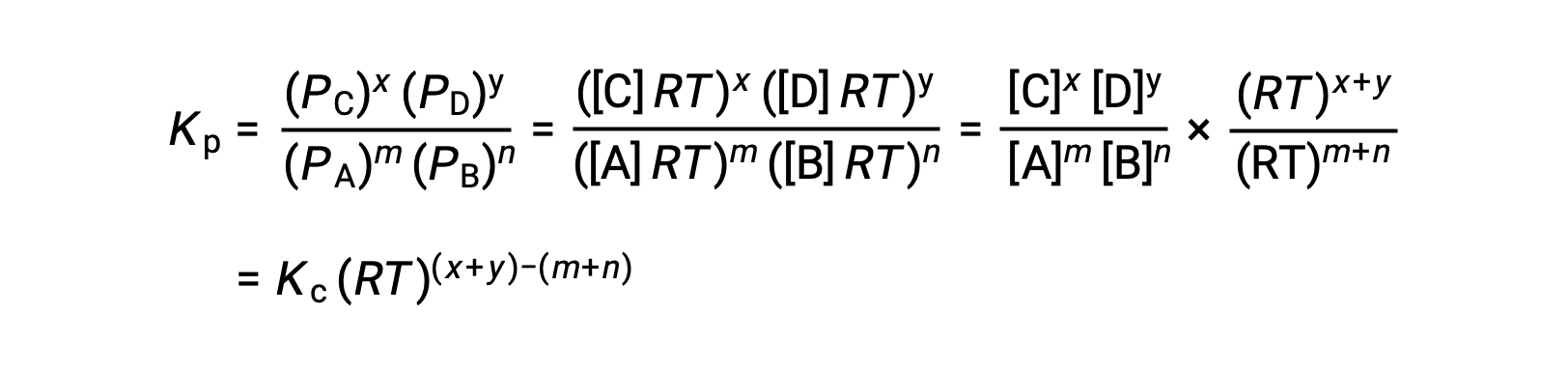
Y así, la relación entre Kc y Kp es
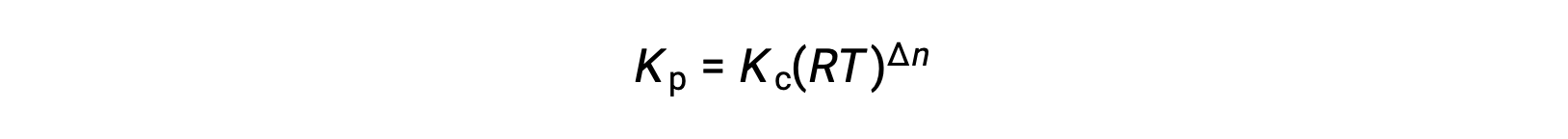
Donde Δn es la diferencia en las cantidades molares de gases del producto y los reactivos, en este caso:
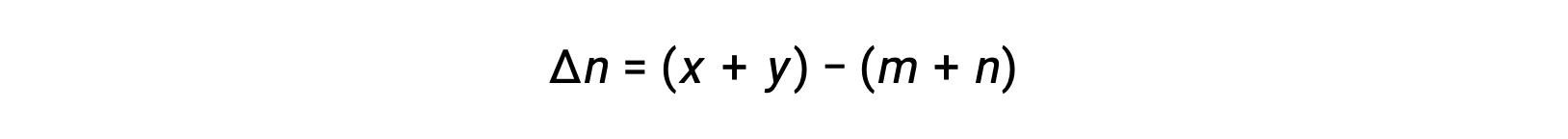
Este texto ha sido adaptado de Openstax, Química 2e, Sección 13.2: Las Constantes de Equilibrio.
Del capítulo 14:

Now Playing
14.3 : Equilibrios para Reacciones Gaseosas y Reacciones Heterogéneas
Equilibrio químico
23.3K Vistas

14.1 : Equilibrio Dinámico
Equilibrio químico
48.5K Vistas

14.2 : La Constante de Equilibrio
Equilibrio químico
45.0K Vistas

14.4 : Calculando la Constante de Equilibrio
Equilibrio químico
29.8K Vistas

14.5 : Cociente de Reacción
Equilibrio químico
47.1K Vistas

14.6 : Calculando las Concentraciones en Equilibrio
Equilibrio químico
46.1K Vistas

14.7 : Principio de le Chatelier: Cambios de Concentración
Equilibrio químico
56.4K Vistas

14.8 : Principio de le Chatelier: Cambios de Volumen (Presión)
Equilibrio químico
33.2K Vistas

14.9 : Principio de le Chatelier: Cambios de Temperatura
Equilibrio químico
28.2K Vistas

14.10 : El Supuesto x es Pequeña
Equilibrio químico
45.3K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados