La constante de equilibrio de una reacción se calcula a partir de las concentraciones (o presiones) en equilibrio de sus reactivos y productos. Si se conocen estas concentraciones, el cálculo simplemente implica su sustitución en la expresión Kc.
Por ejemplo, el dióxido de nitrógeno gaseoso forma tetróxido de dinitrógeno de acuerdo con esta ecuación:
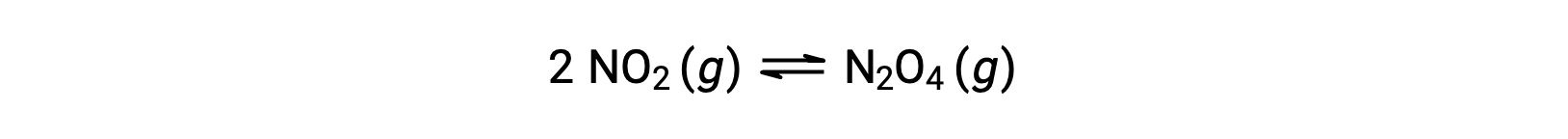
Cuando se añade 0,10 mol de NO2 a un matraz de 1,0 l a 25 °C, la concentración cambia de modo que, en equilibrio, [NO2] = 0,016 M y [N2O4] = 0,042 M. El valor de la constante de equilibrio de la reacción se puede calcular de la siguiente manera:
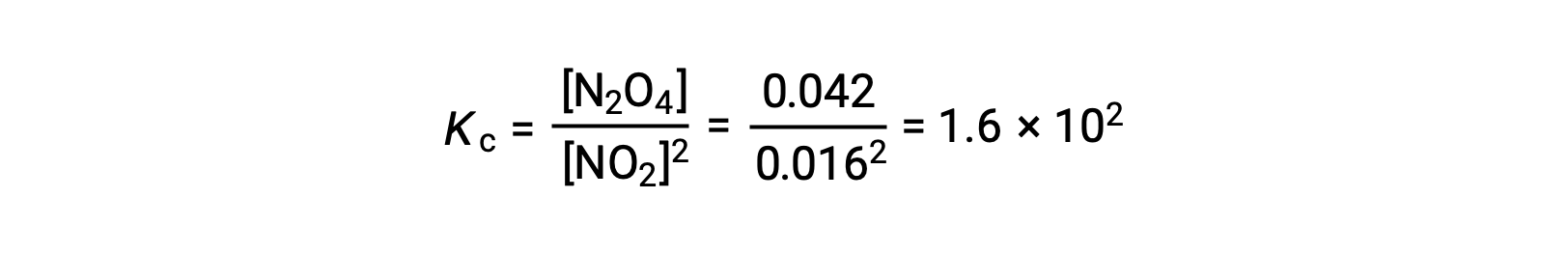
A continuación se ofrece un ejemplo ligeramente más desafiante, en el que la estequiometría de la reacción se utiliza para obtener concentraciones en equilibrio a partir de la información proporcionada. La estrategia básica de este cálculo es útil para muchos tipos de cálculos en equilibrio y se basa en el uso de términos para las concentraciones de reactivos y productos inicialmente presentes, para cómo cambian a medida que avanza la reacción, y para lo que son cuando el sistema alcanza el equilibrio. El acrónimo ICE se utiliza comúnmente para referirse a este enfoque matemático, y los términos de concentración se reúnen generalmente en un formato tabular llamado tabla ICE.
Cálculo de una constante de equilibrio
Las moléculas de yodo reaccionan de forma reversible con los iones de yoduro para producir iones de triyoduro.
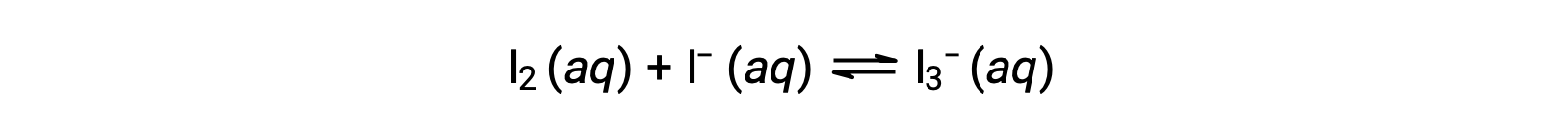
Si una solución con las concentraciones de I2 y I− ambas iguales a 1,000 × 10−3 M antes de la reacción da una concentración de equilibrio de I2 de 6,61 × 10−4 M, ¿cuál es la constante de equilibrio para la reacción?
Para calcular las constantes de equilibrio, se necesitan concentraciones en equilibrio para todos los reactivos y productos:
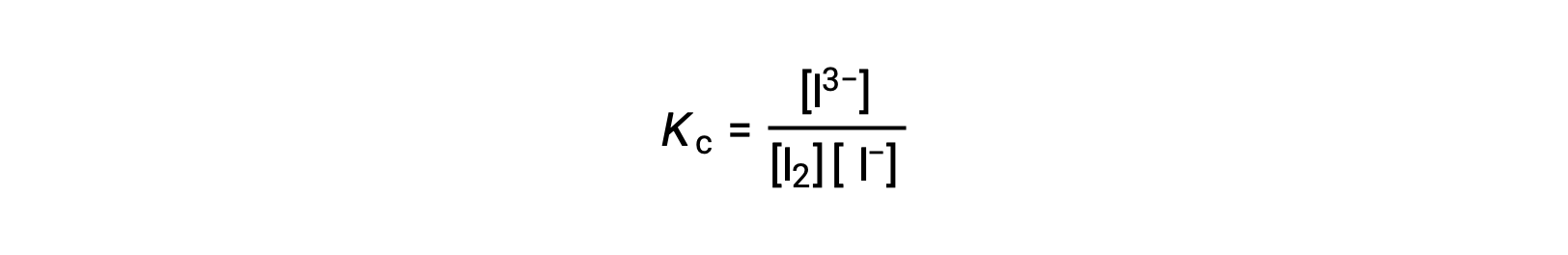
Se proporcionan las concentraciones iniciales de los reactivos y la concentración en equilibrio del producto. Esta información puede utilizarse para obtener valores para las concentraciones en equilibrio de los reactivos, presentando toda la información en una tabla ICE.
| I2 (aq) | I− (aq) | I3− (aq) | |
| Concentración inicial (M) | 1,000 × 10−3 | 1,000 × 10−3 | 0 |
| Cambio (M) | −x | −x | +x |
| Concentración en equilibrio (M) | 1,000 × 10−3 − x | 1,000 × 10−3 − x | x |
En equilibrio, la concentración de I2 es de 6,61 ×: 10−4 M, por lo que
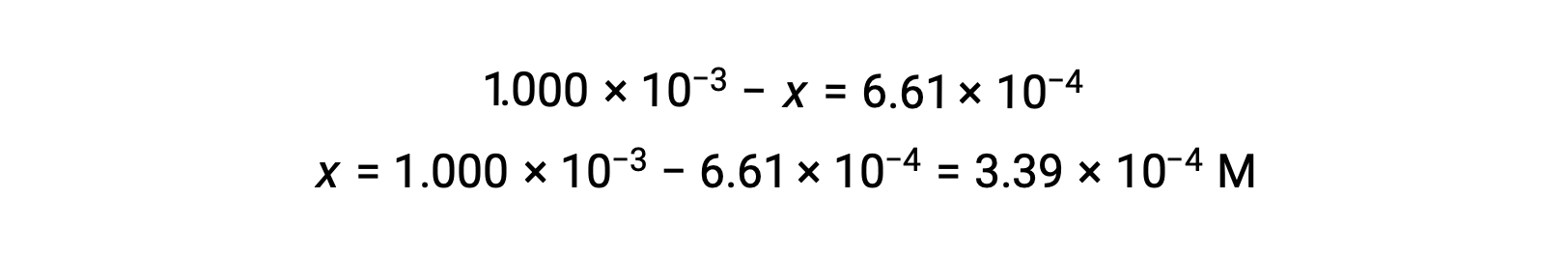
La tabla ICE puede actualizarse ahora con valores numéricos para todas sus concentraciones:
| I2 (aq) | I− (aq) | I3−(aq) | |
| Concentración inicial (M) | 1,000 × 10−3 | 1,000 × 103 | 0 |
| Cambio (M) | −3,39 × 10−4 | −3,39 × 10−4 | +3,39 × 10-4 |
| Concentración en equilibrio (M) | 6,61 × 10−4 | 6,61 × 10−4 | 3,39 × 10−4 |
Por último, las concentraciones en equilibrio pueden sustituirse por la expresión Kc y resolverse:
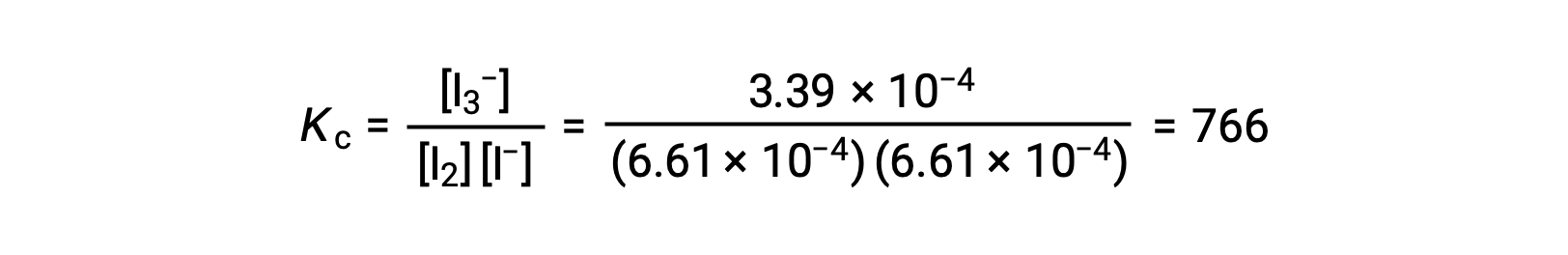
Este texto ha sido adaptado de Openstax, Química 2e, Sección 13.4 Cálculos de Equilibrio.
Del capítulo 14:

Now Playing
14.4 : Calculando la Constante de Equilibrio
Equilibrio químico
29.8K Vistas

14.1 : Equilibrio Dinámico
Equilibrio químico
48.5K Vistas

14.2 : La Constante de Equilibrio
Equilibrio químico
45.0K Vistas

14.3 : Equilibrios para Reacciones Gaseosas y Reacciones Heterogéneas
Equilibrio químico
23.2K Vistas

14.5 : Cociente de Reacción
Equilibrio químico
47.1K Vistas

14.6 : Calculando las Concentraciones en Equilibrio
Equilibrio químico
46.0K Vistas

14.7 : Principio de le Chatelier: Cambios de Concentración
Equilibrio químico
56.3K Vistas

14.8 : Principio de le Chatelier: Cambios de Volumen (Presión)
Equilibrio químico
33.2K Vistas

14.9 : Principio de le Chatelier: Cambios de Temperatura
Equilibrio químico
28.2K Vistas

14.10 : El Supuesto x es Pequeña
Equilibrio químico
45.3K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados