Un sistema en equilibrio se encuentra en un estado de equilibrio dinámico, con reacciones hacia delante y hacia atrás que tienen lugar a velocidades iguales. Si un sistema en equilibrio es sometido a un cambio en las condiciones que afecta a estas velocidades de reacción de forma diferente (una tensión), las velocidades ya no son iguales y el sistema no está en equilibrio. El sistema experimentará posteriormente una reacción neta en la dirección de una velocidad mayor (un cambio) que restablecerá el equilibrio. Este fenómeno se resume en el principio de Le Châtelier: Si un sistema en equilibrio es sometido a una tensión, el sistema experimentará un cambio en respuesta a la tensión que restablece el equilibrio.
Las velocidades de reacción se ven afectadas principalmente por las concentraciones, como se describe en la ley de velocidad de reacción, y la temperatura, como se describe en la ecuación de Arrhenius. En consecuencia, los cambios en la concentración y la temperatura son los dos estresores que pueden desplazar un equilibrio.
Efecto de un cambio en la concentración
Si un sistema en equilibrio es sometido a un cambio en la concentración de un reactante o de un producto, la velocidad de la reacción directa o inversa cambiará. Por ejemplo, considere la reacción en equilibrio:

Cuando este sistema está en equilibrio, las velocidades de reacción hacia delante y hacia atrás son iguales.
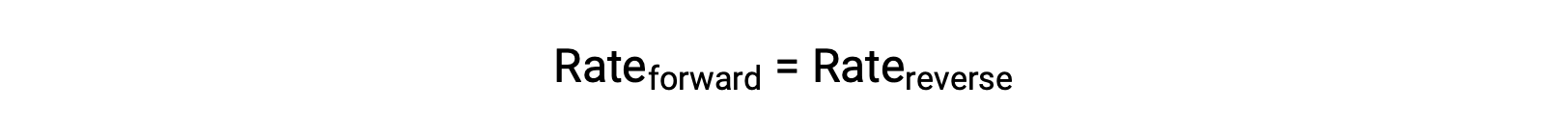
Si el sistema se estresa añadiendo reactivo, ya sea N2 u O2, el aumento de concentración resultante hace que aumente la velocidad de la reacción hacia delante, superando la de la reacción inversa:

El sistema experimentará una reacción neta temporal en la dirección de avance para restablecer el equilibrio (el equilibrio cambiará hacia la derecha). Este mismo cambio se producirá si se elimina alguna cantidad de producto, NO, del sistema, lo que disminuye la velocidad de la reacción inversa, lo que de nuevo dará lugar al mismo desequilibrio en las velocidades.
La misma lógica se puede utilizar para explicar el cambio hacia la izquierda que resulta de eliminar el reactivo o añadir producto a un sistema en equilibrio. Ambas tensiones dan como resultado un aumento de la velocidad de la reacción inversa

y una reacción neta temporal en la dirección inversa para restablecer el equilibrio.
Como alternativa a esta interpretación cinética, el efecto de los cambios en la concentración sobre los equilibrios puede racionalizarse en términos del cociente de reacción. Cuando el sistema está en equilibrio,
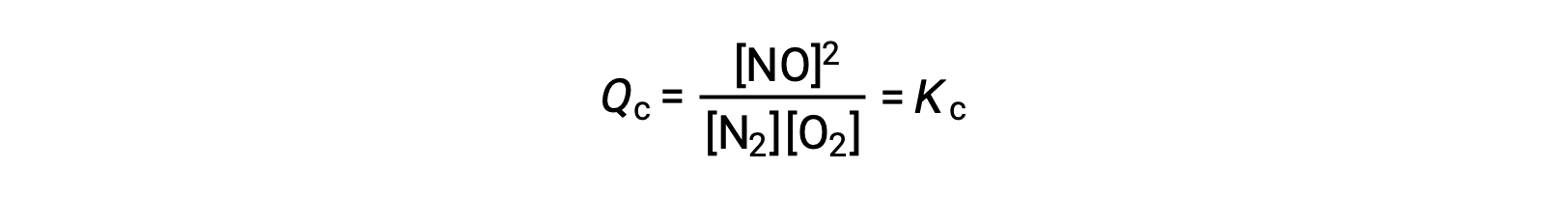
Si se añade un reactivo (aumentando el denominador del cociente de la reacción) o se elimina el producto (disminuyendo el numerador), Qc < Kc y el equilibrio se desplazará hacia la derecha. Tenga en cuenta que las tres formas diferentes de inducir esta tensión producen tres cambios diferentes en la composición de la mezcla en equilibrio. Si se añade N2, el cambio hacia la derecha consumirá O2 y producirá NO a medida que se restablece el equilibrio, produciendo una mezcla con una concentración mayor de N2 y NO y una concentración de O2 menor que la que estaba presente previamente. Si se añade O2, la nueva mezcla en equilibrio tendrá mayores concentraciones de O2 y NO y una menor concentración de N2. Finalmente, si se elimina NO, la nueva mezcla en equilibrio tendrá mayores concentraciones de N2 y O2 y una menor concentración de NO. A pesar de estas diferencias en la composición, el valor de la constante de equilibrio será el mismo antes y después de la tensión (según la ley de acción de masas). Se puede aplicar la misma lógica para las tensiones que implican la eliminación de reactivos o la adición de productos, en cuyo caso Qc > Kc y el equilibrio se desplazará hacia la izquierda.
Este texto ha sido adaptado de Openstax, Química 2e, Sección 13.3 Cambios de los equilibrios: Principio de LeChatelier.
Tags
Del capítulo 14:

Now Playing
14.7 : Principio de le Chatelier: Cambios de Concentración
Equilibrio químico
56.3K Vistas

14.1 : Equilibrio Dinámico
Equilibrio químico
48.5K Vistas

14.2 : La Constante de Equilibrio
Equilibrio químico
45.0K Vistas

14.3 : Equilibrios para Reacciones Gaseosas y Reacciones Heterogéneas
Equilibrio químico
23.2K Vistas

14.4 : Calculando la Constante de Equilibrio
Equilibrio químico
29.7K Vistas

14.5 : Cociente de Reacción
Equilibrio químico
47.1K Vistas

14.6 : Calculando las Concentraciones en Equilibrio
Equilibrio químico
46.0K Vistas

14.8 : Principio de le Chatelier: Cambios de Volumen (Presión)
Equilibrio químico
33.2K Vistas

14.9 : Principio de le Chatelier: Cambios de Temperatura
Equilibrio químico
28.2K Vistas

14.10 : El Supuesto x es Pequeña
Equilibrio químico
45.3K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados