17.3 : Segunda Ley de la Termodinámica
En la búsqueda de identificar una propiedad que pueda predecir con fiabilidad la espontaneidad de un proceso, se ha identificado un candidato prometedor: La entropía. Los procesos que implican un aumento en la entropía del sistema (ΔS > 0) muy a menudo son espontáneos; sin embargo, abundan los ejemplos contrarios. Al ampliar la consideración de los cambios de entropía para incluir el entorno, se puede llegar a una conclusión significativa con respecto a la relación entre esta propiedad y la espontaneidad. En los modelos termodinámicos, el sistema y sus alrededores comprenden todo, es decir, el universo, por tanto lo siguiente es cierto:

Para ilustrar esta relación, considere nuevamente el proceso de flujo de calor entre dos objetos, uno identificado como el sistema y el otro como el entorno. Hay tres posibilidades para tal proceso:
- Los objetos se encuentran a diferentes temperaturas y el calor fluye desde el objeto más caliente al más frío. Esto siempre se observa que ocurre espontáneamente. Si se designa el objeto más caliente como el sistema y se invoca la definición de entropía, se obtiene lo siguiente:
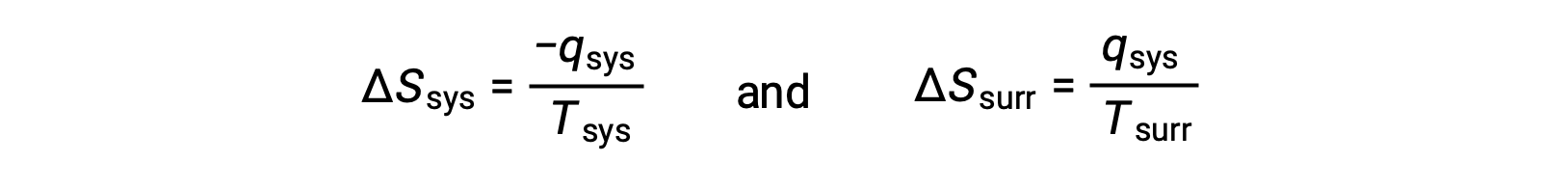
Las magnitudes de −qsis y qsis son iguales, sus signos aritméticos opuestos denotan pérdida de calor por el sistema y ganancia de calor por el entorno. Debido a que Tsis > Tent en este escenario, la disminución de la entropía del sistema será menor que el aumento de entropía del entorno, y así la entropía del universo aumentará:
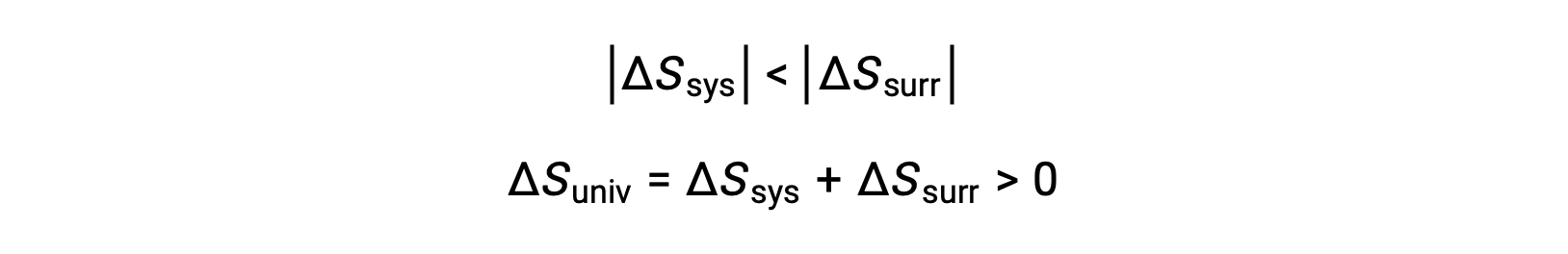
- Los objetos se encuentran a diferentes temperaturas y el calor fluye desde el refrigerador hasta el objeto más caliente. Esto nunca se observa que ocurra espontáneamente. De nuevo, al designar el objeto más caliente como el sistema y al invocar la definición de entropía se obtiene lo siguiente:
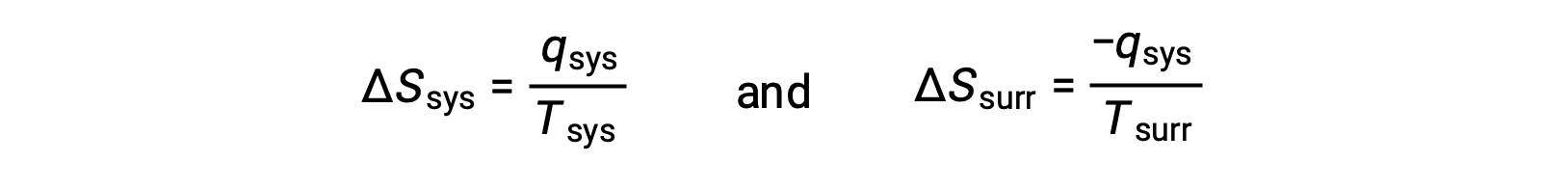
los signos aritméticos de qsis denotan la ganancia de calor por el sistema y la pérdida de calor por el entorno. La magnitud del cambio de entropía para el entorno será nuevamente mayor que la del sistema, pero en este caso, los signos de los cambios de calor (es decir, la dirección del flujo de calor) producirán un valor negativo para ΔSuniv. Este proceso implica una disminución en la entropía del universo.
- Los objetos están esencialmente a la misma temperatura,Tsis ≈ Tent, y por lo tanto las magnitudes de los cambios de entropía son esencialmente las mismas tanto para el sistema como para el entorno. En este caso, el cambio de entropía del universo es cero, y el sistema está en equilibrio.
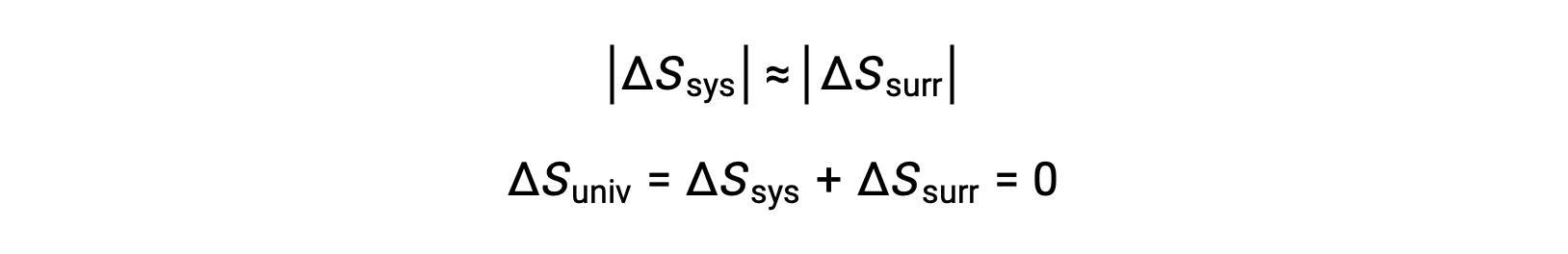
Estos resultados conducen a una declaración profunda con respecto a la relación entre entropía y espontaneidad conocida como la segunda ley de la termodinámica: Todos los cambios espontáneos causan un aumento en la entropía del universo. En el cuadro que figura a continuación se presenta un resumen de estas tres relaciones.
| La Segunda Ley de Termodinámica | |
| ΔSuniv > 0 | espontáneo |
| ΔSuniv < 0 | no espontáneo (espontáneo en dirección opuesta) |
| ΔSuniv = 0 | en equilibrio |
Para muchas aplicaciones realistas, el entorno es amplio en comparación con el sistema. En tales casos, el calor ganado o perdido por el entorno como resultado de algún proceso representa una fracción muy pequeña, casi infinitesimal, de su energía térmica total. Por ejemplo, la combustión de un combustible en el aire implica la transferencia de calor de un sistema (el combustible y las moléculas de oxígeno que están en reacción) a un entorno infinitamente más masivo (la atmósfera de la tierra). Como resultado, qent es una buena aproximación de qsis, y la segunda ley puede ser enunciada como sigue:
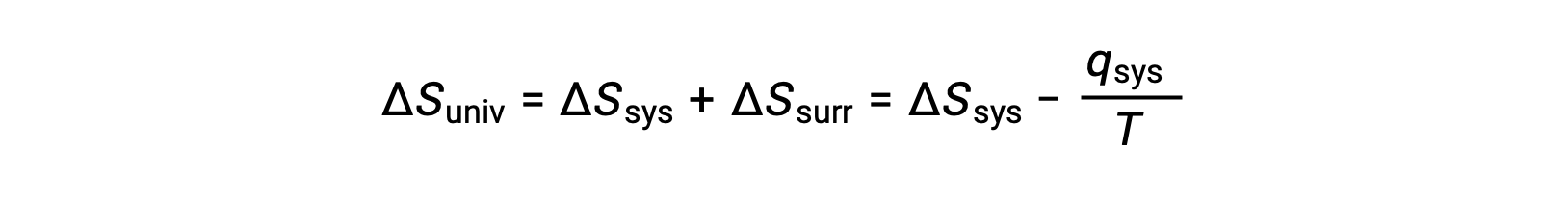
Esta ecuación es útil para predecir la espontaneidad de un proceso.
Este texto es adaptado de Openstax, Química 2e, Capítulo 16.2: La Segunda y Tercera Ley de Termodinámica.
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
