Uno de los desafíos de usar la segunda ley de la termodinámica para determinar si un proceso es espontáneo es que requiere mediciones del cambio de entropía para el sistema y del cambio de entropía para el entorno. Un enfoque alternativo que involucraba una nueva propiedad termodinámica definida en términos de propiedades del sistema fue introducido sólo hasta finales del siglo XIX por el matemático estadounidense Josiah Willard Gibbs. Esta nueva propiedad se llama la energía libre de Gibbs (G) (o simplemente la energía libre), y se define en términos de la entalpía y entropía de un sistema como el siguiente:
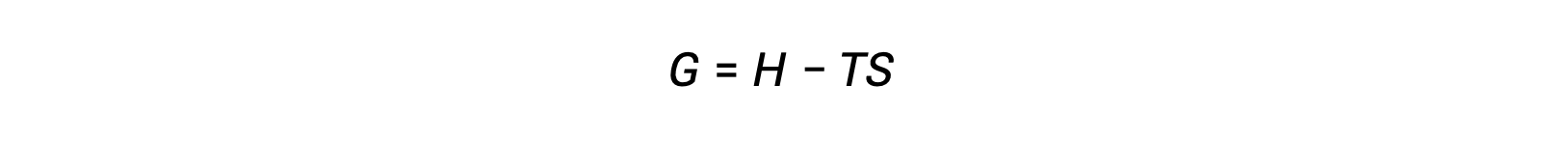
La energía libre es una función de estado, y a temperatura y presión constantes, el cambio de energía libre (ΔG) puede expresarse de la siguiente manera:
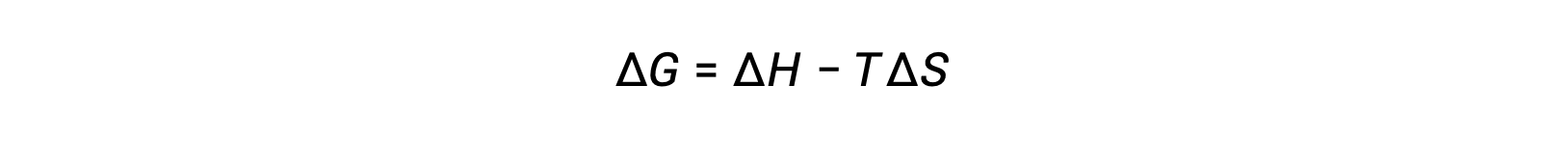
La relación entre esta propiedad del sistema y la espontaneidad de un proceso puede entenderse recordando la expresión de la segunda ley obtenida previamente:
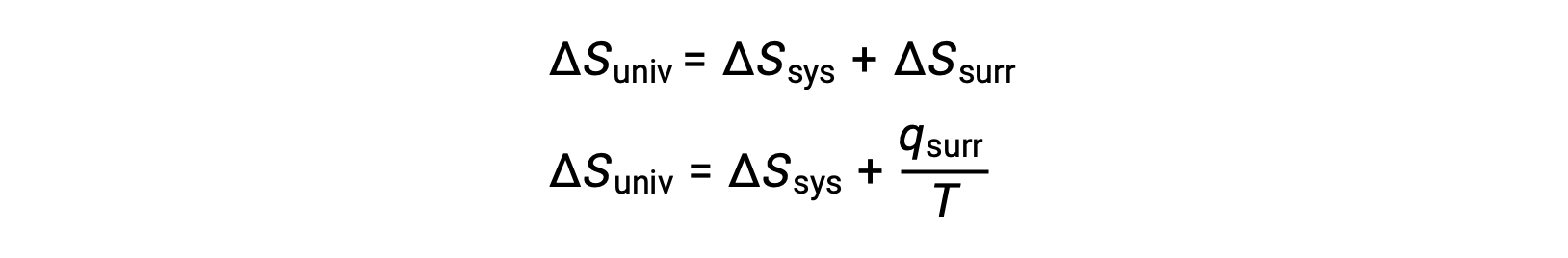
La primera ley requiere que qent = −qsis, y a presión constante qsis = ΔH, por lo que esta expresión puede ser reescrita como:
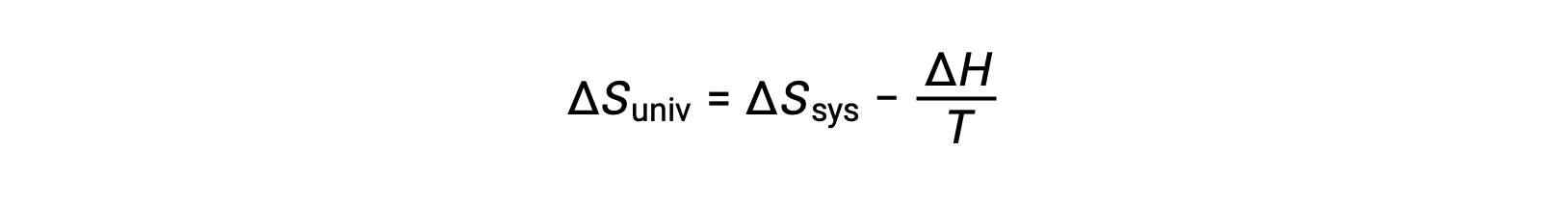
Al multiplicar ambos lados de esta ecuación por −T y reorganizarla, se obtiene lo siguiente:
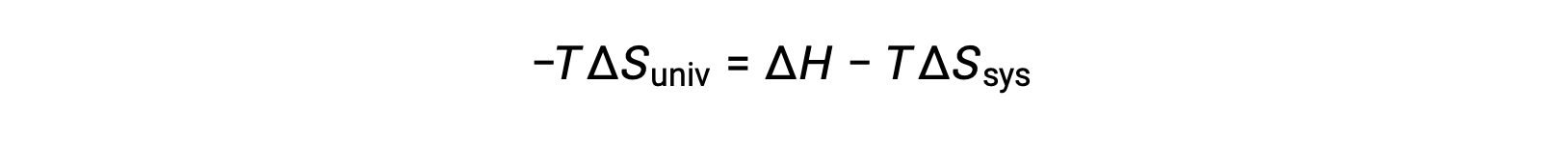
Por razones de simplicidad, el subíndice “sis” puede omitirse y la expresión se convierte en
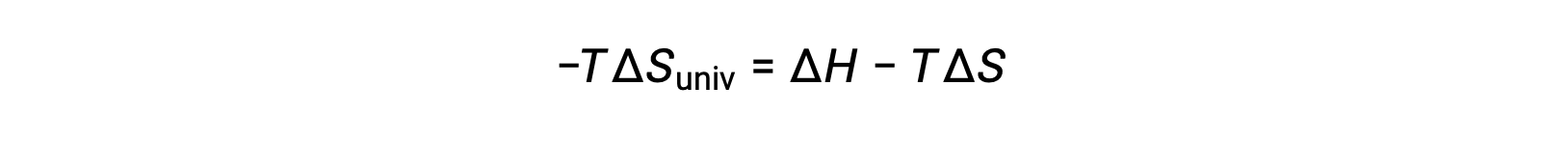
Al comparar esta ecuación con la anterior para el cambio de energía libre muestra la siguiente relación:
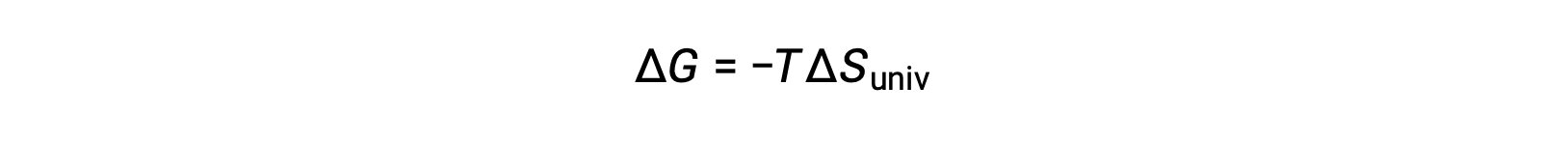
El cambio de energía libre es, por lo tanto, un indicador confiable de la espontaneidad de un proceso, ya que está directamente relacionado con el indicador de espontaneidad previamente identificado, ΔSuniv.
Si ΔSuniv > 0, ΔG < 0, la reacción es espontánea.
Si ΔSuniv < 0, ΔG > 0, la reacción es no espontánea.
SiΔSuniv = 0, ΔG = 0, la reacción está en equilibrio.
Este texto está adaptado de Openstax, Química 2e, Capítulo 16.4: Energía Libre.
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
