Одна из задач использования второго закона термодинамики для определения спонтанного процесса заключается в том, что он требует измерения изменения энтропии для системы и изменения энтропии для окружающей среды. Альтернативный подход, включающий новое термодинамическое свойство, определенное с точки зрения свойств системы, был введен в конце девятнадцатого века американским математиком Джосиахом Уиллардом Гиббсом. Это новое свойство называется свободной энергией Гиббса (G) (или просто свободной энергией), и оно определяется в терминах энтальпии и энтропии системы следующим образом:
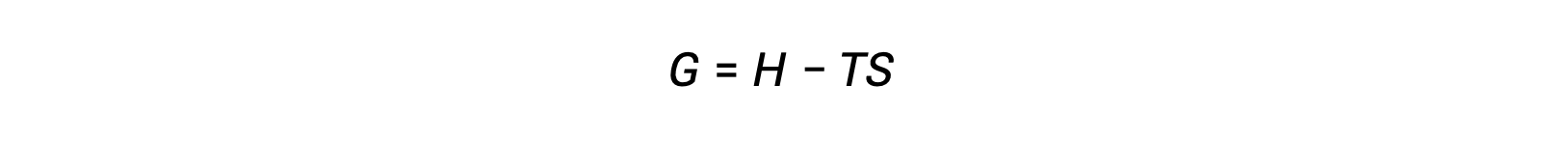
Свободная энергия является функцией состояния, и при постоянной температуре и давлении свободное изменение энергии (ΔG) может быть выражено следующим образом:
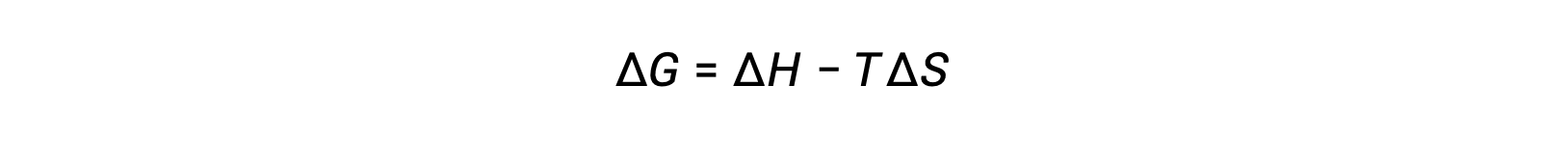
Связь между этим системным свойством и спонтанностью процесса может быть понятна, если вспомнить ранее полученное второе выражение закона:
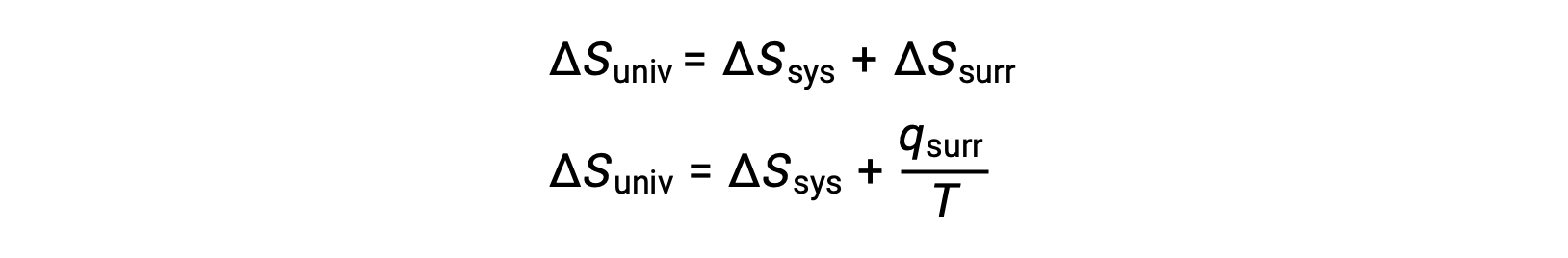
Первый закон требует, чтобы qsurr = -qsys и при постоянном давлении qsys = ΔH, поэтому это выражение можно переписать следующим образом:
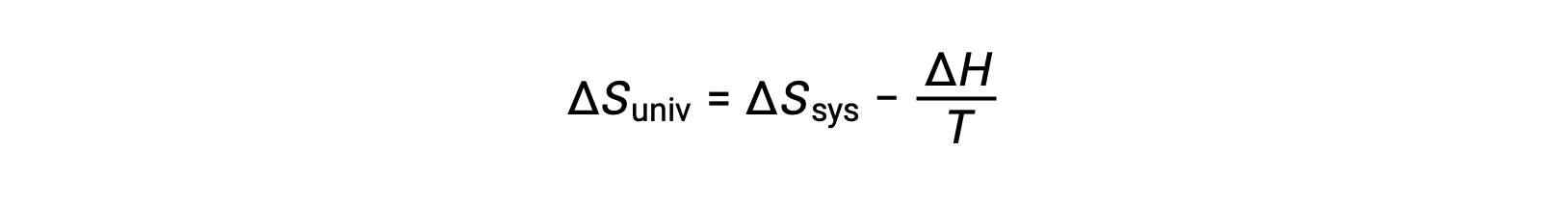
Умножение обеих сторон этого уравнения на -T и перестановка приводит к следующему:
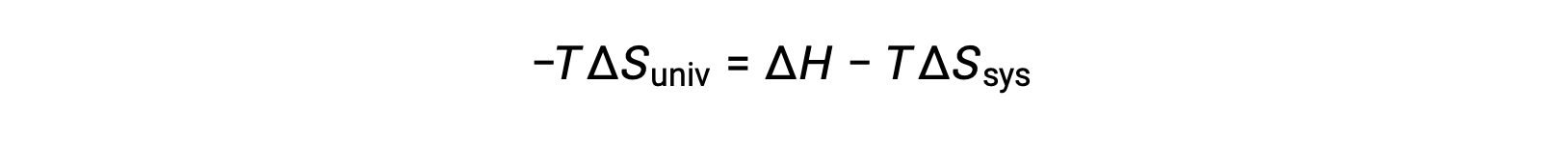
Ради простоты, подстрочная “sys” может быть опущена, и выражение становится
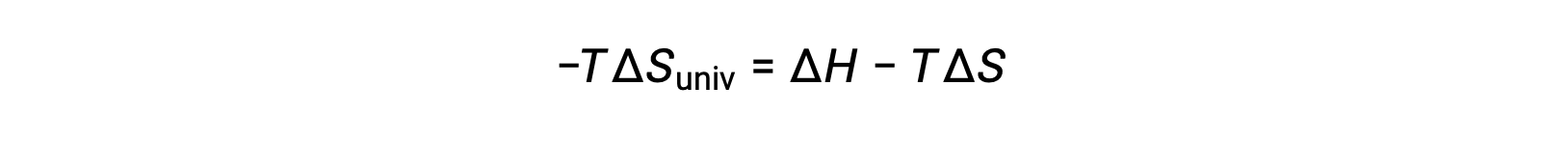
Сравнение этого уравнения с предыдущим для изменения свободной энергии показывает следующее соотношение:
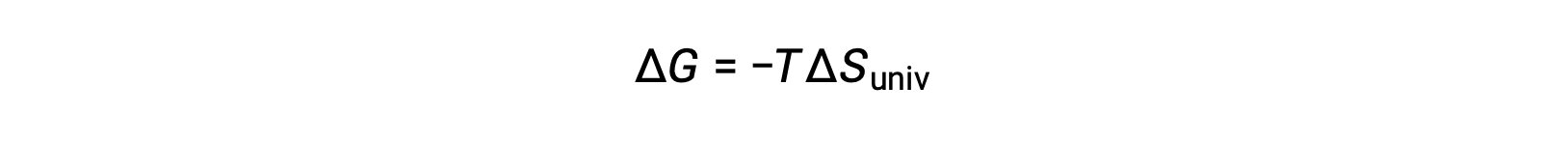
Таким образом, свободное изменение энергии является надежным индикатором спонтанности процесса, так как оно напрямую связано с ранее выявленным индикатором спонтанности, ΔSuniv.
Если ΔSuniv > 0, ΔG < 0 и реакция спонтанная.
Если ΔSuniv < 0, ΔG > 0 и реакция не является спонтанной.
Если ΔSuniv = 0, ΔG = 0 и реакция находится в равновесии.
Этот текст адаптирован из Openstax, Химия 2е изд., Глава 16.4: Свободная энергия.
Авторские права © 2025 MyJoVE Corporation. Все права защищены
