Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Células madre embrionarias-las células endoteliales derivadas de tratamiento de la isquemia Miembro Posterior
En este artículo
Resumen
El procedimiento quirúrgico para el suministro de células madre embrionarias derivadas de las células endoteliales de las extremidades inferiores isquémicas se demuestra, con no invasiva de seguimiento por imágenes de bioluminiscencia.
Resumen
Enfermedad arterial periférica (PAD) se debe a un estrechamiento de las arterias periféricas que irrigan sangre oxigenada y nutrientes a las piernas y los pies, esta patología provoca síntomas como la claudicación intermitente (dolor al caminar), dolorosas úlceras isquémicas, o incluso gangrena del miembro en peligro. Se cree generalmente que el endotelio vascular, una monocapa de células endoteliales, que invierte la superficie luminal de los vasos sanguíneos y linfáticos, juega un papel dominante en la homeostasis vascular y la regeneración vascular. Como resultado, las células madre basado en la regeneración del endotelio puede ser un enfoque prometedor para el tratamiento de PAD.
En este vídeo, se demuestra el trasplante de células madre embrionarias (ESC)-derivados de las células endoteliales para el tratamiento de la isquemia hindimb unilateral como un modelo de PAD, seguido por el seguimiento no invasivo de homing de las células y la supervivencia de imágenes de bioluminiscencia. Los materiales y procedimientos específicos para la entrega de la celda y las imágenes se describen. Este protocolo sigue a otra publicación en la descripción de la inducción de isquemia extremidades inferiores por Niiyama et al 1.
Protocolo
1. Diferenciación de los CES murino en células endoteliales
- El protocolo para la diferenciación de los CES en las células endoteliales se describe en otro lugar y no es el objetivo de este protocolo 2,3. En pocas palabras, las células pueden diferenciarse, y las células que son positivas para los marcadores endoteliales como el CD31 o caderina del endotelio vascular (VE-cadherina) se purifican por clasificación celular activado por fluorescencia (FACS).
2. La construcción de la fusión de genes reportero doble y transducción de lentivirales
- Bioluminiscencia puede ser usado para rastrear las células que son modificadas para expresar los genes indicadores, tales como luciferasa de luciérnaga (fluctuaciones). Para esta aplicación, las células contienen fluctuaciones y aumento de proteína verde fluorescente (eGFP) gen de fusión bajo el control de un promotor de la ubiquitina interna. Con el fin de modificar las células, el vector transgénico lentiviral que contiene la clave optimizado elementos genéticos para cumplir con los criterios de bioseguridad, así como una mayor eficiencia de transducción, UFP-FG vector desarrollado en nuestro laboratorio que lleva el gen de fusión fluc-eGFP reportero se puede utilizar para estable transducción de las células después de la diferenciación. Esta construcción de fusión permite que tanto la bioluminiscencia y el seguimiento de la fluorescencia de las células trasplantadas. El procedimiento para la generación de partículas del virus, la transducción y la producción de células marcadas que los genes que expresan reportero se describe en otro 4.
3. El trasplante de células derivadas de CES endotelial a las extremidades inferiores isquémicas
- Iniciar el procedimiento mediante la elaboración de un ratón que ha sido objeto de isquemia miembro posterior para el trasplante de células. Para ello, coloque el ratón en la cámara de inducción de la anestesia que contiene un 1-3% de isoflurano en oxígeno al 100%, con un caudal de 1L/min.
- Deja el ratón en la cámara de inducción hasta que no responde a los estímulos externos. A continuación, retire el animal de la cámara de inducción.
- Luego, coloque el animal en decúbito supino en la mesa de operaciones y conectarlo a un flujo continuo de 1-3% isoflurano en oxígeno al 100%, con un caudal de 1L/min.
- Limpie la piel de las extremidades inferiores con tres alterna matorrales Betadine y alcohol.
- Una vez que se limpia la piel, obtener millón ESC derivados de las células endoteliales en 30 l de tampón fosfato salino (PBS). La carga de estas células en una aguja de calibre 28.
- Cuando las células están listas, levante suavemente y extender las extremidades inferiores para visualizar mejor la ubicación de los músculos gemelos. Mientras se extiende la pierna, insertar la aguja en la piel en el músculo subyacente. Tenga cuidado de no acercarse a los huesos. Suave y lentamente se inyecta la mezcla de 30 l de células en el gemelo. Para la inyección intramuscular, 30 l está cerca de los límites de volumen que se puede inyectar. Por lo tanto, de calibre 28 jeringas de insulina son preferidos porque, según nuestra experiencia, que eliminan la pérdida de volumen en agujas de jeringas.
- Después de la inyección, vuelva el ratón hacia la jaula de recuperación y controlar de forma continua hasta que despierto. Que el animal pueda recuperarse durante varias horas y luego proceder con la de imágenes de bioluminiscencia in vivo de las células trasplantadas.
4. Bioluminiscencia de imágenes de ESC derivados células endoteliales in vivo
- El trasplantado células derivadas de CES endothelials fueron modificados para expresar tanto la fluctuaciones y el gen de fusión EGFP bajo el control de un promotor de la ubiquitina interna. Por lo tanto, la bioluminiscencia puede ser usado para rastrear las células dentro de la extremidad posterior isquémica.
- Para comenzar este paso, a su vez en el sistema de imágenes de bioluminiscencia y el software de adquisición de imágenes de vida. A continuación, inicializar el sistema de adquisición y especificar las dimensiones del campo de visión.
- Luego, coloque papel negro mate en la caja de imagen para absorber las emisiones de fondo.
- Una vez que el cuadro de imagen esté listo, coloque el ratón en la cámara de inducción de la anestesia que contiene un 1-3% isoflurano en oxígeno en la salida de 1L/min. Deja el ratón en la cámara de inducción hasta que no responde a los estímulos externos. A continuación, retire el animal de la cámara de inducción.
- Quitar el pelo de ambas extremidades posteriores utilizando una máquina de afeitar eléctrica cuando sea necesario.
- Inyectar 10 L de D-luciferina por gramo de peso corporal en el peritoneo. El D-luciferina se prepara con antelación en las soluciones de filtrado de valores de 15 mg / ml en PBS.
- Una vez que la luciferina se inyecta, el lugar del animal en la caja de imágenes sobre el papel negro en posición supina, conectado a un flujo continuo de isoflurano.
- La colocación de animales en la caja de imagen y la conexión con el isoflurano.
- Comienzan a adquirir las imágenes de 10 a 60 segundos con el fin de determinar un tiempo de exposición óptimo para que la imagen no está saturado. Si la imagen se satura, reducir el tiempo de exposición. Si la señal de bioluminiscencia es muy débil, aumentar el tiempo de exposición.
- Usíng el tiempo de exposición óptimo, continuar adquiriendo imágenes cada 1-3 minutos hasta que la señal llega al máximo y luego se desvanece. Cuando la adquisición se haya completado, guarde el archivo.
- Para analizar los datos, seleccionar las regiones de interés (ROI) que cubren el sitio de la inyección. Como control negativo, un retorno de la inversión similar puede ser seleccionado para la pierna que no funciona. Usando el software, medir la radiación total, que se expresa en unidades de fotones / segundo / cm 2 / estereorradián (p / s / cm 2 / sr), para el rendimiento de la inversión para cada punto de tiempo. El valor máximo debe ser utilizado en los datos finales. Los datos también pueden ser exportados a Excel para su uso futuro.
- Una vez que todos los datos adquiridos, devolver el animal a la jaula de recuperación y seguimiento continuo hasta que la despierta animal.
- Repita este procedimiento para realizar un seguimiento de las células a través del tiempo.
- En un momento de tiempo deseado, el animal puede ser sacrificado para la evaluación de la función del tejido.
5. Resultados representante
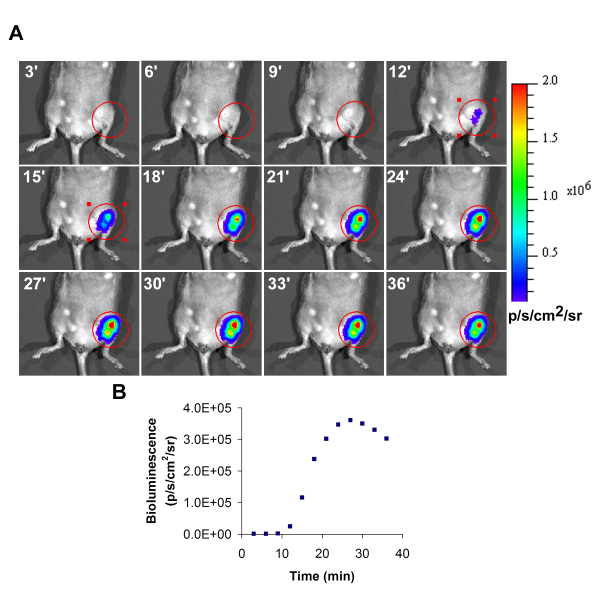
Una imagen de bioluminiscencia representante de las células trasplantadas en la extremidad posterior izquierda isquémica se muestra en la Figura 1. Durante la adquisición de la bioluminiscencia, la intensidad aumentará con el tiempo, y el valor máximo obtenido durante el transcurso del tiempo debe ser reportado como el valor final.
Discusión
CES es una fuente de células prometedoras para el tratamiento de la isquemia tisular, debido a su plasticidad de diferenciación y su capacidad de dar lugar a linajes de células que comprende las tres capas germinales, incluyendo las células endoteliales. Para superar los problemas éticos asociados con la CES, células madre pluripotentes inducidas (CMPi) puede ser una madre pluripotentes alternativa fuente de células que supera las preocupaciones éticas. Además de los CES, las células madre adultas, como las células progenitoras e...
Agradecimientos
Los autores agradecen a Andrea Axtell, Satoshi Itoh, MD, Velotta Jeff, MD, Hoyt Grant, Robert C. Robbins, MD, Yu Jin, MD, Tim Doyle, PhD, y el Stanford pequeño núcleo de imágenes de animales para la asistencia técnica. Los autores también agradecen AM Bickford, Inc. para el apoyo del equipo de veterinarios. Esta investigación fue financiada por becas de investigación de los Institutos Nacionales de Salud (R01 HL-75774, R01 CA098303, R21 HL085743, 1K12 HL087746), el tabaco de California las enfermedades relacionadas con el Programa de Investigación de la Universidad de California (15IT-0257 y 0169-1514RT) , y el Instituto de Medicina Regenerativa de California (RS1-00183).
NH es apoyado por una beca de la Asociación Americana del Corazón. puede Heart Association.
Materiales
| Name | Company | Catalog Number | Comments | |
| Surgical tools | Tool | Fine Science Tools | ||
| Syringe needle | Tool | BD Biosciences | 28G insulin syringe is preferred | |
| Phosphate Buffered Saline | Reagent | Invitrogen | ||
| D-luciferin | Reagent | Biosynth International, Inc | Prepare D-luciferin in advance into filtered stock solutions of 15 mg/mL in PBS | |
| IVIS 200 Bioluminescence imaging system and acquisition software | Equipment |  Xenogen Corporation Xenogen Corporation |
Referencias
- Niiyama, H., Huang, N. F., Rollins, M., Cooke, J. P. Murine model of hindlimb ischemia. JoVE. , (2008).
- Levenberg, S., Golub, J. S., Amit, M., Itsakovitz-Eldor, J., Langer, R. Endothelial cells derived from human embryonic stem cells. Proc. Natl. Acad. Sci. U.S.A. 99, 4391-4396 (2002).
- Yamashita, J., Itoh, H., Hirashima, M., Ogawa, M., Nishikawa, S., Yurugi, T., Naito, M., Nakao, K., Nishikawa, S. Flk1-positive cells derived from embryonic stem cells serve as vascular progenitors. Nature. 408, 926-926 (2000).
- De, A., Yaghoubi, S. S., Gambhir, S. S. Applications of lentiviral vectors in noninvasive molecular imaging. Methods Mol Biol. 433, 177-202 (2008).
- Niiyama, H., Kai, H., Yamamoto, T., Shimada, T., Sasaki, K., Murohara, T., Egashira, K., Imaizumi, T. Roles of endogenous monocyte chemoattractant protein-1 in ischemia-induced neovascularization. J. Am. Coll. Cardiol. 44, 661-666 (2004).
- Cook, M. J. The anatomy of the laboratory mouse. , (1976).
- Contag, P. R., Olomu, I. N., Stevenson, D. K., Contag, C. H. Bioluminescent indicators in living mammals. Nature Med. 4, 245-247 (1998).
- Ray, P., De, A., Min, J. J., Tsien, R. Y., Gambhir, S. S. Imaging tri-fusion multimodality reporter gene expression in living subjects. Cancer Res. 64, 1323-1330 (2004).
- Huang, N. F., Lee, R. J., Li, S. Chemical and physical regulation of stem cells and progenitor cells: potential for cardiovascular tissue engineering. Tissue Eng. 13, 1809-1823 (2007).
- Cao, F., Lin, S., Xie, X., Ray, P., Patel, M., Zhang, X., Drukker, M., Dylla, S. J., Connolly, A. J., Chen, X., Weissman, I. L., Gambhir, S. S., Wu, J. C. In vivo visualization of embryonic stem cell survival, proliferation, and migration after cardiac delivery. Circulation. 113, 1005-1114 (2006).
- Wilson, K., Yu, J., Lee, A., Wu, J. C. In vitro and in vivo bioluminescence reporter gene imaging of human embryonic stem cells. J Vis Exp. , (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados