A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
עובריים, נגזר גזע לתאי אנדותל לטיפול איסכמיה Hindlimb
In This Article
Summary
הליך כירורגי עבור משלוח של תא גזע עובריים שמקורם בתאי האנדותל כדי hindlimb איסכמי הוא הוכיח, עם מעקב פולשני על ידי הדמיה פליטת אור.
Abstract
עורקים היקפית (PAD) המחלה נובעת היצרות של העורקים ההיקפיים המספקים דם מחומצן וחומרים מזינים ברגליים ובכפות הרגליים, פתולוגיה זו גורמת לתופעות כגון צליעה לסירוגין (כאב בהליכה), כיבים כואבים איסכמי, או אפילו איבר סכנת נמק. מקובל לחשוב כי האנדותל של כלי הדם, monolayer של בתאי האנדותל המשקיעה את פני השטח luminal של כל כלי הדם הלימפה, משחקת תפקיד דומיננטי הומאוסטזיס של כלי הדם ואת התחדשות כלי הדם. כתוצאה מכך, גזע מבוססי תאים התחדשות של האנדותל עשויה להיות גישה מבטיחה לטיפול PAD.
בסרטון הזה, אנחנו מדגימים את השתלת תא גזע עובריים (ESC), שמקורם בתאי האנדותל לטיפול איסכמיה hindimb חד צדדית כמודל של PAD, ואחריו מעקב פולשני של התא הישרדות ביות ועל ידי הדמיה פליטת אור. החומרים הספציפיים ונהלים למסירה תא הדמיה יתוארו. פרוטוקול זה עוקב אחר פרסום בתיאור אינדוקציה של איסכמיה hindlimb ידי Niiyama ואח' 1.
Protocol
1. דיפרנציאציה של ESCs Murine לתאי אנדותל
- פרוטוקול עבור המבדילים ESCs לתאי אנדותל מתואר במקומות אחרים ולא מוקד בפרוטוקול זה 2,3. בקצרה, התאים מותר להבדיל, ואת התאים חיובית עבור סמנים האנדותל כגון CD31 או cadherin אנדותל כלי הדם (VE-cadherin) הם מטוהרים מכן על ידי מיון הקרינה התא הפעיל (FACS).
2. בנייה של ג'ין כתב פעמיים היתוך ו transduction lentiviral
- פליטת אור ניתן להשתמש כדי לעקוב אחר התאים שונה כדי להביע את הגנים הכתב כמו גחלילית בלוציפראז (fluc). עבור יישום זה, התאים שלנו מכילים הקרינה הן fluc משופרת ירוק חלבון (eGFP) גן היתוך בשליטת היזם היוביקוויטין פנימי. כדי לשנות את התאים, את וקטור lentiviral transgene המכיל אלמנטים גנטיים מפתח מותאם למלא ביו בטיחות קריטריונים, כמו גם יעילות מוגברת התמרה, pFU-FG וקטור שפותחה במעבדה שלנו נושאת את fluc-eGFP כתב הגן היתוך ניתן להשתמש ביציבות transduce בתאים לאחר התמיינות. זה מאפשר לבנות היתוך הן פליטת אור ומעקב הקרינה של התאים המושתלים. ההליך להפקת חלקיקי נגיף, התמרה הייצור של תאים שכותרתו כי הגנים להביע כתב מתואר במקומות אחרים 4.
3. השתלה של ESC שמקורם בתאי האנדותל כדי hindlimb איסכמי
- בגין ההליך על ידי הכנת עכבר שעבר איסכמיה hindlimb עבור השתלת תאים. כדי לעשות זאת, במקום את העכבר לתוך תא הרדמה אינדוקציה המכיל 1-3% isoflurane ב 100% חמצן בקצב זרימה של 1L/min.
- השאירו את העכבר בתא אינדוקציה עד שהוא לא מגיב לגירויים חיצוניים. ואז להסיר את החיה מבית הבליעה אינדוקציה.
- ואז, במקום חיה במצב פרקדן על שולחן הניתוחים ולחבר אותו זרם מתמשך של 1-3% isoflurane ב 100% חמצן בקצב זרימה של 1L/min.
- נגבו את עור hindlimb עם שלושה עלובי לסירוגין בבטאדין ואלכוהול.
- לאחר ניקוי העור, להשיג 1,000,000 ESC שמקורם בתאי האנדותל ב 30 μL של פוספט בופר סליין (PBS). טען תאים אלה לתוך מחט מד 28.
- כאשר תאים מוכנים, בעדינות להרים להאריך את hindlimb כדי להמחיש טוב יותר את המיקום של שריר הגסטרוקנמיוס. בעוד רגל מוארך, הכנס את המחט דרך העור לתוך השריר הבסיסית. הקפד לא הגישה את העצם. בעדינות ולאט לאט להזריק את התערובת 30 תא μL לתוך הגסטרוקנמיוס. עבור זריקה תוך שרירית, 30 μL הוא קרוב לגבול של נפח כי ניתן להזריק. לכן, 28-מד אינסולין מזרקים הם העדיפו, משום שעל פי הניסיון שלנו, הם לחסל את נפח הפסד מחטים המזרק.
- לאחר הזרקת תושלם, להחזיר את העכבר לכלוב התאוששות ולנטר אותה ברציפות עד ערה. אפשר החיה להתאושש במשך מספר שעות ולאחר מכן להמשיך עם פליטת אור בתחום ההדמיה vivo של התאים המושתלים.
4. פליטת אור הדמיה של ESC שמקורם בתאי האנדותל in vivo
- המושתלים ESC-derived תאים endothelials שונו כדי להביע גם את fluc ואת הגן היתוך eGFP בשליטת היזם היוביקוויטין פנימי. לכן, פליטת אור ניתן להשתמש כדי לעקוב אחר תאים בתוך hindlimb איסכמי.
- כדי להתחיל את הצעד הזה, להפעיל את מערכת פליטת אור הדמיה תמונה Living תוכנה הרכישה. לאחר מכן לאתחל את מערכת הרכישה לציין את הממדים של שדה הראייה.
- בשלב הבא, שחור על גבי נייר מט מקום בתיבה הדמיה לספוג פליטת רקע.
- לאחר בתיבת הדמיה מוכן, במקום את העכבר לתוך תא הרדמה אינדוקציה המכיל 1-3% חמצן isoflurane במוצא של 1L/min. השאירו את העכבר בתא אינדוקציה עד שהוא לא מגיב לגירויים חיצוניים. ואז להסיר את החיה מבית הבליעה אינדוקציה.
- הסרת שיער משני hindlimbs באמצעות מכונת גילוח חשמלית לפי הצורך.
- הזרק 10 μL של D-luciferin לגרם משקל גוף לתוך הצפק. D-luciferin מוכנה מראש לתוך פתרונות מניות מסונן של 15 מ"ג / מ"ל PBS.
- לאחר luciferin מוזרק, במקום חיה לתוך תיבת הדמיה על הנייר שחור במצב שכיבה, קשור זרימה רציפה של isoflurane.
- הצבת חיה לתוך תיבת הדמיה חיבור isoflurane.
- התחל לרכוש תמונות 10-60 שניות על מנת לקבוע זמן החשיפה האופטימלית עבורו את התמונה לא רווי. אם התמונה הופכת להיות רווי, לצמצם את זמן החשיפה. אם אות פליטת אור חלש מאוד, להגדיל את זמן החשיפה.
- מנצליםg את זמן החשיפה האופטימלית, המשך רכישת תמונות כל 1-3 דקות עד האות מגיע לכל היותר, ואז נמוג. כאשר הרכישה הושלמה, לשמור את הקובץ.
- כדי לנתח את הנתונים, בחר אזורים של עניין (ROIs) שמכסים את ההזרקה. כביקורת שלילית, ההחזר על ההשקעה דומה ניתן לבחור עבור הרגל לא פעל. שימוש בתוכנה, למדוד את הקרינה הכוללת, אשר מבוטא ביחידות של פוטונים / שניות / 2 ס"מ / steradian (P / S / cm 2 / sr), עבור ROIs עבור כל timepoint. הערך המקסימלי אמור לשמש את הנתונים הסופיים. הנתונים יכולים גם להיות מיוצא אקסל לשימוש עתידי.
- ברגע שכל הנתונים רכשה, להחזיר את בעל החיים לכלוב התאוששות ולנטר באופן רציף עד מתעורר בעלי חיים.
- חזור על נוהל זה כדי לעקוב אחר תאים לאורך זמן.
- בשלב הזמן הרצוי, החיה יכולה להיות מורדמים להערכת תפקוד הרקמה.
5. נציג תוצאות
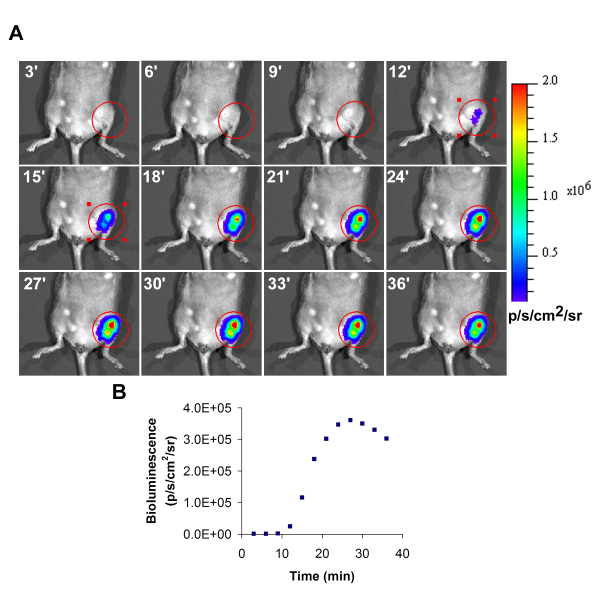
פליטת אור נציג תמונה של התאים המושתלים בתוך hindlimb איסכמי שמאל מוצג באיור 1. במהלך רכישה של פליטת אור, עוצמת יגדל עם הזמן, ואת הערך המקסימלי שהושג במהלך הזמן צריך להיות כפי שדווח הערך הסופי.
Discussion
ESCs הם מקור התא מבטיח לטיפול איסכמיה רקמות בגלל הפלסטיות של בידול שלהם ויכולתם להצמיח שושלות תאים הכולל את כל שלוש שכבות נבט, כולל בתאי האנדותל. כדי להתגבר על חששות אתיים הקשורים ESCs, הנגרם לתאי גזע pluripotent (iPSCs) עשוי להיות חלופה pluripotent בתאי גזע ממקור זה מתגבר על שיקולים אתיים. מלבד ESCs...
Acknowledgements
המחברים מודים אנדריאה Axtell, סטושי Itoh, MD, ג'ף Velotta, MD, גרנט הויט, רוברט ג רובינס, MD, יו ג'ין, MD, טים דויל, PhD, והדמיה הקטן סטנפורד בעלי חיים Core לקבלת סיוע טכני. המחברים גם להודות AM ביקפורדס, Inc התמיכה של ציוד וטרינרי. מחקר זה נתמך על ידי מענקי מחקר מן המכון הלאומי לבריאות (HL-75774 R01, R01 CA098303, R21 HL085743, 1K12 HL087746), טבק קשורות קליפורניה מחלות תוכנית המחקר של אוניברסיטת קליפורניה (15IT-0257 ו-1514RT 0169) , ומכון קליפורניה עבור הרגנרציה לרפואה (RS1-00183).
NH נתמך על ידי מענק של איגוד הלב האמריקני. איגוד הלב יכול.
Materials
| Name | Company | Catalog Number | Comments | |
| Surgical tools | Tool | Fine Science Tools | ||
| Syringe needle | Tool | BD Biosciences | 28G insulin syringe is preferred | |
| Phosphate Buffered Saline | Reagent | Invitrogen | ||
| D-luciferin | Reagent | Biosynth International, Inc | Prepare D-luciferin in advance into filtered stock solutions of 15 mg/mL in PBS | |
| IVIS 200 Bioluminescence imaging system and acquisition software | Equipment |  Xenogen Corporation Xenogen Corporation |
References
- Niiyama, H., Huang, N. F., Rollins, M., Cooke, J. P. Murine model of hindlimb ischemia. JoVE. , (2008).
- Levenberg, S., Golub, J. S., Amit, M., Itsakovitz-Eldor, J., Langer, R. Endothelial cells derived from human embryonic stem cells. Proc. Natl. Acad. Sci. U.S.A. 99, 4391-4396 (2002).
- Yamashita, J., Itoh, H., Hirashima, M., Ogawa, M., Nishikawa, S., Yurugi, T., Naito, M., Nakao, K., Nishikawa, S. Flk1-positive cells derived from embryonic stem cells serve as vascular progenitors. Nature. 408, 926-926 (2000).
- De, A., Yaghoubi, S. S., Gambhir, S. S. Applications of lentiviral vectors in noninvasive molecular imaging. Methods Mol Biol. 433, 177-202 (2008).
- Niiyama, H., Kai, H., Yamamoto, T., Shimada, T., Sasaki, K., Murohara, T., Egashira, K., Imaizumi, T. Roles of endogenous monocyte chemoattractant protein-1 in ischemia-induced neovascularization. J. Am. Coll. Cardiol. 44, 661-666 (2004).
- Cook, M. J. The anatomy of the laboratory mouse. , (1976).
- Contag, P. R., Olomu, I. N., Stevenson, D. K., Contag, C. H. Bioluminescent indicators in living mammals. Nature Med. 4, 245-247 (1998).
- Ray, P., De, A., Min, J. J., Tsien, R. Y., Gambhir, S. S. Imaging tri-fusion multimodality reporter gene expression in living subjects. Cancer Res. 64, 1323-1330 (2004).
- Huang, N. F., Lee, R. J., Li, S. Chemical and physical regulation of stem cells and progenitor cells: potential for cardiovascular tissue engineering. Tissue Eng. 13, 1809-1823 (2007).
- Cao, F., Lin, S., Xie, X., Ray, P., Patel, M., Zhang, X., Drukker, M., Dylla, S. J., Connolly, A. J., Chen, X., Weissman, I. L., Gambhir, S. S., Wu, J. C. In vivo visualization of embryonic stem cell survival, proliferation, and migration after cardiac delivery. Circulation. 113, 1005-1114 (2006).
- Wilson, K., Yu, J., Lee, A., Wu, J. C. In vitro and in vivo bioluminescence reporter gene imaging of human embryonic stem cells. J Vis Exp. , (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved