Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Electrospinning andamios fibroso polímero para ingeniería de tejidos y cultivos celulares
En este artículo
Resumen
El proceso de electrospinning polímeros de ingeniería de tejidos y cultivos celulares se trata en este artículo. En concreto, el electrospinning de macrómeros fotorreactivos con capacidades de procesamiento adicional de photopatterning y electrospinning multi-polímero se describe.
Resumen
Como el campo de la ingeniería de tejidos evoluciona, hay una enorme demanda para producir materiales más adecuados y las técnicas de procesamiento con el fin de atender las necesidades (por ejemplo, la mecánica y la vascularización) de los órganos más complejos y los tejidos. Electrospinning es una técnica popular para crear andamios fibroso que imitan la arquitectura y la escala de tamaño de la matriz extracelular nativa. Estos andamios fibra también son útiles como sustratos de cultivo celular ya que las fibras se pueden utilizar para dirigir el comportamiento celular, incluyendo la diferenciación de células madre (ver comentarios extensos por Mauck
Protocolo
A. único polímero electrospinning
- Antes de preparar la solución de electrospinning, hacer una solución de peso de 0,5% del fotoiniciador, Irgacure 2959 (I2959), en agua destilada por la disolución a 37 ° C durante varios días. Este paso no es necesario si un polímero fotorreactivos no se está utilizando.
- Combinar el ácido hialurónico methacrylated (MEHA, ver Burdick et al. Para la síntesis), el poli (óxido de etileno) (PEO, 900 kDa), y I2959 en agua destilada para preparar una solución con una concentración final de 2% en peso MEHA, 3% en peso PEO, y 0,05% en peso I2959. Use un remolino para mezclar la solución hasta que esté claro. El tipo de polímero y concentración, así como el solvente usado puede ser modificada en este paso en función de las propiedades deseadas del andamio.
- La transferencia de la solución en una jeringa y fijar un calibre 18, 6 pulgadas de largo, aguja de punta roma hasta el final.
- Programa de una jeringa de la bomba para expulsar a una tasa de 1,2 ml / hr. Inserte la jeringa y la aguja en el dispositivo.
- Conecte el cable a tierra de una fuente de alimentación de alta tensión al aparato de colección. Para recoger al azar las fibras distribuidas utilizan una placa de metal, o el uso de un mandril que gira a unos 10 m / s para recoger las fibras alineadas. Conecte el cable de carga positiva a la aguja. En la figura 1 una representación esquemática del aparato de electrospinning.
- Ajuste la aguja o dispositivo de recogida, de tal manera que hay una distancia de 15 cm entre los dos.
- Iniciar el flujo de la bomba de jeringa. Cuando el líquido se visualiza en la punta de la aguja, a su vez la fuente de alimentación y ajustar la tensión de 22 kV.
- Después de la colección es completa (a partir de varios minutos de películas delgadas, de hasta 24 horas por una alfombra gruesa), retire el andamio desde el aparato de recogida y almacenarlo bajo vacío durante la noche para asegurar la eliminación completa del disolvente.
- Visualizar la morfología de las fibras mediante microscopía electrónica de barrido (SEM), representante de un andamio se muestra en la Figura 1, tanto para las estructuras alineados y no alineados.
Nota: La tasa de flujo de la muestra, la distancia al dispositivo de recolección, y la tensión dependen de la combinación de polímero y solvente, y debe ser optimizado para cada sistema, por lo general mediante la observación de la morfología del andamio con SEM.
B. Photocrosslinking y Photopatterning
- Cortar las muestras de 5mm x 5mm de la estera del andamio.
- Preparar para la reticulación mediante la colocación de cada andamio en una lámina portaobjetos de vidrio cubierta, la colocación de la fotomáscara directamente en el andamio, que cubre con un portaobjetos de vidrio limpio y el recorte de los dos extremos con clips de la carpeta. Nota: cuatro muestras se puede hacer a la vez, y una transparencia sin un patrón se puede utilizar para la reticulación, si un patrón no deseado.
- Purga andamio instalado en una cámara de nitrógeno. Es importante mantener la construcción libre de oxígeno, que puede inhibir la reticulación.
- Lugar de instalación de andamios en la cámara de nitrógeno a ~ 10 mW / cm 2 de luz de 365 nm con un adaptador de colimación durante 5 minutos. Vea el esquema de la Figura 2.
- Retire cada andamio y colocar en una placa de 12 también.
- Añadir 2 ml de agua destilada en cada pozo, la placa de parafina para evitar la evaporación del agua y el lugar a 37 ° C durante 24 horas. Cambiar el agua tres veces.
- Visualizar la formación de poros bajo microscopio de luz (ver ejemplo en Figura 2). Los andamios ya están listos para su uso.
Nota: Photocrosslinking no es necesario para muchos tipos de polímeros, sin embargo photopatterning sólo se puede utilizar con polímeros fotorreactivos.
C. Doble polímero fluorescente electrospinning con la visualización de fibra
- Prepare una solución al 5% en peso de PEO (200 kDa) en el 90% de etanol. Revuelva a 700 rpm a 50 ° C durante al menos 2 horas antes de electrospinning.
- Transferir la solución a una jeringa de OPE y añadir DAPI para una concentración final de 10 mg / mL de concentración en la solución de electrospinning. Envuelva la jeringa en papel de aluminio para protegerlo de la luz.
- Preparar la misma solución que se describe en el paso A2, con la excepción también se suman methacryloxyethyl tiocarbamoil rodamina B (MeRho, 683,24 g / mol) para una concentración final de 25 mM en la solución de electrospinning. Envuelva la jeringa en papel de aluminio para protegerlo de la luz.
- Cuidadosamente el uso de cinta adhesiva para asegurar methacrylated cubreobjetos de vidrio (véase Khademhosseini et al.) A la superficie del mandril. Nota: las fibras se convertirá atados a cubreobjetos de vidrio methacrylated.
- Conecte un extremo de una pieza de 5 mm de longitud de tubo de silicona con archivos adjuntos Luer a una de las jeringas y conecte el otro extremo a una aguja. Inserte la jeringa en la bomba de jeringa y poner la aguja a través del agujero en el agricultor. Repita con la otra jeringa y agricultor en el lado opuesto del mandril. Los agricultores traducir el length del mandril y se utilizan para garantizar una distribución equitativa de los polímeros en los que resulta andamio. Vea el esquema de la Figura 3.
- Ajustar los parámetros descritos en la sección A apropiadamente de acuerdo a la Tabla 1. Asegúrese de que las puntas de aguja se centran en el mandril.
Tabla 1. Doble polímero electrospinning Parámetros
Jeringa Agricultor a punta de la aguja (cm) Punta de la aguja de Mandril (cm) Flujo (ml / h) Aplica tensión (kV) MEHA 6 15 1.2 22 OPE 6 10 1.2 15 - Una vez que todo esté alineado correctamente, apague las luces y encender el mandril y las bombas de jeringa. Retire el papel aluminio de las jeringas. Cuando el líquido es visible en las puntas de ambas agujas, simultáneamente a su vez en las fuentes de alimentación y conecte el los agricultores.
- Cuando la colección está completa, apagar la fuente de alimentación y el mandril y desenchufe el los agricultores. Retire con cuidado el cubreobjetos y la cinta con una cuchilla de afeitar.
- Visualizar las fibras utilizando un microscopio de fluorescencia equipado con filtros de rodamina y DAPI. Véase el ejemplo en la figura 3. Nota: las fibras fluorescentes son más claros a la vista cuando electrospun por períodos cortos de tiempo (<3 minutos), sin embargo, este proceso puede ser prorrogado por una cantidad ilimitada de tiempo a fin de crear más gruesas las construcciones, especialmente sin el uso de la cubreobjetos de vidrio .
D. Las células de siembra en los andamiajes
- Coloque cada cubreobjetos con electrospun polímero unido a un individuo así de una placa y de tamaño adecuado. Nota: las interacciones celulares con las fibras son fácilmente visibles por electrospinning en cubreobjetos de vidrio methacrylated. Además, MeRho nuevo se puede utilizar para la visualización de la fibra.
- Incubar los andamios en PBS durante la noche para asegurar la completa eliminación de solventes y cualquier lixiviable posibles subproductos.
- Retire la PBS de los pozos.
- Para esterilizar los andamios, los coloca bajo una lámpara germicida en una campana de flujo laminar durante 30 minutos. Si una completa estructura es ser cabeza de serie, dar la vuelta al cadalso y colóquelo debajo de una lámpara germicida por otros 30 minutos.
- Realizar el cultivo celular estándar y preparar una suspensión celular se concentró en la densidad celular deseada (por ejemplo, 6.000 células cm -2). Por ejemplo, utilizar una de 100 ml de suspensión celular de una de 22 mm X 22 mm cubreobjetos. Lugar en la incubadora durante 1 hora.
- Añadir la cantidad apropiada de medios de cultivo celular a cada pocillo. Coloque los andamios de nuevo en la incubadora.
- Tinción de las células utilizando un kit disponible comercialmente Live / Dead. Nota: otros tipos de tinción de células, como DAPI (núcleos de las células) y la etiqueta fluorescente phalloidin (fibras de actina estrés) puede ser aplicado para visualizar las células.
- Visualizar las células y las fibras utilizando un microscopio de fluorescencia equipado con filtros para FITC y TRITC. Véase el ejemplo en la Figura 4.
Los resultados representativos:
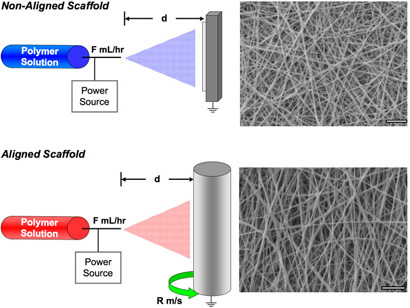
Figura 1. Esquema que ilustra la instalación de dispositivos para los países no alineados formación de andamios (arriba) y se alinea la formación de andamios (abajo). Ejemplo de digitalización de imágenes de microscopía electrónica de cada tipo de andamio se muestran. Barra de escala = 5μm. Por favor, haga clic aquí para ver una versión ampliada de la figura 1.
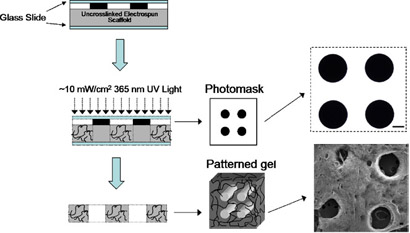
Figura 2. Esquema del método de los patrones. Patrones se forman mediante la colocación de una fotomáscara entre la fuente de luz y andamio durante photocrosslinking y luego lavando polímero sin reaccionar. Fotomáscara SEM y la imagen de los andamios después de la formación de poros y la liofilización. Barra de escala = 100 micras. Por favor, haga clic aquí para ver una versión ampliada de la figura 2.

Figura 3 Esquema de la configuración multi-polímero electrospinning y los parámetros necesarios de procesamiento, así como una imagen representativa de fluorescencia de una mezcla de dos poblaciones de fibra (por ejemplo: rojo MEHA y PEO azul). Que eran al mismo tiempo electrospun para formar un andamio de varios polímeros . Barra de escala = 100 micras. Por favor, haga clic aquí para veruna versión más grande de la figura 3.
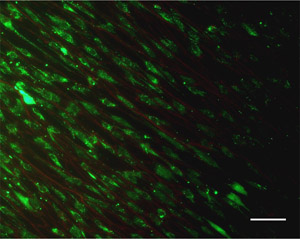
Figura 4. Un ejemplo Live / Dead tinción imagen de células madre mesenquimales humanas y sus interacciones con las fibras electrospun. Barra de escala = 100 micras. Por favor, haga clic aquí para ver una versión ampliada de la figura 4.
Discusión
Electrospinning se utilizó para preparar los andamios fibra a partir de polímeros. Photocrosslinkable andamios a base de ácido hialurónico se utiliza como un ejemplo ilustrativo, donde se requiere exposición a la luz para la reticulación. Con el uso de macrómeros reactivos, como MEHA, los canales que previamente han demostrado una mayor distribución de celulares fueron incorporados en los andamios, con el uso de una máscara durante photocrosslinking para formar andamios de macro y micro poroso. Por otra parte, ...
Agradecimientos
Este trabajo fue apoyado por la American Heart Asociación de becas predoctorales para JLI y los Institutos Nacionales de Salud de subvención R01AR056624.
Materiales
| Name | Company | Catalog Number | Comments | |
| DAPI | Reagent | Invitrogen | D1306 | |
| I2959 | Reagent | Ciba Specialty Chemicals | ||
| PEO 200 kDa | Polysciences, Inc. | 17503 | ||
| PEO 900 kDa | Reagent | Sigma-Aldrich | 189456 | |
| Methacryloxethyl thiocarbamoyl rhodamine B | Reagent | Polysciences, Inc. | 23591-100 | Prepare stock solution in DMSO |
| Live/Dead Stain Kit | Reagent | Invitrogen | L3224 | Contains Calcein (stains live cells green) and ethidium homodime (stains red dead cells) |
| Syringe Pump | Equipment | KD Scientific | KDS100 | Two are needed for dual polymer spinning |
| Power Source | Equipment | Gamma High Voltage | ES30P-5W | Two are needed for dual polymer spinning |
| Motor | Equipment | Triem Electric Motors, Inc | 0132022-15 | Must attach to a custom built mandrel |
| Tachometer | Equipment | Network Tool Warehouse | ESI-330 | Use to monitor mandrel speed |
| Omnicure UV Spot Cure System with collimating adapter | Equipment | EXFO | S1000 | |
| Silicone Tubing | Equipment | McMaster-Carr | 51135K151 | |
| Luer Lock Female Adapter | Equipment | McMaster-Carr | 51525K293 | |
| Luer Lock Male Adapter | Equipment | McMaster-Carr | 51525K143 | |
| Needles | Equipment | Fisher Scientific | 14-825-16H | |
| Coverslips | Equipment | Corning | 2875-22 |
Referencias
- Burdick, J. A., Chung, C., Jia, X., Randolf, M. A., Langer, R. Controlled degradation and mechanical behavior of photopolymerized hyaluronic acid networks. Biomacromolecules. 6, 386-391 (2005).
- Baker, B. M., Gee, A. O., Metter, R. B., Nathan, A. S., Marklein, R. A., Burdick, J. A., Mauck, L. R. The potential to improve cell infiltration in composite fiber-aligned electrospun scaffolds by the selective removal of sacrificial fibers. Biomaterials. 29, 2348-2358 (2008).
- Ifkovits, J. L., Burdick, J. A. Review: Photopolymerizable and degradable biomaterials for tissue engineering applications. Tissue Engineering. 13, 2369-2385 (2007).
- Khademhosseini, A., Eng, G., Yeh, J., Fukuda, J., Blumling, J., Langer, R., Burdick, J. A. Micromolding of photocrosslinkable hyaluronic acid for cell encapsulation and entrapment. J. Biomed Mater Res A. 79A, 522-532 (2006).
- Mauck, R. L., Baker, B. M., Nerurkar, N. L., Burdick, J. A., Li, W. J., Tuan, R. S., Elliott, D. M., M, D. Engineering on the Straight and Narrow: The Mechanics of Nanofibrous Assemblies for Fiber-Reinforced Tissue Regeneration. Tissue Engineering B. 15, 171-193 (2009).
- Sill, T. J., Von Recum, H. a. v. o. n. Electrospinning: applications in drug delivery and tissue engineering. Biomaterials. 29, 1989-2006 (2008).
- Sundararaghavan, H. G., Metter, R. B., Burdick, J. A. Electrospun fibrous scaffolds with multi-scale and photopatterned porosity. , (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados