Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Электропрядения Волокнистые Строительные леса Полимер для тканевой инженерии и клеточной культуры
Резюме
Процесс электропрядения полимеров для тканевой инженерии и клеточной культуры рассматривается в данной статье. В частности, электропрядения из фотореакционноспособных macromers с дополнительными возможностями обработки photopatterning и мульти-полимерный электропрядения описано.
Аннотация
Как области тканевой инженерии развивается, есть огромный спрос, чтобы произвести больше подходящие материалы и методы обработки в целях удовлетворения требований (например, механиков и кровоснабжение) более сложные органы и ткани. Электропрядения является популярная техника для создания волокнистых строительные леса, которые имитируют архитектуру и размер масштаба родной внеклеточного матрикса. Эти волокнистые лесов могут быть также использованы в качестве субстратов культуре клеток с волокнами могут быть использованы для прямого сотовой поведения, включая дифференциацию стволовых клеток (см. обширные обзоры Mauck
протокол
А. Одноместный Полимерные электропрядения
- До подготовки электропрядения решение, сделать 0,5% решение фотоинициатора, Irgacure 2959 (I2959), в деионизированной водой, растворяя при температуре 37 ° С в течение нескольких дней. Этот шаг не является необходимым, если фотореакционноспособных полимер не используются.
- Комбинат methacrylated гиалуроновой кислоты (MeHA см. Бердик и соавт. Синтеза), поли (этилен оксид) (ПЭО, 900 кДа) и I2959 в деионизированной воды для приготовления раствора с конечной концентрации 2% по весу MeHA, 3% по весу ПЭО, и 0,05% I2959. Используйте вихрь смешивать раствор, пока не ясно. Типа полимера и концентрации, а также растворитель, используемый может быть изменена на этом этапе в зависимости от требуемых свойств лесов.
- Перенесите раствор в шприц и присоедините 18 калибра, 6 дюйма длиной, тупой конец стрелки до конца.
- Программа шприцевой насос, чтобы извлечь из расчета 1,2 мл / час. Вставьте шприц и иглу в устройстве.
- Прикрепить обоснованные примеру источник высокого напряжения в коллекцию аппарата. Для сбора случайным образом распределены волокна использовать металлическую пластину, или использовать оправки вращающихся на ~ 10 м / с для сбора выровнены волокон. Прикрепить положительно заряженные привести к игле. См. рисунок 1 для схема электропрядения аппарата.
- Отрегулируйте иглы или сбора устройства, например, что есть расстоянии 15 см между ними.
- Начало течения на шприцевой насос. Когда жидкость визуализируется на кончике иглы, включите источник питания и установить напряжение до 22 кВ.
- После завершения коллекции (от нескольких минут для тонких пленок, чтобы до 24 часов для толще циновка), снять строительные леса из коллекции аппарата и хранить его под вакууме в течение ночи, чтобы обеспечить полное удаление растворителя.
- Визуализация морфологии волокна с помощью сканирующей электронной микроскопии (SEM), представитель эшафот показано на Рисунке 1 как для выравнивания и неприсоединившихся структур.
Примечание: расход пробы, расстояние до коллекцию устройства, и напряжение в зависимости от полимера и растворителя комбинация и должна быть оптимизирована для каждой системы, как правило, путем наблюдения морфологии эшафот с SEM.
Б. Photocrosslinking и Photopatterning
- Вырежьте 5 мм х 5 мм образцы из мата эшафот.
- Подготовка для сшивания, помещая каждую эшафот на фольги, покрытой стекло, размещение фотошаблон непосредственно на эшафот, покрывая чистую предметное стекло и обрезки обоих концах зажимы. Примечание: четыре образца может быть сделано сразу, и прозрачности без шаблон может использоваться для сшивания, если шаблон не желательно.
- Чистки эшафот создана в азоте камеры. Важно сохранить построить свободный от кислорода, который может подавлять сшивания.
- Место установки лесов азотом камере под ~ 10 мВт / см 2 365 нм свет с коллимирующей адаптер на 5 минут. См. схему на рисунке 2.
- Удалите каждую эшафот и место в 12-луночного планшета.
- Добавьте 2 мл деионизованной воды в каждую лунку, парафильмом пластина для предотвращения испарения воды и место при 37 ° С в течение 24 часов. Меняйте воду в три раза.
- Визуализируйте порообразования под световым микроскопом (см. пример на рисунке 2). Строительные леса в настоящее время готова к использованию.
Примечание: Photocrosslinking не является необходимым для многих типов полимеров, однако photopatterning могут быть использованы только с фотореакционноспособных полимеров.
C. Двойная Полимерные электропрядения с Флуоресцентный волоконно Визуализация
- Подготовка 5 мас% раствор ПЭО (200 кДа) в 90% этанола. Движение при 700 оборотов в минуту при 50 ° С в течение по крайней мере за 2 часа до электропрядения.
- Перенесите раствор ПЭО в шприц и добавить DAPI для конечной концентрации 10 мг / мл в концентрации электропрядения решение. Оберните шприц в алюминиевой фольгой для защиты от света.
- Подготовка же решение описано в шаге А2, за исключением также добавить methacryloxyethyl тиокарбамоил родамина B (MeRho, 683,24 г / моль) для конечной концентрации 25 мкМ в электропрядения решение. Оберните шприц в алюминиевой фольгой для защиты от света.
- Осторожно использовать скотч для обеспечения methacrylated покровные стекла (см. Khademhosseini и др.). К поверхности оправки. Примечание: волокна станут привязанным к methacrylated покровные стекла.
- Подключите один конец 5 мм длинный кусок силиконовой трубки с вложениями Luer Lock с одним из шприца и прикрепите другой конец иглы. Вставьте шприц в шприцевой насос и поставить иглу через отверстие в веялка. Повторите с другой шприц и веялка на противоположной сайт оправки. Fanners переводить лength из оправки и используются для обеспечения равномерного распределения и полимеров в результате эшафот. См. схему на рисунке 3.
- Настройте параметры, описанные в разделе надлежащим в соответствии с таблицей 1. Убедитесь, что игла советы сосредоточены на оправку.
Таблица 1. Двойной Полимерные электропрядения ПараметрыШприц Fanner на кончике иглы (см) Иглы для оправки (см) Скорость потока (мл / ч) Приложенного напряжения (кВ) MeHA 6 15 1,2 +22 ПЭО 6 10 1,2 +15 - Как только все будет выровнен должным образом, выключить свет и включить оправки и шприцевые насосы. Удалить из алюминиевой фольги от шприцев. Когда жидкость видна на кончиках игл и, одновременно включить блоки питания и подключить fanners.
- Когда сбор завершится, выключите источники питания и оправки и отключите fanners. Осторожно удалите покровные и ленту с помощью лезвия бритвы.
- Визуализируйте волокон с использованием флуоресцентного микроскопа оснащен фильтрами для родамин и DAPI. См. пример на рисунке 3. Примечание: Флуоресцентный волокна наиболее четко, чтобы посмотреть, когда electrospun в течение коротких периодов времени (<3 минут), однако этот процесс может быть продлен на неограниченное количество времени, чтобы создать толще конструкции, особенно без использования стекла покровные .
Д. Посев Ячейки Строительные леса
- Место каждого покровное с electrospun полимеров прилагаются в отдельных скважин из соответствующего размера и пластины. Примечание: межклеточных взаимодействий с волокнами хорошо видны на электропрядения на methacrylated покровные стекла. Кроме того, MeRho можно снова использовать для волоконно-визуализации.
- Инкубируйте лесов в ФБР всю ночь, чтобы обеспечить полное удаление растворителя и любые возможные выщелачиванию побочных продуктов.
- Удалить PBS из скважин.
- Для стерилизации леса, поставить их под бактерицидной лампой в ламинарном потоке на 30 минут. Если полный эшафот в настоящее время отобранный, флип эшафот снова и место под бактерицидной лампой в течение еще 30 минут.
- Выполните стандартных клеточных культур и подготовить концентрированный суспензии клеток в нужную ячейку плотности (например, 6000 клетки см -2). Например, можно использовать 100 мл клеточной суспензии для 22 мм Х 22 мм покровным. Место в инкубаторе в течение 1 часа.
- Добавить необходимое количество средств массовой информации культуре клеток в каждую лунку. Место леса обратно в инкубатор.
- Пятно клеток с использованием коммерчески доступных Live / Мертвые комплект. Примечание: другие типы клеток, окрашивание, например, DAPI (клеточных ядер) и флуоресцентно меченных фаллоидином (волокна актина стресс) может быть применена для визуализации клеток.
- Визуализация клеток и волокон с использованием флуоресцентного микроскопа оснащен фильтрами для TRITC и FITC. См. пример на рисунке 4.
Представитель Результаты:
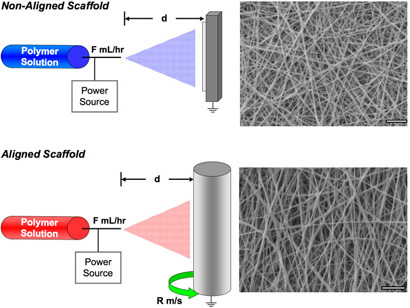
Рисунок 1. Схема иллюстрирующая устройство установки для неприсоединившихся эшафот образования (вверху) и приведены в соответствие эшафот образование (внизу). Пример растровой электронной микроскопии изображений каждого типа леса представлены. Шкала бар = 5 мкм. Пожалуйста, нажмите здесь , чтобы видеть большую версию рисунке 1.
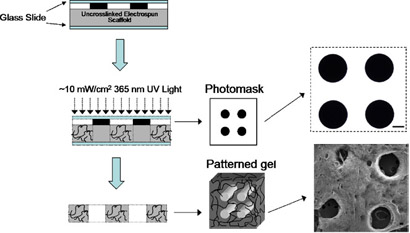
Рисунок 2. Схема структурирования метод. Шаблоны формируются путем размещения фотошаблона между источником света и леса во время photocrosslinking а затем смывая непрореагировавшего полимера. Photomask и СЭМ изображения строительных лесов после образования пор и лиофилизации. Шкала бар = 100 мкм. Пожалуйста, нажмите здесь , чтобы видеть большую версию рисунке 2.

Рисунок 3 Схема мульти-полимерный электропрядения установки и необходимые параметры обработки, а также представитель флуоресцентное изображение смесь двух волокна групп населения (например: красный и синий MeHA ПЭО). Которые одновременно electrospun сформировать мульти-полимерные строительные леса . Шкала бар = 100 мкм. Пожалуйста, нажмите здесь , чтобы увидеть увеличенное versioп рисунке 3.
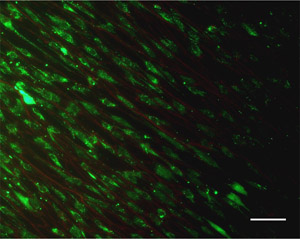
Рисунок 4. Пример Live / Мертвые окрашивания образ мезенхимальных стволовых клеток человека и их взаимодействия с electrospun волокон. Шкала бар = 100 мкм. Пожалуйста, нажмите здесь , чтобы видеть большую версию рисунке 4.
Обсуждение
Электропрядения был использован для подготовки волокнистых леса из полимеров. Photocrosslinkable лесов на основе гиалуроновой кислоты были использованы в качестве наглядного примера, где освещенность нужна для сшивания. С помощью реактивного macromers, таких как MeHA, каналы, которые ранее продемон...
Благодарности
Эта работа была поддержана американской ассоциации сердца Predoctoral стипендий для JLI и Национального института Хит грант R01AR056624.
Материалы
| Name | Company | Catalog Number | Comments | |
| DAPI | Reagent | Invitrogen | D1306 | |
| I2959 | Reagent | Ciba Specialty Chemicals | ||
| PEO 200 kDa | Polysciences, Inc. | 17503 | ||
| PEO 900 kDa | Reagent | Sigma-Aldrich | 189456 | |
| Methacryloxethyl thiocarbamoyl rhodamine B | Reagent | Polysciences, Inc. | 23591-100 | Prepare stock solution in DMSO |
| Live/Dead Stain Kit | Reagent | Invitrogen | L3224 | Contains Calcein (stains live cells green) and ethidium homodime (stains red dead cells) |
| Syringe Pump | Equipment | KD Scientific | KDS100 | Two are needed for dual polymer spinning |
| Power Source | Equipment | Gamma High Voltage | ES30P-5W | Two are needed for dual polymer spinning |
| Motor | Equipment | Triem Electric Motors, Inc | 0132022-15 | Must attach to a custom built mandrel |
| Tachometer | Equipment | Network Tool Warehouse | ESI-330 | Use to monitor mandrel speed |
| Omnicure UV Spot Cure System with collimating adapter | Equipment | EXFO | S1000 | |
| Silicone Tubing | Equipment | McMaster-Carr | 51135K151 | |
| Luer Lock Female Adapter | Equipment | McMaster-Carr | 51525K293 | |
| Luer Lock Male Adapter | Equipment | McMaster-Carr | 51525K143 | |
| Needles | Equipment | Fisher Scientific | 14-825-16H | |
| Coverslips | Equipment | Corning | 2875-22 |
Ссылки
- Burdick, J. A., Chung, C., Jia, X., Randolf, M. A., Langer, R. Controlled degradation and mechanical behavior of photopolymerized hyaluronic acid networks. Biomacromolecules. 6, 386-391 (2005).
- Baker, B. M., Gee, A. O., Metter, R. B., Nathan, A. S., Marklein, R. A., Burdick, J. A., Mauck, L. R. The potential to improve cell infiltration in composite fiber-aligned electrospun scaffolds by the selective removal of sacrificial fibers. Biomaterials. 29, 2348-2358 (2008).
- Ifkovits, J. L., Burdick, J. A. Review: Photopolymerizable and degradable biomaterials for tissue engineering applications. Tissue Engineering. 13, 2369-2385 (2007).
- Khademhosseini, A., Eng, G., Yeh, J., Fukuda, J., Blumling, J., Langer, R., Burdick, J. A. Micromolding of photocrosslinkable hyaluronic acid for cell encapsulation and entrapment. J. Biomed Mater Res A. 79A, 522-532 (2006).
- Mauck, R. L., Baker, B. M., Nerurkar, N. L., Burdick, J. A., Li, W. J., Tuan, R. S., Elliott, D. M., M, D. Engineering on the Straight and Narrow: The Mechanics of Nanofibrous Assemblies for Fiber-Reinforced Tissue Regeneration. Tissue Engineering B. 15, 171-193 (2009).
- Sill, T. J., Von Recum, H. a. v. o. n. Electrospinning: applications in drug delivery and tissue engineering. Biomaterials. 29, 1989-2006 (2008).
- Sundararaghavan, H. G., Metter, R. B., Burdick, J. A. Electrospun fibrous scaffolds with multi-scale and photopatterned porosity. , (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены