Method Article
La disección de los órganos del pez cebra adultos
En este artículo
Resumen
Este protocolo describe un procedimiento para identificar y disecar los órganos de los adultos de pez cebra.
Resumen
En los últimos 20 años, el pez cebra se ha convertido en un organismo modelo de gran alcance para la comprensión del desarrollo de vertebrados y la enfermedad. Aunque el análisis experimental del embrión y la larva es muy amplia y la morfología ha sido bien documentada, las descripciones de la anatomía de adultos de pez cebra y los estudios de desarrollo de las estructuras y órganos adultos, junto con técnicas para trabajar con adultos que carecen. Los órganos de la larva de experimentar cambios significativos en su estructura general, la morfología y localización anatómica en la larva de la transición para adultos. Externamente, la larva transparente desarrolla su patrón característico de rayas pigmento y adultos emparejados aletas pélvicas, mientras que internamente, los órganos de someterse a un crecimiento masivo y remodelación. Además, la gónada bipotenciales primordio desarrolla en cualquiera de los testículos o los ovarios. Este protocolo se identifican muchos de los órganos del adulto y muestra los métodos para la disección del cerebro, las gónadas, el sistema gastrointestinal, el corazón y los riñones de los adultos de pez cebra. Los órganos diseccionados se pueden utilizar para la hibridación in situ, inmunohistoquímica, la histología, la extracción de ARN, el análisis de proteínas, y otras técnicas moleculares. Este protocolo ayudará en la ampliación de estudios en el pez cebra para incluir la remodelación de los órganos de las larvas, la morfogénesis de órganos específicos para las investigaciones de adultos y otros de los sistemas de órganos adultos.
Protocolo
- Un pez cebra macho se diseca primero, seguido por un pez hembra. Antes de comenzar la disección, anestesiar a un pez en un 0,2% tricaína y la eutanasia que mediante la incubación en agua helada durante 15 minutos.
- Comience suavemente acaricia el pescado seco en una toalla de papel y colocarlo sobre una alfombra de disección. Externamente, el pez cebra tiene una sola aleta dorsal, caudal y anal y emparejado aletas pectorales y pélvicas (Figura 1).
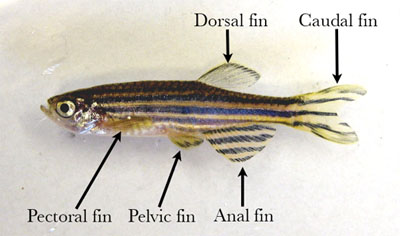
Figura 1. Peces adultos machos con aletas de la etiqueta. - Pin el pescado a la lona a través de la disección de la parte carnosa de la cola y la parte ventral de la órbita del ojo.
- Cortar la piel en el vientre del pez justo por delante de la aleta anal. Cortar la piel y el músculo subyacente a lo largo del vientre de la aleta anal a la opérculo (la cubierta dura más de las branquias) (Figura 2, paso 1).

Figura 2. Pasos en la eliminación de la piel y el músculo de la pared del cuerpo para exponer los órganos internos. - A continuación, retire el opérculo y la aleta pectoral, incluyendo la faja pectoral (la región de espesor, del hueso en la base de la aleta) (Figura 2, paso 2). Cortar la piel y el músculo subyacente principio por encima de la ahora expuesta posteriormente enmalle a lo largo del lado de los peces y, después, a la aleta anal (Figura 2, paso 3).
- Retire con cuidado la piel y el músculo subyacente desde el lado de los peces. Muchos de los órganos internos son visibles (Figura 3).
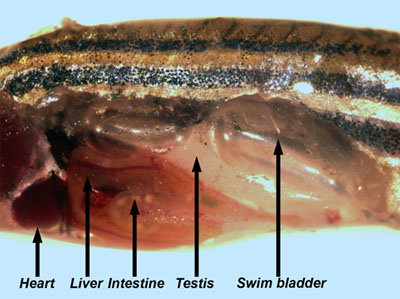
Figura 3. Peces adultos masculinos con la pared del cuerpo y los músculos eliminado permitiendo la visualización de los órganos internos. - Los testículos son largos, los órganos blanco, a la par que se fija a la pared dorsal del cuerpo. Quitar un testículo y colócalo en un plato de PBS. Examinar los testículos con la luz reflejada para visualizar los túbulos seminíferos (Figura 4), que contienen quistes en las diferentes fases de las células germinales en desarrollo de spermatagonia de espermátidas (Leal et al., 2009).
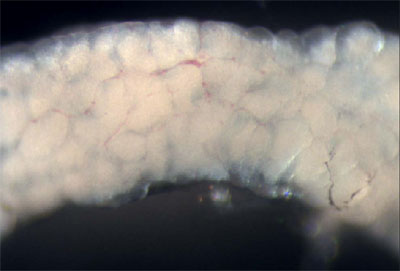
Figura 4. Disección de un testículo. Las estructuras redondeadas blancas son los túbulos seminíferos. - A continuación, retire el sistema gastrointestinal, desde la cavidad del cuerpo de los peces. El hígado puede ser identificado por su gran tamaño, la morfología lobulada, color tannish, y la vascularización extensa. La vesícula biliar, un saco verde transparente llena de líquido, y el bazo, de color rojo brillante, se encuentran dentro de las vísceras.
- Separar el intestino del resto de los órganos y se extienden hacia fuera. Las regiones anterior, media y posterior del intestino se definen por la altura de los pliegues epiteliales (Wallace et al., 2005).
- Coloque un pedazo de intestino en PBS y se observan los pliegues epiteliales con luz transmitida.
- A continuación, examinar la vejiga natatoria. La vejiga natatoria se compone de una cámara posterior, que se conecta al esófago a través del conducto neumático y una cámara anterior, que se conecta al oído interno a través del aparato de Weber (Finney et al., 2006).
- Retire y deseche la vejiga natatoria. Liberar a los peces y re-pin es la parte ventral hasta la disección del riñón, que se encuentra a lo largo de la pared dorsal del cuerpo. El riñón es una estructura transparente de color rosa asociado con la aorta dorsal y las células pigmentadas. El riñón se divide en regiones de la cabeza, cuerpo y cola (Figura 5). Diseccionar un pedazo de riñón y colocarlo en PBS. Separar el tejido del riñón para revelar los túbulos renales.
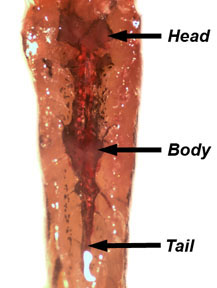
Figura 5. Ubicación de la cabeza, cuerpo y cola del riñón a lo largo de la pared dorsal del cuerpo. - Diseccionar un pez hembra. Como se describió anteriormente, la eutanasia a los peces de agua fría y seque antes de sujetándola a la lona de disección. Quitar la piel de la cara de los peces como se demostró anteriormente. El ovario es una estructura bilobulada que se suspende en la cavidad del cuerpo por un mesovario vascularizado.
- Extraer un lóbulo del ovario, lugar en PBS, y examinar con luz transmitida. Los ovocitos pueden ser objeto de burlas aparte utilizando agujas muy finas y por etapas (Figura 6, Selman et al., 1993). Ovocitos en estadio I es de aproximadamente 10 a 150 micras de tamaño y translúcido. Etapa II ovocitos son de 150 a 350 micras de tamaño y se define por la aparición de los gránulos corticales. Etapa III ovocitos son 350 a 750 micras de tamaño y son opacas, debido a la acumulación de yema de huevo. Ovocitos maduros etapa IV y V son translúcidos y, en general no se encuentran en los ovarios de las mujeres que recientemente han acoplado.
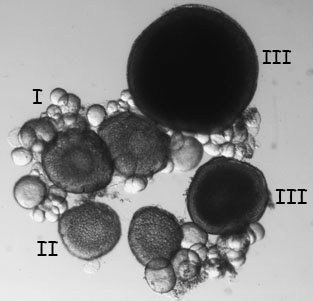
Figura 6. Etapa en vivo I, II, III y los oocitos observados bajo unmicroscopio de disección con luz transmitida. - A continuación, analizar el corazón de los peces. El corazón se encuentra posterior y ventral de las branquias. Comience por cortar el corazón y todo el tejido circundante y colocarla en PBS. Diseccionar cuidadosamente el tejido que rodea el corazón, con cuidado de no dañar la delicada atrio.
- Coloque el corazón disecado en solución de Ringer para observar el latido del corazón.
Identificar el atrio, el ventrículo y bulbo arterioso (Figura 7, Hu et al., 2001).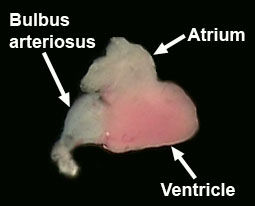
Figura 7. Disección del corazón adulto. - Completar la disección del cerebro mediante la eliminación de los peces. Comience por desclavar el pescado y la eliminación de la cabeza con una cuchilla de afeitar. Eliminar los tejidos blandos como sea posible de la parte ventral del cráneo con unas pinzas. Eliminar los ojos con unas tijeras pequeñas de primavera. Romper el cráneo y extraer el hueso de la parte ventral del cerebro. Ahora coloca la cabeza en un plato de PBS y quitar los huesos piel y el cráneo de la cara dorsal del cerebro.
- Identificar los bulbos olfatorios, telencéfalo, habénula, techo óptico, cerebelo y la médula (Figura 8, Wullimann et al, 1996;. Schilling, 2002).
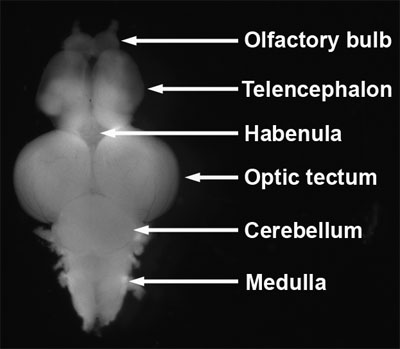
Figura 8. Cerebro diseccionado adultos de pez cebra. Vista dorsal, anterior al inicio.
Divulgaciones
Agradecimientos
Este trabajo fue apoyado por el NIH subvención R01 HD050901 a MCM y estadounidenses beca postdoctoral Cancer Society # PF-05-041-01-DDC a TG.
Materiales
Reactivos:
0,2% tricaína (etil-3-aminobenzoato)
200 mg polvo tricaína
97,9 ml de agua DD
~ 1 ml 1 M Tris (pH 9)
Ajustar el pH a 7.0
Tampón fosfato salino (PBS)
4,0 g de NaCl
0,1 g de KCl
100 ml 0,1 M tampón PO 4, pH 7,3
150 ml dH 2 O
Solución Ringer
6,7 g de NaCl
0,2 g KCl
0,2 g de CaCl2
1,2 g de Hepes
1 LH 2 O
Ajustar el pH a 7.2
Equipos:
Plato de disección con estera
Microscopía electrónica de Ciencias
Catálogo # 70540
Vannas primavera tijera
Herramientas de Bellas Ciencia
Catálogo # 91500-09
Referencias
- Finney, J. L., Robertson, G. N., McGee, C. A., Smith, F. M., Croll, R. P. Structure and Autonomic Innervation of the Swim Bladder in the Zebrafish (Danio rerio). J Comp Neurol. 495, 587-606 (2006).
- Hu, N., Yost, H. J., Clark, E. B. Cardiac morphology and blood pressure in the adult zebrafish. Anat Rec. 264, 1-12 (2001).
- Leal, M. C., Cardoso, E. R., Nóbrega, R. H., Batlouni, S. R., Bogerd, J., França, L. R., Schulz, R. W. Histological and stereological evaluation of zebrafish (Danio rerio) spermatogenesis with an emphasis on spermatogonial generations. Biol Reprod. 81, 177-187 (2009).
- Schilling, T. F., Nusslein-Volhard, C., Dahm, R. The morphology of larval and adult zebrafish. Zebrafish: A Practical Approach (The Practical Approach Series). , (2002).
- Selman, K., Wallace, R., Sarka, A., Qi, X. Stages of oocyte development in the Zebrafish, Brachydanio rerio. J. Morphol. 218, 203-224 (1993).
- Wallace, K. N., Akhter, S., Smith, E. M., Lorent, K., Pack, M. Intestinal growth and differentiation in zebrafish. Mech Dev. 122, 157-173 (2005).
- Wullimann, M. F., Rupp, B., Reichert, H. . Neuroanatomy of the zebrafish brain : a topological atlas. , (1996).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados