Method Article
El uso de un contador de células automatizado para simplificar estudios de expresión génica: siRNA Derribo de IL-4 la expresión génica en células dependientes Namalwa
Resumen
Este procedimiento describe un flujo de trabajo rápido y fácil de introducir en siRNA difíciles de transfectar líneas celulares y seguir la expresión de genes por PCR en tiempo real. El uso de un contador de células automatizado, multi-así placa electroporación, y la estación de electroforesis automatizados proporcionar resultados rápidos y confiables sin la necesidad de manipulación robótica caro.
Resumen
El uso de la caída de genes mediada por siRNA continúa siendo una herramienta importante en los estudios de la expresión génica. estudios de siRNA se llevan a cabo no sólo para estudiar los efectos de la regulación negativa de un solo gen, sino también para interrogar a las vías de señalización y otras redes de interacción compleja. Estos análisis vía requiere tanto el uso de modelos celulares relevantes y los métodos que causen menos perturbaciones a la fisiología celular. La electroporación es cada vez más como una manera eficaz de introducir siRNA y otros ácidos nucleicos en las difíciles de transfectar líneas celulares y células primarias sin alterar la vía de señalización bajo investigación. Hay varios pasos fundamentales para un experimento de siRNA con éxito, y hay maneras de simplificar el trabajo, mientras que la mejora de la calidad de los datos en varias etapas experimentales. Para ayudarle a empezar con su proyecto mediada siRNA caída gen, vamos a demostrar cómo llevar a cabo un estudio completo de la vía de la recolección y conteo de las células antes de la electroporación mediante transfección análisis de PCR en tiempo real de la expresión génica. El presente estudio investiga el papel de activador transcripcional STAT6 en IL-4 la expresión de genes dependientes de CCL17 en una línea celular de linfoma de Burkitt (Namalwa). Las técnicas demostradas son útiles para una amplia gama de siRNA basado en experimentos en los dos adherente y células en suspensión. También le mostraremos la manera de agilizar el conteo de células con el contador de células automatizado TC10, cómo electroporar varias muestras al mismo tiempo utilizando el sistema de electroporación MXcell, y la forma de evaluar al mismo tiempo la calidad y la cantidad de ARN con el sistema de electroforesis Experion automatizado.
Protocolo
1. La preparación y contar las células Namalwa
- Extraer células del frasco de cultivo y centrifugación de las células de pellets. Eliminar las células sobrenadante y resuspender en un volumen conocido de PBS. Las células utilizadas en este protocolo son las células en suspensión. Si está utilizando las células adherentes tendrá que trypsinize antes de la recogida.
- Para determinar el número de células vivas, la mancha de una alícuota de la suspensión celular mediante la mezcla de 1:1 con una solución 0,4% azul de tripano y pipeta 10 ul de la mezcla en un portaobjetos de contar, y luego insertar la diapositiva en la célula automatizada TC10 contador (Bio-Rad Laboratories, Inc).
- El contador de células TC10 se enfoque automático para asegurar los resultados más exactos, y luego proceder con el conteo. Se determina automáticamente la densidad de las células vivas y células totales en la muestra.
- Seleccione ver la imagen para mostrar las celdas en la pantalla de visión. A continuación, seleccione la calculadora de dilución para que el contador de células TC10 calcula automáticamente la cantidad de mezcla de células que se necesitarán.
- Este experimento se utiliza un total de tres siRNAs: un siRNA control y dos diferentes siRNAs dirigidos al gen STAT6, además de los controles no transfectadas. Esto requiere de 3,6 ml a una concentración final de 5 x 10 6 células por ml.
- Entrar en la concentración deseada y los valores finales de volumen en la calculadora de dilución, y se calcula el volumen de suspensión celular necesario en función del recuento de células vivas para esa muestra. Por otra parte, realizar el cálculo manualmente. Luego transferir el volumen necesario de mezcla de células de estos experimentos en un nuevo tubo.
- Haga girar la mezcla de células para que sedimenten las células y eliminar todas las PBS. Volver a suspender en 3,6 ml de solución tampón de electroporación Gene impulsos (Bio-Rad Laboratories). Transferencia de 800 alícuotas en tubos que contienen el siRNAs apropiado y mezcle suavemente. Las células están listas para la electroporación.
2. Electroporating las células en placas de 96 pozos
- La placa de 96 pozos de electroporación permite la replica de los cuatro tratamientos que se electroporated juntos.
- Transferencia de 150 ml de la suspensión de células en los pocillos correspondientes de una placa de 96 pozos de electroporación.
- Inserte la placa en la cámara de placa MXcell electroporación y cierre la tapa.
- Electroporar con los ajustes optimizados para la línea celular y el tampón utilizado. Estas células se someten a electroporación con una ola de decaimiento exponencial con la configuración de instrumento de 250 V, 350 mF, y 1000 Ω de resistencia.
- Después de la electroporación es completa, una pipeta de arriba a abajo con suavidad en cada bien para mezclar y luego transferir las células en una placa de cultivo de tejidos que contienen pre-calentado los medios de comunicación. Namalwa células son cultivadas en RPMI (Life Technologies) suplementado con 7,5% de FCS y 1% de piruvato.
- Las muestras de control que no han sido electroporated se han tomado de la suspensión de células restantes y se añaden a placas de cultivo de medio de cultivo pre-calentado de forma idéntica a las células por electroporación.
- Las células se incuban durante la noche a 37 º C con CO2 al 5%.
- Después de 24 horas, un grupo de células se indujo con 10 concentración final ng / ml recombinante de IL-4 (R & D Systems). El segundo grupo de control de las células sólo reciben los medios de comunicación adicionales. Todas las células se incuban otras 24 horas a 37 ° C y 5% CO 2.
3. Extraer y verificar el ARN
- Después de un total de 48 horas de crecimiento, el recuento de las células en cada pocillo, y la transferencia de una parte alícuota de cada pocillo a un tubo de microcentrífuga para la extracción de ARN, y la congelación de una alícuota para el análisis de Western Blot de proteínas u otros.
- Centrifugar las muestras para que sedimenten las células, y luego retirar y desechar el sobrenadante de cada tubo.
- Proceder a la extracción de RNA. Por lo general el uso de la Aurum ARN total kit (Bio-Rad) según el protocolo incluido.
- Al supervisar caída génica mediada por siRNA es particularmente importante para verificar la calidad del ARN porque el ARN se degrada dar resultados engañosos. El ratio de 260/280 no indica la integridad del RNA por lo tanto, es importante para ejecutar las muestras en un gel o un dispositivo de microfluidos para confirmar el ARN no se degradan.
- Para evaluar la calidad y cantidad en un solo paso, estas muestras serán analizadas mediante el sistema automatizado de electroforesis Experion (Bio-Rad).
- Las primeras muestras, el calor. Entonces, el primer, de carga, y el vórtice de chips Experion ARN. Insertar el chip en la estación de electroforesis Experion y empezar a correr.
- Después de la corrida se ha completado, el software Experion mostrará los resultados de forma automática en la forma de un electroferograma, tabla de resultados (que muestra la concentración de ARN, la relación ribosomal, y el número indicador de la calidad del ARN), y el gel virtual (que es similar a una tradicional ARN gel). Muestras de alta calidad total de ARN suele tener un RQI de 8-10.
4. PCR en tiempo real
- Después de verificar la calidad del ARN, proceda con las reacciones de cDNA. Este experimento se utilizó el iScript un paso RT-PCR mix (Bio-Rad) para combinar síntesis de cDNA y PCR en tiempo real en una sola reacción.
- Haga una mezcla maestra contiene todos los componentes de la reacción que no sea las plantillas de ARN para cada conjunto de cebadores, y distribuir dicho en la placa de PCR.
- Después de diluir el RNA a una concentración uniforme, añadir el RNA de muestras en los pocillos adecuados. Cada reacción está configurado por triplicado.
- Sellar la placa, y colóquelo en el CFX384 sistema en tiempo real PCR (Bio-Rad). Seleccione el protocolo apropiado y comenzar la carrera.
- Una vez que la carrera se ha completado, la expresión del gen se determina mediante la comparación de la expresión genética del gen de interés normalizado a una referencia de genes en las células por electroporación con siRNA experimental para la normalización de las mismas células por electroporación con un control de siRNA.
5. Análisis de la caída del siRNA
- La expresión de CCL17 se monitorizó utilizando cuantitativa en tiempo real PCR para investigar el papel del activador de la transcripción STAT6 en la inducción de IL-4 dependiente de CCL17. Para este experimento, se utilizó GAPDH como gen de referencia. Genes alternativos de referencia o varios genes de referencia se pueden utilizar de la misma manera.
- El software de gestión CFX normalizado automáticamente CCL17 expresión a la expresión del gen de referencia de la misma muestra y automáticamente comparado los valores resultantes normalizado a los tratamientos de control mediante la simple selección GAPDH como "referencia" y el tratamiento control (siRNA control sin inducción de IL-4) como "control" en la ventana de configuración del experimento del software de gestión de CFX.
- Sin la inducción de IL-4, la transcripción de CCL17 se mantuvo en niveles bajos, comparables a los constitutivos del tratamiento de control.
- Inducida por las células con IL-4 y mantener una vía normal de STAT6 (es decir, el control de siRNA o tratamientos de control no transfectadas) demostró la inducción de 8.10 veces de CCL17 expresión.
- Inducida por las células con IL-4, pero con STAT6 expresión inhibida por la introducción de cualquiera de siRNA STAT6 mostraron expresión sólo 2 veces mayor que el CCL17 células no inducidas, confirmando el papel de STAT6 en la IL-4 inducida por la expresión de CCL17.
6. Resultados representante
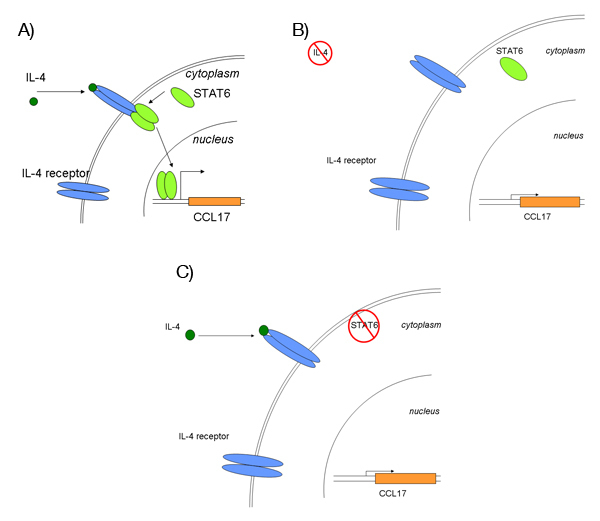
Figura 1. Descripción general de la vía de señalización de IL-4.
Un enlace) de la IL-4 a su receptor conduce a la dimerización y activación de STAT6. STAT6 activado transloca al núcleo y activa la transcripción de sus genes diana, como el CC17.
B) Sin inducción de IL-4, la transcripción de CCL17 se mantendrá en niveles bajos, constitutiva.
C) Después de silenciar siRNA mediada por el gen STAT6, el tratamiento con IL-4 debe dar lugar a poco o ningún aumento en CCL17 expresión.
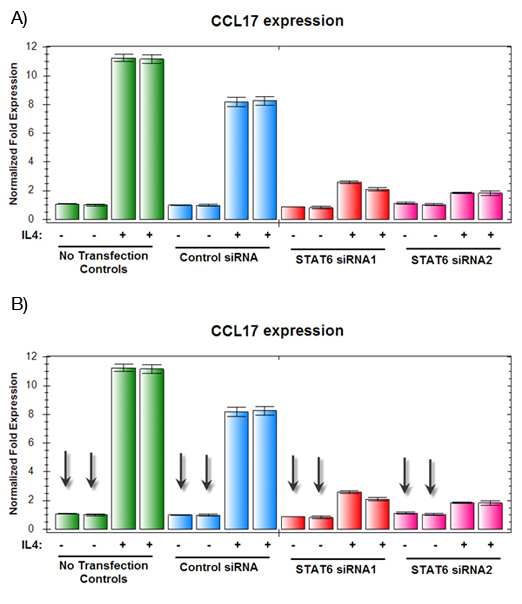
Figura 2. La inducción de IL-4 por CCL17 medida por las diferentes condiciones de PCR cuantitativa en tiempo real.
A) Las muestras cultivadas en ausencia de IL-4 tenía un bajo nivel constitutivo de expresión, independientemente de la expresión génica.
B) Como se muestra en verde y azul, las muestras de control respondieron normalmente al tratamiento con IL-4, con una inducción de 8-10 veces CCL17. Sin embargo, las células transfectadas con siRNAs dirigidos STAT6, que se muestra en rojo y rosa, había disminuido CCL17 expresión en respuesta a IL-4, el apoyo a la idea de que STAT6 juega un papel en la IL-4 inducida por la expresión de CCL17.
Discusión
Este artículo ha demostrado cómo electroporar siRNAs en un difícil transfectar la línea de suspensión de células y cómo seguir la expresión génica en estas células. Al hacer este procedimiento s importante tener en cuenta para mantener las cosas lo más coherente posible en todas las muestras.
Divulgaciones
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados