Method Article
Transducción retroviral de receptores de células T en ratones las células T
En este artículo
Resumen
Se presenta un protocolo para producir antígenos específicos de células T de ratón usando la transducción retroviral
Resumen
Receptores de células T (TCR) juegan un papel central en el sistema inmunológico. TCR en la superficie de las células T pueden reconocer específicamente antígenos peptídicos presentados por las células presentadoras de antígeno (APC) 1. Este reconocimiento conduce a la activación de las células T y una serie de resultados funcionales (por ejemplo la producción de citoquinas, causando la muerte de las células diana). La comprensión del papel funcional de la TCR es fundamental para aprovechar el poder del sistema inmunológico para tratar una variedad de enfermedades relacionadas con la inmunología (por ejemplo el cáncer o la autoinmunidad).
Es conveniente estudiar TCR en modelos de ratón, que se puede lograr de varias maneras. Hacer TCR transgénicos modelos de ratón es costoso y requiere mucho tiempo y en la actualidad sólo hay un número limitado de ellos dispone de 2-4. Por otra parte, los ratones con antígenos específicos de células T pueden ser generados por la médula ósea quimera. Este método también toma varias semanas y requiere de experiencia 5. Transducción retroviral de TCR en ratón in vitro activa las células T es un método rápido y relativamente fácil de obtener las células T de la deseada péptido-MHC especificidad. De antígenos específicos de células T se pueden generar en una semana y se utiliza en las aplicaciones posteriores. El estudio de las células T transducidas también tiene aplicación directa a la inmunoterapia humanos, como la transferencia adoptiva de células T humanas transducidas con el antígeno específico de TCR es una nueva estrategia para el tratamiento del cáncer 6.
Aquí se presenta un protocolo para la transducción retroviral TCR en activa in vitro de las células T de ratón. Humanos y los genes del ratón TCR se puede utilizar. Retrovirus llevar genes específicos TCR se generan y se utilizan para infectar las células T de ratón activados con anticuerpos anti-CD3 y anti-CD28. Después de la expansión in vitro, las células T transducidas son analizadas por citometría de flujo.
Protocolo
1. Prepare Construir retrovirales
- Sub-clon del receptor de células T (TCR) de genes de interés en un vector retroviral (Figura 1, los vectores de ejemplo pMSG 7, pMIGII 5,8, pMXs de Cellbiolabs). El TCR α y β gen de la cadena debe estar en el mismo vector bajo el control del mismo promotor para garantizar la igualdad de expresión. Si el TCR de interés humano, los dominios constantes humanos deben ser reemplazados por los dominios del ratón constante 9. Nuestra observación es que los TCR de cuerpo entero humanos no expresan establemente en el ratón de células-T.
- Preparar ADN de alta calidad utilizando el plásmido Qiagen Maxi Kit de Preparación o producto similar. La concentración del plásmido debe estar en alrededor de 1 mg / mL.
2. Transfección y aislamiento de las células T
Día 1 (células de la placa de embalaje)
- Desalojar de platino-E (Plat-E, Cellbiolabs) células retroviral envases con tripsina-EDTA y neutralizar con DMEM los medios de comunicación.
- Centrifugar las células a 1000 xg durante 5 min. Aspirar el sobrenadante y resuspender el botón celular en DMEM los medios de comunicación.
- Determinar el número de células y diluir las células a 0.6x10 6 / mL. Placa 10 ml de suspensión celular en un 10 mm poli-lisina placa recubierta de cultivo de tejidos y crecer durante la noche en una celda de la incubadora a 37 ° C, 5% de CO 2.
El día 0 (transfección)
- A la mañana siguiente, examinar las células bajo un microscopio de luz. Las células deben ser aproximadamente el 80% confluente.
- Retire con cuidado los medios de comunicación de la placa. Lave las células una vez con PBS 1x y agregar 10 ml previamente calentada, fresco medios DMEM sin penicilina-estreptomicina (penicilina / estreptomicina).
(Nota: penicilina / estreptomicina puede interferir con la transfección) - Preparar complejos de transfección.
Prepare la mezcla de A y B de la siguiente manera:Mezcla A: El ADN del plásmido 9 mg PCL-Eco plásmido auxiliar 6,3 mg OptiMEM 1,5 ml Mezcla B: Lipopfectime 2000 60 l OptiMEM 1,5 ml
Incubar A y B por separado durante 5 minutos a temperatura ambiente
Mezcla de A y B juntos suavemente e incubar durante 20 minutos a temperatura ambiente para formar complejos de transfección. - Lentamente por goteo la mezcla (un total de 3 ml) en las células Plat-E. Agite suavemente la placa de un lado a otro para distribuir uniformemente la mezcla de transfección.
- Se incuban las células a 37 ° C / 5% CO 2 en un incubador de células.
- Después de 6-8 horas, sustituya medio con 10 ml de medio DMEM fresco (con penicilina / estreptomicina) para la producción viral.
Escudo plato con anticuerpos
- Ratón las células T necesitan ser activadas antes de transducción viral. Hay varias formas diferentes para activar las células T. Aquí se utiliza la placa de obligado anticuerpos anti-CD3e y anti-CD28. Prepare una mezcla de anticuerpos de 1 mg / ml de anti-CD3e y 2 mg / ml de anti-CD28 en PBS estéril.
- Prescindir de 250 l de la mezcla de anticuerpos a cada pocillo de una placa de tejidos de 24 pocillos. La placa se puede recubrir toda la noche a 4 ° C o 2 horas a 37 ° C.
Preparación de una sola célula de suspensión de bazo de ratón
- Cosecha de bazo de ratón y traslado al medio RPMI.
- Colocar el bazo en un colador de la célula. Mash el bazo con un émbolo de la jeringa en una placa de cultivo de 5 cm de tejido. Enjuague las células de la células colador con PBS estéril.
- Centrífuga 1000 xg, 5 min.
- Desechar el sobrenadante. Resuspender el sedimento celular en tampón de lisis ACK (2 ml por bazo). Incubar 2 a 3 minutos a temperatura ambiente. Añadir medio RPMI hasta 20 ml y centrifugar 1000 xg durante 5 min.
- Desechar el sobrenadante. Resuspender el sedimento celular en PBS estéril. Determinar el número de células y centrifugar 1000 xg durante 5 min a 4 ° C. Proceder al aislamiento de las células T.
El aislamiento y la activación de las células T de ratón
- Magnéticamente identificar a las células de acuerdo con el manual del producto (CD8 + T-cell kit de aislamiento de Miltenyi Biotec).
- Coloque una columna LS (Miltenyi Biotec) en el magnetic campo. Solicitar la suspensión de células etiquetadas en la columna. Recoge el flujo a través de (enriquecido ratón CD8 + células T). Lavar la columna tres veces con tampón 3 ml de acuerdo con el manual del producto y se combinan con las anteriores de flujo continuo.
- Tinción de las células con anticuerpos anti-CD3e y anti-CD8a y analizar por citometría de flujo (Figura 2a). Para una separación típica, ~ 8.10% del total de células pueden ser aisladas. ~ 90% de las células aisladas son CD8 + T-células.
- Centrifugar las células a 1000 xg, 5 min. Eliminar el sobrenadante. Resuspender el botón celular en medio RPMI con recombinante humano IL-2 (rhIL2, 20 ng / ml) a 1x10 6 / mL.
- Justo antes de la adición de las células, eliminar la solución de anticuerpos de la placa (preparado previamente en 2.11). Enjuague cada pocillo con PBS estéril y PBS quitar.
- Añadir 1 ml de la suspensión celular a cada pocillo. Poner la placa a 37 ° C / 5% CO 2 en una celda de la incubadora.
3. (Día 2 y Día 3) La infección de células T activadas
- Después de 2 días de producción de virus, el medio de la placa celular Plat-E debe ser de color amarillo. Transferir el sobrenadante viral a un tubo cónico de 15 ml. Agregar 10 ml de medio DMEM fresco a la plancha para la producción de más virus (Opcional).
- Centrifugar el sobrenadante del virus a 1000 xg durante 5 min para eliminar los restos células. Transferir cuidadosamente el sobrenadante del virus a un nuevo tubo. Deje un poco de líquido en la parte inferior del tubo y no molestar a los restos células.
- Recoger las células T activadas a partir de la placa en un tubo cónico de 50 ml. Determinar el número de células. Ahorra un poco de las células en un tubo separado para ser utilizado como negativos (sin transducidas) control. Centrifugar a 1000 xg durante 5 minutos y desechar el sobrenadante.
- Resuspender el botón celular en virus sobrenadante a 10 6 células por 1 ml con 20 ng / mL rhIL2 y 10 mg / mL de sulfato de protamina. Añadir 1 ml de suspensión celular a cada pocillo de una placa y 24. Resuspender las células en el tubo de control en el medio RPMI a la misma densidad celular con la misma cantidad de sulfato de protamina y rhIL2. Añadir a las células a la misma placa.
- Envuelva el plato con film de plástico. Centrifugar 90 minutos a 2000 xg, a 32 ° C sin freno.
- Después de la centrifugación, quite la película plástica. Añadir 1 ml de medio fresco RPMI con 20 ng / mL rhIL2 a cada pocillo. Colocar la placa de nuevo a la incubadora.
- (Opcional) Mayor nivel de expresión de TCR se puede lograr mediante la recopilación de los virus sobrenadante y repetir el procedimiento de la infección en el día 3.
4. Expansión de las células y la evaluación de la eficiencia de transducción
- Examinar la transducción de células T al día. División de las células en proporciones 01:03, cuando sea necesario en medio RPMI rhIL2. No deje que un crecimiento excesivo de las células (medio se vuelve amarilla).
- En el día 6 o 7 días, teñir las células con el anticuerpo y tetrámero MHC específicos para el TCR para evaluar la expresión de TCR en las células T a la superficie. Uso de la ONU-transduced las células T como de control (Figura 2c).
- La transducción de células T están preparados para más aplicaciones posteriores.
5. Resultados representante
A menudo es ventajoso para purificar subconjuntos de células T antes de la transducción de esplenocitos, aunque pueden ser transducidas sin purificación. De alta pureza subconjuntos de células T se pueden obtener utilizando comerciales bolas magnéticas (Figura 2a).
Para evaluar el nivel de expresión de TCR en las células T, anticuerpos específicos para el TCR alfa o beta cadenas se pueden utilizar. Por lo general 30% al 80% de las células transducidas pueden expresar TCR (Figura 2b) en función de los genes de TCR y los títulos de virus. MHC específicos tetrámero para el TCR también se puede utilizar para verificar a fondo la expresión funcional del TCR (Figura 2c).
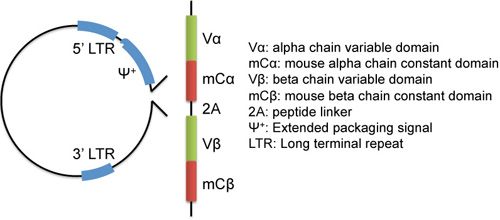
Figura 1. Ejemplo de gen del receptor de células T construcción de sub-clonado en un vector retroviral. Alpha de longitud completa y los genes de la cadena beta están unidos por un conector de auto-2A escindibles péptido 8.
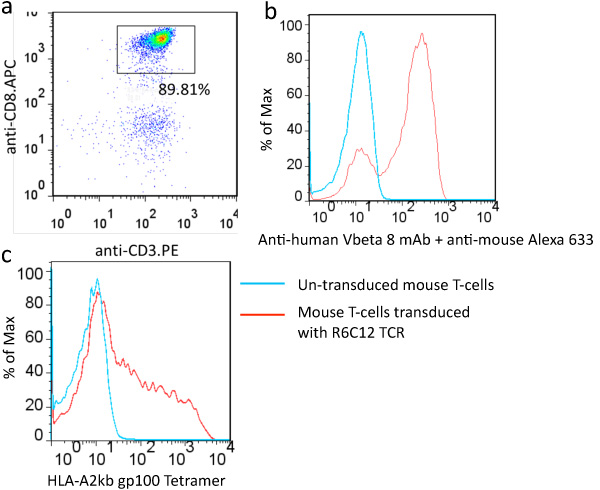
Figura 2. Ejemplo de éxito en el aislamiento y la transducción de las células T de ratón. (A) células T CD8 fueron aislados a partir de esplenocitos con CD8a + T celda de aislamiento Kit (Miltenyi Biotec) y teñidas con anticuerpos anti-CD3e y anti-CD8a. Aisladas células T CD8 fueron transducidas con R6C12 TCR específico para humanos gp100: 209 -217 4 de péptidos y teñidas con anti-anticuerpos humanos vbeta 8 (b) y HLA-A2kb gp100 tetrámero (c).
Discusión
Varios pasos son críticos para lograr resultados óptimos. Plat-E línea celular de empaquetamiento se debe mantener en buenas condiciones. Si es necesario, las células pueden ser pasados un par de veces en medio DMEM con 1 mg / ml puromycin, mg 10 / blasticidin ml para evitar la pérdida de expresión retroviral estructura de proteínas. En el día de la transfección, las células deben ser confluentes ~ 80%. Muy pocas células o demasiadas puede reducir el título del virus. La calidad virus se puede comprobar mediante ensayos con líneas celulares que pueden ser fácilmente transducidas. Desde TCR requiere CD3 complejos que se expresa en la superficie celular, que utilizan de forma habitual 58α-/β- células de hibridoma 10 (una línea celular que no expresa endógeno α TCR o la cadena β, pero no expresa complejo CD3). Se obtiene casi el 100% de eficiencia de transducción de células de hibridoma cuando transducción de las células con 1 ml de sobrenadante de virus. Finalmente, las células T necesitan ser activados y proliferan porque retrovirus sólo puede infectar a las células en división activa.
El método que aquí se presenta para la producción de antígenos específicos de células T tiene varias limitaciones. En primer lugar, es difícil alcanzar el 100% de eficiencia de la transducción de principal del ratón las células-T. Una parte de las células no expresan el TCR de interés. En segundo lugar, el TCR α transducidas y las cadenas de β puede mispair con TCR endógeno 9, que puede reducir el nivel de expresión del TCR de interés. Además, el TCR mispaired puede causar autoinmunidad en vivo 11. Finalmente, sólo hay un tiempo limitado de la transducción de células T puede ser utilizado. Después de aproximadamente una semana, las células sufren apoptosis a menos que se re-estimulado. Sin embargo, las células pueden agotarse y perder con funciones repetitivas re-estimulaciones.
Divulgaciones
Agradecimientos
Este trabajo fue apoyado por subvenciones del NIH (5U01CA137070) y la Sociedad Americana del Cáncer (RSG-09-070-01-LIB), un Premio de Investigación del Cáncer del Instituto Investigador (MK), una Asociación Americana del Corazón beca predoctoral (KM) y el Ministerio español de Educación y Ciencia Becas (APG).
Nos gustaría agradecer a la Dr. Nicholas Restifo y el Dr. Zhiya Yu (NIH / NCI) por sus útiles sugerencias para el protocolo.
Materiales
Los medios de comunicación:
Medio DMEM (calor DMEM +10% FBS inactivado + penicilina / estreptomicina + L-Glu + + piruvato de sodio no aminoácidos esenciales).
Medio DMEM sin penicilina / estreptomicina (Igual que el medio DMEM, pero sin la adición de penicilina / estreptomicina).
Medio RPMI (calor RPMI 10% FBS inactivado + L-Glu + no aminoácidos esenciales + β-Mercaphoethanol + penicilina / estreptomicina + piruvato sódico).
Referencias
- Krogsgaard, M., Davis, M. M. How T cells 'see' antigen. Nat. Immunol. 6, 239-245 (2005).
- Berg, L. J. Antigen/MHC-specific T cells are preferentially exported from the thymus in the presence of their MHC ligand. Cell. 58, 1035-1046 (1989).
- Hogquist, K. A. T cell receptor antagonist peptides induce positive selection. Cell. 76, 17-27 (1994).
- Yu, Z. Poor immunogenicity of a self/tumor antigen derives from peptide-MHC-I instability and is independent of tolerance. J. Clin. Invest. 114, 551-559 (2004).
- Holst, J. Generation of T-cell receptor retrogenic mice. Nat Protoc. 1, 406-417 (2006).
- Morgan, R. A. Cancer regression in patients after transfer of genetically engineered lymphocytes. Science. 314, 126-129 (2006).
- Hawley, R. G., Lieu, F. H., Fong, A. Z., Hawley, T. S. Versatile retroviral vectors for potential use in gene therapy. Gene Ther. 1, 136-138 (1994).
- Szymczak, A. L. Correction of multi-gene deficiency in vivo using a single 'self-cleaving' 2A peptide-based retroviral vector. Nat. Biotechnol. 22, 589-594 (2004).
- Cohen, C. J., Zhao, Y., Zheng, Z., Rosenberg, S. A., Morgan, R. A. Enhanced antitumor activity of murine-human hybrid T-cell receptor (TCR) in human lymphocytes is associated with improved pairing and TCR/CD3 stability. Cancer Res. 66, 8878-8886 (2006).
- Letourneur, F., Malissen, B. Derivation of a T cell hybridoma variant deprived of functional T cell receptor alpha and beta chain transcripts reveals a nonfunctional alpha-mRNA of BW5147 origin. Eur. J. Immunol. 19, 2269-2274 (1989).
- Bendle, G. M. Lethal graft-versus-host disease in mouse models of T cell receptor gene therapy. Nat. Med. 16, 565-570 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados