Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
In vivo e in vitro de adaptador de clatrina-Interacción
En este artículo
Resumen
Clathrin endocitosis mediada depende de las proteínas adaptador que coordinar la selección de carga y montaje capa clatrina. A continuación se describen los procedimientos para el estudio del adaptador de clatrina interacción física y imágenes de células vivas enfoques, utilizando como modelo la levadura endocítica Sla1p adaptador de proteínas.
Resumen
Una importante vía endocítica se inicia con la formación de vesículas de clatrina recubiertos (CCV) que transportan cargas de la superficie celular de endosomas 1-6. CCV se distinguen por una red poliédrica de clatrina que cubre la membrana de la vesícula y sirve como un andamio mecánico. Abrigos de clatrina se ensamblan en la formación de vesículas de clatrina triskelia individuales, la forma soluble de clatrina compuesto por tres subunidades de la cadena pesada y tres de luz 7,8. Debido a que el triskelion no tiene la capacidad de unirse a la membrana directamente, clatrina vinculante adaptadores son fundamentales para vincular la red de clatrina que forman la membrana a través de la asociación con los lípidos y / o proteínas de membrana 9. Adaptadores también transmembrana paquete de proteínas de carga, como los receptores, y pueden interactuar entre sí y con otros componentes de la formación CCV maquinaria 9.
Más de veinte adaptadores de clatrina se han descrito, hay varios implicados en la endocitosis mediada por clatrina y otros localizar a la red trans Golgi o endosomas 9. Con la excepción de HIP1R (levadura Sla2p), todos los adaptadores de clatrina conocidos se unen al dominio N-terminal-hélice de la cadena pesada de clatrina 9. Adaptadores de clatrina son proteínas modular que consta de dominios cruzados conectados por conectores flexibles no estructurados. Dentro de estas regiones enlazador, a corto motivos de unión a mediar en la interacción con la clatrina N-terminal de dominio o de otros componentes de la formación de vesículas maquinaria 9. Dos distintas clatrina motivos de unión se han definido: la caja de clatrina y la caja de W-9. El consenso de clatrina-box secuencia se había definido como L [L / I] [D / E / N] [I / F] [D / E] 10, pero las variantes se han descubierto posteriormente 11. El W-box se ajusta a la secuencia de PWxxW (donde x es cualquier residuo).
Sla1p (sintética letal con la proteína de unión actina-1) fue originalmente identificado como una proteína actina asociados y es necesaria para la estructura normal del citoesqueleto de actina y la dinámica en los sitios de endocitosis en células de levadura 12. Sla1p también se une a la señal de NPFxD clasificación endocítica y es fundamental para la endocitosis de la carga que lleva la señal de NPFxD 13,14. Más recientemente, se demostró que Sla1p unen clatrina a través de un motivo similar a la caja de clatrina, LLDLQ, denominada variante de clatrina-box (VCB), y para funcionar como un adaptador de endocitosis clatrina 15. Además, Sla1p ha convertido en un marcador ampliamente utilizado para la capa de endocítica en los estudios de microscopía de fluorescencia de células vivas 16. Aquí se utiliza Sla1p como un modelo para describir los enfoques de los estudios de interacción clathrin adaptador. Nos centramos en la microscopía de fluorescencia de células en vivo, GST-pull down, y los métodos de co-inmunoprecipitación.
Protocolo
1. Incorporación de una etiqueta de las buenas prácticas agrarias y marcador de selección en el gen SLA1
Aplicar el método Longtine 17, a fin de fusionar una etiqueta de las buenas prácticas agrarias directamente en el extremo 3 'del marco de lectura abierta del gen SLA1 (Sla1p C-terminal) y al mismo tiempo marca el gen con la E. coli kan r gen que permite la selección G418.
- Generar un fragmento de ADN por PCR utilizando como molde el plásmido pFA6a-GFP (S65T)-kanMX6 18 y los siguientes cebadores: adelante, 5'-CA AGG CAA CCG AAC ATA TTC AAT ACT GCA GCT TCA AAT CCG TTT GGA CGG TTC ATC CCC GGG ATT ATT AA-3 ', e invertir, 5'-CA TAT AGC TTG TTT TAG TTA TTA TCC TAT TTA AAA AAA ATC TAC TCA AAT GAA TTC GAG CTC TAA GTT AC-3'. La secuencia subrayada corresponde al segmento de gen específico SLA1 inmediatamente anterior (cebador) y después del codón de parada (primer inversa). Aislar el producto de PCR por electroforesis en gel de agarosa seguido por la purificación de ADN.
- Preparar un cultivo de S. 50 ml cerevisiae cepa SEY6210 (MAΤα ura3-52, leu2-3, 112 his3-Δ200, trp1-Δ901, LYS2-801, SUC2 Δ9-GAL-MEL) 19 de YPD, cada vez mayor en la fase temprana logarítmica (OD 600 = 0,2 hasta 0,6). Girar a temperatura ambiente durante 3 minutos a 2.000 xg, lavar dos veces con agua estéril.
- Transformar el fragmento de PCR obtenido en el paso 1 en las células mediante el procedimiento de acetato de litio 20. Lavan las células con 1 ml de agua estéril, añadir 1 ml de YPD y se incuba durante 4 horas a 30 ° C en un agitador.
- Propagación de las células en placas de YPD-G418 para seleccionar transformantes resistentes a G418, se incuba a 30 ° C durante 2-3 días. Elige las colonias y los racha de YPD-G418 placas.
- Usando la colonia-PCR, identificar transformantes en el que se integró el módulo de GFP-kan correctamente con el SLA1 secuencias de genes por recombinación homóloga. Utilizar un cebador que hibrida en el marco de lectura abierta SLA1 y un cebador inverso que hibrida en el interior del módulo de GFP-kan. Identificar las colonias que los productos de PCR del tamaño esperado y verificar por secuenciación.
- Pantalla de las colonias por microscopía de fluorescencia para confirmar que han fluorescencia de GFP.
2. La mutación de la caja de la variante de clatrina (CCV) en el gen SLA1
- Introducir un LLDLQ a una mutación en el gen AAALQ SLA1 (nucleótidos 2.407 hasta 2.415) después de un enfoque en dos fases 15.
- En primer lugar, ampliar SLA1 nucleótidos 1207-1410 y 2427-2589 por PCR y clonar los fragmentos en NotI / BamHI y EcoRI / SalI sitios de pBluescriptKS, respectivamente.
- Subclon en los sitios BamHI / EcoRI un fragmento de PCR que contiene URA3.
- Unirá el plásmido resultante con NotI / SalI, aislar el fragmento URA3 por purificación en gel, e introducirlo por la transformación de litio acetato en la cepa Sla1-GFP generado en la parte 1, o en TVY614 (MATA ura3-52-3112 leu2 his3-Δ200 trp1 -Δ901 LYS2-801-SUC2 Δ9 PEP4:: LEU2 PRB1:: HISG PRC1:: HIS3) 21.
- Propagación de las células en las placas SD complementado falta uracilo. Confirmar por la colonia-PCR y secuenciación de que el Ura + colonias contienen URA3 debidamente integrado sustituyendo el fragmento de VCB.
- En un segundo paso, subclon SLA1 nucleótidos 1207-2589 en NotI / SalI sitios de pBluescriptKS. Utilizando el QuickChange-XL mutagénesis dirigida kit (Stratagene), mutar los residuos VCB LLDLQ a AAALQ. Verificar por secuenciación.
- Unirá la construcción resultante con BsgI / AgeI, y aislar el BCV mutante que contiene fragmentos de purificación en gel. Cotransform el fragmento BsgI / AgeI con pRS313 (HIS3) 22 en la cepa obtenida en la Parte 2.3.
- Propagación de las células en las placas SD complementado carecen de histidina. Su placa de réplica-colonias + en un medio de agar que contienen ácido 5-fluorotic para identificar las células en las que las secuencias mutantes reemplazado URA3, regenerando así el gen que contiene la sla1 LLDLQ a la mutación AAALQ (sla1 AAA). Confirmar por la colonia-PCR y secuenciación.
3. Microscopía de fluorescencia
- Crecen las cepas de levadura Sla1-GFP y sla1 AAA-GFP generado en las partes 1 y 2 en 4 ml de complementarse SD medios de comunicación a 30 ° C en un rotor en la oscuridad hasta llegar a un OD 600 = 0,1-0,4. Giro de 1 ml de la cultura en microcentrífuga a 4.000 xg durante 1 minuto a temperatura ambiente. Deseche ~ 950 l de sobrenadante. Resuspender las células en el líquido residual (~ 50 l).
- Depósito de 3 l de la suspensión de células en un portaobjetos de microscopio y se cubre con un cubreobjetos. Proteger la muestra de la luz.
- Montaje de diapositivas en un 100x de inmersión en aceite objetivo de un microscopio confocal de girar discos.
- Localizar plano correcto focal de las células utilizando iluminación campo claro o 488 nm láser con los filtros adecuados para excitar y detectar la fluorescencia de GFP.
- Captura de imágenes con lapso de tiempo de Sla1-GFP y sla1 AAA-GFP en las células con el tiempo de exposición de 500 ms (o valor apropiado) a unan intervalo de una imagen por segundo durante 150 segundos. Resultado esperado: punctae GFP etiqueta aparecerá en la superficie interna de la membrana limitante de la célula, persisten durante varios segundos, y moverse hacia el centro de la célula como la señal desaparece rápidamente (lo que indica capa de desmontaje).
- Seleccione una parte de una imagen en la que los puntos se considera que aparecen, permanecen durante varios segundos, y desaparecen. La cosecha de este apartado de la imagen en cada fotograma de las imágenes con lapso de tiempo.
- Generar un quimógrafo representa esta sección de la imagen en cada fotograma de la 150 segundos de lapso de tiempo la imagen mediante la alineación de los marcos a lo largo de un eje correspondiente al tiempo transcurrido.
- Calcular la duración de cada spot basado en el número de segundos (tiempo transcurrido-frames) los puntos se encuentra en el quimógrafo. Tenga en cuenta que cada punto debe "curva" hacia el interior de la célula, ya que está desapareciendo, lo que refleja la endocitosis y el desmontaje de la cubierta.
- Comparar el tipo salvaje Sla1-GFP con sla1 AAA-GFP. Repita el procedimiento para determinar si los resultados son estadísticamente significativos. Resultado esperado: sla1 AAA-GFP manchas persisten mucho más tiempo (~ 80 seg) que las cepas silvestres (~ 30 seg), que indica un defecto en la formación de capa 15.
4. Preparación de extracto de levadura y extracto citosólico total de células
- Inocular 3 litros de YPD con una cepa de levadura adecuada, como TVY614 21, y crecen a 30 ° C en una incubadora de agitación hasta alcanzar una OD 600 = 2.1.
- Centrifugar el cultivo de levadura a temperatura ambiente durante 20 minutos a 3700 x g. Descartar el sobrenadante, añadir 5.3 ml de agua estéril, y la pipeta hacia arriba y hacia abajo hasta que la pastilla se resuspendió completamente.
- Vierta ~ 150 ml de nitrógeno líquido en un vaso de plástico de 250 ml. Flash congelar la levadura añadiendo gota a gota en el nitrógeno líquido en un patrón circular para evitar la aglutinación de los gránulos congelados. No deje que el deshielo de pellets, añadir más nitrógeno líquido si es necesario.
- Una frialdad de acero inoxidable licuadora mediante el vertido de nitrógeno líquido en ella. Permita que el nitrógeno líquido se evapore casi por completo. Añadir la levadura pellets congelados en el frío vaso de la licuadora. Cierre el vaso de la licuadora con un tapón de goma fría y moler las pastillas de levadura de 10 segundos. Invertir veces el envase 3.4 para mezclar el contenido y repetir la etapa de molienda en dos ocasiones. La levadura de suelo congelado tendrá un aspecto similar al polvo.
- Enfriar un embudo y un tubo cónico de 50 ml con nitrógeno líquido. Usando el embudo frío, la transferencia de la levadura de tierra en el tubo. La levadura de suelo congelado se puede almacenar a -80 ° C o utilizarse de inmediato.
- Para obtener un extracto citosólico para el análisis de la proteína de fusión GST-afinidad (parte 5), el peso de 3 g de suelo congelado TVY614 la levadura en un tubo cónico de 15 ml y resuspender en 3 ml de solución tampón a temperatura ambiente A (10 mM HEPES, pH 7,0, 150 mM NaCl, 1 mM EDTA, 1 mM DTT), que contiene un cóctel de inhibidores de proteasa (Sigma).
- Cierre e invierta el tubo varias veces hasta que esté completamente descongelado y luego poner en el hielo.
- Ultracentrífuga el extracto a 4 ° C durante 20 minutos a 300.000 x g. Transferir cuidadosamente el sobrenadante (extracto citosólico) a un tubo cónico con una pipeta sin perturbar el precipitado. Mantenga el extracto citosólico en el hielo.
- Añadir 100 ml de un 50% (v / v) glutatión-Sepharosa suspensión en tampón A. Es conveniente cortar el extremo de la punta con el fin de facilitar la pipeta de las cuentas. Gire a 4 ° C durante 15 minutos, spin-down las cuentas por centrifugación a 4 º C durante 2 min a 1.000 xg, y la transferencia (extracto citosólico) sobrenadante a un tubo nuevo. Reserva 50 l de extracto para el control de entrada.
- Para obtener los extractos totales de células para los experimentos de co-inmunoprecipitación (Parte 6), el uso cepa TVY614 (WT SLA1), la cepa sla1 AAA llevar una LLDLQ a la mutación AAALQ generados en la parte 2 en TVY614 de fondo, y una cepa sla1 llevar a una supresión de la SLA1 gen como GPY3130 23. Peso 2 g de la levadura correspondiente toma de tierra congelada en tubos cónicos y se resuspenden en 2 ml de solución tampón a temperatura ambiente A, que contiene un cóctel de inhibidores de proteasa (Sigma) y el 2% Triton X-100.
- Cierre e invierta el tubo varias veces hasta que esté completamente descongelado y luego incubar en hielo durante 10 minutos, de forma periódica mezcla por inversión.
- Transferir el material a tubos de microcentrífuga y el giro a 4 ° C durante 15 minutos a 16.000 xg (máxima velocidad en microcentrífuga). Transferir cuidadosamente el sobrenadante (extracto celular total) a un tubo cónico en el hielo con una pipeta sin perturbar el precipitado.
- Añadir 100 ml de una proteína de 50% (v / v) A-Sepharosa suspensión en tampón A. Gire a 4 ° C durante 15 minutos, spin-down las cuentas por centrifugación a 4 º C durante 2 min a 1.000 xg, y la transferencia el sobrenadante (extracto total) a un tubo nuevo. Reserva 50 l de extracto para el control de entrada.
5. GST-proteína de fusión de ensayo de afinidad
- Amplificación mediante PCR de un fragmento de containing la variante Sla1p clatrina-box (VCB) (residuos 803-807), se copia en pGEX-5X para obtener pGEX-5X-VCB. Verificar por secuenciación.
- Utilizando pGEX-5X-VCB como una plantilla y la QuickChange-XL mutagénesis dirigida kit (Stratagene), mutar el BCV LLDLQ residuos de AAALQ obtener pGEX-5X-vCBmut. Verificar por secuenciación.
- Expresa GST y las proteínas de fusión GST-VCB y GST-vCBmut en E. coli (BL21 DE3), purificar con glutatión-Sepharosa, elución de las cuentas con el glutatión reducido, diálisis contra PBS, y determinar la concentración de proteínas.
- Etiqueta 3 tubos de microcentrífuga: GST, GST-VCB, y GST vCBmut, y añadir 1 ml de PBS, 30 l de un 50% (v / v) glutatión-Sepharosa suspensión en un buffer, y 50 mg de dialized GST, -VCB, o GST-vCBmut proteínas de fusión.
- Gire a la temperatura ambiente durante 30 min para permitir la encuadernación.
- Lavar las perlas de dos veces con PBS y una vez con tampón A. Añadir 1 ml de extracto de levadura citosólica - preparada como se describe en la Parte 4 - a cada tubo.
- Gire los tubos de 1 hora a 4 ° C, giro 10 segundos a 5.000 xg para sedimentar las cuentas, eliminar el sobrenadante y lave rápidamente las cuentas 3 veces con tampón A que contiene 0,1% de tiempo de Triton X-100, y 1 con tampón A.
- De girar las bolas una vez más y con una punta de carga de gel eliminar la mayor cantidad de líquido posible. En este punto, las muestras pueden ser almacenadas a -20 ° C para continuar en otro momento.
- Añadir 15 l de tampón de muestra Laemmli 2x a cada tubo, se incuba a 96 ° C durante 5 minutos, y el giro 10 segundos a 5.000 x g.
- Analizar las muestras por inmunotransferencia utilizando un anticuerpo contra la cadena pesada de clatrina. Resultados esperados: clatrina se une a GST-VCB, pero no a GST o GST vCBmut. También se analizan las muestras por SDS-PAGE para confirmar la carga similar de las proteínas de fusión GST.
6. Co-inmunoprecipitación ensayo
- Etiqueta 3 tubos de microcentrífuga: WT (de tipo salvaje SLA1), sla1 AAA, y sla1Δ, y añadir 1 ml de PBS, 30 l de una proteína de 50% (v / v) A-Sepharosa suspensión en un buffer, y 2 mg de un conejo anti-anticuerpos Sla1p.
- Gire a la temperatura ambiente durante 30 min.
- Lave las cuentas dos veces con PBS y una vez con tampón A conteniendo 1% de Triton X-100.
- Añadir 1 ml de los extractos de levadura total correspondiente elaborado en la Parte 4: SLA1, sla1 AAA, y sla1Δ. Gire 1 hora a 4 ° C.
- Girar 10 segundos a 5.000 xg para sedimentar las cuentas, eliminar el sobrenadante, y lávese rápidamente las cuentas 3 veces con tampón A que contiene 0,1% de Triton X-100, y una vez con tampón A.
- De girar las bolas una vez más y con una punta de carga de gel eliminar la mayor cantidad de líquido posible. En este punto, las muestras pueden ser almacenadas a -20 ° C para continuar en otro momento.
- Añadir 15 l de tampón de muestra Laemmli 2x a cada tubo, se incuba a 96 ° C durante 5 minutos, y el giro 10 segundos a 5.000 x g.
- Analizar las muestras por inmunotransferencia utilizando un anticuerpo contra la cadena pesada de clatrina. Resultados esperados: clatrina co-inmunoprecipitados con Sla1p de tipo salvaje, pero no con sla1 AAA, o en la muestra sla1Δ.
7. Resultados representante
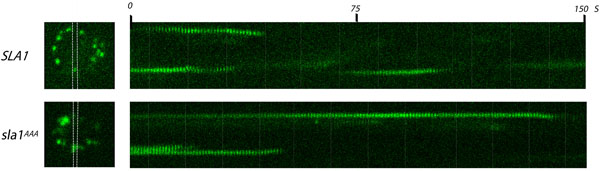
Figura 1. Análisis de adaptador Sla1p clatrina en los sitios de endocítica por microscopía de fluorescencia de células en vivo. Un cuadro (izquierda) de un video y kymographs correspondiente (derecha) de las células de levadura que expresan Sla1-GFP o sla1 AAA-GFP llevar una LLDLQ a la mutación AAALQ. Tanto de tipo salvaje y mutante Sla1-GFP se expresa a partir de las variables endógenas SLA1 lugar. Sitios endocítica se observan como puntos brillantes distribuidos en la periferia de la célula (imagen izquierda). El área entre las líneas blancas corresponde a la región de la que kymographs se generaron. Películas fueron tomadas a una velocidad de 1 fotograma / seg. Aviso de la vida útil más larga de Sla1-GFP en el LLDLQ a AAALQ mutante (sla1 AAA), en comparación con el tipo salvaje (SLA1).
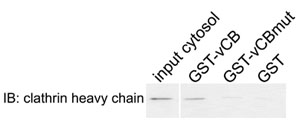
Figura 2. Interacción física entre clatrina y la caja de Sla1p variante de clatrina. GST fusionada al fragmento Sla1p aa798-813 que contiene la secuencia LLDLQ (GST-VCB), el correspondiente mutante AAALQ (GST-vCBmut) o GST sola (GST) estaban destinados a la glutatión-Sepharosa cuentas e incubadas con un extracto citosólico de salvaje el tipo de células de levadura. Las proteínas asociadas se eluyeron y analizadas por inmunoblotting (IB) de la cadena pesada de clatrina.
Discusión
Clathrin vesículas con cubierta (CCV) participan en la endocitosis y el transporte de la red trans Golgi y los endosomas, las vías de conservación que son fundamentales para la biología de las células eucariotas. Los enfoques descritos en este documento los métodos son útiles para estudiar los mecanismos moleculares responsables de la formación de CCV, en particular, las interacciones entre las proteínas y el adaptador de clatrina. De fusión GST-afinidad de proteínas y ensayos de inmunoprecipitación...
Divulgaciones
Agradecimientos
DF con el apoyo de una Puentes NSF para la beca de doctorado. El microscopio usado en este trabajo es apoyado en parte por el microscopio de imagen de infraestructura de red central de la concesión de Colorado State University. El trabajo de los adaptadores de clatrina en el laboratorio del autor s con el apoyo de la CSU fondos iniciales y la adjudicación Asociación Americana del Corazón 09SDG2280525 a SD
Materiales
| Material | Empresa | ||
|---|---|---|---|
| Name | Company | Catalog Number | Comments |
| QuickChange-XL mutagénesis dirigida kit | Stratagene | ||
| cóctel de inhibidores de la proteasa | Sigma |
Referencias
- Mellman, I., Warren, G. The road taken: past and future foundations of membrane traffic. Cell. 100, 99-112 (2000).
- Engqvist-Goldstein, A. E., Drubin, D. G. Actin assembly and endocytosis: from yeast to mammals. Annu Rev Cell Dev Biol. 19, 287-332 (2003).
- Conner, S. D., Schmid, S. L. Regulated portals of entry into the cell. Nature. 422, 37-44 (2003).
- Bonifacino, J. S., Traub, L. M. Signals for sorting of transmembrane proteins to endosomes and lysosomes. Annu Rev Biochem. 72, 395-447 (2003).
- Ungewickell, E. J., Hinrichsen, L. Endocytosis: clathrin-mediated membrane budding. Curr Opin Cell Biol. 19, 417-425 (2007).
- Doherty, G. J., McMahon, H. T. Mechanisms of endocytosis. Annu Rev Biochem. 78, 857-902 (2009).
- Kirchhausen, T. Clathrin. Annu Rev Biochem. 69, 699-727 (2000).
- Brodsky, F. M., Chen, C. Y., Knuehl, C., Towler, M. C., Wakeham, D. E. Biological basket weaving: formation and function of clathrin-coated vesicles. Annu Rev Cell Dev Biol. 17, 517-568 (2001).
- Owen, D. J., Collins, B. M., Evans, P. R. Adaptors for clathrin coats: structure and function. Annu Rev Cell Dev Biol. 20, 153-191 (2004).
- Dell'Angelica, E. C., Klumperman, J., Stoorvogel, W., Bonifacino, J. S. Association of the AP-3 adaptor complex with clathrin. Science. 280, 431-434 (1998).
- Dell'Angelica, E. C. Clathrin-binding proteins: got a motif? Join the network!. Trends Cell Biol. 11, 315-318 (2001).
- Holtzman, D. A., Yang, S., Drubin, D. G. Synthetic-lethal interactions identify two novel genes, SLA1 and SLA2, that control membrane cytoskeleton assembly in Saccharomyces cerevisiae. J Cell Biol. 122, 635-644 (1993).
- Howard, J. P., Hutton, J. L., Olson, J. M., Payne, G. S. Sla1p serves as the targeting signal recognition factor for NPFX(1,2)D-mediated endocytosis. J. Cell. Biol. 157, 315-326 (2002).
- Mahadev, R. K., Pietro, S. M. D. i., Olson, J. M., Piao, H. L., Payne, G. S., Overduin, M. Structure of Sla1p homology domain 1 and interaction with the NPFxD endocytic internalization motif. EMBO J. 26, 1963-1971 (2007).
- Pietro, S. M. D. i., Cascio, D., Feliciano, D., Bowie, J. U., Payne, G. S. Regulation of clathrin adaptor function in endocytosis: A novel role for the SAM domain. EMBO J. 29, 1033-1044 (2010).
- Kaksonen, M., Toret, C. P., Drubin, D. G. A modular design for the clathrin- and actin-mediated endocytosis machinery. Cell. 123, 305-320 (2005).
- Longtine, M. S., McKenzie, A., Demarini, D. J., Shah, N. G., Wach, A., Brachat, A., Philippsen, P., Pringle, J. R. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae. Yeast. 14, 953-9561 (1998).
- Wach, A., Brachat, A., Alberti-Segui, C., Rebischung, C., Philippsen, P. Heterologous HIS3 marker and GFP reporter modules for PCR-targeting in Saccharomyces cerevisiae. Yeast. 13, 1065-1075 (1997).
- Robinson, J. S., Klionsky, D. J., Banta, L. M., Emr, S. D. Protein sorting in Saccharomyces cerevisiae: isolation of mutants defective in the delivery and processing of multiple vacuolar hydrolases. Mol Cell Biol. 8, 4936-4948 (1988).
- Ito, H., Fukuda, Y., Murata, K., Kimura, A. Transformation of intact yeast cells treated with alkali cations. J. Bacteriology. 153, 163-168 (1983).
- Vida, T. A., Emr, S. D. A new vital stain for visualizing vacuolar membrane dynamics and endocytosis in yeast. J Cell Biol. 128, 779-792 (1995).
- Sikorski, R. S., Hieter, P. A system of shuttle vectors and yeast host strains designed for efficient manipulation of DNA in Saccharomyces cerevisiae. Genetics. 122, 19-27 (1989).
- Piao, H. L., Machado, I. M., Payne, G. S. NPFXD-mediated endocytosis is required for polarity and function of a yeast cell wall stress sensor. Mol Biol Cell. 18, 57-65 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados