Method Article
Múltiples imágenes del ratón neuroanatómicos de Resonancia Magnética
En este artículo
Resumen
La resonancia magnética (MRI) se ha convertido en una herramienta cada vez más popular para examinar el fenotipo de los ratones alterados genéticamente. Este artículo ilustra los métodos necesarios para alcanzar un alto rendimiento fenotipo de los ratones alterados genéticamente con múltiples ratón MRI.
Resumen
El campo de fenotipo del ratón con la resonancia magnética (MRI) es de rápido crecimiento, motivado por la necesidad de mejores herramientas para la caracterización y evaluación de modelos de ratón de la enfermedad en humanos. La RM es una modalidad excelente para la investigación de animales alterados genéticamente. Es capaz de cobertura de todo el cerebro, se puede utilizar en vivo, y ofrece múltiples mecanismos de contraste para investigar diferentes aspectos de neuranatomy y fisiología. El advenimiento de alto campo escáneres junto con la capacidad de escanear simultáneamente múltiples ratones permite fenotipo rápido de nuevas mutaciones.
Efectiva del ratón estudios de resonancia magnética requieren la atención a muchos aspectos de diseño de experimentos. En este artículo vamos a describir los métodos generales para obtener imágenes de calidad para el fenotipo del ratón mediante un sistema que las imágenes de los ratones al mismo tiempo en la frecuencia de radio protegidos de transmisión / recepción (RF) las bobinas en un imán común (Bock et al., 2003). Nos centramos sobre todo en el fenotipo anatómica, una aplicación importante y accesible que ha mostrado un alto potencial de impacto en modelos de ratón muchos en nuestro centro de formación de imágenes. Antes de que podamos dar los pasos detallados para adquirir este tipo de imágenes, hay importantes consideraciones prácticas, tanto in vivo de imágenes cerebrales (Dazai et al., 2004) y ex vivo de imágenes cerebrales (Spring et al., 2007) que deben tenerse en cuenta. Estos se discuten a continuación.
Protocolo
1. Múltiples imágenes del cerebro de ratón en vivo:
Cuando los animales imágenes en vivo, varias características clave debe estar presente a lo largo de la sesión de imágenes: 1) un método seguro de la anestesia, 2) el control del medio ambiente y 3) la monitorización fisiológica. Además, cuando los sujetos de imágenes de forma simultánea, se añaden complejidad en relación con la facilidad y rapidez de preparación y la reproducibilidad de las posiciones de los animales para facilitar el registro de la imagen. En consecuencia, los tres componentes principales personalizadas se han diseñado y fabricado: un sistema de carga para insertar los ratones en las bobinas de radiofrecuencia dentro de la resonancia magnética, una cámara de inducción para facilitar la preparación y una plataforma de control integrado lleva a estandarizar la posición.
El sistema de carga:
El sistema de carga del mouse se compone de dos partes principales: "conjunto de carga", el "ratón colmena" y la. La función principal de la colmena del ratón es la posición de siete Millipede bobinas de RF (RMN Varian, Palo Alto, CA) en una matriz hexagonal interior de la cavidad del imán. La matriz de carga está diseñado para conservar y transportar varios ratones alojados en tubos de 50 ml centrífuga con agujeros perforados a través de sus consejos para permitir la entrada de gas anestésico. Después de los ratones son anestesiados y la interfaz con el equipo de monitoreo en un área de preparación en las proximidades del imán, que se insertan en los tubos de centrifugación modificado y montado en la matriz de carga. Después de montar todos los ratones, la matriz de carga se transporta y se inserta en el imán y se coloca en un sistema ferroviario. El sistema ferroviario permite a la matriz de par con la sección del ratón cuando se introducen en la cavidad del imán. Cuando esté totalmente insertado en el imán, el muelle de tubos de centrífuga en el sistema de aplicación de anestesia dentro de las bobinas de radiofrecuencia. El isoflurano se mezcla con el oxígeno se suministra desde el final colmena ratón para la muestra a través de un tubo en el eje de cada bobina individual. Esta mezcla de gas anestésico fluye en los tubos, más allá de los ratones y es recogida por una unidad activa de barrido en la pared posterior de la matriz de carga (Figura 1).
La Cámara de inducción:
Desde los tiempos de imagen puede tardar hasta tres horas, minimizando el tiempo de preparación de los animales es crucial para limitar la exposición del ratón a la anestesia. Por lo tanto, hemos desarrollado una cámara de inducción a medida para agilizar el proceso de preparación (Figura 2). La cámara de inducción personalizada crea un ambiente único para la inducción y el manejo de varios ratones. Construida en material acrílico transparente, las características cámara de inducción obturadores de silicona puertos iris para minimizar las fugas de anestesia y permite al usuario acceder al entorno interno sin necesidad de guantes especiales. En comparación con la máscara convencional y los circuitos de un solo ratón, la cámara de inducción es lo suficientemente grande para albergar a un máximo de veinte ratones y permite la manipulación libre de los ratones sin la unión de tubos pesados y máscaras. El equipo se suministra con un flujo constante de gas anestésico que se recogió mediante un sistema pasivo de recolección de residuos. Elementos de calentamiento por resistencia se utilizan para calentar el suelo de la cámara para mantener la temperatura corporal de los animales durante la preparación.
El trineo:
Uno de los aspectos más difíciles y requiere mucho tiempo de preparación de los ratones de la resonancia magnética son la aplicación de electrocardiograma (ECG) electrodos y las sondas de temperatura rectal. Además, muchos de los electrodos convencionales, como la del manguito y los electrodos de aguja, se encontraron a distorsionar la postura del animal por lo que es difícil de estandarizar el posicionamiento. Por lo tanto, hemos desarrollado una forma personalizada-equipada con plataforma de posicionamiento integrado ECG, la respiración y las sondas de temperatura llamado el "trineo" (Patente de EE.UU. 7.146.936) (Figura 3). Restricciones de movimiento a partir de cierres de velcro se utiliza para limitar el movimiento de la cabeza.
Múltiples pasos del ratón en vivo imágenes del cerebro:
- Toda investigación requiere del ratón locales del CAC (Comité de Protección de los Animales), la aprobación de IACUC (Cuidado de Animales institucional y el empleo) o su equivalente para los procedimientos de manejo del ratón.
- Todos los procedimientos tales como la identificación y pesaje de los animales debe realizarse bajo una campana de seguridad biológica (BSC) y en la Unidad de RM. Los animales se transfieren a un recipiente de plástico autoclavable y transportado a la cámara de inducción magnética.
- Los ratones son anestesiados en una cámara de inducción precalentado utilizando el 4% de isoflurano y 4 L / min de oxígeno. Los animales son completamente anestesiados una vez que no responden a la pizca de pata. Piel del pecho se elimina con un removedor de pelo (Nair) si es necesario para proporcionar un mejor contacto con el ECG y los dispositivos de control de la temperatura que se han construido en un trineo tirado por encargo. Salve Eva (Tears Naturale PM) se aplica a los ojos para evitar la sequedad, y aproximadamente 0,3 ml de solución salina se administra por vía subcutánea para mantener la hidratación.
- Gd-DTPA-BMA (Omniscan) puedeutilizar si se desea mejorar el contraste. Si Gd-DTPA se va a utilizar, se diluye en (volumen final 300uL) de solución salina y se administra en una sola dosis de 1 mg / kg antes de la sesión de MR a través de IP.
- Los ratones se cargan en trineos individuales, inmovilizado con correas de la cabeza y caer en abierta tubo cónico de 50 ml (Figura 3). Hasta 7 ratones vivos se pueden escanear a la vez. Una vez que todos los animales sean cargados con la monitorización fisiológica conectados, establecer el nivel de isoflurano en la cavidad del imán al 2% y el nivel de oxígeno a 8 L / min.
- Los tubos cónicos se montan en un sistema de acoplamiento (Figura 1) diseñado para los ratones de manera uniforme en cada posición de la bobina de RF situado en el centro de la cavidad del imán. Una vez cargado, el isoflurano puede ser reducido a 0,9-2%. ECG y la temperatura se controlan en cada animal durante todo el curso de la exploración. Los animales se mantienen calientes durante el curso de la exploración con aire caliente.
- La duración de cada análisis en tres dimensiones es de aproximadamente 3 horas. Los detalles son los siguientes: echo giro rápido con el TR de 2300 ms y 36 ms de TEeff. Echo longitud de los trenes de 8 con un promedio. Resolución de la imagen resultante es de 125 micras (Figura 4).
- Cuando haya finalizado la exploración, los animales son retirados del imán y descarga en una cámara de inducción cálida llena de oxígeno al 100%. Los animales se transfieren a una contenedores sellados de plástico y transportados en un BSC. Se colocan en una jaula sin corrientes de aire cálido y les permitió recuperarse de la anestesia.
2. Múltiples ratón ex vivo imágenes del cerebro:
No se ve afectado por los artefactos de movimiento, fija la RM consigue una mayor resolución de imagen en vivo. De alta resolución, tridimensionales de bases de datos proporcionan la máxima flexibilidad en la extracción de información cuantitativa y permitir el análisis automatizado de imágenes. A medida amplia de la bobina de RF se ha desarrollado en paralelo para la adquisición de 16 conjuntos de datos de alta resolución RM de cráneo fija en cerebros de ratones en la noche sesiones de exploración.
El 16-Coil ex vivo Brain Imaging Array:
Una costumbre-construido de 16 bobina de conjunto de solenoide se ha creado a la imagen de 16 muestras al mismo tiempo. Este diseño mejora en un prototipo anterior utiliza la imagen de tres muestras al mismo tiempo en un conjunto de insertar gradiente de 60 mm. Las bobinas de 8 vueltas más de la herida en los extremos para proporcionar una sensibilidad uniforme a menos de 10% en una longitud de 26 mm y blindaje individual dentro de los compartimentos modulares (Idziak y Haeberlen, 1982). Los 16 compartimentos de la bobina se montan en un marco (Figura 5), que las posiciones de las bobinas en el gradiente y la sujeta en su lugar con una cámara de neumático para reducir al mínimo el movimiento.
Múltiples pasos del ratón ex vivo de imágenes del cerebro:
- Cavidad torácica abierta e inserte la aguja (o un conjunto de seguridad de infusión con alas, 25G X 3 / 4) en el ventrículo izquierdo del corazón de un ratón anestesiado (a través de la inyección intraperitoneal de ketamina (150 mg / kg) y xilazina (10 mg / kg) . Cortar la aurícula derecha.
- Perfusión transcardiaca a ras de la temperatura ambiente 30 ml de 1 X PBS + 1 l / mL de heparina (1000 unidades USP / ml) + 2 mM ProHance con un caudal de aproximadamente 100 ml / hr.
- Aprobar la fijación con 30 ml 4% PFA (temperatura ambiente) + 2 ProHance mm a 100 ml / hr.
- Decapitar y eliminar la piel, la mandíbula inferior, las orejas, punta de la nariz cartilaginosa.
- Colocar el resto de la estructura del cráneo PFA al 4% + 2 mM ProHance la noche a 4 ° C.
- Traslado a 1X PBS + 0,02% azida de sodio + 2 mM ProHance.
- De alta resolución de escaneo tres dimensiones de resonancia magnética en 7 Tesla se produce entre 4 días y no meses, más de 2,5 después de la perfusión. Los cerebros se colocan en una matriz de solenoide de 16 canales de la bobina (Figura 5).
- Los parámetros de imagen son los siguientes: echo giro rápido con TR 325 ms y un TEeff de 30 ms, longitud de los trenes eco de 6 con cuatro promedios. Las imágenes finales tienen una resolución isotrópica de 32 micras (Figura 6) y la duración del análisis es de aproximadamente 12 horas.
- Después de la exploración, el lugar del cráneo en formol al 10% + 2 mM ProHance para su conservación.
3. Los resultados representativos:

Figura 1. El sistema de carga del mouse. La "matriz de carga" y "ratón colmena" conectado con un sistema de tren de fibra de vidrio común.

Figura 2. La cámara de inducción.
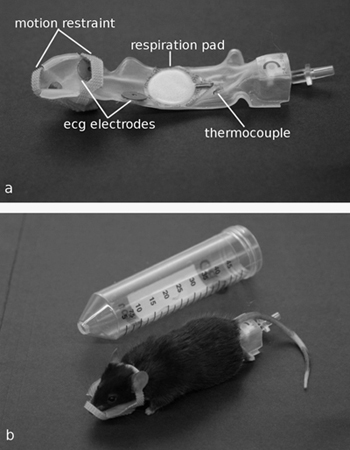
Figura 3. A) El trineo, mostrando integrados sensores de monitoreo y el reposacabezas. b) Un ratón anestesiado en un trineo con el reposacabezas unido. El conjunto del trineo se desliza fácilmente en el tubo de centrífuga.
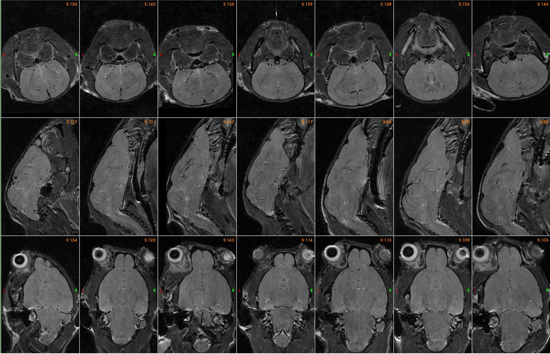
Figura 4. Representación en vivo de imágenes cerebrales múltiples de una tres horas tres análisis dimensional.

Figura 5. 16 canales de serie bobina para la digitalización de 16 muestras de cerebro fijo.
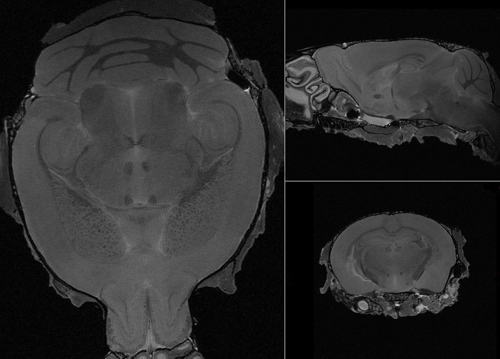
Figura 6. Representante ex-vivo de imágenes del cerebro.
Discusión
Tanto los estudios in vivo y ex vivo de imágenes del ratón temas de imagen de varios sistemas a la vez para aumentar el rendimiento de los estudios de imagen considerablemente sin aumentar el tiempo de imágenes. Las imágenes del cerebro de tanto in vivo y ex vivo de ratón con múltiples técnicas de imagen son de alta calidad y son adecuados para fenotipificación estructuras mayores y menores en el cerebro del ratón, respectivamente.
Para minimizar el tiempo de preparación de muestras de animales varios, la paralelización de los procesos es de suma importancia. Por ejemplo, el desarrollo de la cámara de inducción permitido para la inducción de las muestras de forma simultánea, y el trineo se ha sincronizado a la aplicación del ECG y las sondas de temperatura, mientras que la normalización de la posición del cuerpo. Además, nuestro sistema ex vivo de imágenes nos permite adquirir de alta resolución imágenes en tres dimensiones, de 16 cerebros enteros fijos a la vez que es ideal para los estudios de fenotipo de alto rendimiento.
Las posibles limitaciones de nuestro sistema de imágenes en vivo incluyen la incapacidad para controlar de forma individual de anestesia y de temperatura para cada ratón. Si el control requiere de anestesia individuales pueden ser implementadas con la adición de exclusiva vaporizadores de anestesia para cada ratón. Otra limitación del sistema de imágenes in vivo es que el análisis se limita a los ratones a los que están a menos de aproximadamente 32 gramos. Sin embargo, existe actualmente un plan para aumentar el tamaño de la bobina para dar cabida a los animales más grandes.
Divulgaciones
Agradecimientos
Este trabajo forma parte del Centro de Ratón Imágenes (ratón) en el Hospital for Sick Children y la Universidad de Toronto.
Materiales
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Isoflurane, USP (AErrane) | Baxter | CA2L9108 | ||
| NAIR | Church & Dwight Canada Corp. | |||
| Tears Naturale P.M. | Alcon | DIN 02082519 | ||
| Omniscan (gadodiamide injection USP) | GE healthcare | J-110A | ||
| Custom Sleds | Dazai Research Instruments | |||
| PBS w/o Ca and Mg | Wisent | 311-010-CL | ||
| Heparin 10000USP/10ml | Pharmaceutical Partners of Canada | DIN 02264315 | ||
| ProHance (gadoteridol injection USP) | Bracco Diagnostics | 11181 | ||
| Parafolmadehyde (powder) | Sigma | P-6148-500g | ||
| Sodium Azide | Fisher | S227-100 | ||
| Formalin 10% | Fisher | SF100-4 |
Referencias
- Bock, N. A., Konyer, N. B., Henkelman, R. M. Multiple-mouse MRI. Magn. Reson. Med. 49, 158-167 (2003).
- Dazai, J., Bock, N. A., Nieman, B. J., Davidson, L. M., Henkelman, R. M., Chen, X. J. Multiple mouse biological loading and monitoring system for MRI. Magn. Reson. Med. 52, 709-715 (2004).
- Spring, S., Lerch, J. P., Henkelman, R. M. Sexual dimorphism revealed in the structure of the mouse brain using three-dimensional magnetic resonance imaging. NeuroImage. 35, 1424-1433 (2007).
- Idziak, S., Haeberlen, U. Design and construction of a high homogeneity rf coil for solid-state multiple-pulse NMR. J. Magn. Reson. 50, 281-288 (1982).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados