Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un In Vitro Sistema para el Estudio de latencia del tumor y el salto hacia el crecimiento metastásico
En este artículo
Resumen
Una modificación en 3-D in vitro sistema se presenta en el que las características del crecimiento de varias líneas de células tumorales en la membrana basal reconstituida se correlacionan con el comportamiento inactivo o proliferativa de las células tumorales en un sitio secundario metastásico In vivo.
Resumen
La recurrencia de cáncer de mama a menudo sigue a un período de latencia en el que no hay signos de cáncer y las metástasis pueden no ser clínicamente evidentes hasta muchos años después de la extirpación del tumor primario y la terapia adyuvante. Una probable explicación de este fenómeno es que las células tumorales han sembrado los sitios de metástasis, son resistentes a las terapias convencionales, y permanecer latente durante largos períodos de tiempo 1.4.
La existencia de las células del cáncer latente en sitios secundarios se ha descrito previamente como reposo celdas de aislamiento que no proliferan ni la apoptosis 5-7. Además, estas celdas de aislamiento se ha demostrado que la difusión del tumor primario en una etapa temprana de la progresión de la enfermedad 80-10 y residir crecimiento detenido de nuevo en la médula ósea del paciente, la sangre y los ganglios linfáticos 1,4,11. Por lo tanto, comprender los mecanismos que regulan la latencia o el salto hacia un estado proliferativo es fundamental para el descubrimiento de nuevos objetivos y las intervenciones para prevenir la recurrencia de la enfermedad. Sin embargo, desentrañar los mecanismos que regulan el paso de la latencia del tumor de crecimiento metastásico se ha visto obstaculizada por la falta de sistemas de modelos disponibles.
in vivo y ex vivo sistemas modelo para estudiar la progresión metastásica de las células tumorales se han descrito anteriormente 1,12-14. Sin embargo estos sistemas no han proporcionado el modelo en tiempo real y en una visión de alto rendimiento en forma mecánica lo que desencadena la aparición de células tumorales latentes solitario a proliferar como la enfermedad metastásica. Recientemente hemos desarrollado un sistema in vitro 3D para modelar el crecimiento en las características in vivo de células que presentan un comportamiento metastásico o latente (D2.OR, MCF7, K7M2-AS.46) o proliferativa (D2A1, MDA-MB-231, K7M2) en vivo. Hemos demostrado que las células tumorales que exhiben latencia en vivo en el lugar de la metástasis permanecer en reposo cuando se cultivan en un niño de 3 dimensiones (3D) el extracto de la membrana basal (BME), mientras que las células altamente metastásico in vivo fácilmente proliferan en la cultura 3D después de variables, pero relativamente corto períodos de inactividad. Es importante destacar que mediante la utilización del 3D en el sistema de modelo in vitro se demostró por primera vez que la composición ECM desempeña un papel importante en la regulación de las células tumorales inactivas si se cambia a un estado proliferativo y lo han confirmado en estudios in vivo 15-17. Por lo tanto, el sistema de modelos descritos en este informe proporciona un método in vitro a la latencia modelo de tumor y el estudio de la transición hacia un crecimiento proliferativo inducido por el microambiente.
Protocolo
1. Mantenimiento de los cultivos de células de líneas celulares tumorales metastásicas latentes y
- Crecen las células tumorales inactivas (D2OR / MCF7/K7M2-AS.46) y metástasis (D2A1 / MDA-MB-231 / K7M2) en placas de 10 cm de cultivo que contienen Dulbecco Modificado Medio Eagle (DMEM), la glucosa alta y 10% de suero fetal bovino ( FBS) y antibióticos. Una vez que las células alcanzan el 70-80% de confluencia, proceder a los siguientes ensayos.
2. Ensayo de proliferación celular de las células tumorales inactivas (en reposo) y metástasis (proliferación) cultivadas en un sistema 3D-BME
Cultivo latente / las células metastásicas en el sistema 3D
- Descongele el crecimiento Cultrex factor de reducción del sótano extracto de membrana (BME) en 4 ° C refrigerador una noche antes de llevar a cabo el ensayo. Nota del BME deben ser manejados en el hielo en todo momento.
- Al día siguiente, colocar una placa de 96 pocillos en una bandeja de hielo dentro de una campana laminar. Escudo cada pocillo con 50-100μl de BME fría mediante un dispensador con una jeringa. Asegúrese de que no se forman burbujas en los pozos. Coloque la placa de 96 pozos cubierto con BME en una incubadora humidificada con 5% de CO 2 a 37 ° C durante 30 minutos.
- Mientras tanto aspirar los medios de comunicación de las células tumorales latentes y o metastásico (preparado en la sección 1). Enjuagar las placas de cultivo con 10 ml de tampón fosfato salino pH 7,4 (PBS). Aspirar el PBS y añadir 2 ml de tripsina precalentada a 37 ° C, para las placas de cultivo. Las placas se incuban en un 5% humidificado de CO 2 a 37 ° C, durante 5 minutos.
- La transferencia de células a un tubo cónico de 15 ml que contienen 5 ml de glucosa en DMEM alto suplementado con 10% FCS y antibióticos y el recuento de las células.
- Centrifugar el número total de células que se cultivaron en una centrífuga de cultivo de tejidos a una velocidad de 1500 g, a temperatura ambiente durante 5 min. En nuestros ensayos preparamos 2X10 3 células / pocillo para cada línea celular o un punto de tiempo para ser examinados. Sin embargo, esto puede variar dependiendo de las líneas celulares.
- Con cuidado, aspirar el sobrenadante. Tenga en cuenta, en la mayoría de los casos la pastilla no es visible. Por lo tanto, dejar un poco detrás de los medios de comunicación. Toque en la parte inferior del tubo cónico de 15 ml con los dedos para asegurarse de que una suspensión de células individuales se obtiene. Vuelva a suspender el pellet con la glucosa baja DMEM con antibióticos suplementado con 2% FCS BME + 2% (ensayo de los medios de comunicación). 100 l de los medios de prueba deberá ser agregado por cada 2x10 3 células. Triturar las células muchas veces con una pipeta de 5 ml para asegurarse de que una única suspensión de células se mantiene.
- Una placa 100μl de la mezcla de células por pozo en la parte superior de los 96 y placa recubierta BME. Para la evaluación de antecedentes (en la sección 2.8) en la placa 100μl además por pocillo de ensayo sólo los medios de comunicación en la parte superior de la placa de recubrimiento 96 y BME. Incubar el cultivo en placas de 96 y un 5% humidificado incubadora de CO 2 a 37 ° C. Las células deben ser re-alimentados cada 4 días con los medios de prueba.
Proliferación de ensayo:
- Ensayo de proliferación de las células: añadir a los pozos en el momento deseado puntos de 20 l de la titulación de la célula 96 Una solución acuosa kit de ensayo de proliferación celular. Incubar humidificado en un 5% de CO 2 incubadora a 37 ° C durante 2 horas. El uso de un lector de placas ELISA registro de la absorbancia a 490nm. Para la evaluación de antecedentes y resta, añadir 20μl del título de la célula 96 Una solución acuosa kit de ensayo de proliferación de células de pozos revestidos con pre BME y sólo cubierta con los medios de ensayo. El uso de un lector de placas ELISA registro de la absorbancia a 490 nm.
3. Inmunofluorescencia para las moléculas de señalización celular en la inactiva (latente) las células tumorales y / o metastásico (proliferación) las células tumorales
Cultivo latente / las células metastásicas en el sistema 3D para la tinción immunfluorescence
* El siguiente protocolo es una modificación de un protocolo de cultivo en 3D publicado por Debnath J et al 18.
- BME preparar como se describe en la sección 2.1. Al día siguiente: establecer un sistema de vaso de 8 cámaras de diapositivas en una bandeja de hielo dentro de una campana laminar. Escudo cada pocillo con 50 ul de helado de BME con una 200μl Pipetman. Asegúrese de que BME se distribuye uniformemente y no se forman burbujas en los pozos. Colocar la placa de la cámara 8 de vidrio recubierta de BME en un 5% humidificado de CO 2 a 37 ° C durante 20 min.
- Cosecha o latente y las células metastásicas de la sección 1 y preparar a la cultura tal como se describe en la sección 2.3 a 2.4. Recoge el número total de células que se cultivaron en un tubo cónico de 15 ml. Preparamos 5 x 10 3 células / pocillo para cada línea celular y el punto de tiempo para ser examinados. Centrifugar las células en una centrífuga de cultivo de tejidos a una velocidad de 1500 g, a temperatura ambiente durante 5 min. Aspirar el sobrenadante con cuidado. Tenga en cuenta que la pastilla no es visible, por lo que dejan detrás de algunos medios de comunicación. Toque en la parte inferior del tubo cónico de 15 ml con los dedos para asegurarse de que una única suspensión de células se obtiene.Vuelva a suspender el pellet con los medios de prueba. 400μl de los medios de prueba deberá ser agregado por cada 5x10 3 células. Triturar las células muchas veces con una pipeta de 5 ml. Este paso es muy importante asegurarse de que la única suspensión de células se mantiene.
- 400μl plato de la mezcla de células por pozo en la parte superior de cada una de las 8 cámaras recubiertas con BME. Incubar el cultivo vaso de 8 cámaras de sistema de diapositivas en un 5% humidificado incubadora de CO 2 a 37 ° C. Las células deben ser re-alimentados cada 4 días con los medios de prueba.
La tinción de inmunofluorescencia:
- En los puntos de tiempo deseado, aspirado de la capa superior de los medios de comunicación y añadir 200μl de fijador que contiene 4% de paraformaldehído (PFA), 5% de sacarosa y 0,1% de Triton X-100 y se incuban a temperatura ambiente durante 5 minutos. Aspirar el fijador y añadir 200μl de PFA al 4% que contiene sacarosa al 5% e incubar a temperatura ambiente durante 25 minutos.
- Aspirar el fijador; añadir 400 l de tampón fosfato salino (PBS) a cada pocillo. Incubar durante 10 minutos a temperatura ambiente. Aspirar el PBS y añadir 400 μ PBS que contenía 0,05% de Tween 20 durante 10 minutos a temperatura ambiente.
- Bloquear las células fijas a temperatura ambiente con 200μl de cualquiera de burro 10% de suero o con BSA al 3% durante 1 hora (solución de bloqueo que se utiliza debe ser determinada empíricamente para cada anticuerpo primario).
- Aspirar la solución de bloqueo y añadir 200μl del anticuerpo primario (dilución debe ser determinada empíricamente para cada anticuerpo primario que se utiliza). Diluir el anticuerpo primario en el suero de burro al 10% si el 10% de suero asno fue utilizado para bloquear o diluir el anticuerpo primario de 3% de BSA, si el 3% BSA solución de bloqueo se utiliza. Incubar con el anticuerpo primario durante la noche a 4 ° C.
- Aspirar el anticuerpo, lavar los pocillos con 400μl PBS durante 15 minutos y repetir dos veces. Aspirar el PBS y añadir 200μl de burro anti-respectiva-IgG conjugado con rodamina rojo (dilución debe ser determinada empíricamente), la cubierta de la diapositiva cámara de 8 con papel de aluminio y se incuba durante 1 hora a temperatura ambiente.
- Lavar los pocillos con PBS 400μl (3x15 minutos cada lavado). Aspirar PBS. Montadas con Vectashield medio de montaje con DAPI. Portaobjetos secos durante 40 minutos a temperatura ambiente en la oscuridad. Las diapositivas se pueden conservarse durante una semana a 4 ° C. Tienda de las diapositivas en la oscuridad. Imagen se desliza por microscopía confocal.
4. Los resultados representativos:
Un ejemplo de un análisis de la proliferación de la D2.0R latente y metastásico D2A1 las células tumorales en la cultura en 3D se muestra en la Figura 1. Células D2.0R están inactivos (inactivo) a través de todo el período experimental 14 días mientras que la cultura altamente metastásico D2A1 células permanecen inactivas sólo de cuatro a seis días después de que empiezan a proliferar. Durante la fase de letargo inicial, muchas células permanecen solitarios en la cultura 3-D (Figura 1 B, el día 4), mientras que otras células no proliferantes forma esferoides multicelulares. La transición de D2A1 células de un inactivo a estado proliferativo en 3-D de cultivo (Figura 1B, día 12) se asocia con cambios drásticos en la morfología celular. Por lo tanto, este ensayo puede ser utilizado para probar qué factor / s pueden desencadenar las células inactivas D2.0R a salir de su estado latente y qué factor / s puede prevenir D2A1 células de transición de su estado latente. Figura 2 es un ejemplo de un agente la prevención de D2A1 células de transición de un estado latente de proliferación. Como se ilustra en la Figura 2, los tratamientos de D2A1 células con un inhibidor específico de la cinasa de cadena ligera de miosina (ML-7) mantiene D2A1 células en un estado latente.
Señalización celular en las células tumorales latentes y la proliferación de cultivos en el sistema 3D puede ser estudiada por inmunofluorescencia para las moléculas de señalización celular. Como se ilustra en la Figura 3 un aumento significativo en la fosforilación de la miosina de cadena ligera en D2A1 células (tinción con rojo), seguido por la reorganización de los filamentos de actina F que forman las fibras de actina estrés (tinción verde) se produce durante la transición de la latencia (1-4 días) proliferación (día 7). Sin embargo, el bloqueo de la cadena ligera de la miosina actividad de la cinasa en las células D2A1 por ARNhc o medicamento específico (ML-7) mantiene D2A1 células en un estado latente y los resultados en la inhibición de la fosforilación de la miosina de cadena ligera y F-actina organización de fibra de estrés (Figura 4).
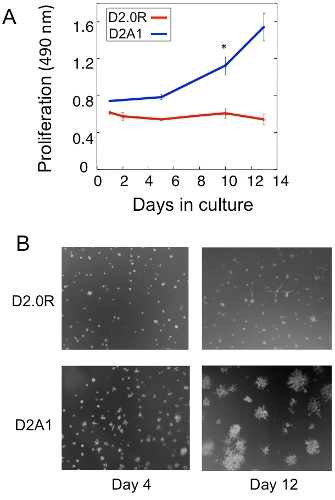
Figura 1. Modelo in vitro para estudiar la latencia de aislamiento de las células tumorales y el cambio hacia el crecimiento metastásico. A) La proliferación de D2.0R latente y D2A1 metastásico en 3-D BME Cultrex, n = 8 (media ± DE). Los resultados representativos de tres experimentos (* p ≤ 0,05). B) Las imágenes de microscopía de luz y las células de D2.0R D2A1 cultivadas en 3-D x20 aumentos Cultrex BME.Figura modificada de Barkan et al 17.
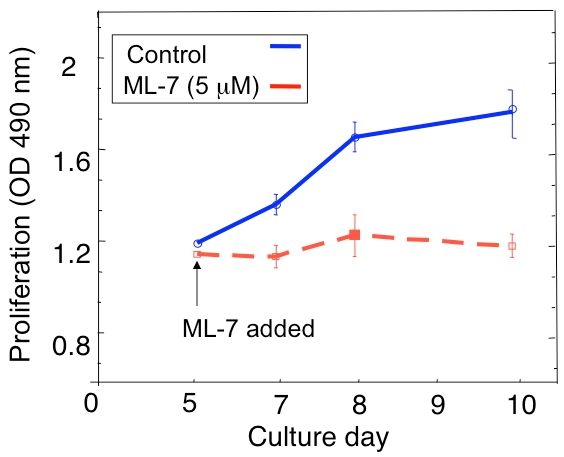
Figura 2. Evitar que el interruptor de D2A1 células de latencia (reposo) a la proliferación en el sistema de cultivo en 3D mediante la inhibición de la cinasa de cadena ligera de miosina (MLCK). Curso del tiempo de la proliferación celular D2A1 cultivadas en 3-D BME Cultrex, n = 8 (media ± DE). Las células fueron tratadas (control), o tratados con un inhibidor específico de MLCK (ML-7, 5 M) para el comienzo de 48 horas en el día de la cultura 5. Figura modificada de Barkan et al 17.
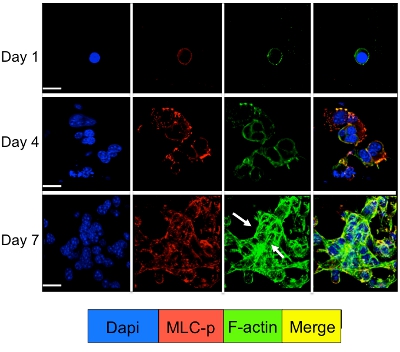
Figura 3. Fosforilación de la miosina de cadena ligera seguida por la reorganización de F-actina durante el cambio de D2A1 células de latencia de crecimiento proliferativo. D2A1 células fueron cultivadas en 3-D BME Cultrex el 8 de portaobjetos de vidrio de cámara. Las células fueron fijadas y teñidas con DAPI (azul) para la localización nuclear, phalloidin (verde) de F-actina y con un anticuerpo contra la forma fosforilada de la cadena ligera de la miosina (MLC-p) (rojo), como se indica en diversos puntos temporales. Fusión de la F-actina, y MLC-p coloración (amarillo). Expresión de la CTM-p se incrementó durante la transición de las células D2A1 de latencia (días1-4) para el crecimiento proliferativa (día 7) seguido por la formación de fibras de actina estrés (flechas). La microscopía confocal, la ampliación x63. Barra blanca es igual a 20 micras. Figura modificada de Barkan et al 17.
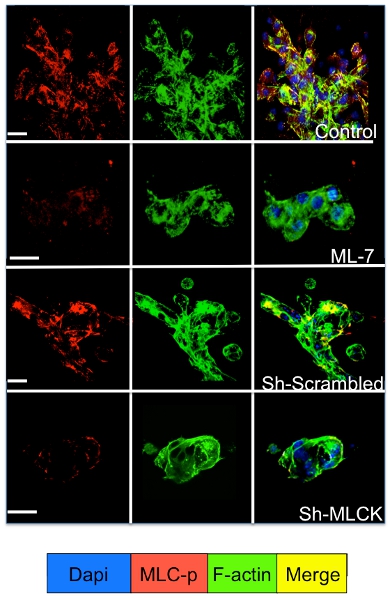
Figura 4. . Inhibición de la quinasa de cadena ligera de miosina (MLCK) mediada por la F-actina formación de fibras de estrés en las células D2A1 D2A1 Las células fueron tratadas (control), o tratados con un inhibidor de la MLCK (ML-7, 5 M), para el inicio de 48 horas en el día de la cultura 5, o tratados con huevos revueltos o ARNhc MLCK y teñidas de la forma fosforilada de la cadena ligera de la miosina (MLC-p) (rojo), f-actina (verde), y los núcleos (azul). Fusión de la F-actina, y MLC-p coloración (amarillo). La microscopía confocal, la ampliación x63. Barra blanca es igual a 20 micras.
Discusión
Los mecanismos subyacentes que mantienen difundido las células tumorales en un estado latente o como resultado de su transición hacia un crecimiento metastático siguen siendo desconocido. Este fenómeno ha sido muy difícil de estudiar en pacientes humanos 4,12 y pocos modelos preclínicos se han desarrollado para abordar esta cuestión. Sin embargo, algunos en vivo y ex vivo modelos de sistemas de latencia del tumor se han caracterizado (revisado en 1,12). Sin embargo, los
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Esta investigación fue financiada en parte por el Programa de Investigación Intramural del Instituto Nacional del Cáncer.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| DMEM altos de glucosa | Invitrogen | 11965-118 | |
| DMEM bajos de glucosa | Invitrogen | 11885-092 | |
| De suero fetal bovino (SFB) | Invitrogen | 10091-148 | |
| El factor de crecimiento reducido en 3-D Sótano Cultrex extracto de membrana | Trevigen Inc. | Concentración de proteínas entre 14-15mg/ml | |
| D2.0R D2A1 y líneas celulares | 5,19 | ||
| K7M2 y K7M2AS1.46 células | 20 | ||
| MCF-7 y MDA-MB-231 células de cáncer de mama | ATCC | ||
| Un vaso de 8 cámara de diapositivas del sistema | (Lab-Tek, Thermo Scientific) | 177402 | |
| Celular Titer 96 Una célula acuosa Solución proliferación kit de ensayo | Promega | G3580 | |
| Vectashield medio de montaje con DAPI | Vector Laboratories Inc. | H-1200 | |
| Suero normal de burro | Jackson ImmunoResearch | 017-000-121 | |
| Lector de placas ELISA | Bio-Tec | 490nm registro | |
| Microscopio confocal | Zeiss-LSM-510 | Ampliación x63 |
Referencias
- Aguirre-Ghiso, J. A. Models, mechanisms and clinical evidence for cancer dormancy. Nat Rev Cancer. 7, 834-846 (2007).
- Pantel, K., Woelfle, U. Micrometastasis in breast cancer and other solid tumors. J Biol Regul Homeost Agents. 18, 120-125 (2004).
- Naumov, G. N. Ineffectiveness of doxorubicin treatment on solitary dormant mammary carcinoma cells or late-developing metastases. Breast Cancer Res Treat. 82, 199-206 (2003).
- Klein, C. A. Framework models of tumor dormancy from patient-derived observations. Curr Opin Genet Dev. , (2010).
- Naumov, G. N. Persistence of solitary mammary carcinoma cells in a secondary site: a possible contributor to dormancy. Cancer Res. 62, 2162-2168 (2002).
- Townson, J. L., Chambers, A. F. Dormancy of solitary metastatic cells. Cell Cycle. 5, 1744-1750 (2006).
- Chambers, A. F., Groom, A. C., MacDonald, I. C. Dissemination and growth of cancer cells in metastatic sites. Nat Rev Cancer. 2, 563-572 (2002).
- Pantel, K. Differential expression of proliferation-associated molecules in individual micrometastatic carcinoma cells. J Natl Cancer Inst. 85, 1419-1424 (1993).
- Demicheli, R. Tumour dormancy: findings and hypotheses from clinical research on breast cancer. Semin Cancer Biol. 11, 297-306 (2001).
- Braun, S. A pooled analysis of bone marrow micrometastasis in breast cancer. N Engl J Med. 353, 793-802 (2005).
- Pantel, K., Alix-Panabieres, C., Riethdorf, S. Cancer micrometastases. Nat Rev Clin Oncol. 6, 339-351 (2009).
- Goss, P. E., Chambers, A. F. Does tumour dormancy offer a therapeutic target. Nat Rev Cancer. 10, 871-877 (2010).
- Mendoza, A. Modeling metastasis biology and therapy in real time in the mouse lung. J Clin Invest. 120, 2979-2988 (2010).
- Naumov, G. N. A model of human tumor dormancy: an angiogenic switch from the nonangiogenic phenotype. J Natl Cancer Inst. 98, 316-325 (2006).
- Barkan, D. Metastatic growth from dormant cells induced by a col-I-enriched fibrotic environment. Cancer Res. 70, 5706-5716 (2010).
- Barkan, D., Green, J. E., Chambers, A. F. Extracellular matrix: A gatekeeper in the transition from dormancy to metastatic growth. Eur J Cancer. , (2010).
- Barkan, D. Inhibition of metastatic outgrowth from single dormant tumor cells by targeting the cytoskeleton. Cancer Res. 68, 6241-6250 (2008).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30, 256-268 (2003).
- Morris, V. L. Mammary carcinoma cell lines of high and low metastatic potential differ not in extravasation but in subsequent migration and growth. Clin Exp Metastasis. 12, 357-367 (1994).
- Khanna, C. The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis. Nat Med. 10, 182-186 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados