このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
アンインビトロシステム
要約
in vitroの系で修正された3 - Dは、再構成基底膜におけるいくつかの腫瘍細胞株の増殖特性が転移セカンダリサイトでの腫瘍細胞の休眠や増殖挙動と相関した表示されます in vivoで。
要約
乳がんの再発はしばしば癌の徴候がないている、長い潜伏期間の後に、転移は原発腫瘍の除去と術後補助療法後何年までは臨床的に明らかになる場合があります。この現象の可能性のある説明は、腫瘍細胞は、転移部位を播種した従来の治療に耐性がある、との時間1〜4の長時間休止状態のままいることです。
セカンダリサイトで休止状態の癌細胞の存在はどちらも増殖されず、アポトーシス5-7を受ける静止孤独な細胞として、以前に記載されている。また、これらの孤独な細胞は、病気の進行8-10の初期段階で原発腫瘍から普及し、患者の骨髄、血液とリンパ節1,4,11で成長逮捕に存在することが示されている。したがって、休眠や増殖状態への切り替えを制御するメカニズムを理解することが病気の再発を防ぐために、新たな目標と介入を発見するために重要です。しかし、転移性増殖する腫瘍の休眠からスイッチを制御するメカニズムを解明することは可能なモデルシステムの不足によって妨げられている。
生体細胞と腫瘍細胞の転移の進行を研究するために生体外でのモデル系で以前に1,12-14記載されている。しかし、これらのモデルシステムは、リアルタイムに、高スループットの方法転移性疾患として増殖することが孤独な休眠腫瘍細胞の出現を誘発するものに機械的な洞察で提供していない。我々は最近(D2A1、MDA - MB - 231、K7M2)のどちらか休眠(D2.OR、MCF7、K7M2 - AS.46)または増殖転移挙動を示す細胞のin vivoでの増殖特性でモデル化するためにin vitroの系で 3Dを開発しました。 生体インチ我々は、転移部位での生体内で休眠を示す腫瘍細胞が3次元(3D)基底膜抽出物(BME)で培養すると、in vivoで高転移性細胞が容易に変数の後に3次元培養中で増殖するのに対し、静止したままであるが、比較的短いことが明らかに休止の期間。重要なのはin vitroのモデル系で 3Dを活用して我々は、ECM組成物は休眠腫瘍細胞が増殖状態に切り替わると、in vivo試験15から17 で 、これを確認したかどうかを制御するのに重要な役割を果たしていることを初めて示した。したがって、本報告書で説明されているモデル系は、in vitro法で腫瘍の休眠をモデル化し、微小環境が誘導される増殖性成長への移行を研究するために用意されています。
プロトコル
1。休眠性および転移性腫瘍細胞株の細胞培養のメンテナンス
- ダルベッコ変法イーグル培地(DMEM)高グルコースおよび10%ウシ胎児血清を(含む10 cm培養プレート中で休眠成長(D2OR / MCF7/K7M2-AS.46)と転移性腫瘍細胞(D2A1 / MDA - MB - 231 / K7M2) FBS)および抗生物質。細胞が70-80%のコンフルエントに到達すると、以下のアッセイに進んでください。
2。休眠(静止)と転移性(増殖)腫瘍細胞の細胞増殖アッセイでは、3D - BME系で培養
3D系の培養休眠/転移性細胞
- アッセイを実施する前に4の融解Cultrexの成長因子-低減基底膜抽出物(BME)は、℃の冷蔵庫夜を。 BMEは常に氷上で処理する必要があります注意してください。
- 翌日に、層流フードの内側氷のトレイに96ウェルプレートを配置。注射器とディスペンサーを用いて氷冷BMEの50 -100μLでコーティング各ウェルを。は気泡がウェル内に形成されていないことを確認してください。 37℃、5%CO 2の加湿インキュベーター℃で30分間のBMEでコートした96ウェルプレートを置きます。
- 一方で休眠したり、転移性腫瘍細胞(セクション1で調製した)から培地を吸引除去する。 10 mlのリン酸塩は生理食塩水、pH7.4の(PBS)をバッファで培養プレートをすすぎます。培養プレートにPBSと追加2ミリリットルトリプシンで37予め温めておいた° Cを、吸引除去する。 37加湿5%CO 2で培養する° C、5分間。
- 10%FCSと抗生物質を補充したDMEM高グルコースの5mlを含む15 mlのコニカルチューブに細胞を移し、細胞を数えます。
- 5分間、室温で、1500グラムの速度で組織培養の遠心で培養される細胞数をスピンダウン。私たちのアッセイでは、検査する各細胞株や時間の点のために/よく2X10 3細胞を準備します。しかし、これは、使用細胞株によって異なる場合があります。
- 注意深く上清を吸引除去する。 (注)は、ほとんどの場合、ペレットは表示されません。そのため、背後にあるいくつかのメディアを残す。単一細胞の懸濁液が得られることを保証するために、指で15ミリリットルコニカルチューブの底をタップします。ペレットは、2%FCS + 2%BME(アッセイ培地)を添加した抗生物質によるDMEM低グルコースで再懸濁する。アッセイ培地を100μlごとに2 × 3セルを追加する必要があります。単一の細胞懸濁液が維持されていることを保証するために5ミリリットルピペットで細胞を何度もひいて粉にする。
- プレートの細胞混合液100μl当たり96ウェルBMEコーティングしたプレートの上に。のためのバックグラウンド評価(セクション2.8で)付加100μlのウェル当たり96ウェルBMEコーティングしたプレートの上に唯一のアッセイ培地のプレート。 37加湿5%CO 2インキュベーターで培養96ウェルプレートをインキュベート℃に細胞はアッセイ培地で4日ごとに再供給されるべきである。
増殖アッセイ:
- 細胞の増殖アッセイ:希望する時にウェルに追加するには、セルの力価96水溶液Oneソリューションの細胞増殖アッセイキットの20μlを指しています。 2時間、37℃で加湿5%CO 2インキュベーター中でインキュベートする。 490nmのELISAプレートリーダーレコード吸光度を使用する。バックグラウンドの評価と減算の場合は、BMEでコートされたとのみアッセイ培地を重ねて井戸の事前にセルの力価96水溶液Oneソリューションの細胞増殖アッセイキットの20μlのを追加します。 490nmでELISAプレートリーダーレコード吸光度を使用する。
3。および/または転移性(増殖)休眠(静止)腫瘍細胞腫瘍細胞における細胞シグナル伝達分子のための免疫蛍光染色
immunfluorescence染色用の3Dシステムで培養休眠/転移性細胞
*以下のプロトコルは、Debnath J ら 18日までに発行された3次元培養のプロトコルを変更したものです。
- としてセクション2.1で説明BMEを準備します。翌日:層流フード内氷のトレイの代わりに、8室のガラススライドのシステムを。 200μlのpipetmanを使用して氷冷BMEの50ULと各ウェルコート。 BMEが均等に分散され、気泡がウェル内に形成されていないことを確認してください。 20分間37℃、加湿5%CO 2でBMEでコートされた8室のガラススライド° Cを置きます。
- セクション1とセクション2.3から2.4で説明したように文化のための準備から収穫休眠したり、転移性細胞。 15 mlコニカルチューブで培養される細胞の総数を収集する。我々は/よく検査される各細胞株と時点を5 × 10 3個を準備。 5分間、室温で、1500グラムの速度で組織培養の遠心で細胞をスピンダウン。注意深く上清を吸引除去する。ペレットが表示されていないことに注意しているので背後にあるいくつかのメディアを残す。単一の細胞懸濁液が得られることを保証するために、指で15ミリリットルコニカルチューブの底をタップします。アッセイ培地でペレットを再懸濁する。アッセイ培地の400μlごとに5 × 3セルを追加する必要があります。 5ミリリットルピペットで細胞を何度もひいて粉にする。このステップでは、単一の細胞懸濁液が維持されていることを保証するために非常に重要です。
- BMEでコートされた8室の各々の上にウェルあたりの細胞混合物のプレートを400μl。 37℃加湿5%CO 2インキュベーターで培養8室のガラスのスライドシステム℃にインキュベートする。細胞はアッセイ培地で4日ごとに再供給されるべきである。
免疫蛍光染色:
- 希望する時点で、メディアの上層を吸引除去し、4%パラホルムアルデヒド(PFA)、5%スクロースおよび0.1%トリトンX - 100を含む固定液の200μlのを追加し、室温で5分間インキュベートする。固定液を吸引し、25分間室温で5%スクロースとインキュベートを含む4%PFAの200μlのを追加します。
- 固定液を吸引、リン酸塩の追加を400μlを各ウェルに(PBS)緩衝生理食塩水。室温で10分間インキュベートする。 PBSを吸引し、400μPBSで室温で10分間、0.05%Tween 20を含むを追加します。
- どちらかの10%ロバ血清の200μlの、または1時間の3%のBSA(使用されるブロッキング溶液を各一次抗体のために経験的に決定されるべきである)と室温で固定された細胞をブロックする。
- ブロッキング溶液を吸引除去し、一次抗体(希釈が使用する各一次抗体のために経験的に決定する必要がある)の200μlのを追加します。 10パーセントロバ血清をブロッキングまたは3%BSAブロッキング溶液が使用されている場合、3%BSAで一次抗体を希釈するために使用されていた場合、10%ロバ血清中に一次抗体を希釈します。 4℃で一晩一次抗体とインキュベート℃に
- 抗体を吸引、15分間400μlPBSでウェルを洗浄し、二回繰り返す。 PBSを吸引し、ローダミン、赤色(希釈は、経験的に決定されるべきである)に結合ロバ抗それぞれ- IgGの200μlのを追加し、室温で1時間、アルミ箔とインキュベートした8チャンバースライドをカバーしています。
- 400μlPBS(3x15分各洗浄)でウェルを洗ってください。 PBSを吸引除去する。 VECTASHIELDはDAPIでメディアをマウントするとマウント。暗所で室温で40分間乾燥したスライド。スライドは4℃で1週間のために保持することができます暗闇の中でスライドを保存する。画像は、共焦点顕微鏡でスライドします。
4。代表的な結果:
3D文化における休眠D2.0Rと転移性D2A1腫瘍細胞の増殖の解析の例を図1Aに示されています。高転移D2A1細胞だけが増殖を開始した後4〜6日のために休止状態のまま、一方D2.0R細胞が全体の実験的な14日間の培養期間を通じて、(静止)休止状態です。他の非増殖細胞は多細胞スフェロイドを形成するのに対し、初期休眠期の間に、多くの細胞が3次元培養(4日目図1B)で孤独なままです。 3次元培養( 図1B、12日目)で休眠から増殖状態にD2A1細胞の転移は、細胞の形態の劇的な変化に関連付けられています。したがって、このアッセイは、どのような因子をテストするために使用することができます/ sはその休眠状態から出現する休眠D2.0R細胞を誘発する可能性があり、どのような要因は、/ sはその休眠状態からの遷移にD2A1細胞を防ぐことができます。 図2は、エージェントの例です。休眠から増殖状態に移行するD2A1細胞を防止。 図2に示すように、ミオシン軽鎖キナーゼの特異的阻害剤とD2A1細胞(ML - 7)の治療は、休眠状態にD2A1細胞を維持した。
3Dシステムで培養休眠と増殖腫瘍細胞において細胞内シグナル伝達は、細胞シグナル伝達分子のための免疫蛍光染色によって調べることができます。 図3に示すように、アクチンストレスファイバー(緑色の染色)を形成するF -アクチンフィラメントの再編が続くD2A1細胞(赤染色)におけるミオシン軽鎖のリン酸化の有意な増加は、休眠状態からの移行時に発生します(1-4日)へ増殖(7日)。しかし、shRNAまたは特定の薬剤(ML - 7)でD2A1細胞におけるミオシン軽鎖キナーゼ活性をブロックすることはD2A1休眠状態の細胞とミオシン軽鎖のリン酸化およびF -アクチンのストレスファイバーの組織( 図4)の阻害の結果を保持します。
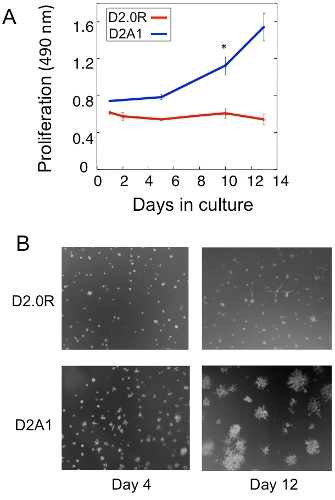
図1 in vitroモデルで孤立性腫瘍細胞の休眠と転移の成長への切り替えを検討する。 3 - D Cultrex BMEで休眠D2.0Rと転移D2A1のA)拡散、N = 8(± SEを意味する)。三つの実験(* P≤0.05)の代表的な結果。 B)D2.0RとD2A1細胞の光学顕微鏡像は3次元Cultrex BMEの倍率x20かで培養。図はBarkanら17から変更。
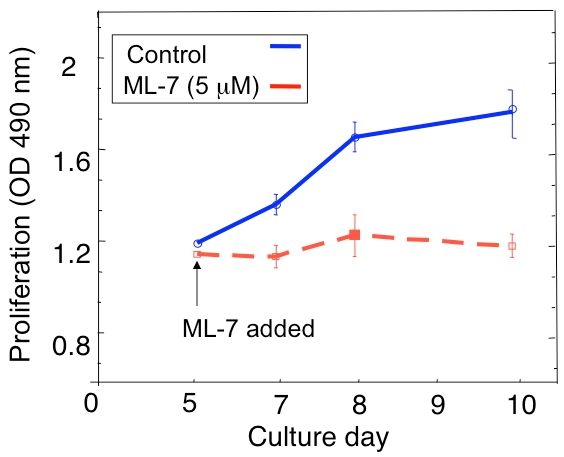
図2。ミオシン軽鎖キナーゼ(MLCK)の阻害により、3次元培養系での休眠(静止)から増殖までD2A1細胞のスイッチを防止 。 3 - D Cultrex BME、N = 8(± SEを意味する)で培養D2A1細胞増殖の時間経過。細胞は、(コントロール)未処理だった、またはMLCKの特異的阻害剤(ML - 7、5μM)で処理し、培養5日目に48時間の始まりのために。図はBarkanら17から変更。
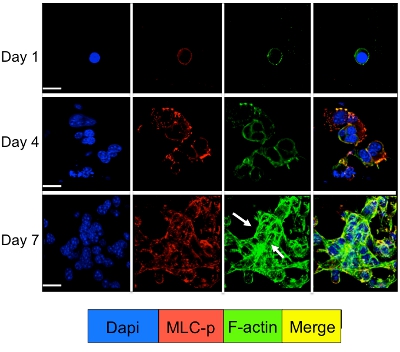
図3。休眠から増殖成長へD2A1細胞のスイッチの間にF -アクチンの再編成に続いてミオシン軽鎖のリン酸化 。 D2A1細胞は、8室のガラススライド上に3 - D Cultrex BMEで培養した。細胞を固定し、核局在化のためのDAPI(青)、F -アクチンのファロイジン(緑色)でとのような種々の時点で示されたミオシン軽鎖(MLC - P)(赤)、のリン酸化体に対する抗体で染色した。 F -アクチンのマージ、およびMLC - P染色(黄色)。 MLC - Pの発現は、休眠(days1 - 4)からアクチンストレスファイバーの形成(矢印)に続いて、増殖成長(7日目)にD2A1セルの遷移中に増加した。共焦点顕微鏡、倍率X63。白いバーは20ミクロンに等しい。図はBarkanら17から変更。
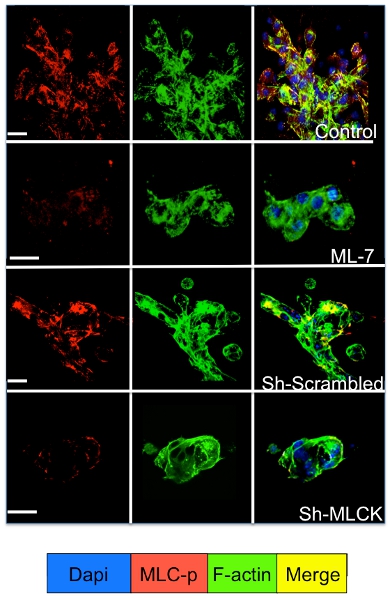
図4。ミオシン軽鎖キナーゼの阻害(MLCK)D2A1細胞で介したF -アクチンのストレスファイバーの形成 D2A1細胞(コントロール)未処理だった、またはMLCK阻害剤(ML - 7、5μM)で処理した。、文化の日に48時間の始まりのために5、またはスクランブルまたはMLCK shRNAをで処理し、ミオシン軽鎖(MLC - P)(赤)、F -アクチン(緑)、および核(青)のリン酸化形態のために染色。 F -アクチンのマージ、およびMLC - P染色(黄色)。共焦点顕微鏡、倍率X63。白いバーは20ミクロンに等しい。
ディスカッション
転移性の成長への移行を検討されて休止状態または結果で腫瘍細胞を播種維持のメカニズムはほとんどわかっていない。この現象は、この問題に対処するために開発されている人間の患者4,12およびいくつかの前臨床モデルで勉強することは極めて困難されています。それにもかかわらず、腫瘍休眠の in vivo および ex - vivoモデル系の一部は(1,12のレ...
開示事項
利害の衝突は宣言されません。
謝辞
この研究は国立癌研究所の学内研究プログラムによって部分的にサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| DMEM高グルコース | インビトロジェン | 11965-118 | |
| DMEM低グルコース | インビトロジェン | 11885-092 | |
| ウシ胎児血清(FBS) | インビトロジェン | 10091-148 | |
| 成長因子減少の3 - D Cultrex基底膜抽出物 | Trevigen株式会社 | 14-15mg/mlの間のタンパク質濃度 | |
| D2.0RとD2A1細胞株 | 5,19 | ||
| K7M2とK7M2AS1.46細胞 | 20 | ||
| MCF - 7およびMDA - MB - 231乳癌細胞 | ATCC | ||
| 8室のガラスのスライドシステム | (ラボ- TEK、サーモ科学) | 177402 | |
| 細胞力価96水溶液Oneソリューションの細胞増殖アッセイキット | プロメガ | G3580 | |
| VECTASHIELDはDAPIでメディアをマウントする | ベクターラボラトリーズ(株) | H - 1200 | |
| 通常のロバ血清 | ジャクソンイムノ | 017-000-121 | |
| ELISAプレートリーダー | バイオテック | 記録490nmの | |
| 共焦点顕微鏡 | ツァイスLSM - 510 | 倍率X63 |
参考文献
- Aguirre-Ghiso, J. A. Models, mechanisms and clinical evidence for cancer dormancy. Nat Rev Cancer. 7, 834-846 (2007).
- Pantel, K., Woelfle, U. Micrometastasis in breast cancer and other solid tumors. J Biol Regul Homeost Agents. 18, 120-125 (2004).
- Naumov, G. N. Ineffectiveness of doxorubicin treatment on solitary dormant mammary carcinoma cells or late-developing metastases. Breast Cancer Res Treat. 82, 199-206 (2003).
- Klein, C. A. Framework models of tumor dormancy from patient-derived observations. Curr Opin Genet Dev. , (2010).
- Naumov, G. N. Persistence of solitary mammary carcinoma cells in a secondary site: a possible contributor to dormancy. Cancer Res. 62, 2162-2168 (2002).
- Townson, J. L., Chambers, A. F. Dormancy of solitary metastatic cells. Cell Cycle. 5, 1744-1750 (2006).
- Chambers, A. F., Groom, A. C., MacDonald, I. C. Dissemination and growth of cancer cells in metastatic sites. Nat Rev Cancer. 2, 563-572 (2002).
- Pantel, K. Differential expression of proliferation-associated molecules in individual micrometastatic carcinoma cells. J Natl Cancer Inst. 85, 1419-1424 (1993).
- Demicheli, R. Tumour dormancy: findings and hypotheses from clinical research on breast cancer. Semin Cancer Biol. 11, 297-306 (2001).
- Braun, S. A pooled analysis of bone marrow micrometastasis in breast cancer. N Engl J Med. 353, 793-802 (2005).
- Pantel, K., Alix-Panabieres, C., Riethdorf, S. Cancer micrometastases. Nat Rev Clin Oncol. 6, 339-351 (2009).
- Goss, P. E., Chambers, A. F. Does tumour dormancy offer a therapeutic target. Nat Rev Cancer. 10, 871-877 (2010).
- Mendoza, A. Modeling metastasis biology and therapy in real time in the mouse lung. J Clin Invest. 120, 2979-2988 (2010).
- Naumov, G. N. A model of human tumor dormancy: an angiogenic switch from the nonangiogenic phenotype. J Natl Cancer Inst. 98, 316-325 (2006).
- Barkan, D. Metastatic growth from dormant cells induced by a col-I-enriched fibrotic environment. Cancer Res. 70, 5706-5716 (2010).
- Barkan, D., Green, J. E., Chambers, A. F. Extracellular matrix: A gatekeeper in the transition from dormancy to metastatic growth. Eur J Cancer. , (2010).
- Barkan, D. Inhibition of metastatic outgrowth from single dormant tumor cells by targeting the cytoskeleton. Cancer Res. 68, 6241-6250 (2008).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30, 256-268 (2003).
- Morris, V. L. Mammary carcinoma cell lines of high and low metastatic potential differ not in extravasation but in subsequent migration and growth. Clin Exp Metastasis. 12, 357-367 (1994).
- Khanna, C. The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis. Nat Med. 10, 182-186 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved