Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Mapeo de los circuitos neuronales inhibitorios por Laser Scanning fotoestimulación
En este artículo
Resumen
Este documento presenta un enfoque combinado de fotoestimulación láser con las grabaciones de células enteras en ratones transgénicos que expresan GFP en poblaciones de neuronas inhibidoras limitan. La técnica permite la cartografía y de análisis cuantitativo de los locales de los circuitos sinápticos de las neuronas corticales específicas inhibitorias.
Resumen
Neuronas inhibidoras son cruciales para la función cortical. Que comprenden un 20% de toda la población de neuronas corticales y puede subdividirse en diversos subtipos sobre la base de sus propiedades inmunoquímicas, morfológicas, fisiológicas y 1-4. Aunque investigaciones previas han revelado mucho sobre las propiedades intrínsecas de los distintos tipos de neuronas inhibitorias, el conocimiento acerca de sus conexiones en el circuito local sigue siendo relativamente limitada 3,5,6. Teniendo en cuenta que la función de cada neurona individual está marcada por su entrada de excitación e inhibición sináptica dentro de los circuitos corticales, que hemos estado usando escaneo láser fotoestimulación (LSP) a las conexiones mapa del circuito local para tipos específicos de células inhibitorias. En comparación con la estimulación eléctrica convencional o la estimulación de hojaldre glutamato, LSP tiene ventajas únicas permitiendo para el mapeo de amplia y el análisis cuantitativo de los insumos locales funcionales registrados individualmente neuronas 3,7-9. Fotoestimulación con láser a través de uncaging glutamato activa selectivamente las neuronas perisomatically, sin necesidad de activar los axones de paso o dendritas distal, lo que garantiza una resolución de asignación de sub-laminar. La sensibilidad y la eficiencia de los proveedores de servicios lingüísticos para las entradas de mapeo de los sitios de estimulación muchos sobre una gran región son muy adecuadas para el análisis de circuitos corticales.
Aquí se introduce la técnica de la LSP en combinación con células enteras patch clamp para la asignación de locales del circuito inhibitorio. Grabaciones objetivo de tipos específicos de células inhibidoras se ven facilitadas por el uso de ratones transgénicos que expresan proteínas verde fluorescente (GFP) en poblaciones de neuronas inhibidoras limitan la corteza 3,10, lo que permite el muestreo constante de los tipos de células específicas y la identificación inequívoca de los tipos celulares registrados . En cuanto a la asignación de LSP, se describe la instrumentación del sistema, se describe el procedimiento experimental y de adquisición de datos, y se presentan ejemplos de los mapas del circuito en el ratón corteza somatosensorial primaria. Como se ilustra en nuestros experimentos, el glutamato enjaulados se activa en una región espacialmente restringida de los cortes de cerebro por fotólisis láser UV; simultánea fijación de voltaje, las grabaciones permiten la detección de fotoestimulación-evocó las respuestas sinápticas. Mapas de cualquiera de las entradas sinápticas excitadoras o inhibidoras de la neurona objetivo se generan mediante el escaneo del rayo láser para estimular a cientos de posibles sitios presináptica. Por lo tanto, LSP permite la construcción de mapas detallados de las entradas sinápticas que inciden en los tipos específicos de neuronas inhibitorias a través de repetidos experimentos. En conjunto, la técnica basada en la fotoestimulación ofrece neurocientíficos una herramienta poderosa para la determinación de la organización funcional de los circuitos corticales locales.
Protocolo
1. Cerebro rebanada preparación
- Los ratones transgénicos son profundamente anestesiados con pentobarbital sódico (> 100 mg / kg, ip) y decapitado con rapidez, y sus cerebros extraídos en una solución de corte congelado y oxigenada.
- Gafas de GFP se utilizan para detectar visualmente si el cerebro del ratón de hecho expresa GFP.
- Primaria secciones somatosensorial cortical de 400 micras de grosor se cortan con un vibratome de sacarosa que contienen líquido cefalorraquídeo artificial (ACSF). Las láminas se incuban primero en sacarosa que contienen ACSF durante 30 minutos a 1 hora a 32 ° C, y después del período inicial de incubación, se transfirió a ACSF grabación a temperatura ambiente. A lo largo de la incubación y el registro, las rebanadas son continuamente burbujas con un 95% de O 2 -5% de CO 2.
2. Equipo de inicio
La implementación del sistema en general se ilustra en la Figura 1.
- El sistema de enfriamiento por láser y el proveedor se conecta la alimentación, para obtener el láser listo.
- Todo el hardware relacionados con el control de la fotoestimulación (incluido el sistema de escaneado con espejo, un modulador óptico, un obturador electrónico y un amplificador de fotodiodo de entrada) está activada.
- El equipo de electrofisiología (incluyendo un amplificador MultiClamp 700B y micromanipulador) está activada. Registros electrofisiológicos, fotoestimulación, y las imágenes de los preparativos de corte se realizan en una cámara de perfusión corte montado en la platina del microscopio.
- La cámara de imágenes (Retiga 2000, Q-imagen, Austin, TX) está activada. Los sectores se visualizaron con el microscopio en posición vertical (BW51X, Olympus) con contraste diferencial de interferencia infrarroja (DIC) y epi-fluorescencia óptica a través del sistema de imágenes.
- El software basado en Matlab EPHUS Q y software de captura de la cámara se puso en marcha. Una versión modificada de la medida Ephus software (Ephus, disponible en https://openwiki.janelia.org/ ) se utiliza para controlar los protocolos de fotoestimulación y adquirir datos de la fotoestimulación.
- Después de que el sistema está encendido, se debe comprobar para ver si el sistema de fotoestimulación con láser se encuentra en un estado de trabajo. Como el objetivo del microscopio 4x se utiliza para la entrega de los destellos de rayos UV para uncaging glutamato, un pedazo de papel blanco puede ser sometido a observar el patrón de escaneo láser, mientras que el sistema funciona.
3. La creación de la perfusión rebanada
- Un sistema de perfusión a presión se activa para alimentar a los ACSF grabación en la cámara de corte. Hay que tener cuidado para asegurar un nivel de fluido constante de 2,0 mm por encima de la rebanada en la cámara.
- Una parte alícuota de la solución madre de MNI-enjaulado-glutamato se añade a 25 ml de circulación ACSF para una concentración de 0.2 mM de glutamato enjaulado. Tenga en cuenta que después de 5-6 h de la experimentación, la solución del baño y el MNI-glutamato se actualizará.
- Una porción del cerebro se mueve dentro de la cámara de grabación. Se puede ejecutar el sistema de imagen para comprobar la calidad de corte y anatómicamente localizar el área somatosensorial primaria. A continuación, la división se sujeta con un anillo de platino por encargo de cuerda. Tenga cuidado de no poner el ancla en la región del cerebro destinadas a las grabaciones.
4. Patch-clamp de células enteras de grabación
- Los electrodos de vidrio (4.6 mW resistencia) se tira y se llena con una solución interna que contiene 0,1% biocitina para el etiquetado de las células y la identificación morfológica.
- Para realizar la grabación de parches, las células se visualizan en el objetivo de 60x. Tipos de células inhibidoras se identificó por primera vez y seleccionados en base a la visualización de la expresión de GFP en un microscopio Olympus DIC / fluorescentes, las grabaciones se realizaron posteriormente bajo control visual ayuda de la monitorización de vídeo infrarrojo DIC. Tenga en cuenta que un par de veces para cambiar entre los modos de DIC y fluorescencia es necesario para confirmar la localización de células GFP mientras se aproximaba el electrodo de la célula diana.
- Las técnicas convencionales de sujeción de parches se aplican. El electrodo se llena con presión positiva, se acercó a la superficie celular para establecer un hoyuelo percibir en el momento de la membrana de la célula objetivo, y entonces la presión negativa es aplicada rápidamente para formar un gigaseal y ruptura de monitoreo de las respuestas, mientras que la inyección de corriente en el monitor de vídeo.
- Al romper en las imágenes de la celda en 60 veces en los modos de DIC y fluorescencia se toman para la verificación en línea. Antes de la recolección de los datos de la fotoestimulación, hiperpolarización y despolarización pulsos de corriente se inyecta a examinar cada célula de las propiedades electrofisiológicas básicas.
- Grabaciones de todo, una vez estable de células se obtienen con la resistencia a un buen acceso (por lo general <20 MW), el objetivo del microscopio se cambia de 60x a 4x para fotoestimulación de escaneo láser. La imagen de corte a 4x se adquiere y se usa para guiar y registrar los sitios de fotoestimulación.
5. Laser scanning fotoestimulación
- Los parámetros de adquisición de la fotoestimulación y los datos se establece mediante la activación del módulo de conmutador de configuración de Ephus. Normalmente, de 1 ms con láser (20 mW) con un intervalo de estímulo de 1 segundo se utiliza para la asignación de fotoestimulación. Trazas de datos de un segundo muestreo a 10 kHz se adquieren.
- La imagen de rebanada de 4x se carga en el módulo de mapeo de Ephus. La ubicación del soma celular se define, y los sitios de fotoestimulación de un patrón de 16x16 (80 m x 80 m distancia) se establecen en torno a la ubicación de la celda, que abarca todas las capas corticales.
- El perfil de excitación de la neurona registrada se asigna mediante el examen de los lugares de remate en respuesta a la fotoestimulación en el modo de pinza de corriente. Nuestro software de fácil manejo con las características de visualización en línea facilita la asignación de los experimentos.
- Local conexiones del circuito de excitación se asignan mediante la detección de corrientes de excitación post-sináptica (EPSC) de la célula grabado mientras escaneo láser en diferentes lugares. La célula se mantiene a -70 mV en el modo de fijación de voltaje para detectar las corrientes hacia el interior de excitación. Los mapas EPSC se repiten 2-3 veces con la gira de la fotoestimulación patrón o volteado.
- Opcional: conexiones de los circuitos inhibitorios locales también pueden asignar mediante la detección de inhibidores postsinápticos corrientes (IPSC) de la célula registró a cabo en cerca de 0 mV en el modo de fijación de voltaje para detectar las corrientes hacia el exterior inhibitorio. Tenga en cuenta que lo mejor es utilizar la solución de electrodo interno con el potasio sustituido por el cesio para la asignación de IPSC.
- Después de todas las pruebas fisiológicas se han completado, el electrodo se retira suavemente desde la celda registrado. Los cortes de cerebro se saca y se fijaron en paraformaldehído al 4% durante la noche. Las células teñidas se registra contra biocitina. La morfología celular se examina con microscopio confocal o epi-fluorescencia, lo que confirma también que cada célula registrado es de hecho el interneuronas que expresan GFP previstos inicialmente.
6. Fotoestimulación de análisis de datos
Nuestra metodología de reciente desarrollo e implementación de software 11 se aplica a la detección y medida de fotoestimulación evocado acontecimientos sináptica en los mapas de los datos en bruto. Como se ejemplifica en la figura 2, un código de colores los mapas se construyen para ilustrar el patrón de entrada sináptica de las neuronas registradas.
7. Los resultados representativos:
Ejemplo de resultados de registro electrofisiológico y la cartografía de la fotoestimulación se muestran en la Figura 2. Grabaciones objetivo de tipos específicos de células inhibitorias son posibles mediante el uso de ratones transgénicos que expresan GFP en conocidos tipos de células inhibitorias. Dada la diversidad de las interneuronas inhibitorias, análisis de expresión de las buenas prácticas agrarias, la electrofisiología intrínseco y características morfológicas (Figura 2) se combinan para llegar a la clasificación de las células de tipo final. Figura 2B-C muestran que la fotoestimulación de escaneo láser permite la asignación de locales amplios conexiones del circuito cortical en un solo neuronas inhibidoras. El mapa de los datos en bruto se muestra en la Figura 2C. Las respuestas uncaging directos están excluidas de análisis de datos (Fig. 2C). Los mapas de entrada cuantitativos están codificados por colores, que se muestra en la Figura 2D-F. El ejemplo de rápido remate interneuronas inhibitorias recibió un fuerte entrada de excitación sináptica (EPSCs) de la capa 4 y las capas más profundas. Al relacionar la organización de la célula de la entrada sináptica a definir las vías corticales, que son capaces de inferir su posible papel (por ejemplo, la retroalimentación y la inhibición de feedforward) en el procesamiento de información cortical.
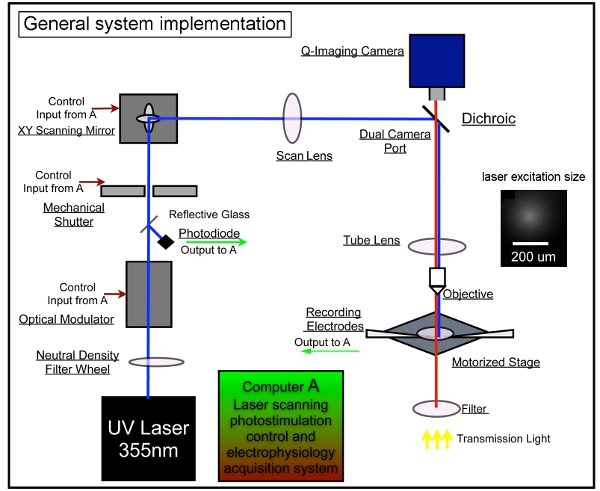
Figura 1. Instrumentación de sistema general de fotoestimulación de escaneo láser. Nuestro sistema general consiste en el control de la fotoestimulación, imágenes de video y sistemas de grabación electrofisiológica. Hemos aprobado el diseño del sistema de LSP se describió anteriormente 7,17. Una unidad de láser se utiliza para generar 355 nm láser ultravioleta para uncaging glutamato. El rayo láser se dirige a través de la trayectoria óptica de nuestro sistema. Corta duración de destellos láser (por ejemplo, 1 - 3 ms) son controlados por medio de un modulador electro-óptico (es decir, células Pockels) y un obturador mecánico. La potencia del láser de haz es modulada por una rueda de gradiente de densidad neutral y supervisado por la desviación de una pequeña fracción del haz de láser con un cubreobjetos de un fotodiodo. El sistema de escaneo láser incluye un par XY de los espejos de escaneo, la lente de escaneado, el lente del tubo, y la lente del objetivo. Los espejos de entregar el rayo láser a través de una lente de exploración, a continuación, el haz entra en el microscopio a través de un espejo dicroico y se centra por una lente de tubo a medida UV-transmisión. El haz bajo rellenos de la abertura posterior del objetivo del microscopio para proporcionar una más columnas (en lugar de cónicos), haz de iluminación, mantenimiento de la cartografía como de dos dimensiones como sea posible al reducir la resolución axial. Con arreglo al objetivo de 4x, el rayo láser forma manchas uncaging, cada approximating un perfil gaussiano con un ancho de 153 m lateralmente en el plano focal (ver recuadro). Varios puestos de la estimulación con láser se puede lograr a través de galvanómetros impulsada por los espejos de escaneo XY, como los espejos y la apertura posterior del objetivo están en planos conjugados, la traducción de las posiciones espejo en diferentes localizaciones de exploración en el plano focal de la lente objetivo. Durante uncaging, un número variable de páginas con dibujos que abarca todo el campo son estimulados de forma secuencial en un nonraster, secuencia aleatoria para evitar volver a visitar los alrededores de los sitios recientemente estimulada. Por favor refiérase a Xu et al. (2010) para obtener información más detallada.
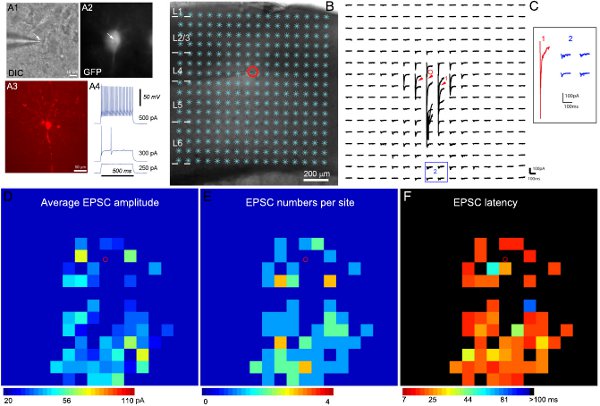
Figura 2. Asignación de conexiones del circuito local de excitación a un expresan GFP rápido clavar las interneuronas de la capa 4 de la corteza sensorial primaria del ratón. A1 y A2 muestran la DIC y fluorescente GFP imágenes de la célula se prevé en el objetivo de 60x en la porción del cerebro que viven, mientras que muestra A3 la morfología de las células reveló mediante tinción biocitina en el post-registro, el tramo fijo. A4 muestra los patrones de descarga de la célula de las buenas prácticas agrarias registradas, característica de un interneuronas inhibitorias rápido remate, en respuesta a las inyecciones de intrasomatic actual de diferentes potencias. B mostrar la imagen de corte superpuestas con los 16 sitios de fotoestimulación x16 (*). La ubicación de la celda se indica por el pequeño círculo rojo. C muestra una serie de fotoestimulación evocado por los rastros de respuesta de las ubicaciones de la estimulación se muestra en la B, mientras que la célula se llevó a cabo a -70 mV para detectar las corrientes hacia el interior de excitación. Las diferentes formas de respuestas fotoestimulación se ilustran por las huellas en los lugares de 1 y 2, que se expanden y se muestran por separado en el inserto. La huella 1 es un ejemplo de las respuestas directas (indicado por las flechas rojas) para glutamato uncaging en el cuerpo celular y las dendritas promximal. Otras huellas en 2 son ejemplos típicos de las respuestas de excitación sináptica de entrada (azul). Respuestas directas y entradas sinápticas pueden ser distinguidos por sus amplitudes y las latencias de respuesta. D, E y F son los mapas codificados por color (16x16 sitios) de la media de EPSC amplitud, el número de EPSC, y la primera latencia detectado EPSC por sitio, respectivamente, para los datos en bruto mapa que se muestra en C. La amplitud media de entrada de cada lugar de estimulación es la amplitud media de EPSCs en la ventana de análisis, con la respuesta espontánea de referencia resta de la respuesta de la fotoestimulación del mismo sitio. El número de EPSCs y la hora de llegada o la latencia de la EPSC detectó por primera vez por el sitio también se miden y se representan. Por favor, consulte (Shi et al., 2010) para más detalles.
Discusión
Fotoestimulación técnicas basadas en la cartografía han sido efectivamente aplicadas para el análisis de los circuitos corticales. Fotoestimulación de escaneo láser combinado con la grabación de células completas permite el mapeo de alta resolución de la distribución laminar de las fuentes de entrada presináptica de neuronas individuales, ya que el registro simultáneo de una neurona postsináptica con fotoestimulación de grupos de neuronas presinápticas en muchos lugares diferentes proporciona medidas cuan...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Damos las gracias a Tran Huynh, Andrés San Antonio, Jerry Lin por su asistencia técnica. Este trabajo fue financiado por los Institutos Nacionales de Salud subvenciones DA023700 y DA023700 04S1-a XX
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| líneas transgénicas de ratón | Jackson de laboratorio o de otras fuentes | Por favor refiérase a Xu y Callaway (2009) | |
| GFP gafas | BLS Ltd., Hungría | ||
| vibratome | Leica | VT1200S | |
| MNI enjaulados glutamato (4-metoxi-7-nitroindolinyl-jaula L-glutamato) | Bioscience Tocris, Ellisville, MO | No. Cat. 1490 | |
| biocitina | B4261 | ||
| electrodo extractor | Sutter Instrument, Novato, CA | P-97 | |
| tubos de vidrio para la fabricación de electrodos | BF150-86-10 | ||
| MultiClamp amplificador 700B | Molecular Devices, Sunnyvale, CA | MultiClamp 700B | |
| digital de la cámara CCD | Q-imagen, Austin, TX | Retiga 2000 | |
| Investigación microscopio | Olympus, Tokio, Japón | BW51X | |
| Unidad láser UV | DPSS láser, Santa Clara, CA | modelo 3501 | |
| Otros equipos para escaneo láser phostimulation | Por favor refiérase a Xu et al (2010). |
Soluciones:
- Sacarosa que contienen líquido cefalorraquídeo artificial (ACSF) para el corte de corte (en mM: NaCl 85, 75 sacarosa, 2,5 KCl, 25 de glucosa, 1,25 NaH 2 PO 4, 4 MgCl 2, 0,5 CaCl 2, y 24 de NaHCO 3).
- Grabación ACSF (en mM: 126 NaCl, 2,5 KCl, 26 NaHCO 3, 2 CaCl 2, 2 MgCl 2, 1,25 NaH 2 PO 4, y la glucosa 10)
- Electrodo interno solución (en mM: 126 K-gluconato, 4 KCl, 10 HEPES, 4 ATP-Mg, 0,3 GTP-Na, y fosfocreatina 10, pH 7,2, 300 mOsm).
Referencias
- Ascoli, G. A. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nature. 9, 557-568 (2008).
- Markram, H. Interneurons of the neocortical inhibitory system. Nature. 5, 793-807 (2004).
- Xu, X., Callaway, E. M. Laminar specificity of functional input to distinct types of inhibitory cortical neurons. J Neurosci. 29, 70-85 (2009).
- Xu, X., Roby, K. D., Callaway, E. M. Immunochemical characterization of inhibitory mouse cortical neurons: three chemically distinct classes of inhibitory cells. J Comp Neurol. 518, 389-404 (2010).
- Dantzker, J. L., Callaway, E. M. Laminar sources of synaptic input to cortical inhibitory interneurons and pyramidal neurons. Nat Neurosci. 3, 701-707 (2000).
- Yoshimura, Y., Callaway, E. M. Fine-scale specificity of cortical networks depends on inhibitory cell type and connectivity. Nat Neurosci. 8, 1552-1559 (2005).
- Shepherd, G. M., Pologruto, T. A., Svoboda, K. Circuit analysis of experience-dependent plasticity in the developing rat barrel cortex. Neuron. 38, 277-289 (2003).
- Weiler, N., Wood, L., Yu, J., Solla, S. A., Shepherd, G. M. Top-down laminar organization of the excitatory network in motor cortex. Nat Neurosci. 11, 360-366 (2008).
- Xu, X., Olivas, N. D., Levi, R., Ikrar, T., Nenadic, Z. High precision and fast functional mapping of cortical circuitry through a combination of voltage sensitive dye imaging and laser scanning photostimulation. J Neurophysiol. 103, 2301-2312 (2010).
- Xu, X., Roby, K. D., Callaway, E. M. Mouse cortical inhibitory neuron type that coexpresses somatostatin and calretinin. J Comp Neurol. 499, 144-160 (2006).
- Shi, Y., Nenadic, Z., Xu, X. Novel use of matched filtering for synaptic event detection and extraction. PLoS ONE. 5, e15517-e15517 (2010).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Kuhlman, S. J., Huang, Z. J. High-resolution labeling and functional manipulation of specific neuron types in mouse brain by Cre-activated viral gene expression. PLoS ONE. 3, e2005-e2005 (2008).
- Petreanu, L., Huber, D., Sobczyk, A., Svoboda, K. Channelrhodopsin-2-assisted circuit mapping of long-range callosal projections. Nat Neurosci. 10, 663-668 (2007).
- Petreanu, L., Mao, T., Sternson, S. M., Svoboda, K. The subcellular organization of neocortical excitatory connections. Nature. 457, 1142-1145 (2009).
- Cardin, J. A. Driving fast-spiking cells induces gamma rhythm and controls sensory responses. Nature. 459, 663-667 (2009).
- Shepherd, G. M., Svoboda, K. Laminar and columnar organization of ascending excitatory projections to layer 2/3 pyramidal neurons in rat barrel cortex. J Neurosci. 25, 5670-5679 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados