Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mapping hemmende neuronale Schaltungen durch Laser Scanning Photostimulation
In diesem Artikel
Zusammenfassung
Dieses Papier stellt einen Ansatz der Kombination von Laser-Scanning-Photostimulation mit Ganzkeim Aufnahmen in transgenen Mäusen, die GFP in begrenzten hemmende Neuronen Populationen. Die Technik ermöglicht die umfassende Abbildung und quantitative Analyse der lokalen synaptischen Schaltungen des spezifischen inhibitorischen kortikalen Neuronen.
Zusammenfassung
Inhibitorischen Neuronen sind entscheidend für die kortikale Funktion. Sie umfassen etwa 20% des gesamten kortikalen neuronalen Population und können weiter in verschiedene Subtypen auf ihre immunchemische, morphologischen und physiologischen Eigenschaften 1-4 basieren unterteilt werden. Obwohl frühere Untersuchungen haben viel über die inhärenten Eigenschaften der einzelnen Arten von hemmenden Neuronen zeigten, ist das Wissen über die lokalen Anschlüsse des noch relativ begrenzt 3,5,6. Da jedes einzelne Neuron die Funktion durch ihre erregenden und hemmenden synaptischen Eingang in kortikalen Schaltkreisen geprägt ist, haben wir mit Laser-Scanning-Photostimulation (LSP) auf Karte lokalen leitungsvermittelte Verbindungen bis spezifische inhibitorische Zelltypen. Im Vergleich zu herkömmlichen elektrischen Stimulation oder Glutamat puff Stimulation hat LSPS einzigartige Vorteile ermöglicht für umfangreiche Kartierungen und quantitative Analyse der lokalen Funktionseingänge einzeln erfasst Neuronen 3,7-9. Laser Photostimulation über Glutamat Uncaging aktiviert selektiv Neuronen perisomatically, ohne Aktivierung Axone der Passage oder distalen Dendriten, die eine sub-Laminar-Mapping-Auflösung sorgt. Die Sensitivität und Effizienz der LSPS für die Zuordnung von Eingaben aus vielen Stimulation Standorten über eine große Region sind bekannt für kortikalen Schaltkreis-Analyse geeignet.
Hier stellen wir die Technik der LSPS mit whole-cell Patch-Clamp für lokale inhibitorische Schaltung Mapping kombiniert. Gezielte Aufnahmen von spezifischen inhibitorischen Zelltypen sind durch die Verwendung von transgenen Mäusen, grün fluoreszierende Proteine (GFP) in geringgradige hemmende Neuronen Populationen in der Rinde 3,10, was im Einklang Abtastung der gezielten Zelltypen und eindeutige Identifizierung der Zelltypen erfasst ermöglicht erleichtert . Was LSPS Mapping, wir das System Instrumentierung skizzieren, beschreiben die Versuchsdurchführung und Datenerfassung und präsentieren Beispiele der Schaltung Mapping in Maus primären somatosensorischen Kortex. Wie in unseren Experimenten dargestellt, ist geschütztes Glutamat in einem räumlich begrenzten Bereich des Gehirns Scheibe durch UV-Laser-Photolyse aktiviert; gleichzeitige Voltage-Clamp-Aufnahmen ermöglichen die Erfassung von Photostimulation-evozierte synaptische Antworten. Karten entweder erregend oder hemmend synaptischen Input für die gezielte Neuron durch das Scannen des Laserstrahls auf Hunderte von möglichen präsynaptischen Seiten stimulieren generiert. So ermöglicht LSPS den Bau von detaillierten Karten der synaptischen Eingänge Auftreffen auf bestimmte Arten von hemmenden Neuronen durch wiederholte Experimente. Zusammengenommen bietet die Photostimulation-basierte Technik Neurowissenschaftler ein leistungsfähiges Werkzeug zur Bestimmung der funktionalen Organisation der lokalen kortikalen Schaltkreisen.
Protokoll
1. Hirnschnitt Vorbereitung
- Transgene Mäuse sind tief mit Pentobarbital-Natrium (> 100 mg / kg, ip) und schnell enthauptet und ihre Köpfe in einer gefrorenen und mit Sauerstoff versorgt Schneid-Lösung extrahiert.
- GFP Schutzbrille verwendet werden, um visuell-Bildschirm, wenn das Gehirn der Maus in der Tat zum Ausdruck GFP.
- Primären somatosensorischen kortikalen Abschnitte von 400 um dick sind mit einem Vibratom in Saccharose-haltige künstliche Liquor (ACSF) geschnitten. Slices werden zuerst in inkubiert Saccharose-haltige ACSF für 30 min bis 1 h bei 32 ° C, und nach der anfänglichen Inkubationszeit, übertragen, um die Aufnahme ACSF bei Raumtemperatur. Während der Inkubationszeit und der Aufnahme werden die Scheiben kontinuierlich mit 95% O 2 -5% CO 2 geleitet.
2. Ausstattung Start
Die allgemeine Einführung des Systems ist in Abbildung 1 dargestellt.
- Die Laser-Kühlung und Energieversorger eingeschaltet ist, immer den Laser bereit.
- Alle verwendeten Hard Zusammenhang mit Photostimulation Kontrolle (einschließlich der Scan-Spiegel-System, einen optischen Modulator, einen elektronischen Verschluss und einer Photodiode Eingangsverstärker) ist eingeschaltet.
- Die elektrophysiologischen Geräte (einschließlich einer Multiclamp 700B Verstärker und Mikromanipulatoren) ist eingeschaltet. Elektrophysiologischen Ableitungen, Photostimulation, und Abbildung der Scheibe Vorbereitungen sind in einem Stück Perfusionskammer auf dem motorisierten Tisch des Mikroskops montiert getan.
- Die Wärmebildkamera (Retiga 2000, Q-Imaging, Austin, TX) ist eingeschaltet. Slices werden visualisiert mit dem aufrechten Mikroskop (BW51X, Olympus) mit Infrarot-Differential-Interferenz-Kontrast (DIC) und epi-Fluoreszenz-Optik durch die Imaging-System.
- Die Matlab-basierte EPHUS Software und Q-Capture-Software der Kamera sind in Betrieb genommen. Ein speziell modifizierte Version des Ephus Software (Ephus, verfügbar unter https://openwiki.janelia.org/ ) wird verwendet, um Photostimulation Protokolle kontrollieren und Photostimulation Daten.
- Nachdem das System eingeschaltet ist, sollte man überprüfen, ob der Laser Photostimulation System ist in einem funktionsfähigen Zustand. Als 4x Mikroskopobjektiv für die Bereitstellung der UV-Blitze für Glutamat Uncaging verwendet wird, kann ein Stück weißes Papier unter gebracht werden, um die Laser-Scanning-Muster zu beobachten, während das System läuft.
3. Einrichten Scheibe Perfusion
- Ein unter Druck Perfusion System basiert auf der Aufzeichnung ACSF in die Scheibe Kammer Feed eingeschaltet. Es wird darauf geachtet, um eine konstante Füllstand von 2,0 mm über der Scheibe in der Kammer zu gewährleisten.
- Ein Aliquot der Stammlösung des MNI-caged-Glutamat wird in 25 ml des zirkulierenden ACSF für eine Konzentration von 0,2 mM caged Glutamat aufgenommen. Bitte beachten Sie, dass nach 5-6 h des Experimentierens, der Badlösung und MNI-Glutamat wird aktualisiert.
- Ein Hirnschnitt ist in der Aufnahme bewegt wird. Man kann laufen Imaging-System, um die Scheibe Qualitäts-Check und anatomisch suchen Sie den primären somatosensorischen Bereich. Dann wird die Scheibe ist mit einem maßgeschneiderten Saiteninstrumente Platinring verankert. Achten Sie darauf, um den Anker über die Hirnregion für Aufnahmen bestimmt gestellt.
4. Whole cell patch-Klemm-Aufnahme
- Glaselektroden (4-6 MOhm Widerstand) gezogen und mit einer internen Lösung mit 0,1% Biocytin für die Zell-Kennzeichnung und morphologische Identifizierung gefüllt.
- Um Patch-Aufnahme werden die Zellen visualisiert am 60x Ziel. Inhibitory Zelltypen werden zunächst identifiziert und ausgewählt basierend auf Visualisierung der GFP-Expression unter einer DIC / fluoreszierende Olympus Mikroskop; Aufnahmen werden anschließend unter visueller Kontrolle durch Infrarot-DIC Videoüberwachung unterstützt durchgeführt. Bitte beachten Sie, dass ein paar Mal die Umstellung zwischen den DIC-und Fluoreszenz-Modi notwendig, um die GFP-Zelle Lage zu bestätigen, während Annäherung an die Elektrode an die Zielzelle.
- Herkömmliche Patch-Clamp-Techniken angewendet werden. Die Elektrode wird mit Überdruck gefüllt, zog nahe an der Zelloberfläche zu einer spürbaren Delle auf die gezielte Zellmembran zu etablieren, und dann Unterdruck wird schnell angewandt, um eine undurchlässige bilden und brechen in während der Überwachung des Stromeinspeisung Antworten auf dem Videomonitor.
- Nach Einbruch, werden die Bilder der Zelle bei 60x unter der DIC und Fluoreszenz-Modi für die Online-Überprüfung übernommen. Vor Sammlung von Photostimulation Daten sind Hyperpolarisation und depolarisierende Stromimpulse injiziert, um jede Zelle die grundlegenden elektrophysiologischen Eigenschaften zu untersuchen.
- Sobald stabile ganze Zelle Aufnahmen mit gutem Zugang Widerstand (meist <20 M) erzielt werden, ist das Mikroskop-Objektiv von 60x auf 4x für die Laser Scanning Photostimulation eingeschaltet. Das Schnittbild mit 4x erworben und wird für die Führung und Registrierung Photostimulation Sites verwendet werden.
5. Laser scanning Photostimulation
- Die Photostimulation und Datenerfassung Parameter werden durch die Aktivierung der Konfiguration Switch-Modul von Ephus gesetzt. Normalerweise ist 1 ms Laser (20 mW) mit einem Stimulus Intervall von 1 Sekunde für Photostimulation Mapping verwendet. Daten Spuren von 1 Sekunde bei 10 kHz abgetastet erworben werden.
- Die 4x Scheibe Bild wird in der Mapper-Modul von Ephus geladen. Die Lage der Zelle soma definiert ist, und Photostimulation Seiten eines 16x16-Muster (80 um x 80 um Abstand) sind rund um die Zelle Lage gesetzt, die alle kortikalen Schichten.
- Die Anregung Profil der aufgezeichneten Neuron ist durch die Untersuchung der spiking Standorten in Reaktion auf Photostimulation über die derzeitige Einschränkung Modus abgebildet. Unsere benutzerfreundliche Software mit dem Online-Display-Funktionen erleichtert die Mapping-Experimente.
- Lokale exzitatorischen Schaltung Verbindungen sind durch den Nachweis von exzitatorischen postsynaptischen Ströme (EPSC) aus dem aufgenommenen Zelle abgebildet, während Laser-Scanning an verschiedenen Standorten. Die Zelle wird bei -70 mV in Voltage-Clamp-Modus statt, um nach innen erregenden Ströme zu erkennen. Die EPSC Karten sind 2-3 mal mit dem Photostimulation Muster gedreht wiederholt oder gekippt werden.
- Optional: Local hemmende Schaltung Verbindungen können auch durch den Nachweis der inhibitorischen postsynaptischen Ströme (IPSC) aus dem aufgenommenen Zelle bei nahe 0 mV in Voltage-Clamp-Modus statt, um nach außen hemmenden Strömungen erkennen abgebildet. Beachten Sie, dass es am besten ist, die Elektrode interne Lösung mit Kalium mit Cäsium für IPSC-Mapping ersetzt sind.
- Nachdem alle physiologischen Tests abgeschlossen sind, wird die Elektrode vorsichtig aus dem aufgenommenen Zelle entfernt. Die Hirnschnitt wird und in 4% Paraformaldehyd genommen festen Nacht. Die aufgenommenen Zellen wird gegen Biocytin gefärbt. Zellmorphologie mit konfokalen oder epi-Fluoreszenz-Mikroskopie, die auch bestätigt, dass jedes aufgezeichnete Zelle in der Tat ist die GFP-exprimierenden Interneuron ursprünglich angestrebten untersucht.
6. Photostimulation Datenanalyse
Unsere neu entwickelten Methoden und Software-Implementierung 11 ist die Detektion und Messung von Photostimulation-evozierte synaptische Ereignisse in den Rohdaten Karten angewendet. Wie in Abbildung 2 veranschaulicht, sind farblich gekennzeichnet Karten gebaut, um das Muster der synaptischen Input, um die aufgezeichneten Neuronen zu illustrieren.
7. Repräsentative Ergebnisse:
Beispiel Ergebnisse der elektrophysiologischen Aufzeichnung und Photostimulation Mapping sind in Abbildung 2 dargestellt. Gezielte Aufnahmen von spezifischen inhibitorischen Zelltypen werden durch Verwendung von transgenen Mäusen, die GFP in bekannten inhibitorischen Zelltypen. Angesichts der Vielfalt der inhibitorischen Interneurone, sind Analysen der GFP-Expression, intrinsische Elektrophysiologie und morphologischen Eigenschaften (Abbildung 2A) kombiniert, um die endgültige Zelltyp Einstufung zu gelangen. 2B-C zeigen, dass Laser-Scanning-Photostimulation für umfangreiche Kartierung der lokalen kortikalen leitungsvermittelte Verbindungen bis einzigen hemmenden Neuronen ermöglicht. Die Rohdaten Karte ist in Abbildung 2C dargestellt. Der direkte Uncaging Antworten sind aus der Datenanalyse (Abbildung 2C) ausgeschlossen. Die quantitative Input-Karten sind farblich gekennzeichnet, wie in Abbildung 2D-F. Das Beispiel schnell spiking inhibitorischen Interneuronen erhalten starken exzitatorischen synaptischen Inputs (EPSCs) von Layer 4 und tieferen Schichten. Durch den Bezug der Zelle synaptischen Input-Organisation definiert kortikalen Bahnen, sind wir in der Lage, seine mögliche Rolle (zB Feedback-und Feedforward-Hemmung) in kortikalen Informationsverarbeitung zu schließen.
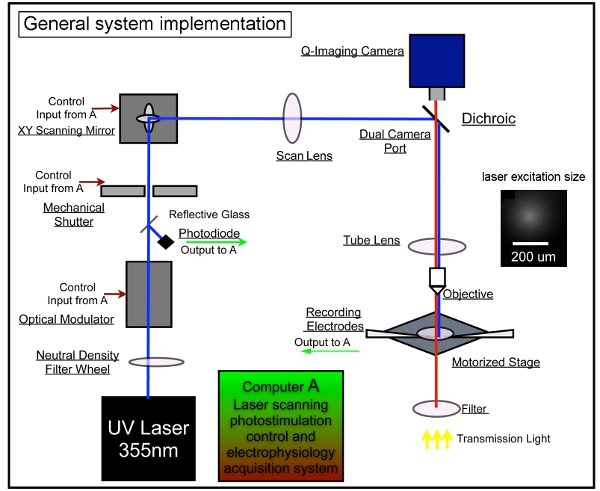
Abbildung 1. Allgemeine System Instrumentierung für die Laser Scanning Photostimulation. Unser Gesamtsystem besteht aus Photostimulation Kontrolle, Video-Bildgebung und Elektrophysiologie Aufzeichnungssysteme. Wir verabschiedeten die Gestaltung der LSPS System zuvor beschrieben 7,17. Ein Laser-Einheit wird verwendet, um 355 nm UV-Laser für Glutamat Uncaging generieren. Der Laserstrahl wird durch den optischen Pfad unseres Systems gerichtet. Kurze Laufzeiten von Laserblitzen (zB 1 bis 3 ms) sind mit einer elektro-optischen Modulator (dh Pockels-Zelle) und einen mechanischen Verschluss gesteuert. Laserleistung moduliert wird durch eine neutrale Dichtegradienten Rad und durch die Umleitung ein kleiner Teil des Laserstrahls mit einem Deckglas auf eine Photodiode überwacht. Die Laser-Scanning-System beinhaltet ein XY-Paar von Scan-Spiegel, die Scan-Objektiv, das Rohr Linse und das Objektiv. Die Spiegel sorgen für den Laserstrahl durch einen Scan-Objektiv, dann der Strahl in das Mikroskop über einen dichroitischen Spiegel und wird durch eine maßgeschneiderte UV-Senderöhre fokussiert. Der Strahl Underfills der Rückseite Apertur des Mikroskop-Objektivs um eine säulenförmige (im Gegensatz zu konischen Gegensatz) Beleuchtungsstrahlengang, Haltung die Zuordnung als zweidimensionale wie möglich durch die Reduzierung der axialen Auflösung. Unter dem 4x Ziel bildet den Laserstrahl Uncaging Flecken, jeder approximating einer Gauß-Profil mit einer Breite von 153 um seitlich in der Brennebene (siehe Beilage). Verschiedene Laser-Stimulation Positionen können durch Galvanometer-driven XY Scanspiegel erreicht werden, wie der Spiegel und der Rückseite Apertur des Objektivs in konjugierten Ebenen sind, die Übersetzung Spiegel-Positionen in verschiedene Scan-Standorte auf das Objektiv Brennebene. Während Uncaging, eine variable Anzahl von gemusterten Seiten, die das gesamte Gebiet erstreckt sich nacheinander in einem nonraster stimuliert, um nonrandom Folge zu vermeiden Wiederaufgreifen der Nähe des kürzlich angeregt Seiten. Bitte beachten Sie Xu et al. (2010) für weitere Informationen.
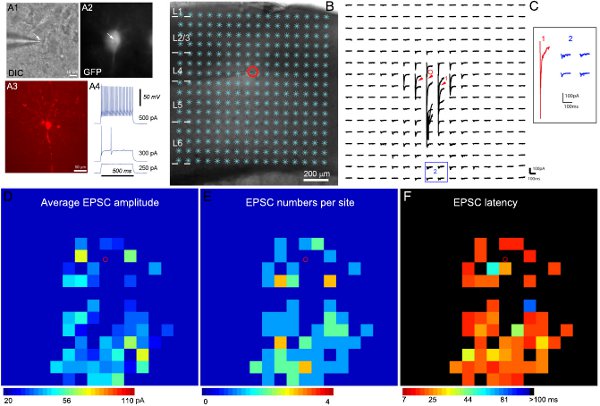
Abbildung 2. Mapping lokale exzitatorische Schaltung Verbindungen zu einem GFP-exprimierenden schnell spiking Interneuron in Schicht 4 des Maus primären sensorischen Kortex. A1 und A2 zeigen die DIC-und GFP-Fluoreszenz-Bilder von der Zielzelle unter dem 60x Objektiv im lebenden Gehirn Scheibe, während A3 zeigt der Zellmorphologie durch Biocytin Färbung in den post-Aufnahme, feste Scheibe offenbart. A4 zeigt das Feuern Muster der aufgezeichneten GFP Zelle, die charakteristisch für ein schnelles Aufstocken hemmenden Interneuron, in Reaktion auf intrasomatic aktuellen Injektionen von verschiedenen Stärken. B zeigen die Scheibe Bild mit dem 16 x16 Photostimulation Websites (*) überlagert. Der Standort der Zelle wird durch den kleinen roten Kreis gekennzeichnet. C zeigt eine Anordnung von Photostimulation-evozierte Spuren aus der Stimulation Standorten in B gezeigt, während die Zelle bei -70 mV gehalten wurde, um nach innen erregenden Ströme zu erkennen. Verschiedene Formen von Photostimulation Antworten werden von den Spuren an den Standorten von 1 und 2, die erweitert und werden separat ausgewiesen im Einsatz gezeigt. Die Spur 1 ist ein Beispiel für die direkte Reaktionen (angedeutet durch die roten Pfeile) zu Glutamat Uncaging auf dem Zellkörper und promximal Dendriten. Andere Spuren in 2 sind typische Beispiele für exzitatorischen synaptischen Inputs Antworten (blau). Direkte Antworten und synaptischer Eingänge können durch ihre Amplituden und Antwortlatenzen unterschieden werden. D, E und F sind die farbigen Karten (16x16 Seiten) des durchschnittlichen EPSC Amplitude, die EPSC Zahlen, und die erste erkannt EPSC Latenz pro Standort jeweils für die Rohdaten Karte in C. Die durchschnittliche Eingangsamplitude voneinander gezeigt Stimulation Website ist die mittlere Amplitude der EPSCs in der Analyse-Fenster, mit dem Ausgangswert spontane Antwort des Photostimulation Reaktion der gleichen Stelle abgezogen. Die Zahl der EPSCs und die Ankunftszeit oder Latenz der ersten erkannt EPSC pro Standort werden ebenfalls gemessen und aufgezeichnet. Bitte beachten Sie (Shi et al., 2010) für weitere Details.
Diskussion
Photostimulation-basierte Mapping-Techniken sind effektiv für die Analyse von kortikalen Schaltkreisen eingesetzt. Laser Scanning Photostimulation mit Ganzkeim Aufnahme kombiniert die hohe Auflösung Abbildung von laminaren Verteilungen der präsynaptischen Input-Quellen zu einzelnen Neuronen, weil die gleichzeitige Aufnahme von einem postsynaptischen Neuron mit Photostimulation von Clustern von präsynaptischen Neuronen an vielen verschiedenen Orten bietet quantitative Maßnahmen der räumlichen Verteilung der exzitat...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken Tran Huynh, Andrew San Antonio, Jerry Lin für ihre technische Unterstützung. Diese Arbeit wurde von den National Institutes of Health gewährt DA023700 und DA023700-04S1 zu XX finanziert
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| transgenen Mauslinien | Jackson-Labor oder aus anderen Quellen | Bitte beachten Sie Xu und Callaway (2009) | |
| GFP Schutzbrille | BLS AG, Ungarn | ||
| Vibratom | Leica Systeme | VT1200S | |
| MNI geschütztes Glutamat (4-methoxy-7-nitroindolinyl-Käfig L-Glutamat) | Tocris Bioscience, Ellisville, MO | Kat. Nr. 1490 | |
| Biocytin | B4261 | ||
| Elektrode puller | Sutter Instrument, Novato, CA | P-97 | |
| Glasröhren zur Herstellung von Elektroden | BF150-86 bis 10 | ||
| Multiclamp 700B Verstärker | Molecular Devices, Sunnyvale, CA | Multiclamp 700B | |
| digitale CCD-Kamera | Q-Imaging, Austin, TX | Retiga 2000 | |
| Forschung Mikroskop | Olympus, Tokyo, Japan | BW51X | |
| UV-Laser-Einheit | DPSS-Laser, Santa Clara, CA | Modell 3501 | |
| Andere Ausrüstung für Laser Scanning phostimulation | Bitte beachten Sie Xu et al. (2010) |
Solutions:
- Saccharose-haltige künstliche Liquor (ACSF) für Scheiben schneiden (in mM: 85 NaCl, 75 Saccharose, 2,5 KCl, 25 Glucose, 1,25 NaH 2 PO 4, 4 MgCl 2, 0,5 CaCl 2 und 24 NaHCO 3).
- Recording ACSF (in mM: 126 NaCl, 2,5 KCl, 26 NaHCO 3, 2 CaCl 2, 2 MgCl 2, 1,25 NaH 2 PO 4 und 10 Glukose)
- Electrode interne Lösung (in mM: 126 K-Gluconat, 4 KCl, 10 HEPES, 4 ATP-Mg, 0,3 GTP-Na, und 10 Phosphokreatin, pH 7,2, 300 mOsm).
Referenzen
- Ascoli, G. A. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nature. 9, 557-568 (2008).
- Markram, H. Interneurons of the neocortical inhibitory system. Nature. 5, 793-807 (2004).
- Xu, X., Callaway, E. M. Laminar specificity of functional input to distinct types of inhibitory cortical neurons. J Neurosci. 29, 70-85 (2009).
- Xu, X., Roby, K. D., Callaway, E. M. Immunochemical characterization of inhibitory mouse cortical neurons: three chemically distinct classes of inhibitory cells. J Comp Neurol. 518, 389-404 (2010).
- Dantzker, J. L., Callaway, E. M. Laminar sources of synaptic input to cortical inhibitory interneurons and pyramidal neurons. Nat Neurosci. 3, 701-707 (2000).
- Yoshimura, Y., Callaway, E. M. Fine-scale specificity of cortical networks depends on inhibitory cell type and connectivity. Nat Neurosci. 8, 1552-1559 (2005).
- Shepherd, G. M., Pologruto, T. A., Svoboda, K. Circuit analysis of experience-dependent plasticity in the developing rat barrel cortex. Neuron. 38, 277-289 (2003).
- Weiler, N., Wood, L., Yu, J., Solla, S. A., Shepherd, G. M. Top-down laminar organization of the excitatory network in motor cortex. Nat Neurosci. 11, 360-366 (2008).
- Xu, X., Olivas, N. D., Levi, R., Ikrar, T., Nenadic, Z. High precision and fast functional mapping of cortical circuitry through a combination of voltage sensitive dye imaging and laser scanning photostimulation. J Neurophysiol. 103, 2301-2312 (2010).
- Xu, X., Roby, K. D., Callaway, E. M. Mouse cortical inhibitory neuron type that coexpresses somatostatin and calretinin. J Comp Neurol. 499, 144-160 (2006).
- Shi, Y., Nenadic, Z., Xu, X. Novel use of matched filtering for synaptic event detection and extraction. PLoS ONE. 5, e15517-e15517 (2010).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Kuhlman, S. J., Huang, Z. J. High-resolution labeling and functional manipulation of specific neuron types in mouse brain by Cre-activated viral gene expression. PLoS ONE. 3, e2005-e2005 (2008).
- Petreanu, L., Huber, D., Sobczyk, A., Svoboda, K. Channelrhodopsin-2-assisted circuit mapping of long-range callosal projections. Nat Neurosci. 10, 663-668 (2007).
- Petreanu, L., Mao, T., Sternson, S. M., Svoboda, K. The subcellular organization of neocortical excitatory connections. Nature. 457, 1142-1145 (2009).
- Cardin, J. A. Driving fast-spiking cells induces gamma rhythm and controls sensory responses. Nature. 459, 663-667 (2009).
- Shepherd, G. M., Svoboda, K. Laminar and columnar organization of ascending excitatory projections to layer 2/3 pyramidal neurons in rat barrel cortex. J Neurosci. 25, 5670-5679 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten